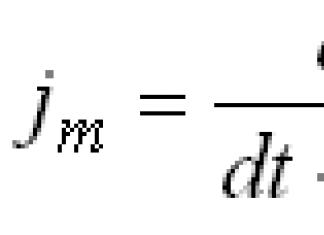L’état acido-basique est l’un des paramètres physiques et chimiques les plus importants de l’environnement interne de l’organisme. Dans le corps d'une personne en bonne santé, des acides se forment constamment quotidiennement au cours du processus métabolique - environ 20 000 mmol d'acide carbonique (H 2 C0 3) et 80 mmol d'acides forts, mais la concentration de H + fluctue dans une plage relativement étroite. Normalement, le pH du liquide extracellulaire est de 7,35 à 7,45 (45 à 35 nmol/l) et le pH du liquide intracellulaire est en moyenne de 6,9. Parallèlement, il faut noter que la concentration en H+ à l’intérieur de la cellule est hétérogène : elle est différente dans les organites d’une même cellule.
Les H+ sont tellement réactifs que même un changement à court terme de leur concentration dans la cellule peut affecter de manière significative l'activité des systèmes enzymatiques et des processus physiologiques. Cependant, ils sont normalement activés instantanément. systèmes tampons, protégeant la cellule des fluctuations défavorables du pH. Le système tampon peut se lier ou, inversement, libérer H+ immédiatement en réponse aux changements d’acidité du liquide intracellulaire. Les systèmes tampons fonctionnent également au niveau du corps dans son ensemble, mais en fin de compte, la régulation du pH du corps est déterminée par le fonctionnement des poumons et des reins.
Alors, qu’est-ce que l’état acido-basique (syn. : équilibre acido-basique ; état acido-basique ; équilibre acido-basique ; homéostasie acido-basique) ? Il s'agit de la constance relative de la valeur du pH de l'environnement interne de l'organisme, due à l'action combinée du tampon et de certains systèmes physiologiques de l'organisme.
L'équilibre acido-basique est la constance relative de l'indice d'hydrogène (pH) du pays interne de l'organisme, due à l'action combinée du tampon et de certains systèmes physiologiques, qui détermine l'utilité des transformations métaboliques dans les cellules de l'organisme (Big Encyclopédie médicale, vol. 10, p. 336).
Le rapport des ions hydrogène et hydroxyle dans l'environnement interne du corps dépend de :
1) activité enzymatique et intensité des réactions redox ;
2) processus d'hydrolyse et de synthèse des protéines, de glycolyse et d'oxydation des glucides et des graisses ;
3) sensibilité des récepteurs aux médiateurs ;
4) perméabilité de la membrane ;
5) la capacité de l'hémoglobine à lier l'oxygène et à le libérer dans les tissus ;
6) caractéristiques physicochimiques des colloïdes et des structures intercellulaires : degré de leur dispersité, hydrophilie, capacité d'adsorption ;
7) fonctions de divers organes et systèmes.
Le rapport H+ et OH- dans les milieux biologiques dépend de la teneur en acides (donneurs de protons) et en bases tampons (accepteurs de protons) dans les fluides corporels. La réaction active du milieu est appréciée par l'un des ions (H+ ou OH-), le plus souvent par H+. La teneur en H+ dans l'organisme dépend de leur formation au cours du métabolisme des protéines, des graisses et des glucides, ainsi que de leur entrée dans l'organisme ou de son élimination sous forme d'acides ou d'acides non volatils. gaz carbonique.
La valeur du pH, qui caractérise l'état du CBS, est l'un des paramètres sanguins les plus « durs » et varie chez l'homme dans des limites très étroites : de 7,35 à 7,45. Un changement de pH de 0,1 au-delà des limites spécifiées provoque des troubles prononcés du système respiratoire, cardiovasculaire, etc., une diminution du pH de 0,3 provoque un coma acidotique et un changement de pH de 0,4 est souvent incompatible avec la vie.
L’échange d’acides et de bases dans le corps est étroitement lié à l’échange d’eau et d’électrolytes. Tous ces types de métabolisme sont unis par la loi de la neutralité électrique, de l'isosmolarité et des mécanismes physiologiques homéosgatiques.
La quantité totale de cations plasmatiques est de 155 mmol/l (Na+ -142 mmol/l ; K+ - 5 mmol/l ; Ca2+ - 2,5 mmol/l ; Mg2+ - 0,5 mmol/l ; autres éléments - 1,5 mmol/l ) et la la même quantité d'anions est contenue (103 mmol/l - base faible Cl- ; 27 mmol/l - base forte HC03- ; 7,5-9 mmol/l - anions protéines ; 1,5 mmol/l - anions phosphate ; 0,5 mmol/ l - sulfatanions ; 5 mmol/l - acides organiques). Étant donné que la teneur en H+ dans le plasma ne dépasse pas 40 x 106 mmol/l et que les principales bases tampons du plasma HCO3- et des anions protéiques sont d'environ 42 mmol/l, le sang est considéré comme un milieu bien tamponné et a une réaction légèrement alcaline.
Les protéines et les anions HCO3- sont étroitement liés au métabolisme des électrolytes et du CBS. À cet égard, l'interprétation correcte des changements de leur concentration est d'une importance décisive pour évaluer les processus se produisant dans l'échange d'électrolytes, d'eau et de H+. Le CBS est soutenu par des systèmes tampons sanguins et tissulaires et par des mécanismes de régulation physiologiques qui impliquent les poumons, les reins, le foie et le tractus gastro-intestinal.
Mécanismes homéostatiques physicochimiques
Les mécanismes physicochimiques homéostatiques incluent les systèmes tampons du sang et des tissus et, en particulier, le système tampon carbonate. Lorsque l'organisme est exposé à des facteurs perturbateurs (acides, alcalis), le maintien de l'homéostasie acido-basique est assuré en premier lieu par un système tampon carbonate constitué d'acide carbonique faible (H 2 CO3) et du sel de sodium de son anion. (NaHCO3) dans un rapport de 1:20. Lorsque ce tampon entre en contact avec des acides, ces derniers sont neutralisés par le composant alcalin du tampon avec formation d'acide carbonique faible : NaHC03 + HCl > NaCl + H2C03
L'acide carbonique se dissocie en CO2 et H20. Le CO2 résultant excite le centre respiratoire et l'excès de dioxyde de carbone est éliminé du sang avec l'air expiré. Le tampon carbonate est également capable de neutraliser les bases en excès en se liant à l'acide carbonique pour former NaHCO3 et son excrétion ultérieure par les reins :
NaOH + H2C03 > NaHCO + H20.
La densité du tampon carbonate est faible et s'élève à 7 à 9 % de la capacité tampon totale du sang, cependant, ce tampon occupe une place centrale dans son importance dans le système tampon sanguin, car il est le premier à entrer en contact avec des facteurs perturbateurs et est étroitement lié à d’autres systèmes tampons et mécanismes de régulation physiologiques. Par conséquent, le système tampon carbonate est un indicateur sensible du CBS, de sorte que la détermination de ses composants est largement utilisée pour diagnostiquer les troubles du CBS.
Le deuxième système tampon du plasma sanguin est un tampon phosphate formé de sels de phosphate monobasiques (acides faibles) et dibasiques (bases fortes) : NaH2P04 et Na2HP04 dans un rapport de 1:4. Le tampon phosphate agit de la même manière que le tampon carbonate. Le rôle stabilisant du tampon phosphate dans le sang est insignifiant ; il joue un rôle beaucoup plus important dans la régulation rénale de l'homéostasie acido-basique, ainsi que dans la régulation de la réaction active de certains tissus. Le tampon phosphate dans le sang joue un rôle important dans le maintien de l’ACR et la reproduction du tampon bicarbonate :
H2CO3 + Na2HPO4 > NaHC03 + NaH2PO 4 c'est-à-dire l'excès de H2C03 est éliminé, la concentration de NaHC03 augmente et le rapport H2C03/NaHC03 reste constant à 1:20.
Le troisième système tampon sanguin est constitué de protéines dont les propriétés tampons sont déterminées par leur amphotéricité. Ils peuvent se dissocier pour former à la fois H+ et OH-. Cependant, le pouvoir tampon des protéines plasmatiques est faible par rapport aux bicarbonates. Le plus grand pouvoir tampon du sang (jusqu’à 75 %) est l’hémoglobine. L'histidine, qui fait partie de l'hémoglobine, contient à la fois des groupes acides (COOH) et basiques (NH2).
Les propriétés tampons de l'hémoglobine sont dues à la possibilité d'interaction des acides avec le sel de potassium de l'hémoglobine pour former une quantité équivalente du sel de potassium correspondant et de l'hémoglobine libre, qui possède les propriétés d'un acide organique très faible. De cette façon, ils peuvent communiquer grandes quantités H+. La capacité à lier H+ dans les sels d’Hb est plus prononcée que dans les sels d’oxyhémoglobine (HbO2). En d’autres termes, l’hémoglobine est un acide organique plus faible que l’oxyhémoglobine. À cet égard, lors de la dissociation de l'HbO, une quantité supplémentaire de bases (sels d'Hb) apparaît dans les capillaires tissulaires sur l'O2 et l'Hb, capables de lier le dioxyde de carbone, contrecarrant la diminution du pH, et vice versa, l'oxygénation de l'Hb entraîne au déplacement du H2CO3 du bicarbonate. Ces mécanismes opèrent lors de la conversion du sang artériel en sang veineux et vice versa, ainsi que lors de la modification de la pCO2.
L'hémoglobine est capable de lier le dioxyde de carbone à l'aide de groupes aminés libres, formant ainsi de la carbohémoglobine.
R-NH2 + CO2 - R-NHCOOH
Ainsi, NHC03 dans le système tampon carbonate lors de « l'agression » des acides est compensé par des protéines alcalines, des phosphates et des sels d'hémoglobine.
L'échange de Cl et HCO3 entre les érythrocytes et le plasma est extrêmement important dans le maintien du CBS. Avec une augmentation de la concentration de dioxyde de carbone dans le plasma, la concentration de Cl diminue, car les ions chlore passent dans les globules rouges. La principale source de Cl dans le plasma est le NaCl. À mesure que la concentration de H2CO3 augmente, la liaison entre Na+ et Cl- se rompt et leur séparation se produit, les ions chlore entrant dans les érythrocytes et les ions sodium restant dans le plasma, puisque la membrane érythrocytaire leur est pratiquement imperméable. Dans le même temps, l'excès de Na+ qui en résulte se combine avec l'excès de HCO3-, formant du bicarbonate de sodium et reconstituant sa perte lors de l'acidification du sang, maintenant ainsi un pH sanguin constant.
Une diminution de la pCO2 dans le sang provoque le processus inverse : les ions chlore quittent les globules rouges et se combinent avec l'excès d'ions sodium libérés par NaHC03, ce qui empêche l'alcalinisation du sang.
Les systèmes tampons tissulaires jouent un rôle important dans le maintien du CBS : ils contiennent des systèmes tampons carbonate et phosphate. Cependant, les protéines tissulaires jouent un rôle particulier, car elles ont la capacité de lier de très grandes quantités d’acides et d’alcalis.
Les processus métaboliques homéostatiques qui se produisent dans les tissus, en particulier dans le foie, les reins et les muscles, jouent un rôle tout aussi important dans la régulation du CBS. Les acides organiques, par exemple, peuvent être oxydés pour former des acides volatils qui sont facilement libérés par le corps (principalement sous forme de dioxyde de carbone) ou se combiner avec des produits du métabolisme des protéines, perdant totalement ou partiellement leurs propriétés acides.
L'acide lactique, formé en grande quantité lors d'un travail musculaire intense, peut être resynthétisé en glycogène, et les corps cétoniques en corps plus élevés. acide gras, puis en graisses, etc. Les acides inorganiques peuvent être neutralisés par les sels de potassium et de sodium, libérés lorsque les acides aminés sont désaminés avec de l'ammoniac pour former des sels d'ammonium.
Les alcalis peuvent être neutralisés par le lactate, qui est intensément formé à partir du glycogène lorsque le pH des tissus change. Le CBS est maintenu grâce à la dissolution des acides et alcalis forts dans les lipides, à leur liaison par divers substances organiques en sels non dissociables et insolubles, échange d'ions entre les cellules de divers tissus et le sang.
En fin de compte, le maillon déterminant dans le maintien de l'homéostasie acido-basique est le métabolisme cellulaire, puisque le flux transmembranaire d'anions et de cations et leur répartition entre les secteurs extra- et intracellulaires sont le résultat de l'activité cellulaire et sont soumis aux besoins de cette activité.
Mécanismes homéostatiques physiologiques
Un rôle tout aussi important dans le maintien de l’homéostasie acido-basique est joué par les mécanismes homéostatiques physiologiques, parmi lesquels le rôle principal appartient aux poumons et aux reins. Les acides organiques formés au cours du processus métabolique, ou les acides qui pénètrent dans l'organisme de l'extérieur, grâce aux systèmes tampons du sang, déplacent le dioxyde de carbone de ses composés avec les bases, et l'excès de CO2 qui en résulte est excrété par les poumons.
Le dioxyde de carbone diffuse environ 20 fois plus intensément que l'oxygène. Ce processus est facilité par deux mécanismes :
la transition de l'hémoglobine en oxyhémoglobine (l'oxyhémoglobine, en tant qu'acide plus fort, déplace le CO2 du sang) ;
L'action de l'anhydrase carbonique pulmonaire anhydrase carbonique
n2co3 - co2+ n2o.
La quantité de dioxyde de carbone éliminée du corps par les poumons dépend de la fréquence et de l'amplitude de la respiration et est déterminée par la teneur en dioxyde de carbone du corps.
La participation des reins au maintien du CBS est principalement déterminée par leur fonction excrétrice d'acide. Dans des conditions normales, les reins produisent une urine dont le pH varie de 5,0 à 7,0. Le pH de l’urine peut atteindre 4,5, ce qui indique un excès de H+ de 800 fois par rapport au plasma sanguin. L'acidification de l'urine dans les tubules rénaux proximaux et distaux est une conséquence de la sécrétion de H+ (acidogenèse). L'anhydrase carbonique de l'épithélium des tubules rénaux joue un rôle important dans ce processus. Cette enzyme accélère l'atteinte de l'équilibre entre la lente réaction d'hydratation et de déshydratation de l'acide carbonique :
anhydrase carbonique
n2co3 - n2o + co2
À mesure que le pH diminue, le taux de H2CO3 non catalysé > H2 + HCO3- augmente. Grâce à l'acidogenèse, les composants acides du tampon phosphate (H + + HP04 2- > H2PO4-) et les acides organiques faibles (lactique, citrique, β-hydroxybutyrique, etc.) sont éliminés de l'organisme. La libération de H+ par l'épithélium des tubules rénaux se produit selon un gradient électrochimique avec des coûts énergétiques, et en même temps se produit la réabsorption d'une quantité équivalente de Na+ (une diminution de la réabsorption de Na+ s'accompagne d'une diminution de l'acidogénèse). Le Na+ réabsorbé par l'acidogenèse forme du bicarbonate de sodium dans le sang avec le HCO3- sécrété par l'épithélium des tubules rénaux.
Na + + HC03 -> NaHC03
Les ions H+ sécrétés par l'épithélium des tubules rénaux interagissent avec les anions des composés tampons. L'acidogénèse assure la libération d'anions majoritairement de tampons carbonate et phosphate et d'anions d'acides organiques faibles.
Les anions d'acides organiques et inorganiques forts (CI-, S0 4 2-) sont éliminés du corps par les reins en raison de l'ammoniogenèse, qui assure l'excrétion des acides et empêche le pH urinaire de diminuer en dessous du niveau critique des tubules distaux et conduits collecteurs. Le NH3, formé dans l'épithélium des tubules rénaux lors de la désamination de la glutamine (60 %) et d'autres acides aminés (40 %), entrant dans la lumière des tubules, se combine avec le H+ formé lors de l'acidogenèse. Ainsi, l'ammoniac lie les ions hydrogène et élimine les anions des acides forts sous forme de sels d'ammonium.
L'ammoniogenèse est étroitement liée à l'acidogenèse, donc la concentration d'ammonium dans l'urine est directement dépendante de la concentration en H+ qu'elle contient : l'acidification du sang, accompagnée d'une diminution du pH du liquide tubulaire, favorise la diffusion de l'ammoniac depuis le cellules. L'excrétion d'ammonium est également déterminée par le taux de sa production et le débit urinaire.
Les chlorures jouent un rôle important dans la régulation de l'excrétion acide par les reins - une augmentation de la réabsorption de HCO3- s'accompagne d'une augmentation de la réabsorption des chlorures. L’ion chlorure suit passivement le cation sodium. Le changement dans le transport des chlorures est une conséquence du changement primaire dans la sécrétion d'ions H+ et la réabsorption de HCO3 et est dû à la nécessité de maintenir la neutralité électrique de l'urine tubulaire.
En plus de l'acidose et de l'ammoniogenèse, un rôle important dans la préservation du Na+ lors de l'acidification du sang appartient à la sécrétion de potassium. Le potassium, libéré par les cellules lorsque le pH du sang diminue, est intensément excrété par l'épithélium des tubules rénaux tout en augmentant simultanément le réabsorption de Na+ - cela affecte l'effet régulateur des minéralocorticoïdes : aldostérone et désoxycorticostérone. Normalement, les reins sécrètent principalement des produits métaboliques acides, mais avec un apport accru de bases dans l'organisme, la réaction urinaire devient plus alcaline en raison de la sécrétion accrue de bicarbonate et de phosphate basique.
Le tractus gastro-intestinal joue un rôle important dans la régulation excrétrice du CBS. L'acide chlorhydrique se forme dans l'estomac : H+ est sécrété par l'épithélium gastrique et CI- provient du sang. En échange de chlorures, le bicarbonate pénètre dans le sang lors de la sécrétion gastrique, mais l'alcalinisation du sang ne se produit pas, puisque le CI- suc gastrique est réabsorbé dans le sang. Dans l'intestin, l'épithélium de la muqueuse intestinale sécrète des sucs alcalins riches en bicarbonates. . Dans ce cas, H+ passe dans le sang sous forme de HCl. Un changement à court terme de la réaction est immédiatement compensé par la réabsorption de NaHC03 dans l’intestin. Tractus intestinal Contrairement aux reins, qui concentrent et libèrent principalement du K+ et des cations monovalents de l'organisme, ils concentrent et éliminent les ions alcalins divalents de l'organisme. Avec un régime acide, la libération de Ca2+ et de Mg2+ principalement augmente, et avec un régime alcalin, la libération de tous les cations augmente.
État acido-basique- l'un des paramètres physiques et chimiques les plus importants de l'environnement interne de l'organisme. Dans le corps d'une personne en bonne santé, des acides se forment constamment quotidiennement au cours du processus métabolique - environ 20 000 mmol d'acide carbonique (H 2 C0 3) et 80 mmol d'acides forts, mais la concentration de H + fluctue dans une plage relativement étroite. Normalement, le pH du liquide extracellulaire est de 7,35 à 7,45 (45 à 35 nmol/l) et le liquide extracellulaire est en moyenne de 6,9. Dans le même temps, il convient de noter que H+ à l’intérieur de la cellule est hétérogène : il est différent dans les organites d’une même cellule.
Les H+ sont si capables que même un changement à court terme de leur concentration dans la cellule peut affecter de manière significative l'activité des systèmes enzymatiques et physiologiques.
processus. Cependant, normalement, les systèmes tampons sont activés instantanément, protégeant la cellule des fluctuations défavorables du pH. Le système tampon peut lier ou, à l'inverse, libérer H + immédiatement
en réponse aux changements de l'acidité du liquide intracellulaire.
Les systèmes tampons fonctionnent également au niveau de l'organisme dans son ensemble, mais, en
En fin de compte, la régulation du pH du corps est déterminée par le fonctionnement des poumons et des reins.
Alors c'est quoi état acido-basique (synonymes : équilibre acido-basique, état acido-basique, équilibre acido-basique, homéostasie acido-basique). Il s'agit de la constance relative de la valeur du pH de l'environnement interne du corps, due à l'action combinée du tampon et de certains systèmes physiologiques du corps (Dictionnaire encyclopédique des termes médicaux, vol. 2, p. 32).
L'équilibre acido-basique est la constance relative de l'indice d'hydrogène (pH) du milieu interne de l'organisme, due à l'action combinée du tampon et de certains systèmes physiologiques, qui détermine l'utilité des transformations métaboliques dans les cellules de l'organisme (BME , tome 10, p. 336).
Le rapport des ions hydrogène et hydroxyle dans l'environnement interne du corps dépend de :
1) activité enzymatique et intensité des réactions redox ;
2) processus d'hydrolyse et de synthèse des protéines, de glycolyse et d'oxydation des glucides et des graisses ;
3) sensibilité des récepteurs aux médiateurs ;
4) perméabilité de la membrane ;
5) la capacité de l'hémoglobine à lier l'oxygène et à le libérer dans les tissus ;
6) caractéristiques physicochimiques des colloïdes et des structures intercellulaires : degré de leur dispersité, hydrophilie, capacité d'adsorption ;
7) fonctions de divers organes et systèmes.
Le rapport H + et OH" dans les milieux biologiques dépend de la teneur en acides (donneurs de protons) et en bases tampons (accepteurs de protons) dans les fluides corporels. La réaction active du milieu est évaluée par l'un des ions (H + ou OH -), le plus souvent par H +. La teneur en H+ dans l'organisme dépend de leur formation au cours du métabolisme des protéines, des graisses et des glucides, ainsi que de leur entrée dans l'organisme ou de son élimination sous forme d'acides ou d'acides non volatils. gaz carbonique.
La valeur du pH, qui caractérise l'état du CBS, est l'un des paramètres sanguins les plus « durs » et varie chez l'homme dans des limites très étroites : de 7,3 5 à 7,45l. Un changement de pH de 0,1 au-delà des limites spécifiées provoque des troubles prononcés du système respiratoire, cardiovasculaire, etc., une diminution du pH de 0,3 entraîne un coma acidosique et un changement de pH de 0,4 est souvent incompatible avec la vie.
L’échange d’acides et de bases dans le corps est étroitement lié à l’échange d’eau et d’électrolytes. Tous ces types d'échanges sont unis par la loi de neutralité électrique, d'isosmolarité et de mécanismes physiologiques homéostatiques.
La quantité totale de cations plasmatiques est de 155 mmol/l (Na+ - 142 mmol/l ; K+ - 5 mmol/l ; Ca 2+ - 2,5 mmol/l ; Mg 2 + 0,5 mmol/l ; autres éléments - 1,5 mmol /l), et la même quantité d'anions est contenue (103 mmol/l - base faible CI ~ ; 27 mmol/l - base forte HCO, - ; 7,5-9 mmol/l - anions protéiques ; 1,5 mmol/l - phosphate anions ; 0,5 mmol/l - anions sulfate ; 5 mmol/l - acides organiques). Étant donné que la teneur en H+ du plasma ne dépasse pas 40 x 10 -6 mmol/l et que les principales bases tampons plasmatiques (HCO3-) des anions protéiques sont d'environ 42 mmol/l, le sang est considéré comme un milieu bien tamponné et a une réaction légèrement alcaline. .
Bloc de location
Tous les systèmes tampons du corps sont impliqués dans le maintien de l'homéostasie acido-basique (l'équilibre des concentrations optimales de composants acides et basiques des systèmes physiologiques). Leurs actions sont interconnectées et sont en équilibre. Le tampon hydrocarboné est le plus associé à tous les systèmes tampons. Les perturbations dans tout système tampon affectent les concentrations de ses composants, de sorte que les changements dans les paramètres du système tampon hydrocarboné peuvent caractériser assez précisément le CBS du corps.
Le CBS sanguin est normalement caractérisé par les paramètres métaboliques suivants :
pH plasmatique 7,4 ± 0,05 ;
[HCO3-]=(24,4±3) mol/l - réserve alcaline ;
рСО2=40 mm Hg - pression partielle de CO2 au-dessus du sang.
D’après l’équation de Henderson-Hasselbach pour un tampon bicarbonate, il est évident que lorsque la concentration ou la pression partielle de CO2 change, le CBS sanguin change.
Maintenir la valeur de réaction optimale de l'environnement dans diverses pièces Le corps est atteint grâce au travail coordonné des systèmes tampons et des organes excréteurs. Un déplacement de la réaction du milieu vers le côté acide est appelé acidose, et en gros – alcalose. Les valeurs critiques pour préserver la vie sont : un passage du côté acide à 6,8 et du côté basique à 8,0. L'acidose et l'alcalose peuvent être d'origine respiratoire ou métabolique.
Acidose métabolique se développe en raison de :
a) production accrue d'acides métaboliques ;
b) à la suite d'une perte de bicarbonates.
Une production accrue d'acides métaboliques se produit avec : 1) un diabète sucré de type I, un jeûne prolongé et complet ou une forte réduction de la proportion de glucides dans l'alimentation ;
2) acidose lactique (choc, hypoxie, diabète sucré de type II, insuffisance cardiaque, infections, intoxication alcoolique).
Une perte accrue de bicarbonates est possible dans les urines (acidose rénale), ou avec certains sucs digestifs (pancréatiques, intestinaux).
Acidose respiratoire se développe avec l'hypoventilation exaltation des poumons qui, quelle que soit la cause qui l'a provoquée, entraîne une augmentation de la pression partielle de CO2 à plus de 40 mm Hg. Art. (hypercapnie). Cela se produit avec des maladies du système respiratoire, une hypoventilation des poumons, une dépression du centre respiratoire avec certains médicaments, par exemple les barbituriques.
Alcalose métabolique observé avec des pertes importantes suc gastrique dû à des vomissements répétés, ainsi qu'à la perte de protons dans les urines lors d'hypokaliémie, de constipation (lorsque des produits alcalins s'accumulent dans les intestins ; après tout, la source d'anions bicarbonates est le pancréas, dont les conduits ouvert dans le duodénum), ainsi que lors d'une prise prolongée d'aliments alcalins et d'eau minérale dont les sels subissent une hydrolyse par anion.
Respiratoire (respiratoire) alcalose se développe à la suite d’une hypervitesse Ntilation des poumons, entraînant une élimination excessive du CO2 du corps et une diminution de sa pression partielle dans le sang à moins de 40 mm. Hg Art. (hypocapnie). Cela se produit lors de l'inhalation d'air raréfié, d'une hyperventilation des poumons, du développement d'un essoufflement thermique, d'une excitation excessive du centre respiratoire due à des lésions cérébrales.
Pour l'acidose comme mesure d'urgence utiliser une perfusion intraveineuse de bicarbonate de sodium à 4 à 8 %, une solution à 3,66 % de trisamine H2NC(CH2OH)3 ou à 11 % de lactate de sodium. Cette dernière, tout en neutralisant les acides, n’émet pas de CO2, ce qui augmente son efficacité.
Les alcaloses sont plus difficiles à corriger, notamment métaboliques (associées à un dysfonctionnement des systèmes digestif et excréteur). Parfois, une solution à 5 % d'acide ascorbique est utilisée, neutralisée avec du bicarbonate de sodium à pH 6 - 7.
Réserve alcaline- c'est la quantité de bicarbonate (NaHC03) (plus précisément, le volume de CO2 pouvant être fixé par le plasma sanguin). Cette valeur ne peut être considérée que sous certaines conditions comme un indicateur de l'équilibre acido-basique, car, malgré l'augmentation ou la diminution de la teneur en bicarbonate, en présence de modifications appropriées du H2CO3, le pH peut rester tout à fait normal.
Puisque les possibilités de compensation grâce à respiration, initialement utilisés par l'organisme, sont limités, le rôle décisif dans le maintien de la constance revient aux reins. L’une des tâches principales des reins est d’éliminer les ions H+ du corps dans les cas où, pour une raison quelconque, une évolution vers une acidose se produit dans le plasma. Acidose ne peut être corrigé que si la quantité appropriée d’ions H est éliminée. Les reins utilisent 3 mécanismes :
1. Échange d'ions hydrogène en ions sodium qui, combinés aux anions HCO3 formés dans les cellules tubulaires, sont entièrement réabsorbés sous forme de NaHCO,
La condition préalable à la libération d'ions H à l'aide de ce mécanisme est la réaction activée par l'anhydrase carbonique CO2 + H20 = H2CO3, et H2CO3 se décompose en ions H et HCO3. Dans cet échange ions hydrogène en ions sodium, il se produit une réabsorption de tout le bicarbonate de sodium filtré dans les glomérules.
2. Excrétion d'ions hydrogène dans l'urine et la réabsorption des ions sodium se produit également en convertissant le sel alcalin du phosphate de sodium (Na2HP04) en sel acide du diphosphate de sodium (NaHaPO4) dans les tubules distaux.
3. Formation de sels d'ammonium : l'ammoniac, formé dans les parties distales des tubules rénaux à partir de la glutamine et d'autres acides aminés, favorise la libération des ions H et la réabsorption des ions sodium ; Le NH4Cl se forme en raison de la combinaison de l'ammoniac et du HCl. L'intensité de la formation d'ammoniac, nécessaire pour neutraliser le HCl fort, est d'autant plus grande que l'acidité de l'urine est élevée.
Tableau 3
Paramètres de base de CBS
(valeur moyenne dans le sang artériel)
40 mm. Hg Art.
(pression partielle de CO2 dans le plasma sanguin)
Cette composante reflète directement la composante respiratoire dans la régulation du CBS (CAR).
(hypercapnie) est observée avec une hypoventilation, caractéristique de l'acidose respiratoire.
Une ↓ (hypocapnie) est observée lors d'une hyperventilation, caractéristique de l'alcalose respiratoire. Cependant, les changements de pCO2 peuvent également être une conséquence de la compensation des troubles métaboliques du CBS. Pour distinguer ces situations les unes des autres, il faut considérer le pH et le [HCO3-]
95 millimètres. Hg Art. (pression partielle dans le plasma sanguin)
SB ou SB
SB – bicarbonate plasmatique standard, c'est-à-dire [НСО3-] ↓ - avec acidose métabolique ou avec compensation de l'alcalose respiratoire.
Pour l'alcalose métabolique ou la compensation de l'acidose respiratoire.
Index supplémentaires
BO ou BB
(tampons de base)
Bases tampons. Il s’agit de la somme de tous les anions du sang total appartenant aux systèmes tampons.
AVANT ou BD
(déficit de base)
Carence en bases. C’est la différence entre la valeur BO pratique et appropriée dans l’acidose métabolique. Défini comme le nombre de bases qu'il faut ajouter au sang pour ramener son pH à la normale (à pCO2 = 40 mmHg à = 38°C)
IO ou ÊTRE
(excédent de base)
Excédent de base. C'est la différence entre les valeurs BO réelles et attendues dans l'alcalose métabolique.
Normalement, relativement parlant, il n'y a ni déficit ni excès de bases (ni DO ni IO). En fait, cela se traduit par le fait que la différence entre le BO attendu et réel est dans des conditions normales de ±2,3 meq/l. L'écart de cet indicateur par rapport à la plage normale est typique des troubles métaboliques du CBS. Des valeurs anormalement élevées sont typiques pour alcalose métabolique. Anormalement bas – pour acidose métabolique.
Travaux pratiques et laboratoire
Expérience 1. Comparaison de la capacité tampon du sérum sanguin et du phosphate BS
Mesurer ml
N flacon
Sérum sanguin (dilution 1:10)
Phosphate BS (dilué 1:10), pH = 7,4
Phénolphtaléine (indicateur)
2. Systèmes tampons sanguins. Le rôle des systèmes tampons dans le maintien de l’homéostasie du pH. État acido-basique. Le concept d'acidose et d'alcalose.
Dans l’organisme, la formation d’acide prédomine sur la formation de composés basiques.
Sources de H+ dans l’organisme :
1. acide volatil H2CO3, 10 à 20 000 mmol de CO2 par jour lors de l'oxydation des protéines, F, U.
2.acides non volatils par jour. 70 mmol :
Phosphorique lors de la dégradation des phosphates organiques (nucléotides, PL, phosphoprotéines)
Sulfurique, chlorhydrique lors de l'oxydation B
3.org.k-you : lait, corps cétoniques, PVC, etc.
Le pH est maintenu à un niveau légèrement alcalin grâce à la participation de cellules tampons et au contrôle physiologique (fonction excrétrice des reins et fonction respiratoire des poumons)
Équation de Henderson-Hesselbach : pH = pKa + log [accumulateur de protons]/[donneur de protons].
(Sel) (acide)
Tout tampon est constitué d’un couple acide-base conjugué : donneur de protons + accepteur.
Capacité tampon : dépend des concentrations absolues des composants tampons.
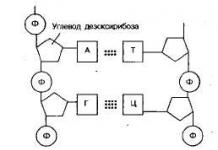
Bicarbonate.
Capacité sanguine tampon de 10 %.
À un pH sanguin normal (7,4), la concentration d'ions bicarbonate HCO 3 dans le plasma sanguin dépasse la concentration de CO 2 d'environ 20 fois. Le système tampon au bicarbonate fonctionne comme un régulateur efficace dans la plage de pH de 7,4.
Le mécanisme d'action de ce système est que lorsque des quantités relativement importantes de produits acides sont libérées dans le sang, les ions hydrogène H + interagissent avec les ions bicarbonate HCO 3 –, ce qui conduit à la formation d'acide carbonique faiblement dissocié H 2 CO 3. Une diminution ultérieure de la concentration de H 2 CO 3 est obtenue à la suite de la libération accélérée de CO 2 à travers les poumons en raison de leur hyperventilation (rappelons que la concentration de H 2 CO 3 dans le plasma sanguin est déterminée par le pression du CO 2 dans le mélange gazeux alvéolaire).
Si la quantité de bases dans le sang augmente, elles interagissent avec l'acide carbonique faible pour former des ions bicarbonate et de l'eau. Dans ce cas, aucun changement notable de la valeur du pH ne se produit. De plus, pour maintenir un rapport normal entre les composants du système tampon, dans ce cas, des mécanismes physiologiques de régulation de l'équilibre acido-basique sont activés : une certaine quantité de CO 2 est retenue dans le plasma sanguin du fait de l'hypoventilation du poumons.
NaHCO3 + H+ → Na+ + H2CO3
Reabs dans les reins ↓anhydrase carbonique
↓augmentation de la ventilation des poumons
Le phosphate est une paire acide-base conjuguée constituée d'un ion H 2 PO 4 – (donneur de protons) et d'un ion HPO 4 2 – (accepteur de protons) :
 Le système tampon phosphate ne représente que 1 % de la capacité tampon du sang. Dans le liquide extracellulaire, y compris le sang, le rapport [HPO 4 2– ] : [H 2 PO 4 – ] est de 4 : 1. L'effet tampon du système phosphate repose sur la possibilité de lier les ions hydrogène avec les ions HPO 4 2– pour former H 2 PO 4 – (H + + + HPO 4 2– -> H 2 PO 4 –), ainsi que OH – ions avec ions H 2 PO 4 – (OH – + + H 2 R O 4 – -> HPO 4 2– + H 2 O). La paire de tampons (H 2 PO 4 – –HPO 4 2–) est capable d'influencer les modifications du pH dans la plage de 6,1 à 7,7 et peut fournir une certaine capacité tampon du liquide intracellulaire, dont la valeur du pH est comprise dans la plage de 6,9 à 7, 4. Dans le sang, la capacité maximale du tampon phosphate apparaît autour de la valeur pH de 7,2.
Le système tampon phosphate ne représente que 1 % de la capacité tampon du sang. Dans le liquide extracellulaire, y compris le sang, le rapport [HPO 4 2– ] : [H 2 PO 4 – ] est de 4 : 1. L'effet tampon du système phosphate repose sur la possibilité de lier les ions hydrogène avec les ions HPO 4 2– pour former H 2 PO 4 – (H + + + HPO 4 2– -> H 2 PO 4 –), ainsi que OH – ions avec ions H 2 PO 4 – (OH – + + H 2 R O 4 – -> HPO 4 2– + H 2 O). La paire de tampons (H 2 PO 4 – –HPO 4 2–) est capable d'influencer les modifications du pH dans la plage de 6,1 à 7,7 et peut fournir une certaine capacité tampon du liquide intracellulaire, dont la valeur du pH est comprise dans la plage de 6,9 à 7, 4. Dans le sang, la capacité maximale du tampon phosphate apparaît autour de la valeur pH de 7,2.
1 et 2 – sortie.
Les protéines sont moins importantes pour maintenir le COR dans le plasma sanguin que les autres systèmes tampons. Les protéines forment un système tampon en raison de la présence de groupes acido-basiques dans la molécule protéique : protéine – H + (acide, donneur de protons) et protéine (base conjuguée, accepteur de protons). Le système tampon protéique du plasma sanguin est efficace dans la plage de pH comprise entre 7,2 et 7,4.
Le système tampon d’hémoglobine est le système tampon le plus puissant du sang. Il est 9 fois plus puissant qu’un tampon bicarbonate ; il représente 75 % de la capacité tampon totale du sang. se compose d'hémoglobine non ionisée HHb (acide organique faible, donneur de protons) et de sel de potassium de l'hémoglobine KHb (base conjuguée, accepteur de protons). Le système tampon oxyhémoglobine peut être envisagé de la même manière. Le système hémoglobine et le système oxyhémoglobine sont des systèmes interconvertibles et existent comme un tout.
Mécanisme d'action :
Dans les tissus : H2O + CO2 (anhydrase carbonique) -> H2CO3 -> H++ HCO3 - (diffuse dans le plasma sanguin)
KNvO2 ->KNv + 4O2
KHb + 2H+ -> HHb + 2K+ (la K-hémoglobine neutralise les ions H+)
Dans les poumons : HHb + 4O2 -> 2H+ + HbO2
2H+ + HBO2 + 2K+ + 2HCO3- ->KHBO2 + 2H2CO3 (anhydrase carbonique) ->H2O + 2CO2
Le pH et la concentration de CO2 affectent la libération et la liaison de l'O2 par effet némoglobine - Bore.
L'augmentation de la concentration de protons, CO2, favorise la libération d'O2, et l'augmentation de la concentration d'O2 stimule la libération de CO2 et de protons.
La concentration en ions hydrogène [H+] dans les cellules et les liquides détermine leur équilibre acido-basique (ABC). L'ASR est évalué par la valeur du pH - l'indice d'hydrogène : pH - le logarithme décimal négatif de la valeur molaire dans le milieu.
La réaction sanguine est légèrement alcaline : pH = 7,35-7,55 - une des constantes rigides de l'homéostasie. Un changement de pH de 0,3 à 0,4 est mortel.
Le corps produit près de 20 fois plus de produits acides que de produits alcalins. À cet égard, des systèmes de neutralisation des composés en excès aux propriétés acides sont nécessaires. La régulation de l'ASR s'effectue à la fois par des mécanismes chimiques et physiologiques.
1. Mécanismes chimiques la régulation se produit au niveau moléculaire. Ceux-ci incluent des systèmes tampons sanguins et une réserve alcaline.
Systèmes tampons. Le principe de fonctionnement des systèmes tampons est basé sur le remplacement d'un acide fort par un acide faible, lors de la dissociation duquel moins d'ions H+ se forment et, par conséquent, le pH diminue dans une moindre mesure. Les systèmes tampons sanguins sont plus résistants aux acides qu’aux bases.
1. Système tampon d’hémoglobine. Il représente 75 % de la capacité tampon du sang total. Ce système comprend de l'hémoglobine réduite et le sel de potassium de l'hémoglobine réduite (HHb/KHb). Les propriétés tampons du système sont dues au fait que KHb, en tant que sel d'un acide faible, cède l'ion K+ et fixe l'ion H+, formant un acide faiblement dissocié :
H+ + KHb = K+ + HHb
Grâce à la diminution de l'hémoglobine, capable de lier les ions CO2 et H+, le pH du sang circulant dans les tissus reste constant. Dans ces conditions, HHb fait office de base. Dans les poumons, l’hémoglobine se comporte comme un acide (l’oxyhémoglobine HHbO2 est un acide plus fort que le CO2), ce qui empêche le sang de devenir alcalin.
2. Le système tampon carboné (H2CO3/NaHCO3) se classe au deuxième rang en termes de puissance. Ses fonctions s'exercent comme suit : NaHCO3 se dissocie en ions Na+ et HCO3-. Si un acide plus fort que l'acide carbonique pénètre dans le sang, alors un échange d'ions Na+ se produit avec la formation d'acide carbonique faiblement dissocié et facilement soluble, ce qui empêche une augmentation de la concentration d'ions H+ dans le sang. Une augmentation de la concentration d'acide carbonique entraîne sa décomposition (sous l'influence de l'enzyme anhydrase carbonique présente dans les érythrocytes) en H2O et CO2. Cette dernière pénètre dans les poumons et est rejetée dans l'environnement. Si une base pénètre dans le sang, elle réagit avec l'acide carbonique, formant du bicarbonate de sodium (NaHCO3) et de l'eau, ce qui empêche encore une fois le pH de passer du côté alcalin.
Dans le sang total, 75 % des propriétés tampons sont assurées par le système hémoglobine, et dans le plasma par le système carbonate.
3. Le système tampon phosphate est formé de dihydrogénophosphate de sodium et d'hydrogénophosphate de sodium (NaH2PO4/Na2HPO4). Le premier composé se comporte comme un acide faible, le second comme un sel d'acide faible. Avec une augmentation du taux d'acides dans le plasma sanguin, la concentration de H2CO3 augmente et la teneur en NaHCO3 diminue :
H2CO3 + Na2HPO4 = NaHCO3 + NaH2PO4
En conséquence, l’excès d’acide carbonique est éliminé et le niveau de NaHCO3 augmente. Des quantités excessives de NaH2PO4 sont éliminées dans l’urine, de sorte que le rapport NaH2PO4/Na2HPO4 ne change pas.
Le système tampon phosphate aide à maintenir le système tampon carbonate.
4. Système tampon protéique : protéines - polymères d'acides aminés COOH - R - NH3
Le système tampon protéique (protéine-COOH/protéine-COONa) est le principal tampon intracellulaire. Les protéines sont des composés amphotères et peuvent neutraliser à la fois les acides et les alcalis (elles se comportent comme des bases dans un environnement acide et comme des acides dans un environnement basique).
Les systèmes tampons les plus puissants se trouvent chez les animaux biologiquement adaptés au travail musculaire intense. Au cours du processus métabolique, le corps produit plus de produits acides que de produits alcalins, il existe donc une réserve de substances alcalines dans le sang - une réserve alcaline.
La réserve alcaline du sang est la somme de toutes les substances alcalines présentes dans le sang, principalement les bicarbonates de sodium et de potassium. La quantité de réserve alcaline est déterminée par la quantité de CO2 qui peut être liée par 100 ml de sang à une tension de CO2 de 40 mm Hg. Art. - méthode gazométrique pour déterminer la réserve alcaline du sang. La méthode titrométrique est basée sur la détermination de la capacité acide du sang (voir Techniques de laboratoire).
La valeur de la réserve alcaline du sang, déterminée par des méthodes titrimétriques et gazométriques
| Vue animale | Réserve alcaline, mg % | Réserve alcaline, ml CO2 |
| KRS | 460- 540 | 55 |
| Mouton | 460- 520 | 48 |
| Cheval | 470- 620 | 57 |
| Chien | - | 50 |
2. Les mécanismes physiologiques de régulation de l'ASR comprennent des mécanismes neurohumoraux complexes affectant les fonctions de divers systèmes organiques (reins, glandes sudoripares et salivaires, foie, pancréas, tractus gastro-intestinal).
La régulation nerveuse joue un rôle important dans le maintien d’un pH sanguin constant. Dans ce cas, les chimiorécepteurs des zones réflexogènes vasculaires sont principalement irrités, dont les impulsions pénètrent dans le bulbe rachidien et d'autres parties du système nerveux central, qui incluent par réflexe les organes périphériques dans la réaction - reins, poumons, glandes sudoripares, tractus gastro-intestinal, etc., dont l'activité vise à restaurer les valeurs de pH d'origine. Ainsi, lorsque le pH passe du côté acide, les reins excrètent intensément l’anion H2PO4- dans l’urine. Lorsque le pH sanguin passe du côté alcalin, la libération d’anions HPO2- et HCO3- par les reins augmente. Les glandes sudoripares sont capables d'éliminer l'excès d'acide lactique et les poumons - le CO2.
Avec certaines réactions physiologiques et pathologiques, une augmentation de la teneur en produits acides ou alcalins dans le sang est possible. Un déplacement de l'acide riche en acide vers le côté acide est appelé acidose et vers le côté alcalin - alcalose.
Selon l'ampleur du déplacement du facteur de correction acide, les acidoses et les alcaloses sont compensées et non compensées :
- acidose ou alcalose compensée - le pH sanguin ne change pas, mais la capacité tampon diminue ;
- acidose ou alcalose non compensée - la capacité tampon diminue et la réaction sanguine change. L'alcalose est moins courante.
Selon les mécanismes d'apparition, l'acidose et l'alcalose peuvent être gazeuses ou non gazeuses.
Acidose gazeuse - se développe lorsqu'il y a des difficultés respiratoires, que les animaux sont gardés dans des conditions de surpeuplement ou dans des zones mal ventilées. Le CO2 s'accumule dans le sang et se transforme en acide carbonique.
Acidose non gazeuse ou métabolique - avec accumulation dans le sang non pas d'acides carboniques, mais d'autres acides - lactique, phosphorique, etc.
- un travail musculaire intense,
- lors de l'alimentation d'une grande quantité d'ensilage acide ;
- un trouble du métabolisme des graisses et en partie des protéines, conduisant à l'accumulation de corps acétoniques dans l'organisme, qui s'observe dans le diabète sucré, le jeûne et les processus fébriles ;
- altération de la fonction excrétrice des reins, en raison de laquelle l'élimination des phosphates acides de l'organisme est réduite et les produits sous-oxydés sont retenus dans les tissus ;
- insuffisance cardiaque et pathologie du système respiratoire, qui entraînent des perturbations soudaines des processus oxydatifs dans l'organisme et l'accumulation de produits sous-oxydés dans celui-ci.
Alcalose gazeuse - avec une ventilation accrue des poumons, le sang contient moins de CO2 et s'alcalise.
L'alcalose non gazeuse est associée à l'apport d'une grande quantité de sels alcalins dans l'organisme, dans ce cas la réserve d'alcalinité du sang augmente ;
- lorsque la teneur en ions chlorure dans les tissus diminue, ce qui se produit avec des pertes importantes de suc gastrique provoquées par des vomissements répétés.