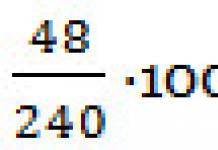Electronégativité (EO) est la capacité des atomes à attirer des électrons lors de la liaison avec d'autres atomes .
L'électronégativité dépend de la distance entre le noyau et les électrons de valence, ainsi que de la distance qui sépare la couche de valence. Plus le rayon d'un atome est petit et plus il y a d'électrons de valence, plus son EO est élevé.
Le fluor est l'élément le plus électronégatif. Premièrement, il possède 7 électrons dans sa couche de valence (il ne manque qu'un seul électron dans l'octet) et, deuxièmement, cette couche de valence (...2s 2 2p 5) est située à proximité du noyau.
Les atomes des métaux alcalins et alcalino-terreux sont les moins électronégatifs. Ils ont de grands rayons et leurs couches électroniques externes sont loin d’être complètes. Il leur est beaucoup plus facile de céder leurs électrons de valence à un autre atome (la coque externe deviendra alors complète) que de « gagner » des électrons.
L'électronégativité peut être exprimée quantitativement et les éléments peuvent être classés par ordre croissant. L'échelle d'électronégativité proposée par le chimiste américain L. Pauling est la plus souvent utilisée.
 La différence d'électronégativité des éléments d'un composé ( ΔX) vous permettra de juger du type de liaison chimique. Si la valeur ΔX= 0 – connexion covalent non polaire.
La différence d'électronégativité des éléments d'un composé ( ΔX) vous permettra de juger du type de liaison chimique. Si la valeur ΔX= 0 – connexion covalent non polaire.
Lorsque la différence d’électronégativité atteint 2,0, la liaison est appelée polaire covalente, par exemple : liaison H-F dans une molécule de fluorure d'hydrogène HF : Δ X = (3,98 - 2,20) = 1,78
Les liaisons avec une différence d'électronégativité supérieure à 2,0 sont considérées ionique. Par exemple : liaison Na-Cl dans un composé NaCl : Δ X = (3,16 - 0,93) = 2,23.
État d'oxydation
État d'oxydation (CO) est la charge conditionnelle d'un atome dans une molécule, calculée en supposant que la molécule est constituée d'ions et qu'elle est généralement électriquement neutre.


Lorsqu'une liaison ionique se forme, un électron passe d'un atome moins électronégatif à un atome plus électronégatif, les atomes perdent leur neutralité électrique et se transforment en ions. des charges entières apparaissent. Lorsqu'une liaison polaire covalente se forme, l'électron n'est pas transféré complètement, mais partiellement, ce qui entraîne l'apparition de charges partielles (HCl dans la figure ci-dessous). Imaginons que l'électron soit complètement transféré de l'atome d'hydrogène au chlore et qu'une charge entière positive de +1 apparaisse sur l'hydrogène et de -1 sur le chlore. Ces charges conventionnelles sont appelées état d’oxydation.


Cette figure montre les états d'oxydation caractéristiques des 20 premiers éléments.
Note. Le CO le plus élevé est généralement égal au numéro de groupe dans le tableau périodique. Les métaux des sous-groupes principaux ont une caractéristique CO, tandis que les non-métaux ont généralement une dispersion de CO. Par conséquent, les non-métaux forment un grand nombre de composés et ont des propriétés plus « diverses » que les métaux.
Exemples de détermination de l'état d'oxydation
Déterminons les états d'oxydation du chlore dans les composés :

Les règles que nous avons considérées ne nous permettent pas toujours de calculer le CO de tous les éléments, comme dans une molécule d'aminopropane donnée.

Ici, il est pratique d'utiliser la technique suivante :
1) Nous décrivons la formule développée de la molécule, le tiret est une liaison, une paire d'électrons.
2) Nous transformons le tiret en une flèche dirigée vers l'atome le plus EO. Cette flèche symbolise la transition d'un électron vers un atome. Si deux atomes identiques sont connectés, nous laissons la ligne telle quelle : il n'y a pas de transfert d'électrons.
3) Nous comptons combien d’électrons « sont venus » et « sont partis ».
Par exemple, calculons la charge du premier atome de carbone. Trois flèches sont dirigées vers l'atome, ce qui signifie que 3 électrons sont arrivés, charge -3.
Deuxième atome de carbone : l’hydrogène lui a donné un électron et l’azote a pris un électron. La charge n'a pas changé, elle est nulle. Etc.
Valence
Valence(du latin valēns « avoir de la force ») - la capacité des atomes à former un certain nombre de liaisons chimiques avec des atomes d'autres éléments.

Fondamentalement, valence signifie la capacité des atomes à former un certain nombre de liaisons covalentes. Si un atome a n des électrons non appariés et m paires d'électrons isolés, alors cet atome peut former n+m liaisons covalentes avec d'autres atomes, c'est-à-dire sa valence sera égale n+m. Lors de l'estimation de la valence maximale, il faut partir de la configuration électronique de l'état « excité ». Par exemple, la valence maximale d'un atome de béryllium, de bore et d'azote est de 4 (par exemple, dans Be(OH) 4 2-, BF 4 - et NH 4 +), de phosphore - de 5 (PCl 5), de soufre - de 6 ( H 2 SO 4) , chlore - 7 (Cl 2 O 7).
Dans certains cas, la valence peut coïncider numériquement avec l'état d'oxydation, mais elles ne sont en aucun cas identiques. Par exemple, dans les molécules de N2 et de CO, une triple liaison est réalisée (c'est-à-dire que la valence de chaque atome est de 3), mais l'état d'oxydation de l'azote est de 0, carbone +2, oxygène -2.




 Dans l'acide nitrique, l'état d'oxydation de l'azote est +5, tandis que l'azote ne peut pas avoir une valence supérieure à 4, car il n'a que 4 orbitales au niveau externe (et la liaison peut être considérée comme des orbitales qui se chevauchent). Et en général, tout élément de la deuxième période pour la même raison ne peut avoir une valence supérieure à 4.
Dans l'acide nitrique, l'état d'oxydation de l'azote est +5, tandis que l'azote ne peut pas avoir une valence supérieure à 4, car il n'a que 4 orbitales au niveau externe (et la liaison peut être considérée comme des orbitales qui se chevauchent). Et en général, tout élément de la deuxième période pour la même raison ne peut avoir une valence supérieure à 4.

Encore quelques questions « délicates » dans lesquelles des erreurs sont souvent commises.
Première partie
1. L'état d'oxydation (so) est la charge conventionnelle des atomes d'un élément chimique dans une substance complexe, calculée sur la base de l'hypothèse qu'elle est constituée d'ions simples.
Tu devrais savoir!
1) En relation avec. O. hydrogène = +1, sauf les hydrures.
2) En relation avec. O. oxygène = -2, sauf peroxydes ![]() et fluorures
et fluorures
3) L'état d'oxydation des métaux est toujours positif.
Pour les métaux des principaux sous-groupes des trois premiers groupes Avec. O. constante:
Métaux du groupe IA - p. O. = +1,
Métaux du groupe IIA - p. O. = +2,
Métaux du groupe IIIA - p. O. = +3.
4) Dans les atomes libres et les substances simples p. O. = 0.
5) Total s. O. tous les éléments de la connexion = 0.
2. Méthode de formation des noms composés à deux éléments (binaires).

4. Complétez le tableau « Noms et formules des composés binaires ».

5. Déterminez l'état d'oxydation de l'élément du composé complexe mis en évidence en police.

Partie II
1. Déterminez les états d'oxydation des éléments chimiques dans les composés à l'aide de leurs formules. Notez les noms de ces substances.

2. Séparez les substances FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3en deux groupes. Notez les noms des substances, en indiquant leurs états d'oxydation.

3. Établir une correspondance entre le nom et l'état d'oxydation d'un atome d'un élément chimique et la formule du composé.

4. Composez des formules pour les substances par leur nom.

5. Combien de molécules y a-t-il dans 48 g d’oxyde de soufre (IV) ?

6. À l'aide d'Internet et d'autres sources d'information, préparez un message sur l'utilisation de tout composé binaire selon le plan suivant :
1) formule ;
2) nom ;
3) propriétés ;
4) demande.
Eau H2O, oxyde d'hydrogène.
Dans des conditions normales, l’eau est liquide, incolore, inodore et bleue en couche épaisse. Le point d'ébullition est d'environ 100⁰С. C'est un bon solvant. Une molécule d'eau est constituée de deux atomes d'hydrogène et d'un atome d'oxygène, c'est sa composition qualitative et quantitative. Il s'agit d'une substance complexe, elle se caractérise par les propriétés chimiques suivantes : interaction avec les métaux alcalins, les métaux alcalino-terreux. Les réactions d'échange avec l'eau sont appelées hydrolyse. Ces réactions sont d'une grande importance en chimie.
7. L'état d'oxydation du manganèse dans le composé K2MnO4 est égal à :
3) +6
8. Le chrome a le degré d'oxydation le plus bas dans le composé dont la formule est :
1)Cr2O3
9. Le chlore présente son état d'oxydation maximal dans un composé dont la formule est :
3)Cl2O7
Tableau. États d'oxydation des éléments chimiques.
Tableau. États d'oxydation des éléments chimiques.
État d'oxydation est la charge conditionnelle des atomes d'un élément chimique dans un composé, calculée en supposant que toutes les liaisons sont de type ionique. Les états d'oxydation peuvent avoir une valeur positive, négative ou nulle, donc la somme algébrique des états d'oxydation des éléments dans une molécule, en tenant compte du nombre de leurs atomes, est égale à 0, et dans un ion - la charge de l'ion .
|
Tableau : Éléments à états d'oxydation constants. |
|
Tableau. États d'oxydation des éléments chimiques par ordre alphabétique.
|
Tableau. États d'oxydation des éléments chimiques par nombre.
|
Évaluation de l'article :
A placer correctement états d'oxydation, vous devez garder quatre règles à l’esprit.
1) Dans une substance simple, l'état d'oxydation de tout élément est 0. Exemples : Na 0, H 0 2, P 0 4.
2) Il faut retenir les éléments caractéristiques états d'oxydation constants. Tous sont répertoriés dans le tableau.
3) En règle générale, l'état d'oxydation le plus élevé d'un élément coïncide avec le numéro du groupe dans lequel se trouve l'élément (par exemple, le phosphore est dans le groupe V, l'écart-type le plus élevé du phosphore est +5). Exceptions importantes : F, O.
4) La recherche des états d'oxydation d'autres éléments repose sur une règle simple :
Dans une molécule neutre, la somme des états d'oxydation de tous les éléments est nulle et dans un ion, la charge de l'ion.
Quelques exemples simples pour déterminer les états d'oxydation
Exemple 1. Il faut retrouver les états d'oxydation des éléments dans l'ammoniac (NH 3).
Solution. On sait déjà (voir 2) que l'Art. D'ACCORD. l'hydrogène est +1. Reste à retrouver cette caractéristique pour l'azote. Soit x l'état d'oxydation souhaité. Nous créons l'équation la plus simple : x + 3 (+1) = 0. La solution est évidente : x = -3. Réponse : N -3 H 3 +1.
Exemple 2. Indiquez les états d'oxydation de tous les atomes de la molécule H 2 SO 4.
Solution. Les états d'oxydation de l'hydrogène et de l'oxygène sont déjà connus : H(+1) et O(-2). Nous créons une équation pour déterminer l'état d'oxydation du soufre : 2 (+1) + x + 4 (-2) = 0. En résolvant cette équation, nous trouvons : x = +6. Réponse : H +1 2 S +6 O -2 4.
Exemple 3. Calculez les états d'oxydation de tous les éléments de la molécule Al(NO 3) 3.
Solution. L'algorithme reste inchangé. La composition de la « molécule » du nitrate d'aluminium comprend un atome d'Al (+3), 9 atomes d'oxygène (-2) et 3 atomes d'azote dont il faut calculer l'état d'oxydation. L'équation correspondante est : 1 (+3) + 3x + 9 (-2) = 0. Réponse : Al +3 (N +5 O -2 3) 3.
Exemple 4. Déterminez les états d’oxydation de tous les atomes de l’ion (AsO 4) 3-.
Solution. Dans ce cas, la somme des états d’oxydation ne sera plus égale à zéro, mais à la charge de l’ion, soit -3. Équation : x + 4 (-2) = -3. Réponse : As(+5), O(-2).
Que faire si les états d'oxydation de deux éléments sont inconnus
Est-il possible de déterminer les états d'oxydation de plusieurs éléments à la fois en utilisant une équation similaire ? Si l’on considère ce problème d’un point de vue mathématique, la réponse sera négative. Une équation linéaire à deux variables ne peut pas avoir de solution unique. Mais nous résolvons bien plus qu’une simple équation !
Exemple 5. Déterminer les états d'oxydation de tous les éléments dans (NH 4) 2 SO 4.
Solution. Les états d’oxydation de l’hydrogène et de l’oxygène sont connus, mais pas le soufre et l’azote. Un exemple classique de problème à deux inconnues ! Nous considérerons le sulfate d'ammonium non pas comme une seule « molécule », mais comme une combinaison de deux ions : NH 4 + et SO 4 2-. Les charges des ions nous sont connues, chacune d'elles ne contient qu'un seul atome avec un état d'oxydation inconnu. Grâce à l'expérience acquise en résolvant des problèmes précédents, nous pouvons facilement trouver les états d'oxydation de l'azote et du soufre. Réponse : (N -3 H 4 +1) 2 S +6 O 4 -2.
Conclusion : si une molécule contient plusieurs atomes avec des états d'oxydation inconnus, essayez de « diviser » la molécule en plusieurs parties.
Comment organiser les états d'oxydation dans les composés organiques
Exemple 6. Indiquez les états d'oxydation de tous les éléments dans CH 3 CH 2 OH.
Solution. La recherche des états d'oxydation dans les composés organiques a ses propres spécificités. En particulier, il est nécessaire de trouver séparément les états d'oxydation pour chaque atome de carbone. Vous pouvez raisonner comme suit. Prenons par exemple l’atome de carbone du groupe méthyle. Cet atome de C est relié à 3 atomes d'hydrogène et à un atome de carbone voisin. Le long de la liaison C-H, la densité électronique se déplace vers l'atome de carbone (puisque l'électronégativité du C dépasse l'EO de l'hydrogène). Si ce déplacement était complet, l’atome de carbone acquerrait une charge de -3.
L'atome C du groupe -CH 2 OH est lié à deux atomes d'hydrogène (un déplacement de la densité électronique vers C), un atome d'oxygène (un déplacement de la densité électronique vers O) et un atome de carbone (on peut supposer que le déplacement en densité électronique dans ce cas ne se produit pas). L'état d'oxydation du carbone est -2 +1 +0 = -1.
Réponse : C -3 H +1 3 C -1 H +1 2 O -2 H +1.
Ne confondez pas les notions de « valence » et « d’état d’oxydation » !
L'indice d'oxydation est souvent confondu avec la valence. Ne faites pas cette erreur. Je vais énumérer les principales différences :
- l'état d'oxydation a un signe (+ ou -), la valence n'en a pas ;
- l'état d'oxydation peut être nul même dans une substance complexe ; une valence égale à zéro signifie, en règle générale, qu'un atome d'un élément donné n'est pas connecté à d'autres atomes (nous ne discuterons d'aucun type de composés d'inclusion et autres « exotiques » ici);
- L'état d'oxydation est un concept formel qui n'acquiert une signification réelle que dans les composés avec des liaisons ioniques ; le concept de « valence », au contraire, est plus commodément appliqué aux composés covalents.
L'état d'oxydation (plus précisément son module) est souvent numériquement égal à la valence, mais le plus souvent ces valeurs ne coïncident PAS. Par exemple, l'état d'oxydation du carbone dans le CO 2 est +4 ; la valence de C est également égale à IV. Mais dans le méthanol (CH 3 OH), la valence du carbone reste la même et le degré d'oxydation de C est égal à -1.
Un petit test sur le thème "État d'oxydation"
Prenez quelques minutes pour vérifier votre compréhension de ce sujet. Vous devez répondre à cinq questions simples. Bonne chance!
Le cours vidéo « Obtenez un A » comprend tous les sujets nécessaires pour réussir l'examen d'État unifié en mathématiques avec 60 à 65 points. Compléter toutes les tâches 1 à 13 de l'examen d'État unifié de profil en mathématiques. Convient également pour réussir l'examen d'État unifié de base en mathématiques. Si vous souhaitez réussir l'examen d'État unifié avec 90 à 100 points, vous devez résoudre la partie 1 en 30 minutes et sans erreurs !
Cours de préparation à l'examen d'État unifié pour les classes 10-11, ainsi que pour les enseignants. Tout ce dont vous avez besoin pour résoudre la partie 1 de l'examen d'État unifié en mathématiques (les 12 premiers problèmes) et le problème 13 (trigonométrie). Et cela représente plus de 70 points à l'examen d'État unifié, et ni un étudiant de 100 points ni un étudiant en sciences humaines ne peuvent s'en passer.
Toute la théorie nécessaire. Solutions rapides, pièges et secrets de l'examen d'État unifié. Toutes les tâches actuelles de la partie 1 de la banque de tâches FIPI ont été analysées. Le cours est entièrement conforme aux exigences de l'examen d'État unifié 2018.
Le cours contient 5 grands sujets de 2,5 heures chacun. Chaque sujet est donné de toutes pièces, simplement et clairement.
Des centaines de tâches d'examen d'État unifié. Problèmes de mots et théorie des probabilités. Algorithmes simples et faciles à retenir pour résoudre des problèmes. Géométrie. Théorie, matériel de référence, analyse de tous types de tâches d'examen d'État unifié. Stéréométrie. Solutions délicates, aide-mémoire utiles, développement de l'imagination spatiale. Trigonométrie de zéro au problème 13. Comprendre au lieu de bachoter. Explications claires de concepts complexes. Algèbre. Racines, puissances et logarithmes, fonction et dérivée. Une base pour résoudre les problèmes complexes de la partie 2 de l'examen d'État unifié.