K p = ∏ p je ν je (\displaystyle K_(p)=\prod p_(i)^((\nu )_(i)))
Par exemple, pour la réaction d’oxydation du monoxyde de carbone :
2CO + O2 = 2CO2
la constante d'équilibre peut être calculée à l'aide de l'équation :
K p = p C O 2 2 p C O 2 ⋅ p O 2 (\displaystyle K_(p)=(\frac (p_(CO_(2))^(2))(p_(CO)^(2)\cdot p_ (O_(2))))) K p = K x P Δ n (\displaystyle K_(p)=K_(x)P^(\Delta n))Où Δn- modification du nombre de moles de substances au cours de la réaction. Il est clair que Kx cela dépend de la pression. Si le nombre de moles de produits de réaction est égal au nombre de moles de substances de départ ( Δ n = 0 (\ displaystyle \ Delta n = 0)), Que K p = K X (\displaystyle K_(p)=K_(x)).
Constante d'équilibre standard
La constante d'équilibre standard d'une réaction dans un mélange de gaz parfaits (lorsque les pressions partielles initiales des participants à la réaction sont égales à leurs valeurs à l'état standard = 0,1013 MPa ou 1 atm) peut être calculée par l'expression :
K 0 = ∏ (p je ~) v je (\displaystyle K^(0)=\prod ((\tilde (p_(i))))^(v_(i))) Où p je ~ (\displaystyle (\tilde (p_(i))))- les pressions partielles relatives des composants, p je ~ = p je / p je 0 (\displaystyle (\tilde (p_(i)))=p_(i)/p_(i)^(0)).La constante d'équilibre standard est une quantité sans dimension. Elle est liée à Kp rapport:
K p = K 0 (p i 0) Δ n (\displaystyle K_(p)=K^(0)(p_(i)^(0))^(\Delta n))Il est clair que si p je 0 (\displaystyle p_(i)^(0)) exprimé en atmosphères, alors (p je 0) Δ n = 1 (\displaystyle (p_(i)^(0))^(\Delta n)=1) Et K p = K 0 (\displaystyle K_(p)=K^(0)).
Pour une réaction dans un mélange de gaz réels à l'état initial standard, la fugacité partielle des gaz est prise égale à leurs pressions partielles f je 0 = p je 0 (\displaystyle f_(i)^(0)=p_(i)^(0))= 0,1013 MPa ou 1 guichet automatique. Kf associé à K 0 rapport:
K f = K 0 (γ i p i 0) Δ n (\displaystyle K_(f)=K^(0)(\gamma _(i)p_(i)^(0))^(\Delta n)) Où γ je- coefficient de fugacité du ième gaz réel du mélange.Constante d'équilibre pour les réactions dans des systèmes hétérogènes
FeO t + CO g = Fe t + CO 2gla constante d'équilibre (en supposant que la phase gazeuse est idéale) a la forme :
K p = p C O 2 p C O (\displaystyle K_(p)=(\frac (p_(CO_(2)))(p_(CO))))Description thermodynamique de l'équilibre
Avec la désignation Q pour le rapport des activités des substances à un moment arbitraire de réaction t (« coefficient de réaction »)
Q r = ( S t ) σ ( T t ) τ ( A t ) α ( B t ) β = ∏ une j (t) ν j ∏ une je (t) ν je = ∏ une n (t) ν n (\displaystyle Q_ (r)=(\frac (\left\(S_(t)\right\)^(\sigma )\left\(T_(t)\right\)^(\tau ))(\left\(A_( t)\right\)^(\alpha )\left\(B_(t)\right\)^(\beta )))=(\frac (\prod a_(j(t))^(\nu _( j)))(\prod a_(i(t))^(\nu _(i))))=\prod a_(n(t))^(\nu _(n)))(notation pour la réaction ci-dessous ; la dernière égalité est écrite dans la notation selon laquelle les coefficients stoechiométriques sont pris avec un signe « + » pour les produits et avec un signe « - » pour les substances de départ)en thermodynamique chimique, la notation est utilisée K éq pour la même forme de relation entre les activités d'équilibre des substances
K e q = [ S ] σ [ T ] τ [ UNE ] α [ B ] β = ∏ une j (t = ∞) ν j ∏ une je (t = ∞) ν je = ∏ une n (t = ∞) ν n (\ style d'affichage K_(eq)=(\frac ([S]^(\sigma )[T]^(\tau ))([A]^(\alpha )(B]^(\beta )))=(\frac (\prod a_(j(t=\infty))^(\nu _(j)))(\prod a_(i(t=\infty))^(\nu _(i))))=\prod a_(n(t=\infty))^(\nu _(n)))(c'est-à-dire le ratio d'activités en ce moment t = ∞ (\displaystyle t=\infty ), au moment de l'équilibre). Ce qui suit est une description thermodynamique de l'équilibre chimique et décrit la relation K éq avec l'énergie Gibbs standard du processus.Dans un système où se produit une réaction chimique
α A + β B ⇌ σ S + τ T (\displaystyle \alpha A+\beta B\rightleftharpoons \sigma S+\tau T)l'équilibre peut être décrit par la condition
(d G d ξ) T , p = 0 (\displaystyle \left((\frac (dG)(d\xi ))\right)_(T,p)=0) Où ξ (\displaystyle \xi ) il y a une variable chimiqueou, la même condition d'équilibre peut être écrite en utilisant des potentiels chimiques comme
α μ A + β μ B = σ μ S + τ μ T (\displaystyle \alpha \mu _(A)+\beta \mu _(B)=\sigma \mu _(S)+\tau \mu _ (T))où sont les potentiels chimiques
μ A = μ A ⊖ + R T ln ( A ) (\displaystyle \mu _(A)=\mu _(A)^(\ominus )+RT\ln\(A\)) ici (A) - à proprement parler, l'activité du réactif A ; sous l'hypothèse des gaz parfaits, ils peuvent être remplacés par des pressions ; pour les gaz réels, ils peuvent être remplacés par la fugacité ; sous l'hypothèse que la solution obéit à la loi de Henry, ils peuvent être remplacés par des fractions molaires ; et sous l'hypothèse que la solution obéit Loi de Raoult, elles peuvent être remplacées par des pressions partielles ; car un système à l’équilibre peut être remplacé par la concentration molaire d’équilibre ou l’activité d’équilibre. Δ r G o = − R T ln K e q (\displaystyle \Delta _(r)G^(o)=-RT\ln K_(eq))Composition à l'équilibre du mélange et sens de la réaction
Le « coefficient de réaction » mentionné ci-dessus Q(d'autres désignations trouvées dans la littérature sont Ω (\displaystyle \Omega) ou π (\displaystyle \pi ), "produit de réaction")
Q r = ∏ a n (t) ν n (\displaystyle Q_(r)=\prod a_(n(t))^(\nu _(n)))reflète le rapport des activités actuelles de tous les participants à la réaction et peut être utilisé pour déterminer la direction de la réaction au moment pour lequel Q est connu
Si à l'instant t le coefficient Q > K, alors les activités actuelles des produits sont supérieures à celles d'équilibre, ce qui signifie qu'elles doivent diminuer au moment où l'équilibre est établi, c'est-à-dire qu'une réaction inverse se produit actuellement ; Si Q = K, alors l'état d'équilibre a été atteint et les taux de réactions directes et inverses sont égaux ; Si Q< K, то v 1 > v − 1 (\displaystyle v_(1)>v_(-1))
Utiliser la valeur Q r ( displaystyle Q_ (r)) l'équation s'écrit isothermes de réaction chimique
Δ G p , T = R T ln Q r − R T ln K e q = R T ln Q r K e q = ∑ ν je μ i (\displaystyle \Delta G_(p,T)=RT\ln Q_(r) -RT\ln K_(eq)=RT\ln (\frac (Q_(r))(K_(eq)))=\sum \nu _(i)\mu _(i))Où ν ( displaystyle nu )- coefficients stoechiométriques (pour les produits - avec un signe « + », pour les substances de départ - avec un signe « - » ; les mêmes que dans les expressions pour Q et K), et μ (\displaystyle \mu)- les potentiels chimiques et l'énergie standard de Gibbs et la constante standard sont
Δ G p , T o = − R T ln K e q o = ∑ ν je μ i o (\displaystyle \Delta G_(p,T)^(o)=-RT\ln K_(eq)^(o)=\sum \nu _(i)\mu _(i)^(o))Où μ o ( displaystyle mu ^ (o))- potentiels chimiques standards
L'équation isotherme montre comment la valeur de Q est liée à la variation de l'énergie libre de la réaction :
À Q > K (\displaystyle Q>K) pour une réaction directe Δ G > 0 (\displaystyle \Delta G>0), c'est ∑ ν j μ j (\displaystyle \sum \nu _(j)\mu _(j)) pour les produits de la réaction directe est supérieur à celui des substances de départ - cela signifie que la réaction directe est interdite (ce qui signifie que la réaction inverse n'est pas interdite) ; à Q = K (\ displaystyle Q = K) pour une réaction directe Δ G = 0 (\displaystyle \Delta G=0), c'est-à-dire que la réaction a atteint un état d'équilibre ; à Q<
K
{\displaystyle Q
La valeur, par définition, n'a de sens que pour l'état d'équilibre, c'est-à-dire pour l'état avec v 1 v − 1 = 1 (\displaystyle (\frac (v_(1))(v_(-1)))=1) Et Δ G r = 0 (\displaystyle \Delta G_(r)=0). Ordre de grandeur K e q (\displaystyle K_(eq)) ne dit rien sur les vitesses de réactions, mais il décrit la composition du système en état d'équilibre.
Si K >> 1, alors le système est dominé par les produits de réaction (directs) Si K<< 1, то в системе преобладают исходные вещества (продукты обратной реакции)
États standards
L'énergie de Gibbs standard d'une réaction dans un mélange gazeux est l'énergie de Gibbs d'une réaction à des pressions partielles standard de tous les composants égales à 0,1013 MPa (1 atm). L'énergie de Gibbs standard d'une réaction en solution est l'énergie de Gibbs à l'état standard de la solution, qui est considérée comme étant hypothétique une solution avec les propriétés d'une solution extrêmement diluée, mais avec une concentration de tous les réactifs égale à l'unité. Pour une substance pure et un liquide, l'énergie de Gibbs standard coïncide avec l'énergie de Gibbs de formation de ces substances. La valeur de l'énergie de Gibbs standard d'une réaction peut être utilisée pour approximer la possibilité thermodynamique d'une réaction se déroulant dans une direction donnée, si les conditions initiales ne diffèrent pas beaucoup des conditions standard. De plus, en comparant les valeurs de l'énergie de Gibbs standard de plusieurs réactions, il est possible de sélectionner les plus préférables, pour lesquelles elle a le plus grand module négatif taille.
Description cinétique
Pour une réaction chimique réversible, la constante d’équilibre est K éq peut être exprimé par les constantes de vitesse des réactions directes et inverses. Considérons une réaction chimique élémentaire réversible du premier ordre
A ⇄ B (\displaystyle \mathrm (A) \rightleftarrows \mathrm (B) )Par définition, l'équilibre est donné par la condition v 1 = v − 1 (\displaystyle v_(1)=v_(-1)), c'est-à-dire l'égalité des taux de réactions directes et inverses.
Conformément à la loi de l'action de masse v = k ∏ a j n j (\displaystyle v=k(\prod )(a_(j))^(n_(j)))
Où k est la constante de vitesse de la réaction correspondante, et une j n j (\displaystyle (a_(j))^(n_(j)))- activités d'équilibre des réactifs de cette réaction, élevées à des puissances égales à leurs coefficients stoechiométriques
on peut écrire la condition d'équilibre sous la forme
1 = v 1 v − 1 = k 1 ∏ une A n A k − 1 ∏ a B n B (\displaystyle 1=(\frac (v_(1))(v_(-1)))=(\frac ( k_(1)(\prod )(a_(A))^(n_(A)))(k_(-1)(\prod )(a_(B))^(n_(B))))) 1 = k 1 k − 1 ⋅ ∏ une A n A ∏ a B n B = k 1 k − 1 ⋅ (K e q) − 1 (\displaystyle 1=(\frac (k_(1))(k_(-1 )))\cdot (\frac (\prod (a_(A))^(n_(A)))(\prod (a_(B))^(n_(B))))=(\frac (k_( 1))(k_(-1)))\cdot \left(K_(eq)\right)^(-1))(voir description thermodynamique de la constante d'équilibre), ce qui n'est possible que si
K e q = k 1 k − 1 (\displaystyle K_(eq)=(\frac (k_(1))(k_(-1))))Cette relation importante constitue l'un des « points de contact » entre la chimie cinétique et la chimie thermodynamique.
Équilibres multiples
Dans le cas où plusieurs équilibres sont établis dans un système à la fois (c'est-à-dire que plusieurs processus se produisent simultanément ou séquentiellement), chacun d'eux peut être caractérisé par sa propre constante d'équilibre, à partir de laquelle la constante d'équilibre générale pour l'ensemble des processus peut s'exprimer. On peut considérer cette situation en utilisant l'exemple de dissociation par étapes de l'acide dibasique H 2 A. Sa solution aqueuse contiendra des particules (solvatées) H +, H 2 A, HA - et A 2-. Le processus de dissociation se déroule en deux étapes :
H 2 A ⇌ H A − + H + : K 1 = [ H A − ] [ H + ] [ H 2 A ] (\displaystyle H_(2)A\rightleftharpoons HA^(-)+H^(+):K_( 1)=(\frac ()())) H A − ⇌ A 2 − + H + : K 2 = [ A 2 − ] [ H + ] [ H A − ] (\displaystyle HA^(-)\rightleftharpoons A^(2-)+H^(+):K_ (2)=(\frac ()()))K 1 et K 2 - constantes des première et deuxième étapes de dissociation, respectivement. À partir de celles-ci, nous pouvons exprimer la constante d’équilibre « totale » pour le processus de dissociation complète :
H 2 A ⇌ A 2 − + 2 H + : K 1 + 2 = [ A 2 − ] [ H + ] 2 [ H 2 A ] = K 1 K 2 (\displaystyle H_(2)A\rightleftharpoons A^( 2-)+2H^(+):K_(1+2)=(\frac (^(2))())=K_(1)K_(2))Un autre exemple d’équilibre multiple est l’analyse du système complexe précipité/soluble. Supposons qu'il existe un équilibre
A g I 2 − (a q) ⇌ A g I (s o l i d) + I − (a q) (\displaystyle AgI_(2)^(-)(aq)\rightleftharpoons AgI(solid)+I^(-)(aq) )La réaction peut être représentée sous la forme de deux équilibres successifs - l'équilibre de décomposition d'un ion complexe en ses ions constitutifs, qui est caractérisé par une « constante d'instabilité » (l'inverse de la « constante de stabilité » β) :
A g I 2 − (a q) ⇌ A g + (a q) + 2 I − (a q) : K 1 = α A g + α I − 2 α A g I 2 − = β − 1 (\displaystyle AgI_(2 )^(-)(aq)\rightleftharpoons Ag^(+)(aq)+2I^(-)(aq):K_(1)=(\frac (\alpha _(Ag^(+))\alpha _ (I^(-))^(2))(\alpha _(AgI_(2)^(-))))=\beta ^(-1))et équilibre de la transition des ions de la majeure partie du solvant au réseau cristallin
A g + (a q) + I − (a q) ⇌ A g I (s o l i d) : K 2 = α A g I α A g + α I − (\displaystyle Ag^(+)(aq)+I^(- )(aq)\rightleftharpoons AgI(solid):K_(2)=(\frac (\alpha _(AgI))(\alpha _(Ag^(+))\alpha _(I^(-)))) )en tenant compte du fait que pour les substances solides, l'activité est supposée égale à 1 , et dans les solutions diluées les activités peuvent être remplacées par des concentrations molaires, on obtient
K 2 = α A g I α A g + α I − = 1 [ A g + ] [ I − ] = 1 K s p (\displaystyle K_(2)=(\frac (\alpha _(AgI))(\ alpha _(Ag^(+))\alpha _(I^(-))))=(\frac (1)())=(\frac (1)(K_(sp))))Où Ksp (\displaystyle K_(sp))- produit de solubilité
Alors l’équilibre total sera décrit par la constante
A g I 2 − (a q) ⇌ A g I (s o l i d) + I − (a q) : K = α A g I α I − α A g I 2 − = K 1 ⋅ K 2 = 1 β ⋅ K s p ( \displaystyle AgI_(2)^(-)(aq)\rightleftharpoons AgI(solid)+I^(-)(aq):K=(\frac (\alpha _(AgI)\alpha _(I^(-) ))(\alpha _(AgI_(2)^(-))))=K_(1)\cdot K_(2)=(\frac (1)(\beta \cdot K_(sp))))Et la valeur de cette constante sera la condition de la prédominance d'un composé complexe ou d'un sel solide dans le mélange à l'équilibre : comme ci-dessus, si K<< 1, то в равновесной смеси большая часть ионов связана в комплексное соединение, если K >> 1, alors à l'état d'équilibre dans le système, la plupart des ions sont liés dans la phase cristalline. une réaction se produisant respectivement à pression constante ou à volume constant. Si Δ H > 0 (\displaystyle \Delta H>0)(l'effet thermique est positif, la réaction est endothermique), alors le coefficient de température de la constante d'équilibre ré ln K p ré T (\displaystyle (\frac (d\ln K_(p))(dT))) est également positif, c'est-à-dire qu'avec l'augmentation de la température, la constante d'équilibre de la réaction endothermique augmente, l'équilibre se déplace vers la droite (ce qui est tout à fait cohérent avec le principe de Le Chatelier).
Méthodes de calcul de la constante d'équilibre
Les méthodes de calcul pour déterminer la constante d'équilibre d'une réaction se résument généralement à calculer d'une manière ou d'une autre la variation standard de l'énergie de Gibbs au cours de la réaction ( ΔG 0), puis en utilisant la formule :
Δ G 0 = − R T ln K 0 (\displaystyle \Delta G^(0)=-RT\ln K^(0)), Où R (style d'affichage R)- Constante du gaz universel.Il ne faut pas oublier que l'énergie de Gibbs est fonction de l'état du système, c'est-à-dire qu'elle ne dépend pas du déroulement du processus, du mécanisme de réaction, mais est déterminée uniquement par les états initial et final du système. . Par conséquent, si la détermination ou le calcul direct ΔG 0 car certaines réactions sont difficiles pour une raison quelconque, vous pouvez sélectionner des réactions intermédiaires pour lesquelles ΔG 0 connue ou peut être facilement déterminée, et dont la sommation donnera la réaction en question (voir la loi de Hess). En particulier, les réactions de formation de composés à partir d'éléments sont souvent utilisées comme réactions intermédiaires.
Calcul d'entropie de la variation de l'énergie de Gibbs et de la constante d'équilibre de la réaction
Méthode de calcul de l'entropie ΔG la réaction est l’une des plus courantes et des plus pratiques. Elle est basée sur la relation :
Δ G T = Δ H T − T Δ S T (\displaystyle \Delta G_(T)=\Delta H_(T) -T\Delta S_(T))ou, en conséquence, pour standard Changements d'énergie de Gibbs :
Δ G T 0 = Δ H T 0 − T Δ S T 0 (\displaystyle \Delta G_(T)^(0)=\Delta H_(T)^(0) -T\Delta S_(T)^(0))Ici ΔH 0à pression et température constantes est égal à l'effet thermique de la réaction dont les méthodes de calcul et de détermination expérimentale sont connues - voir, par exemple, l'équation de Kirchhoff :
Δ H T 0 = Δ H 298 0 + ∫ 298 T Δ C p ré T (\displaystyle \Delta H_(T)^(0)=\Delta H_(298)^(0)+\int _(298)^(T )\Delta C_(p)dT)Il est nécessaire d'obtenir le changement d'entropie au cours de la réaction. Ce problème peut être résolu de plusieurs manières, par exemple :
- Selon des données thermiques - basées sur le théorème thermique de Nernst et utilisant des informations sur la dépendance à la température de la capacité thermique des participants à la réaction. Par exemple, pour les substances qui sont à l’état solide dans des conditions normales :
Donc si on le sait Δ H 298 0 (\displaystyle \Delta H_(298)^(0)), Δ S 298 0 (\displaystyle \Delta S_(298)^(0)) et les dépendances en température de la capacité thermique, Δ G T 0 (\displaystyle \Delta G_(T)^(0)) peut être calculé à l'aide de la formule :
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 + ∫ 298 T Δ C p d T − T ∫ 298 T Δ C p d T T (\displaystyle \Delta G_(T)^(0)=\Delta H_(298 )^(0)-T\Delta S_(298)^(0)+\int _(298)^(T)\Delta C_(p)dT-T\int _(298)^(T)\Delta C_ (p)(\frac (dT)(T)))Une version quelque peu simplifiée de cette formule est obtenue en considérant la somme des capacités calorifiques des substances comme indépendante de la température et égale à la somme des capacités calorifiques à 298 K :
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 + Δ C p 298 (T − 298) − T ln T 298 (\displaystyle \Delta G_(T)^(0)=\Delta H_(298) ^(0)-T\Delta S_(298)^(0)+\Delta C_(p~298)(T-298) -T\ln (\frac (T)(298)))Et un calcul encore plus simplifié est effectué en assimilant la somme des capacités thermiques à zéro :
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 (\displaystyle \Delta G_(T)^(0)=\Delta H_(298)^(0) -T\Delta S_(298)^(0) )Transfert à partir de Δ G T 0 (\displaystyle \Delta G_(T)^(0))à la constante d'équilibre s'effectue selon la formule ci-dessus.
L'équilibre chimique est un état de réaction chimique réversible.
aA+ b B = c C+ d D,
dans lequel il n'y a pas de changement dans les concentrations de réactifs dans le mélange réactionnel au fil du temps. L'état d'équilibre chimique est caractérisé constante d'équilibre chimique:
Où C je– concentration des composants dans équilibre mélange parfait.
La constante d'équilibre peut également être exprimée en termes de fractions molaires d'équilibre X je Composants:
Pour les réactions se produisant en phase gazeuse, il est pratique d'exprimer la constante d'équilibre en termes de pressions partielles d'équilibre P je Composants:
Pour les gaz parfaits P je = C je RT Et P je = X je P, Où P. est la pression totale, donc KP, KC Et K X sont liés par la relation suivante :
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
La constante d'équilibre est liée à rG o réaction chimique :
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Changement rG ou rF dans une réaction chimique à des pressions partielles données (pas nécessairement à l'équilibre) P je ou concentrations C je les composants peuvent être calculés à l’aide de l’équation isothermes de réaction chimique (isothermes de Van't Hoff):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Selon Le principe du Chatelier, si une influence externe est exercée sur un système en équilibre, alors l'équilibre se déplacera de manière à réduire l'effet de l'influence externe. Ainsi, une augmentation de la pression déplace l’équilibre vers une diminution du nombre de molécules de gaz. L'ajout d'un composant réactionnel à un mélange d'équilibre déplace l'équilibre vers une diminution de la quantité de ce composant. Une augmentation (ou une diminution) de la température déplace l'équilibre vers une réaction qui se produit avec l'absorption (libération) de chaleur.
La dépendance quantitative de la constante d'équilibre sur la température est décrite par l'équation isobares de réaction chimique (isobares de Van't Hoff)
![]() (9.9)
(9.9)
Et isochore d'une réaction chimique (isochores de Van't Hoff)
![]() . (9.10)
. (9.10)
Intégration de l’équation (9.9) sous l’hypothèse que rH la réaction ne dépend pas de la température (ce qui est vrai dans des plages de température étroites), donne :
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Où C- constante d’intégration. Ainsi, la dépendance ln K P à partir de 1 /T doit être linéaire, et la pente de la droite est – rH/R..
Intégration au sein K 1 , K 2, et T 1, T 2 donne :
 (9.13)
(9.13)
 (9.14)
(9.14)
En utilisant cette équation, connaissant les constantes d’équilibre à deux températures différentes, nous pouvons calculer rH réactions. En conséquence, sachant rH réaction et la constante d’équilibre à une température, vous pouvez calculer la constante d’équilibre à une autre température.
EXEMPLES
CO(g) + 2H 2 (g) = CH 3 OH(g)
à 500K. f Aller pour CO(g) et CH 3 OH(g) à 500 K sont égaux à –155,41 kJ. mol –1 et –134,20 kJ. mol –1 respectivement.
Solution. Aller réactions :
r Aller= f Aller(CH3OH) – f Aller(CO) = –134,20 – (–155,41) = 21,21 kJ. mole –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Exemple 9-2. Constante d'équilibre de réaction
égal à K P = 1,64 10 –4 à 400 o C. Quelle pression totale faut-il appliquer à un mélange équimolaire de N 2 et H 2 pour que 10 % de N 2 se transforme en NH 3 ? Les gaz sont considérés comme idéaux.
Solution. Laissez réagir une mole de N 2. Alors
| N 2 (g) | + | 3H2 (g) | = | 2NH3 (g) | |
| Quantité originale | 1 | 1 | |||
| Quantité d'équilibre | 1– | 1–3 | 2 (Total : 2–2) | ||
| Fraction molaire d'équilibre : |
Ainsi, K X = 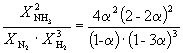 Et K P = K X . P. –2
=
Et K P = K X . P. –2
=  .
.
En remplaçant = 0,1 dans la formule résultante, nous avons
1.64 10 –4 = , où P.= 51,2 guichets automatiques.
, où P.= 51,2 guichets automatiques.
Exemple 9-3. Constante d'équilibre de réaction
CO(g) + 2H 2 (g) = CH 3 OH(g)
à 500 K est égal à K P = 6,09 10 –3 . Un mélange réactionnel constitué de 1 mole de CO, 2 moles de H 2 et 1 mole de gaz inerte (N 2) est chauffé à 500 K et à une pression totale de 100 atm. Calculez la composition du mélange à l’équilibre.
Solution. Laissez réagir une mole de CO. Alors
| Dent) | + | 2H2 (g) | = | CH3OH(g) | |
| Quantité d'origine : | 1 | 2 | 0 | ||
| Quantité d'équilibre : | 1– | 2–2 | |||
| Total en mélange à l'équilibre : | 3 à 2 composants molaires + 1 mol N 2 = 4 à 2 mol | ||||
| Fraction molaire d'équilibre | |||||
Ainsi, K X =  Et K P = K X . P-2 =
Et K P = K X . P-2 = ![]() .
.
Ainsi, 6,09 10 –3 = ![]() .
.
En résolvant cette équation, nous obtenons = 0,732. En conséquence, les fractions molaires des substances dans le mélange à l'équilibre sont égales à : = 0,288, = 0,106, = 0,212 et = 0,394.
Exemple 9-4. Pour réaction
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
à 298 K K P = 6,0 10 5 , une f H o(NH 3) = –46,1 kJ. mole –1 . Estimez la valeur de la constante d’équilibre à 500 K.
Solution. L'enthalpie molaire standard de la réaction est
r H o= 2f H o(NH 3) = –92,2 kJ. mole –1 .
D'après l'équation (9.14),  =
=
Ln (6,0 10 5) + ![]() = –1,73, d'où K 2 =
0.18.
= –1,73, d'où K 2 =
0.18.
A noter que la constante d'équilibre d'une réaction exothermique diminue avec l'augmentation de la température, ce qui correspond au principe de Le Chatelier.
TÂCHES
- À 1273 K et une pression totale de 30 atm dans un mélange à l'équilibre
- A 2000°C et une pression totale de 1 atm, 2% de l'eau est dissociée en hydrogène et oxygène. Calculer la constante d'équilibre de la réaction
- Constante d'équilibre de réaction
- Constante d'équilibre de réaction
- Un récipient de 3 litres contenant 1,79 10 –2 mol I 2 a été chauffé à 973 K. La pression dans le récipient à l'équilibre s'est avérée être de 0,49 atm. En supposant que les gaz soient idéaux, calculez la constante d'équilibre à 973 K pour la réaction
- Pour réaction
- Pour réaction
- Un récipient de 1 litre contenant 0,341 mole de PCl 5 et 0,233 mole de N 2 a été chauffé à 250 °C. La pression totale dans le récipient à l'équilibre s'est avérée être de 29,33 atm. En supposant que tous les gaz sont idéaux, calculez la constante d'équilibre à 250 °C pour la réaction se produisant dans le récipient.
- Constante d'équilibre de réaction
- À 25°C f Aller(NH 3) = –16,5 kJ. mole –1 . Calculer rG réactions de formation de NH 3 à des pressions partielles de N 2, H 2 et NH 3 égales respectivement à 3 atm, 1 atm et 4 atm. Dans quelle direction la réaction se déroulera-t-elle spontanément dans ces conditions ?
- Réaction exothermique
- La constante d'équilibre de la réaction en phase gazeuse d'isomérisation du bornéol (C 10 H 17 OH) en isobornéol est de 0,106 à 503 K. Un mélange de 7,5 g de bornéol et de 14,0 g d'isobornéol a été placé dans un récipient de 5 litres et conservé à 503 K jusqu'à ce que l'équilibre soit atteint. Calculer les fractions molaires et les masses de bornéol et d'isobornéol dans le mélange à l'équilibre.
- Équilibre en réaction
- Calculer la pression totale qui doit être appliquée à un mélange de 3 parties de H 2 et 1 partie de N 2 pour obtenir un mélange à l'équilibre contenant 10 % de NH 3 en volume à 400 o C. Constante d'équilibre de la réaction
- A 250°C et une pression totale de 1 atm, PCl 5 est dissocié à 80% par la réaction
- À 2000 o C pour la réaction
- Calculer l'enthalpie standard de la réaction pour laquelle la constante d'équilibre est
a) augmente de 2 fois, b) diminue de 2 fois lorsque la température passe de 298 K à 308 K. - La dépendance de la constante d'équilibre de la réaction 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) sur la température comprise entre 300 K et 600 K est décrite par l'équation
CO 2 (g) + C(tv) = 2CO(g)
contient 17% (en volume) de CO 2 . Quel pourcentage de CO 2 sera contenu dans le gaz à une pression totale de 20 atm ? A quelle pression le gaz contiendra-t-il 25 % de CO 2 ?
H 2 O (g) = H 2 (g) + 1/2O 2 (g) dans ces conditions.
CO(g) + H 2 O(g) = CO 2 (g) + H 2 (g)
à 500 o C est égal Kp= 5,5. Un mélange constitué de 1 mole de CO et de 5 moles de H 2 O a été chauffé à cette température. Calculez la fraction molaire de H 2 O dans le mélange à l'équilibre.
N 2 O 4 (g) = 2NO 2 (g)
à 25 o C est égal Kp= 0,143. Calculez la pression qui s'établira dans un récipient d'un volume de 1 litre, dans lequel 1 g de N 2 O 4 a été placé à cette température.
Je 2 (g) = 2I (g).
à 250°C rG o = –2508 Jmol –1. À quelle pression totale le degré de conversion de PCl 5 en PCl 3 et Cl 2 à 250 o C sera-t-il de 30 % ?
2HI(g) = H 2 (g) + I 2 (g)
constante d'équilibre K P = 1,83 10 –2 à 698,6 K. Combien de grammes de HI se forment lorsque 10 g de I 2 et 0,2 g de H 2 sont chauffés à cette température dans un récipient de trois litres ? Quelles sont les pressions partielles de H 2, I 2 et HI ?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(g) + 2H 2 (g) = CH 3 OH(g)
à 500 K est égal à K P = 6,09 10 –3 . Calculez la pression totale requise pour produire du méthanol avec un rendement de 90 % si le CO et le H2 sont pris dans un rapport de 1:2.
CO(g) + 2H 2 (g) = CH 3 OH(g)
est en équilibre à 500 K et 10 bar. Si les gaz sont idéaux, comment les facteurs suivants affecteront-ils le rendement en méthanol : a) augmentation T; b) promotion P.; c) ajouter du gaz inerte à V= const; d) ajouter du gaz inerte à P.= const; e) ajouter H 2 à P.= const ?
2NOCl(g) = 2NO(g) + Cl 2 (g)
réglé à 227 o C et une pression totale de 1,0 bar lorsque la pression partielle de NOCl est de 0,64 bar (au départ, seul NOCl était présent). Calculer r Aller pour la réaction. A quelle pression totale la pression partielle de Cl 2 sera-t-elle égale à 0,10 bar ?
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
à 400 o C est égal K = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
Quel sera le degré de dissociation du PCl 5 si du N 2 est ajouté au système de telle sorte que la pression partielle d'azote soit de 0,9 atm ? La pression totale est maintenue à 1 atm.
N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 –3 . Un mélange à l'équilibre de N 2, O 2, NO et de gaz inerte à une pression totale de 1 bar contient 80 % (en volume) de N 2 et 16 % d'O 2. Quel pourcentage en volume correspond au NON ? Quelle est la pression partielle d'un gaz inerte ?
dans K = –1.04 –1088 /T +1.51 10 5 /T 2 .
La plupart des réactions chimiques sont réversibles, c'est-à-dire circuler simultanément dans des directions opposées. Dans les cas où les réactions directes et inverses se produisent au même rythme, un équilibre chimique se produit. Par exemple, dans une réaction homogène réversible : H 2 (g) + I 2 (g) ↔ 2HI (g), le rapport des taux de réactions directes et inverses selon la loi d'action de masse dépend du rapport des concentrations des réactifs, à savoir : la vitesse de la réaction directe : υ 1 = k 1 [H 2 ]. Taux de réaction inverse : υ 2 = k 2 2.
Si H 2 et I 2 sont des substances de départ, alors au premier instant, la vitesse de la réaction directe est déterminée par leurs concentrations initiales et la vitesse de la réaction inverse est nulle. À mesure que H 2 et I 2 sont consommés et que HI se forme, la vitesse de la réaction directe diminue et la vitesse de la réaction inverse augmente. Après un certain temps, les deux taux s'égalisent et l'équilibre chimique s'établit dans le système, c'est-à-dire le nombre de molécules HI produites et consommées par unité de temps devient le même.
Puisqu'à l'équilibre chimique, les taux de réactions directes et inverses sont égaux à V 1 = V 2, alors k 1 = k 2 2.
Puisque k 1 et k 2 sont constants à une température donnée, leur rapport sera constant. En le notant K, on obtient :

K est appelée constante d'équilibre chimique et l'équation ci-dessus est appelée loi d'action de masse (Guldberg - Waale).
Dans le cas général, pour une réaction de la forme aA+bB+…↔dD+eE+…, la constante d'équilibre est égale à ![]() . Pour l'interaction entre substances gazeuses, on utilise souvent l'expression dans laquelle les réactifs sont représentés par des pressions partielles d'équilibre p. Pour la réaction mentionnée
. Pour l'interaction entre substances gazeuses, on utilise souvent l'expression dans laquelle les réactifs sont représentés par des pressions partielles d'équilibre p. Pour la réaction mentionnée  .
.
L'état d'équilibre caractérise la limite jusqu'à laquelle, dans des conditions données, la réaction se déroule spontanément (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
La relation entre les concentrations d'équilibre ne dépend pas des substances prises comme substances initiales (par exemple, H 2 et I 2 ou HI), c'est-à-dire l’état d’équilibre peut être abordé des deux côtés.
La constante d'équilibre chimique dépend de la nature des réactifs et de la température ; La constante d'équilibre ne dépend pas de la pression (si elle est trop élevée) ni de la concentration des réactifs.
Influence sur la constante d'équilibre des facteurs de température, d'enthalpie et d'entropie. La constante d'équilibre est liée à la variation du potentiel isobare-isotherme standard d'une réaction chimique ∆G o par la simple équation ∆G o = -RT ln K.
Il montre que les grandes valeurs négatives de ∆G o (∆G o<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), alors les substances de départ prédominent dans le mélange à l'équilibre. Cette équation permet de calculer K à partir de la valeur de ∆G o, puis des concentrations à l'équilibre (pressions partielles) des réactifs. Si nous prenons en compte le fait que ∆G o =∆Н o -Т∆S o , alors après quelques transformations nous obtenons ![]() . Cette équation montre clairement que la constante d’équilibre est très sensible aux changements de température. L'influence de la nature des réactifs sur la constante d'équilibre détermine sa dépendance aux facteurs d'enthalpie et d'entropie.
. Cette équation montre clairement que la constante d’équilibre est très sensible aux changements de température. L'influence de la nature des réactifs sur la constante d'équilibre détermine sa dépendance aux facteurs d'enthalpie et d'entropie.
Le principe du Chatelier
L’état d’équilibre chimique est maintenu à tout moment dans des conditions constantes données. Lorsque les conditions changent, l'état d'équilibre est perturbé, puisque dans ce cas les taux des processus opposés changent à des degrés divers. Cependant, après un certain temps, le système atteint à nouveau un état d’équilibre, mais cette fois correspondant aux nouvelles conditions modifiées.
Le déplacement de l’équilibre en fonction des changements de conditions est généralement déterminé par le principe de Le Chatelier (ou principe d’équilibre mobile) : Si un système en équilibre est influencé de l'extérieur en modifiant l'une des conditions qui déterminent la position d'équilibre, il se déplace alors dans la direction du processus, dont le déroulement affaiblit l'effet produit.
Ainsi, une augmentation de la température provoque un déplacement de l'équilibre dans le sens de celui des processus dont le déroulement s'accompagne d'une absorption de chaleur, et une diminution de la température agit en sens inverse. De même, une augmentation de pression déplace l’équilibre dans le sens d’un processus accompagné d’une diminution de volume, et une diminution de pression agit dans le sens opposé. Par exemple, dans le système d'équilibre 3H 2 + N 2 2H 3 N, ∆H o = -46,2 kJ, une augmentation de la température améliore la décomposition de H 3 N en hydrogène et azote, puisque ce processus est endothermique. Une augmentation de pression déplace l'équilibre vers la formation de H 3 N, car le volume diminue.
Si une certaine quantité de l'une des substances participant à la réaction est ajoutée à un système en état d'équilibre (ou, à l'inverse, retirée du système), alors les vitesses des réactions directes et inverses changent, mais s'égalisent progressivement à nouveau. En d’autres termes, le système revient à un état d’équilibre chimique. Dans ce nouvel état, les concentrations d’équilibre de toutes les substances présentes dans le système différeront des concentrations d’équilibre d’origine, mais le rapport entre elles restera le même. Ainsi, dans un système en équilibre, il est impossible de modifier la concentration d’une des substances sans provoquer une modification des concentrations de toutes les autres.
Conformément au principe de Le Chatelier, l'introduction de quantités supplémentaires d'un réactif dans un système d'équilibre provoque un déplacement de l'équilibre dans le sens dans lequel la concentration de cette substance diminue et, par conséquent, la concentration des produits de son interaction augmente.
L'étude de l'équilibre chimique revêt une grande importance tant pour la recherche théorique que pour la résolution de problèmes pratiques. En déterminant la position d'équilibre pour différentes températures et pressions, il est possible de sélectionner les conditions les plus favorables pour le processus chimique. Lors du choix final des conditions de processus, leur effet sur la vitesse du processus est également pris en compte.
Exemple 1. Calcul de la constante d'équilibre d'une réaction à partir des concentrations d'équilibre des réactifs.
Calculer la constante d'équilibre de la réaction A + B 2C, si les concentrations d'équilibre [A] = 0,3 mol∙l -1 ; [V]=1,1mol∙l -1 ; [C]=2,1mol∙l -1.
Solution. L'expression de la constante d'équilibre pour cette réaction a la forme : . Remplaçons ici les concentrations d'équilibre indiquées dans l'énoncé du problème : =5,79.
Exemple 2. Calcul des concentrations d'équilibre des substances réactives. La réaction se déroule selon l'équation A + 2B C.
Déterminer les concentrations d'équilibre des substances en réaction si les concentrations initiales des substances A et B sont respectivement de 0,5 et 0,7 mol∙l -1, et la constante d'équilibre de la réaction K p = 50.
Solution. Pour chaque mole de substances A et B, il se forme 2 moles de substance C. Si la diminution de la concentration des substances A et B est désignée par X mole, alors l'augmentation de la concentration de la substance sera égale à 2X mole. Les concentrations d'équilibre des réactifs seront :
C A = (environ 0,5-x)mol∙l -1 ; C B = (0,7-x) mol∙l -1 ; C C =2x mol∙l -1
x1 =0,86 ; x2 =0,44
Selon les conditions du problème, la valeur x 2 est valide. Les concentrations d’équilibre des réactifs sont donc :
C A =0,5-0,44=0,06mol∙l -1 ; C B =0,7-0,44=0,26mol∙l -1 ; C C =0,44∙2=0,88mol∙l -1.
Exemple 3. Détermination de la variation de l'énergie de Gibbs ∆G o d'une réaction par la valeur de la constante d'équilibre K r. Calculez l'énergie de Gibbs et déterminez la possibilité de la réaction CO + Cl 2 = COCl 2 à 700 K si la constante d'équilibre est égale à Kp = 1,0685∙10 -4. La pression partielle de toutes les substances réagissantes est la même et égale à 101325 Pa.
Solution.∆G 700 =2,303∙RT ![]() .
.
Pour ce processus :
Depuis ∆Go<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
Exemple 4. Changement d'équilibre chimique. Dans quelle direction l'équilibre se déplacera-t-il dans le système N 2 +3H 2 2NH 3 -22kcal :
a) avec une concentration croissante de N 2 ;
b) avec une concentration croissante de H 2 ;
c) avec une température croissante ;
d) quand la pression diminue ?
Solution. Une augmentation de la concentration des substances du côté gauche de l’équation de réaction, selon la règle de Le Chatelier, devrait provoquer un processus qui tend à affaiblir l’effet et conduire à une diminution des concentrations, c’est-à-dire l'équilibre se déplacera vers la droite (cas a et b).
La réaction de synthèse de l'ammoniac est exothermique. Une augmentation de la température provoque un déplacement de l'équilibre vers la gauche - vers une réaction endothermique, affaiblissant l'effet (cas c).
Une diminution de pression (cas d) favorisera une réaction conduisant à une augmentation du volume du système, c'est-à-dire vers la formation de N 2 et H 2.
Exemple 5. Combien de fois la vitesse des réactions directe et inverse dans le système 2SO 2 (g) + O 2 (g) 2SO 3 (r) changera-t-elle si le volume du mélange gazeux diminue de trois fois ? Dans quelle direction l’équilibre du système va-t-il se déplacer ?
Solution. Notons les concentrations de réactifs : = UN, =b,=Avec. Selon la loi de l'action de masse, les taux de réactions directes et inverses avant le changement de volume sont égaux
v pr = Ka 2 b, v arr = K 1 s 2
Après avoir réduit de trois fois le volume d'un système homogène, la concentration de chacun des réactifs augmentera trois fois : = 3a,[O2] = 3b; = 3s. A de nouvelles concentrations, la vitesse v" np des réactions directes et inverses :
v" np = K(3a) 2 (3b) = 27 Ka 2 b ; v o 6 p = K 1 (3c) 2 = 9K 1 c 2.
![]() ;
; ![]()
Par conséquent, la vitesse de la réaction directe a été multipliée par 27 et celle de la réaction inverse par neuf fois seulement. L'équilibre du système s'est déplacé vers la formation de SO 3.
Exemple 6. Calculez combien de fois la vitesse d'une réaction se produisant en phase gazeuse augmentera lorsque la température augmente de 30 à 70 0 C, si le coefficient de température de la réaction est de 2.
Solution. La dépendance de la vitesse d'une réaction chimique sur la température est déterminée par la règle empirique de Van't Hoff selon la formule
Par conséquent, la vitesse de réaction à 70°C est 16 fois supérieure à la vitesse de réaction à 30°C.
Exemple 7. Constante d'équilibre d'un système homogène
CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) à 850°C est égal à 1. Calculez les concentrations de toutes les substances à l'équilibre si les concentrations initiales sont : [CO] ISH = 3 mol/l, [H 2 O] RI = 2 mol/l.
Solution.À l'équilibre, les vitesses des réactions directes et inverses sont égales, et le rapport des constantes de ces vitesses est constant et est appelé constante d'équilibre du système donné :
V np = K1[CO][H 2 O]; V o b p = À 2 [CO 2 ][H 2 ];
![]()
Dans l'énoncé du problème, les concentrations initiales sont données, tandis que dans l'expression K r inclut uniquement les concentrations d’équilibre de toutes les substances du système. Supposons qu'au moment de l'équilibre la concentration [CO 2 ] P = X mole/l. D’après l’équation du système, le nombre de moles d’hydrogène formées sera également X mole/l. Pour le même nombre de taupes (X mol/l) CO et H 2 O sont consommés pour former X moles de CO 2 et H 2. Par conséquent, les concentrations d’équilibre des quatre substances (mol/l) :
[CO 2 ] P = [H 2 ] P = X;[CO] P = (3 – x); P =(2x).
Connaissant la constante d'équilibre, on trouve la valeur X, puis les concentrations initiales de toutes les substances :
![]() ; x2 =6-2x-3x + x2; 5x = 6, l = 1,2 mol/l.
; x2 =6-2x-3x + x2; 5x = 6, l = 1,2 mol/l.
Revenons au processus de production d'ammoniac, exprimé par l'équation :
N 2 (g) + 3H 2 (g) → 2NH 3 (g)
Étant dans un volume fermé, l'azote et l'hydrogène se combinent et forment de l'ammoniac. Combien de temps durera ce processus ? Il est logique de supposer cela jusqu'à ce que l'un des réactifs soit épuisé. Cependant, dans la vraie vie, ce n’est pas tout à fait vrai. Le fait est que quelque temps après le début de la réaction, l'ammoniac résultant commencera à se décomposer en azote et en hydrogène, c'est-à-dire qu'une réaction inverse commencera :
2NH 3 (g) → N 2 (g) + 3H 2 (g)
En effet, dans un volume fermé, deux réactions, directement opposées l’une à l’autre, auront lieu en même temps. Ce processus s’écrit donc par l’équation suivante :
N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g)
Une double flèche indique que la réaction se déroule dans deux directions. La réaction de combinaison de l’azote et de l’hydrogène est appelée réaction directe. Réaction de décomposition de l'ammoniac - contrecoup.
Au tout début du processus, la vitesse de réaction directe est très élevée. Mais avec le temps, les concentrations de réactifs diminuent et la quantité d'ammoniac augmente. En conséquence, la vitesse de la réaction directe diminue et la vitesse de la réaction inverse augmente. Il arrive un moment où les taux de réactions directes et inverses sont comparés - l'équilibre chimique ou l'équilibre dynamique se produit. À l’équilibre, des réactions directes et inverses se produisent, mais leurs taux sont les mêmes, donc aucun changement n’est perceptible.
Constante d'équilibre
Différentes réactions se déroulent de différentes manières. Dans certaines réactions, un assez grand nombre de produits de réaction se forment avant que l'équilibre ne se produise ; dans d'autres, beaucoup moins. Ainsi, on peut dire qu’une équation particulière a sa propre constante d’équilibre. Connaissant la constante d'équilibre d'une réaction, il est possible de déterminer les quantités relatives de réactifs et de produits de réaction auxquelles se produit l'équilibre chimique.
Soit une réaction décrite par l'équation : aA + bB = cC + dD
- a, b, c, d - coefficients de l'équation de réaction ;
- A, B, C, D - formules chimiques de substances.
Constante d'équilibre:
[C] c [D] d K = ———————— [A] a [B] b
Les crochets indiquent que la formule implique des concentrations molaires de substances.
Que dit la constante d’équilibre ?
Pour la synthèse de l'ammoniac à température ambiante K = 3,5·10 8. Il s'agit d'un nombre assez élevé, indiquant que l'équilibre chimique se produira lorsque la concentration en ammoniac sera bien supérieure à celle des matières premières restantes.
Dans la production réelle d’ammoniac, la tâche du technologue est d’obtenir le coefficient d’équilibre le plus élevé possible, c’est-à-dire de sorte que la réaction directe se poursuive jusqu’à son terme. Comment cela peut il etre accompli?
Le principe du Chatelier
Le principe du Chatelier lit :
Comment comprendre cela ? Tout est très simple. Il existe trois manières de bouleverser l’équilibre :
- changer la concentration de la substance;
- changer la température;
- changer la pression.
Lorsque la réaction de synthèse de l'ammoniac est à l'équilibre, elle peut être représentée comme suit (la réaction est exothermique) :
N 2 (g) + 3H 2 (g) → 2NH 3 (g) + Chaleur
Changer de concentration
Introduisons de l'azote supplémentaire dans un système équilibré. Cela va bouleverser l’équilibre :

La réaction directe commencera à se dérouler plus rapidement car la quantité d’azote a augmenté et une plus grande quantité d’azote réagit. Après un certain temps, l'équilibre chimique se reproduira, mais la concentration en azote sera supérieure à la concentration en hydrogène :

Mais il est possible de « biaiser » le système vers la gauche d'une autre manière - en « allégeant » le côté droit, par exemple en éliminant l'ammoniac du système au fur et à mesure qu'il se forme. Ainsi, la réaction directe de formation d’ammoniac prédominera à nouveau.
Changer la température
Le côté droit de notre « balance » peut être modifié en modifiant la température. Pour que le côté gauche « l'emporte », il faut « alléger » le côté droit - réduire la température :

Changer la pression
Il est possible de perturber l'équilibre dans un système en utilisant la pression uniquement lors de réactions avec des gaz. Il existe deux manières d'augmenter la pression :
- réduire le volume du système;
- introduction de gaz inerte.
À mesure que la pression augmente, le nombre de collisions moléculaires augmente. Dans le même temps, la concentration de gaz dans le système augmente et les taux de réactions directes et inverses changent - l'équilibre est perturbé. Pour rétablir l’équilibre, le système « essaie » de réduire la pression.
Lors de la synthèse de l'ammoniac, deux molécules d'ammoniac se forment à partir de 4 molécules d'azote et d'hydrogène. En conséquence, le nombre de molécules de gaz diminue – la pression chute. En conséquence, afin d’atteindre l’équilibre après avoir augmenté la pression, la vitesse de la réaction directe augmente.
Résumer. Selon le principe de Le Chatelier, la production d'ammoniac peut être augmentée par :
- augmenter la concentration des réactifs;
- réduire la concentration des produits de réaction ;
- réduire la température de réaction ;
- augmenter la pression à laquelle la réaction se produit.
Une caractéristique quantitative montrant la direction d'une réaction et le changement de concentration des substances est appelée constante d'équilibre d'une réaction chimique. La constante d'équilibre dépend de la température et de la nature des réactifs.
Réactions réversibles et irréversibles
Toutes les réactions peuvent être divisées en deux types :
- réversible, circulant simultanément dans deux directions mutuellement opposées ;
- irréversible, s'écoulant dans une direction avec consommation complète d'au moins une substance de départ.
Les réactions irréversibles produisent généralement des substances insolubles sous forme de précipité ou de gaz. De telles réactions incluent :
- la combustion:
C 2 H 5 OH + 3O 2 → 2CO 2 + H 2 O;
- décomposition:
2KMnO 4 → K 2 MnO 4 + MnO 2 + H 2 O ;
- lien avec la formation de sédiments ou de gaz :
BaCl 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaCl.

Riz. 1. Formation de précipité BaSO 4.
Les réactions réversibles ne sont possibles que dans certaines conditions constantes. Les substances originelles donnent naissance à une nouvelle substance, qui se décompose immédiatement en ses composants et est réassemblée. Par exemple, à la suite de la réaction 2NO + O 2 ↔ 2NO 2, l'oxyde nitrique (IV) se décompose facilement en oxyde nitrique (II) et en oxygène.
Équilibre
Après un certain temps, la vitesse d'une réaction réversible ralentit. L'équilibre chimique est atteint - un état dans lequel il n'y a pas de changement dans la concentration des substances de départ et des produits de réaction au fil du temps, puisque les vitesses des réactions directes et inverses sont égalisées. L'équilibre n'est possible que dans des systèmes homogènes, c'est-à-dire que toutes les substances en réaction sont soit des liquides, soit des gaz.
Considérons l'équilibre chimique en utilisant l'exemple de la réaction de l'hydrogène avec l'iode :
- réaction directe -
H 2 + I 2 ↔ 2HI;
- contrecoup -
2HI ↔ H2 + I2 .
Dès que deux réactifs sont mélangés - l'hydrogène et l'iode - l'iodure d'hydrogène n'existe pas encore, puisque les substances simples ne réagissent que. Un grand nombre de substances de départ réagissent activement les unes avec les autres, la vitesse de la réaction directe sera donc maximale. Dans ce cas, la réaction inverse ne se produit pas et sa vitesse est nulle.
Le taux de réaction directe peut être exprimé graphiquement :
ν pr = k pr ∙ ∙ ,
où k pr est la constante de vitesse de la réaction directe.
Au fil du temps, les réactifs se consomment et leur concentration diminue. En conséquence, la vitesse de la réaction directe diminue. Dans le même temps, la concentration d’une nouvelle substance, l’iodure d’hydrogène, augmente. Une fois accumulé, il commence à se décomposer et la vitesse de la réaction inverse augmente. Cela peut être exprimé comme
ν arr = k arr ∙ 2 .
Iodure d'hydrogène au carré, puisque le coefficient de la molécule est de deux.
À un certain point, les vitesses des réactions directes et inverses deviennent égales. Un état d’équilibre chimique se produit.

Riz. 2. Graphique de la vitesse de réaction en fonction du temps.
L'équilibre peut être déplacé soit vers les matières premières, soit vers les produits de réaction. Le déplacement sous l'influence de facteurs externes est appelé principe de Le Chatelier. L'équilibre est affecté par la température, la pression et la concentration de l'une des substances.
Calcul constant
Dans un état d'équilibre, les deux réactions se produisent, mais en même temps les concentrations de substances sont en équilibre (des concentrations d'équilibre se forment), puisque les taux sont équilibrés (ν pr = ν arr).
L'équilibre chimique est caractérisé par une constante d'équilibre chimique, qui est exprimée par la formule récapitulative :
K p = k pr / k arr = const.
Les constantes de vitesse de réaction peuvent être exprimées en termes de rapport de vitesse de réaction. Prenons l'équation conditionnelle de la réaction inverse :
aA + bB ↔ cC + dD.
Ensuite, les taux de réactions directes et inverses seront égaux :
- ν pr = k pr ∙ [A] p a ∙ [B] p b
- ν arr = k arr ∙ [C] p c ∙ [D] p ré .
En conséquence, si
ν pr = ν arr,
k pr ∙ [A] p a ∙ [B] p b = k arr ∙ [C] p c ∙ [D] p d .
De là, nous pouvons exprimer la relation de constantes :
k arr / k pr = [C] p c ∙ [D] p d / [A] p a ∙ [B] p b .
Ce rapport est égal à la constante d'équilibre :
K p = [C] p c ∙ [D] p ré / [A] p a ∙ [B] p b .

Riz. 3. Formule de la constante d'équilibre.
La valeur indique combien de fois la vitesse de la réaction directe est supérieure à la vitesse de la réaction inverse.
Qu'avons-nous appris ?
En fonction des produits finaux, les réactions sont classées en réversibles et irréversibles. Les réactions réversibles se déroulent dans les deux sens : les substances de départ forment des produits finaux qui se décomposent en substances de départ. Pendant la réaction, les taux des réactions directes et inverses sont équilibrés. Cet état est appelé équilibre chimique. Il peut être exprimé comme le rapport du produit des concentrations à l'équilibre des produits de réaction au produit des concentrations à l'équilibre des substances de départ.
Test sur le sujet
Évaluation du rapport
Note moyenne: 4.8. Notes totales reçues : 193.