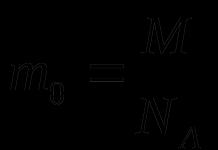Le rôle des protéines dans l’organisme est extrêmement important. De plus, une substance ne peut porter un tel nom qu'après avoir acquis une structure prédéterminée. Jusqu’à présent, il s’agit d’un polypeptide, simplement d’une chaîne d’acides aminés qui ne peut pas remplir les fonctions prévues. En général, la structure spatiale des protéines (primaire, secondaire, tertiaire et domaine) est leur structure tridimensionnelle. De plus, les plus importantes pour le corps sont les structures secondaires, tertiaires et domaniales.
Conditions préalables à l'étude de la structure des protéines
Parmi les méthodes d'étude de la structure substances chimiques La cristallographie aux rayons X joue un rôle particulier. Grâce à lui, vous pouvez obtenir des informations sur la séquence des atomes dans les composés moléculaires et leur organisation spatiale. En termes simples, une radiographie peut être prise pour une seule molécule, ce qui est devenu possible dans les années 30 du 20e siècle.
C’est alors que les chercheurs ont découvert que de nombreuses protéines ont non seulement une structure linéaire, mais peuvent également être localisées dans des hélices, des bobines et des domaines. Et à la suite de nombreuses expériences scientifiques, il s'est avéré que la structure secondaire d'une protéine est la forme finale des protéines structurelles et une forme intermédiaire pour les enzymes et les immunoglobulines. Cela signifie que les substances qui ont finalement une structure tertiaire ou quaternaire, au stade de leur « maturation », doivent également passer par l'étape de formation en spirale caractéristique de la structure secondaire.

Formation d'une structure protéique secondaire
Dès que la synthèse du polypeptide sur les ribosomes dans le réseau grossier de l'endoplasme cellulaire est terminée, la structure secondaire de la protéine commence à se former. Le polypeptide lui-même est une longue molécule qui prend beaucoup de place et n'est pas pratique à transporter et à remplir ses fonctions prévues. Par conséquent, afin de réduire sa taille et de lui conférer des propriétés particulières, une structure secondaire est développée. Cela se produit grâce à la formation d’hélices alpha et de feuilles bêta. De cette façon, on obtient une protéine de structure secondaire, qui à l'avenir se transformera en tertiaire et quaternaire, ou sera utilisée sous cette forme.

Organisation de la structure secondaire
Comme de nombreuses études l'ont montré, la structure secondaire d'une protéine est soit une hélice alpha, soit un feuillet bêta, soit une alternance de régions avec ces éléments. De plus, la structure secondaire est une méthode de torsion et de formation hélicoïdale d'une molécule protéique. Il s'agit d'un processus chaotique qui se produit en raison des liaisons hydrogène qui se forment entre les régions polaires des résidus d'acides aminés du polypeptide.
Structure secondaire de l'hélice alpha
Étant donné que seuls les acides L-aminés participent à la biosynthèse des polypeptides, la formation de la structure secondaire de la protéine commence par une torsion de l'hélice dans le sens des aiguilles d'une montre (vers la droite). Il y a strictement 3,6 résidus d'acides aminés par tour d'hélice et la distance le long de l'axe de l'hélice est de 0,54 nm. Ce les propriétés générales pour la structure secondaire de la protéine, qui ne dépendent pas du type d'acides aminés impliqués dans la synthèse.

Il a été déterminé que la chaîne polypeptidique entière n’est pas complètement hélicoïdale. Sa structure contient des sections linéaires. En particulier, la molécule de protéine pepsine n'est qu'à 30 % hélicoïdale, le lysozyme à 42 % et l'hémoglobine à 75 %. Cela signifie que la structure secondaire de la protéine n'est pas strictement une hélice, mais une combinaison de ses sections avec des sections linéaires ou en couches.
Structure secondaire de la couche bêta
Le deuxième type d'organisation structurelle d'une substance est une couche bêta, qui est constituée de deux ou plusieurs brins d'un polypeptide reliés par une liaison hydrogène. Ce dernier se produit entre les groupes CO NH2 libres. De cette manière, ce sont principalement les protéines structurelles (musculaires) qui sont connectées.
La structure des protéines de ce type est la suivante : un brin de polypeptide avec la désignation du terminal sections A-B parallèle à l'autre. Le seul bémol est que la deuxième molécule est située de manière antiparallèle et est désignée par BA. Cela forme une couche bêta, qui peut être constituée de n'importe quel nombre de chaînes polypeptidiques reliées par plusieurs liaisons hydrogène.
Liaison hydrogène
Structure secondaire protéine - une liaison basée sur de multiples interactions polaires d'atomes avec différents indices d'électronégativité. Quatre éléments ont la plus grande capacité à former une telle liaison : le fluor, l'oxygène, l'azote et l'hydrogène. Les protéines contiennent tout sauf du fluor. Par conséquent, une liaison hydrogène peut se former et se forme effectivement, permettant de relier les chaînes polypeptidiques en couches bêta et en hélices alpha.

Il est plus facile d'expliquer l'apparition d'une liaison hydrogène en utilisant l'exemple de l'eau, qui est un dipôle. L'oxygène porte une forte charge négative et, en raison de sa forte polarisation Connexion O-H l'hydrogène est considéré comme positif. Dans cet état, les molécules sont présentes dans un certain environnement. De plus, beaucoup d’entre eux se touchent et entrent en collision. Ensuite, l’oxygène de la première molécule d’eau attire l’hydrogène de l’autre. Et ainsi de suite tout au long de la chaîne.
Des processus similaires se produisent dans les protéines : l'oxygène électronégatif d'une liaison peptidique attire l'hydrogène de n'importe quelle partie d'un autre résidu d'acide aminé, formant une liaison hydrogène. Il s’agit d’une conjugaison polaire faible, qui nécessite environ 6,3 kJ d’énergie pour se rompre.
En comparaison, la liaison covalente la plus faible des protéines nécessite 84 kJ d’énergie pour se rompre. La liaison covalente la plus forte nécessiterait 8 400 kJ. Cependant, le nombre de liaisons hydrogène dans une molécule protéique est si énorme que leur énergie totale permet à la molécule d'exister dans des conditions agressives et de maintenir sa structure spatiale. C'est pourquoi les protéines existent. La structure de ce type de protéine fournit la force nécessaire au fonctionnement des muscles, des os et des ligaments. L'importance de la structure secondaire des protéines pour l'organisme est tellement énorme.
Les protéides sont constituées d’une chaîne polypeptidique et une molécule protéique peut être constituée d’une, deux ou plusieurs chaînes. Cependant, les facteurs physiques, biologiques et Propriétés chimiques Les biopolymères sont déterminés non seulement par la structure chimique générale, qui peut être « dénuée de sens », mais également par la présence d’autres niveaux d’organisation de la molécule protéique.
Déterminé quantitativement et qualitativement composition en acides aminés. Les liaisons peptidiques sont à la base de la structure primaire. Cette hypothèse a été exprimée pour la première fois en 1888 par A. Ya. Danilevsky, et plus tard ses hypothèses ont été confirmées par la synthèse de peptides réalisée par E. Fischer. La structure de la molécule protéique a été étudiée en détail par A. Ya. Danilevsky et E. Fischer. Selon cette théorie, les molécules de protéines sont constituées d’un grand nombre de résidus d’acides aminés reliés par des liaisons peptidiques. Une molécule protéique peut avoir une ou plusieurs chaînes polypeptidiques.
Lors de l'étude de la structure primaire des protéines, des agents chimiques et des enzymes protéolytiques sont utilisés. Ainsi, en utilisant la méthode Edman, il est très pratique d’identifier les acides aminés terminaux.
La structure secondaire d'une protéine démontre la configuration spatiale de la molécule protéique. On distingue les types de structure secondaire suivants : hélice alpha, hélice bêta, hélice de collagène. Les scientifiques ont découvert que l'hélice alpha est la plus caractéristique de la structure des peptides.
La structure secondaire de la protéine est stabilisée à l'aide de ces derniers apparaissent entre ceux connectés à l'atome d'azote électronégatif d'une liaison peptidique et l'atome d'oxygène carbonyle du quatrième acide aminé qui en découle, et ils sont dirigés le long de l'hélice. Les calculs énergétiques montrent que l’hélice alpha droite, présente dans les protéines natives, est plus efficace pour polymériser ces acides aminés.
Structure secondaire des protéines : structure en feuillet bêta
Les chaînes polypeptidiques des feuillets bêta sont entièrement étendues. Les plis bêta sont formés par l’interaction de deux liaisons peptidiques. La structure indiquée est caractéristique de (kératine, fibroïne, etc.). En particulier, la bêta-kératine est caractérisée par un arrangement parallèle de chaînes polypeptidiques, qui sont en outre stabilisées par des liaisons disulfure interchaînes. Dans la fibroïne de soie, les chaînes polypeptidiques adjacentes sont antiparallèles.
Structure secondaire des protéines : hélice de collagène
La formation est constituée de trois chaînes hélicoïdales de tropocollagène, qui ont la forme d'une tige. Les chaînes hélicoïdales se tordent et forment une superhélice. L'hélice est stabilisée par des liaisons hydrogène qui naissent entre l'hydrogène des groupes aminés peptidiques des résidus d'acides aminés d'une chaîne et l'oxygène du groupe carbonyle des résidus d'acides aminés de l'autre chaîne. La structure présentée confère au collagène une résistance et une élasticité élevées.
Structure tertiaire des protéines
La plupart des protéines à l’état natif ont une structure très compacte, déterminée par la forme, la taille et la polarité des radicaux d’acides aminés, ainsi que par la séquence des acides aminés.
Les interactions hydrophobes et ioniques, les liaisons hydrogène, etc. ont une influence significative sur le processus de formation de la conformation native d'une protéine ou de sa structure tertiaire. Sous l'influence de ces forces, une conformation thermodynamiquement appropriée de la molécule protéique et sa stabilisation sont atteint.
Structure quaternaire
Ce type de structure moléculaire résulte de l'association de plusieurs sous-unités en une seule molécule complexe. Chaque sous-unité comprend des structures primaires, secondaires et tertiaires.
La structure secondaire est un moyen de replier une chaîne polypeptidique en une structure ordonnée en raison de la formation de liaisons hydrogène entre les groupes peptidiques de la même chaîne ou les chaînes polypeptidiques adjacentes. Selon leur configuration, les structures secondaires sont divisées en hélices (hélice α) et en couches pliées (structure β et forme β croisée).

α-Hélix. Il s’agit d’un type de structure protéique secondaire qui ressemble à une hélice régulière, formée en raison de liaisons hydrogène interpeptidiques au sein d’une chaîne polypeptidique. Le modèle de structure de l'hélice α (Fig. 2), qui prend en compte toutes les propriétés de la liaison peptidique, a été proposé par Pauling et Corey. Principales caractéristiques de l’hélice α :
· configuration hélicoïdale de la chaîne polypeptidique ayant une symétrie hélicoïdale ;
· formation de liaisons hydrogène entre les groupes peptidiques de chaque premier et quatrième résidu d'acide aminé ;
Régularité des virages en spirale ;
· l'équivalence de tous les résidus d'acides aminés dans l'hélice α, quelle que soit la structure de leurs radicaux latéraux ;
· les radicaux latéraux des acides aminés ne participent pas à la formation de l'hélice α.
Extérieurement, l'hélice α ressemble à la spirale légèrement étirée d'une cuisinière électrique. La régularité des liaisons hydrogène entre les premier et quatrième groupes peptidiques détermine la régularité des tours de la chaîne polypeptidique. La hauteur d'un tour, ou le pas de l'hélice α, est de 0,54 nm ; il comprend 3,6 résidus d'acides aminés, c'est-à-dire que chaque résidu d'acide aminé se déplace le long de l'axe (la hauteur d'un résidu d'acide aminé) de 0,15 nm (0,54 : 3,6 = 0,15 nm), ce qui nous permet de parler d'équivalence de tous les résidus d'acides aminés dans l'hélice α. La période de régularité d'une hélice α est de 5 tours ou 18 résidus d'acides aminés ; la durée d'une période est de 2,7 nm. Riz. 3. Modèle à hélice a de Pauling-Corey
Structure β. Il s'agit d'un type de structure secondaire qui présente une configuration légèrement incurvée de la chaîne polypeptidique et est formée par des liaisons hydrogène interpeptidiques au sein de sections individuelles d'une chaîne polypeptidique ou de chaînes polypeptidiques adjacentes. On l'appelle également une structure à plis en couches. Il existe des variétés de structures β. Les régions en couches limitées formées par une chaîne polypeptidique d’une protéine sont appelées forme β croisée (structure β courte). Des liaisons hydrogène sous forme β croisée se forment entre les groupes peptidiques des boucles de la chaîne polypeptidique. Un autre type - la structure β complète - est caractéristique de l'ensemble de la chaîne polypeptidique, qui a une forme allongée et est maintenue par des liaisons hydrogène interpeptidiques entre des chaînes polypeptidiques parallèles adjacentes (Fig. 3). Cette structure ressemble au soufflet d'un accordéon. De plus, des variantes de structures β sont possibles : elles peuvent être formées de chaînes parallèles (les extrémités N-terminales des chaînes polypeptidiques sont dirigées dans la même direction) et antiparallèles (les extrémités N-terminales sont dirigées dans des directions différentes). Les radicaux latéraux d'une couche sont placés entre les radicaux latéraux d'une autre couche.
Dans les protéines, les transitions des structures α aux structures β et inversement sont possibles en raison du réarrangement des liaisons hydrogène. Au lieu de liaisons hydrogène interpeptidiques régulières le long de la chaîne (grâce auxquelles la chaîne polypeptidique est tordue en spirale), les sections hélicoïdales se déroulent et les liaisons hydrogène se ferment entre les fragments allongés des chaînes polypeptidiques. Cette transition se retrouve dans la kératine, la protéine du cheveu. Lors du lavage des cheveux avec un produit alcalin détergents La structure spirale de la β-kératine est facilement détruite et se transforme en α-kératine (les cheveux bouclés se redressent).
La destruction des structures secondaires régulières des protéines (hélices α et structures β), par analogie avec la fusion d'un cristal, est appelée « fusion » des polypeptides. Dans ce cas, les liaisons hydrogène sont rompues et les chaînes polypeptidiques prennent la forme d'un enchevêtrement aléatoire. Par conséquent, la stabilité des structures secondaires est déterminée par les liaisons hydrogène interpeptides. D'autres types de liaisons n'y participent presque pas, à l'exception des liaisons disulfure le long de la chaîne polypeptidique aux emplacements des résidus de cystéine. Les peptides courts sont fermés en cycles en raison des liaisons disulfure. De nombreuses protéines contiennent à la fois des régions hélicoïdales α et des structures β. Il n'existe presque pas de protéines naturelles constituées à 100 % d'hélice α (à l'exception de la paramyosine, une protéine musculaire qui contient 96 à 100 % d'hélice α), tandis que les polypeptides synthétiques ont 100 % d'hélice.
D’autres protéines présentent différents degrés d’enroulement. Une fréquence élevée de structures hélicoïdales α est observée dans la paramyosine, la myoglobine et l'hémoglobine. En revanche, dans la trypsine, une ribonucléase, une partie importante de la chaîne polypeptidique est repliée en structures β en couches. Les protéines des tissus de soutien : la kératine (protéine des cheveux, de la laine), le collagène (protéine des tendons, de la peau), la fibroïne (protéine de la soie naturelle) ont une configuration β de chaînes polypeptidiques. Les différents degrés d'hélicité des chaînes polypeptidiques des protéines indiquent qu'il existe évidemment des forces qui perturbent partiellement l'hélicité ou « brisent » le repliement régulier de la chaîne polypeptidique. La raison en est un repliement plus compact de la chaîne polypeptidique protéique dans un certain volume, c'est-à-dire dans une structure tertiaire.
Le rôle des protéines dans l’organisme est extrêmement important. De plus, une substance ne peut porter un tel nom qu'après avoir acquis une structure prédéterminée. Jusqu’à présent, il s’agit d’un polypeptide, simplement d’une chaîne d’acides aminés qui ne peut pas remplir les fonctions prévues. En général, la structure spatiale des protéines (primaire, secondaire, tertiaire et domaine) est leur structure tridimensionnelle. De plus, les plus importantes pour le corps sont les structures secondaires, tertiaires et domaniales.
Conditions préalables à l'étude de la structure des protéines
Parmi les méthodes d'étude de la structure des substances chimiques, la cristallographie aux rayons X joue un rôle particulier. Grâce à lui, vous pouvez obtenir des informations sur la séquence des atomes dans les composés moléculaires et leur organisation spatiale. En termes simples, une radiographie peut être prise pour une seule molécule, ce qui est devenu possible dans les années 30 du 20e siècle.
C’est alors que les chercheurs ont découvert que de nombreuses protéines ont non seulement une structure linéaire, mais peuvent également être localisées dans des hélices, des bobines et des domaines. Et à la suite de nombreuses expériences scientifiques, il s'est avéré que la structure secondaire d'une protéine est la forme finale des protéines structurelles et une forme intermédiaire pour les enzymes et les immunoglobulines. Cela signifie que les substances qui ont finalement une structure tertiaire ou quaternaire, au stade de leur « maturation », doivent également passer par l'étape de formation en spirale caractéristique de la structure secondaire.

Formation d'une structure protéique secondaire
Dès que la synthèse du polypeptide sur les ribosomes dans le réseau grossier de l'endoplasme cellulaire est terminée, la structure secondaire de la protéine commence à se former. Le polypeptide lui-même est une longue molécule qui prend beaucoup de place et n'est pas pratique à transporter et à remplir ses fonctions prévues. Par conséquent, afin de réduire sa taille et de lui conférer des propriétés particulières, une structure secondaire est développée. Cela se produit grâce à la formation d’hélices alpha et de feuilles bêta. De cette façon, on obtient une protéine de structure secondaire, qui à l'avenir se transformera en tertiaire et quaternaire, ou sera utilisée sous cette forme.

Organisation de la structure secondaire
Comme de nombreuses études l'ont montré, la structure secondaire d'une protéine est soit une hélice alpha, soit un feuillet bêta, soit une alternance de régions avec ces éléments. De plus, la structure secondaire est une méthode de torsion et de formation hélicoïdale d'une molécule protéique. Il s'agit d'un processus chaotique qui se produit en raison des liaisons hydrogène qui se forment entre les régions polaires des résidus d'acides aminés du polypeptide.
Structure secondaire de l'hélice alpha
Étant donné que seuls les acides L-aminés participent à la biosynthèse des polypeptides, la formation de la structure secondaire de la protéine commence par une torsion de l'hélice dans le sens des aiguilles d'une montre (vers la droite). Il y a strictement 3,6 résidus d'acides aminés par tour d'hélice et la distance le long de l'axe de l'hélice est de 0,54 nm. Ce sont des propriétés générales de la structure secondaire d’une protéine qui ne dépendent pas du type d’acides aminés impliqués dans la synthèse.

Il a été déterminé que la chaîne polypeptidique entière n’est pas complètement hélicoïdale. Sa structure contient des sections linéaires. En particulier, la molécule de protéine pepsine n'est qu'à 30 % hélicoïdale, le lysozyme à 42 % et l'hémoglobine à 75 %. Cela signifie que la structure secondaire de la protéine n'est pas strictement une hélice, mais une combinaison de ses sections avec des sections linéaires ou en couches.
Structure secondaire de la couche bêta
Le deuxième type d'organisation structurelle d'une substance est une couche bêta, qui est constituée de deux ou plusieurs brins d'un polypeptide reliés par une liaison hydrogène. Ce dernier se produit entre les groupes CO NH2 libres. De cette manière, ce sont principalement les protéines structurelles (musculaires) qui sont connectées.
La structure des protéines de ce type est la suivante : un brin du polypeptide portant la désignation des sections terminales A-B est parallèle à l'autre. Le seul bémol est que la deuxième molécule est située de manière antiparallèle et est désignée par BA. Cela forme une couche bêta, qui peut être constituée de n'importe quel nombre de chaînes polypeptidiques reliées par plusieurs liaisons hydrogène.
Liaison hydrogène
La structure secondaire d’une protéine est une liaison basée sur de multiples interactions polaires d’atomes ayant différents indices d’électronégativité. Quatre éléments ont la plus grande capacité à former une telle liaison : le fluor, l'oxygène, l'azote et l'hydrogène. Les protéines contiennent tout sauf du fluor. Par conséquent, une liaison hydrogène peut se former et se forme effectivement, permettant de relier les chaînes polypeptidiques en couches bêta et en hélices alpha.

Il est plus facile d'expliquer l'apparition d'une liaison hydrogène en utilisant l'exemple de l'eau, qui est un dipôle. L'oxygène porte une forte charge négative et, en raison de la forte polarisation de la liaison O-H, l'hydrogène est considéré comme positif. Dans cet état, les molécules sont présentes dans un certain environnement. De plus, beaucoup d’entre eux se touchent et entrent en collision. Ensuite, l’oxygène de la première molécule d’eau attire l’hydrogène de l’autre. Et ainsi de suite tout au long de la chaîne.
Des processus similaires se produisent dans les protéines : l'oxygène électronégatif d'une liaison peptidique attire l'hydrogène de n'importe quelle partie d'un autre résidu d'acide aminé, formant une liaison hydrogène. Il s’agit d’une conjugaison polaire faible, qui nécessite environ 6,3 kJ d’énergie pour se rompre.
En comparaison, la liaison covalente la plus faible des protéines nécessite 84 kJ d’énergie pour se rompre. La liaison covalente la plus forte nécessiterait 8 400 kJ. Cependant, le nombre de liaisons hydrogène dans une molécule protéique est si énorme que leur énergie totale permet à la molécule d'exister dans des conditions agressives et de maintenir sa structure spatiale. C'est pourquoi les protéines existent. La structure de ce type de protéine fournit la force nécessaire au fonctionnement des muscles, des os et des ligaments. L'importance de la structure secondaire des protéines pour l'organisme est tellement énorme.
liaisons hydrogène
Distinguer hélice a, structure b (indice).
Structure hélices α a été proposé Pauling Et Corey

collagène
b-Structure
Riz. 2.3. b-Structure
La structure a Forme plate structure B parallèle; si c'est le contraire - structure B antiparallèle
super spirale. protofibrilles microfibrilles d'un diamètre de 10 nm.
Bombyx mori fibroïne
Conformation désordonnée.
Structure suprasecondaire.
VOIR PLUS :
ORGANISATION STRUCTURELLE DES PROTÉINES
L'existence de 4 niveaux d'organisation structurale d'une molécule protéique a été prouvée.
Structure protéique primaire– la séquence d'arrangement des résidus d'acides aminés dans la chaîne polypeptidique. Dans les protéines, les acides aminés individuels sont liés les uns aux autres liaisons peptidiques, résultant de l'interaction des groupes a-carboxyle et a-amino d'acides aminés.

À ce jour, la structure primaire de dizaines de milliers de protéines différentes a été déchiffrée. Pour déterminer la structure primaire d'une protéine, la composition en acides aminés est déterminée à l'aide de méthodes d'hydrolyse. Ensuite, la nature chimique des acides aminés terminaux est déterminée. L'étape suivante consiste à déterminer la séquence d'acides aminés dans la chaîne polypeptidique. A cet effet, une hydrolyse partielle sélective (chimique et enzymatique) est utilisée. Il est possible d'utiliser l'analyse par diffraction des rayons X, ainsi que des données sur la séquence nucléotidique complémentaire de l'ADN.
Structure secondaire des protéines– configuration de la chaîne polypeptidique, c'est-à-dire une méthode d'empaquetage d'une chaîne polypeptidique dans une conformation spécifique. Ce processus ne se déroule pas de manière chaotique, mais conformément au programme intégré dans la structure primaire.
La stabilité de la structure secondaire est assurée principalement par les liaisons hydrogène, mais une certaine contribution est apportée par les liaisons covalentes - peptide et disulfure.
Le type de structure le plus probable des protéines globulaires est considéré une hélice. La torsion de la chaîne polypeptidique se produit dans le sens des aiguilles d'une montre. Chaque protéine est caractérisée un certain degré spiralisation. Si les chaînes d'hémoglobine sont hélicoïdales à 75 %, alors la pepsine n'en représente que 30 %.
Le type de configuration des chaînes polypeptidiques trouvées dans les protéines des cheveux, de la soie et des muscles est appelé structures b.
Les segments de la chaîne peptidique sont disposés en une seule couche, formant une figure semblable à une feuille pliée en accordéon. La couche peut être formée de deux ou gros montant chaînes peptidiques.
Dans la nature, il existe des protéines dont la structure ne correspond ni à la structure β ni à la structure a, par exemple le collagène est une protéine fibrillaire qui constitue la majeure partie du tissu conjonctif du corps humain et animal.
Structure tertiaire des protéines– l'orientation spatiale de l'hélice polypeptidique ou la façon dont la chaîne polypeptidique est disposée dans un certain volume. La première protéine dont la structure tertiaire a été élucidée par analyse par diffraction des rayons X était la myoglobine du cachalot (Fig. 2).
En stabilisant la structure spatiale des protéines, en plus de des liaisons covalentes, le rôle principal est joué par les liaisons non covalentes (hydrogène, interactions électrostatiques de groupes chargés, forces intermoléculaires de Van der Waals, interactions hydrophobes, etc.).
Par idées modernes, la structure tertiaire de la protéine après l'achèvement de sa synthèse se forme spontanément. Basique force motrice est l'interaction des radicaux d'acides aminés avec les molécules d'eau. Dans ce cas, les radicaux d'acides aminés hydrophobes non polaires sont immergés à l'intérieur de la molécule protéique et les radicaux polaires sont orientés vers l'eau. Le processus de formation de la structure spatiale native d’une chaîne polypeptidique est appelé pliant. Des protéines appelées chaperons. Ils participent au pliage. Un certain nombre de maladies humaines héréditaires ont été décrites, dont le développement est associé à des perturbations dues à des mutations du processus de repliement (pigmentose, fibrose, etc.).
Grâce aux méthodes d'analyse par diffraction des rayons X, il a été prouvé l'existence de niveaux d'organisation structurale de la molécule protéique, intermédiaires entre les structures secondaire et tertiaire. Domaine est une unité structurelle globulaire compacte au sein d’une chaîne polypeptidique (Fig. 3). De nombreuses protéines ont été découvertes (par exemple les immunoglobulines), constituées de domaines de structure et de fonctions différentes, codés par différents gènes.
Tous propriétés biologiques les protéines sont associées à la préservation de leur structure tertiaire, appelée indigène. Le globule protéique n'est pas une structure absolument rigide : des mouvements réversibles de parties de la chaîne peptidique sont possibles. Ces changements ne perturbent pas la conformation globale de la molécule. La conformation d'une molécule protéique est influencée par le pH de l'environnement, la force ionique de la solution et l'interaction avec d'autres substances. Toute influence conduisant à une perturbation de la conformation native de la molécule s’accompagne d’une perte partielle ou totale des propriétés biologiques de la protéine.
Structure protéique quaternaire- une méthode de pose dans l'espace de chaînes polypeptidiques individuelles ayant une structure primaire, secondaire ou tertiaire identique ou différente, et la formation d'une formation macromoléculaire structurellement et fonctionnellement unifiée.
Une molécule protéique constituée de plusieurs chaînes polypeptidiques est appelée oligomère, et chaque chaîne qui y est incluse - protomère. Les protéines oligomères sont souvent construites à partir d'un nombre pair de protomères ; par exemple, la molécule d'hémoglobine est constituée de deux chaînes polypeptidiques a et deux chaînes b-polypeptidiques (Fig. 4).
Environ 5 % des protéines ont une structure quaternaire, notamment l'hémoglobine et les immunoglobulines. La structure des sous-unités est caractéristique de nombreuses enzymes.
Les molécules protéiques qui composent une protéine à structure quaternaire se forment séparément sur les ribosomes et ce n'est qu'une fois la synthèse terminée qu'elles forment une structure supramoléculaire commune. Une protéine n'acquiert une activité biologique que lorsque ses protomères constitutifs sont combinés. Les mêmes types d'interactions participent à la stabilisation de la structure quaternaire comme à la stabilisation de la structure tertiaire.
Certains chercheurs reconnaissent l’existence d’un cinquième niveau d’organisation structurale des protéines. Ce métabolons - complexes macromoléculaires polyfonctionnels de diverses enzymes qui catalysent toute la voie des transformations du substrat (synthétases supérieures Les acides gras, complexe pyruvate déshydrogénase, chaîne respiratoire).
Structure secondaire des protéines
La structure secondaire est la manière dont une chaîne polypeptidique est organisée en une structure ordonnée. La structure secondaire est déterminée par la structure primaire. Puisque la structure primaire est déterminée génétiquement, la formation d’une structure secondaire peut se produire lorsque la chaîne polypeptidique quitte le ribosome. La structure secondaire est stabilisée liaisons hydrogène, qui sont formés entre les groupes NH et CO des liaisons peptidiques.
Distinguer hélice a, structure b et conformation désordonnée (indice).
Structure hélices α a été proposé Pauling Et Corey(1951). Il s'agit d'un type de structure secondaire protéique qui ressemble à une hélice régulière (Fig. 2.2). Une hélice α est une structure en forme de bâtonnet dans laquelle les liaisons peptidiques sont situées à l'intérieur de l'hélice et les radicaux d'acides aminés de la chaîne latérale sont situés à l'extérieur. L'hélice a est stabilisée par des liaisons hydrogène, qui sont parallèles à l'axe de l'hélice et se produisent entre le premier et le cinquième résidus d'acides aminés. Ainsi, dans les régions hélicoïdales étendues, chaque résidu d'acide aminé participe à la formation de deux liaisons hydrogène.

Riz. 2.2. Structure d'une hélice α.
Il y a 3,6 résidus d'acides aminés par tour d'hélice, le pas d'hélice est de 0,54 nm et il y a 0,15 nm par résidu d'acide aminé. L'angle d'hélice est de 26°. La période de régularité d'une hélice a est de 5 tours ou 18 résidus d'acides aminés. Les plus courantes sont les hélices a droites, c'est-à-dire La spirale tourne dans le sens des aiguilles d'une montre. La formation d'une hélice a est empêchée par la proline, des acides aminés à radicaux chargés et volumineux (obstacles électrostatiques et mécaniques).
Une autre forme de spirale est présente dans collagène . Dans le corps des mammifères, le collagène est le principal quantitativement Protéines : Elles représentent 25 % des protéines totales. Le collagène est présent sous diverses formes, principalement dans le tissu conjonctif. Il s'agit d'une hélice gauche avec un pas de 0,96 nm et 3,3 résidus par tour, plus plate que l'hélice α. Contrairement à l’hélice α, la formation de ponts hydrogène est ici impossible. Le collagène a une composition inhabituelle en acides aminés : 1/3 est de la glycine, environ 10 % de proline, ainsi que de l'hydroxyproline et de l'hydroxylysine. Les deux derniers acides aminés sont formés après la biosynthèse du collagène par modification post-traductionnelle. Dans la structure du collagène, le triplet gly-X-Y est constamment répété, la position X étant souvent occupée par la proline et la position Y par l'hydroxylysine. Il existe de bonnes preuves que le collagène est omniprésent sous la forme d’une triple hélice droite tordue à partir de trois hélices primaires gauches. Dans une triple hélice, un résidu sur trois aboutit au centre, où, pour des raisons stériques, seule la glycine rentre. La molécule entière de collagène mesure environ 300 nm de long.
b-Structure(couche pliée en B). On le trouve dans les protéines globulaires, ainsi que dans certaines protéines fibrillaires, par exemple la fibroïne de soie (Fig. 2.3).
Riz. 2.3. b-Structure
La structure a Forme plate. Les chaînes polypeptidiques sont presque complètement allongées, plutôt que étroitement tordues, comme dans une hélice a. Les plans des liaisons peptidiques sont situés dans l’espace comme les plis uniformes d’une feuille de papier.
Structure secondaire des polypeptides et des protéines
Il est stabilisé par des liaisons hydrogène entre les groupes CO et NH des liaisons peptidiques des chaînes polypeptidiques adjacentes. Si les chaînes polypeptidiques formant la structure b vont dans la même direction (c'est-à-dire que les extrémités C et N coïncident) – structure B parallèle; si c'est le contraire - structure B antiparallèle. Les radicaux latéraux d'une couche sont placés entre les radicaux latéraux d'une autre couche. Si une chaîne polypeptidique se plie et est parallèle à elle-même, alors cela structure B-cross antiparallèle. Des liaisons hydrogène dans la structure croisée B sont formées entre les groupes peptidiques des boucles de la chaîne polypeptidique.
Le contenu des hélices a dans les protéines étudiées à ce jour est extrêmement variable. Dans certaines protéines, par exemple la myoglobine et l'hémoglobine, l'hélice a sous-tend la structure et représente 75 %, dans le lysozyme - 42 %, dans la pepsine seulement 30 %. D'autres protéines, par exemple l'enzyme digestive chymotrypsine, sont pratiquement dépourvues de structure a-hélicoïdale et une partie importante de la chaîne polypeptidique s'inscrit dans des structures b en couches. Les protéines des tissus de soutien, le collagène (protéines des tendons et de la peau), la fibroïne (protéine de soie naturelle) ont une configuration b de chaînes polypeptidiques.
Il a été prouvé que la formation des hélices α est facilitée par les structures glu, ala, leu et β par met, val, ile ; aux endroits où la chaîne polypeptidique se plie - gly, pro, asn. On pense que six résidus groupés, dont quatre contribuent à la formation de l'hélice, peuvent être considérés comme le centre de l'hélicalisation. De ce centre se produit une croissance d'hélices dans les deux sens jusqu'à une section - un tétrapeptide, constitué de résidus qui empêchent la formation de ces hélices. Lors de la formation de la structure β, le rôle d'amorce est assuré par trois résidus d'acides aminés sur cinq qui contribuent à la formation de la structure β.
Dans la plupart des protéines structurelles, l'une des structures secondaires prédomine, qui est déterminée par leur composition en acides aminés. Protéine structurelle, construit principalement sous la forme d’une hélice α, est l’α-kératine. Les poils (fourrure), les plumes, les piquants, les griffes et les sabots des animaux sont principalement composés de kératine. En tant que composant des filaments intermédiaires, la kératine (cytokératine) est un composant essentiel du cytosquelette. Dans les kératines, la majeure partie de la chaîne peptidique est repliée en une hélice α droite. Deux chaînes peptidiques forment une seule gauche super spirale. Les dimères de kératine superenroulés se combinent en tétramères, qui s'agrègent pour former protofibrilles d'un diamètre de 3 nm. Finalement, huit protofibrilles se forment microfibrilles d'un diamètre de 10 nm.
Les cheveux sont constitués des mêmes fibrilles. Ainsi, dans une seule fibre de laine d'un diamètre de 20 microns, des millions de fibrilles sont entrelacées. Les chaînes kératiniques individuelles sont réticulées par de nombreuses liaisons disulfure, ce qui leur confère une résistance supplémentaire. Lors de la permanente, les processus suivants se produisent : d'abord, les ponts disulfure sont détruits par réduction avec des thiols, puis, pour donner aux cheveux la forme souhaitée, ils sont séchés par chauffage. Dans le même temps, du fait de l'oxydation par l'oxygène de l'air, de nouveaux ponts disulfure se forment, qui conservent la forme de la coiffure.
La soie est obtenue à partir des cocons des chenilles du ver à soie ( Bombyx mori) et espèces apparentées. La principale protéine de la soie, fibroïne, a la structure d'une couche pliée antiparallèle, et les couches elles-mêmes sont situées parallèlement les unes aux autres, formant de nombreuses couches. Étant donné que dans les structures repliées, les chaînes latérales des résidus d'acides aminés sont orientées verticalement de haut en bas, seuls des groupes compacts peuvent s'insérer dans les espaces entre les couches individuelles. En fait, la fibroïne est composée à 80 % de glycine, d'alanine et de sérine, soit trois acides aminés caractérisés par des tailles de chaînes latérales minimales. La molécule de fibroïne contient un fragment répétitif typique (gli-ala-gli-ala-gli-ser)n.
Conformation désordonnée. Les régions d'une molécule protéique qui n'appartiennent pas à des structures hélicoïdales ou repliées sont appelées désordonnées.
Structure suprasecondaire. Les régions structurelles hélicoïdales alpha et bêta des protéines peuvent interagir entre elles et entre elles, formant des assemblages. Les structures supra-secondaires trouvées dans les protéines natives sont énergétiquement les plus préférables. Il s'agit notamment d'une hélice α superenroulée, dans laquelle deux hélices α sont tordues l'une par rapport à l'autre, formant une superhélice gauche (bactériorhodopsine, hémérythrine) ; alternance de fragments α-hélicoïdaux et β-structuraux de la chaîne polypeptidique (par exemple, le lien βαβαβ de Rossmann, trouvé dans la région de liaison NAD+ des molécules d'enzyme déshydrogénase) ; la structure β antiparallèle à trois brins (βββ) est appelée β-zigzag et se trouve dans un certain nombre d'enzymes microbiennes, protozoaires et vertébrées.
Précédent234567891011121314151617Suivant
VOIR PLUS :
Structure secondaire des protéines
Les chaînes peptidiques des protéines sont organisées en une structure secondaire stabilisée par des liaisons hydrogène. L'atome d'oxygène de chaque groupe peptidique forme une liaison hydrogène avec le groupe NH correspondant à la liaison peptidique. En même temps, structures suivantes: hélice a, structure b et courbure b. a-Spirale. L’une des structures les plus thermodynamiquement favorables est l’hélice α droite. une hélice, représentant une structure stable dans laquelle chaque groupe carbonyle forme une liaison hydrogène avec le quatrième groupe NH le long de la chaîne.
Protéines : Structure secondaire des protéines
Dans une hélice α, il y a 3,6 résidus d'acides aminés par tour, le pas de l'hélice est d'environ 0,54 nm et la distance entre les résidus est de 0,15 nm. Les acides L-aminés ne peuvent former que des hélices α droites, avec les radicaux latéraux situés des deux côtés de l’axe et tournés vers l’extérieur. Dans l'hélice a, la possibilité de former des liaisons hydrogène est pleinement utilisée. Par conséquent, contrairement à la structure b, elle n'est pas capable de former des liaisons hydrogène avec d'autres éléments de la structure secondaire. Lorsqu'une hélice α se forme, les chaînes latérales des acides aminés peuvent se rapprocher, formant des sites compacts hydrophobes ou hydrophiles. Ces sites jouent un rôle important dans la formation de la conformation tridimensionnelle de la macromolécule protéique, car ils sont utilisés pour emballer les hélices α dans la structure spatiale de la protéine. Boule en spirale. Le contenu des hélices a dans les protéines n’est pas le même et constitue une caractéristique individuelle de chaque macromolécule protéique. Certaines protéines, comme la myoglobine, ont une hélice α comme base de leur structure ; d'autres, comme la chymotrypsine, n'ont pas de régions en hélice α. En moyenne, les protéines globulaires ont un degré d'hélicalisation de l'ordre de 60 à 70 %. Les sections spiralées alternent avec des bobines chaotiques et, en raison de la dénaturation, les transitions hélice-bobine augmentent. L'hélicalisation d'une chaîne polypeptidique dépend des résidus d'acides aminés qui la forment. Ainsi, les groupes chargés négativement de l'acide glutamique situés à proximité les uns des autres subissent une forte répulsion mutuelle, ce qui empêche la formation des liaisons hydrogène correspondantes dans l'hélice α. Pour la même raison, l'hélicalisation de la chaîne est entravée en raison de la répulsion de groupes chimiques chargés positivement proches de la lysine ou de l'arginine. La grande taille des radicaux d'acides aminés est également la raison pour laquelle l'hélicalisation de la chaîne polypeptidique est difficile (sérine, thréonine, leucine). Le facteur interférant le plus fréquemment dans la formation d’une hélice α est l’acide aminé proline. De plus, la proline ne forme pas de liaison hydrogène intra-chaîne en raison de l’absence d’atome d’hydrogène au niveau de l’atome d’azote. Ainsi, dans tous les cas où la proline est trouvée dans une chaîne polypeptidique, la structure hélicoïdale a est perturbée et une bobine ou (courbure b) est formée. b-Structure. Contrairement à l'hélice a, la structure b est formée en raison de chaîne croisée liaisons hydrogène entre les sections adjacentes de la chaîne polypeptidique, car il n'y a pas de contacts intra-chaîne. Si ces sections sont dirigées dans une direction, alors une telle structure est dite parallèle, mais si dans la direction opposée, alors antiparallèle. La chaîne polypeptidique de la structure b est très allongée et n'a pas une forme en spirale, mais plutôt en zigzag. La distance entre les résidus d'acides aminés adjacents le long de l'axe est de 0,35 nm, c'est-à-dire trois fois plus grande que dans une hélice a, le nombre de résidus par tour est de 2. Dans le cas d'une disposition parallèle de la structure b, les liaisons hydrogène sont moins fort que ceux avec une disposition antiparallèle des résidus d'acides aminés. Contrairement à l'hélice a, qui est saturée de liaisons hydrogène, chaque section de la chaîne polypeptidique de la structure b est ouverte à la formation de liaisons hydrogène supplémentaires. Ce qui précède s'applique aux structures b parallèles et antiparallèles, cependant, dans la structure antiparallèle, les liaisons sont plus stables. Le segment de la chaîne polypeptidique qui forme la structure B contient de trois à sept résidus d'acides aminés, et la structure B elle-même est constituée de 2 à 6 chaînes, bien que leur nombre puisse être plus grand. La structure b a une forme pliée en fonction des atomes de carbone a correspondants. Sa surface peut être plate et à gauche, de sorte que l'angle entre les différentes sections de la chaîne soit de 20 à 25°. b-Pliage. Les protéines globulaires ont une forme sphérique en grande partie due au fait que la chaîne polypeptidique est caractérisée par la présence de boucles, de zigzags, d'épingles à cheveux et que la direction de la chaîne peut changer même de 180°. Dans ce dernier cas, un virage en B se produit. Ce coude a la forme d’une épingle à cheveux et est stabilisé par une seule liaison hydrogène. Le facteur empêchant sa formation peut être de gros radicaux latéraux, c'est pourquoi l'inclusion du plus petit résidu d'acide aminé, la glycine, est assez souvent observée. Cette configuration apparaît toujours à la surface du globule protéique et la courbure B participe donc à l'interaction avec d'autres chaînes polypeptidiques. Structures supersecondaires. Les structures supersecondaires des protéines ont d'abord été postulées puis découvertes par L. Pauling et R. Corey. Un exemple est une hélice α superenroulée, dans laquelle deux hélices α sont tordues en une superhélice gauche. Cependant, le plus souvent, les structures superhélicoïdales comprennent à la fois des hélices a et des feuilles plissées b. Leur composition peut se présenter comme suit : (aa), (ab), (ba) et (bXb). Cette dernière option consiste en deux feuilles pliées parallèles, entre lesquelles se trouve une bobine statistique (bСb). La relation entre les structures secondaires et supersecondaires a un degré élevé de variabilité et dépend de caractéristiques individuelles l'une ou l'autre macromolécule protéique. Les domaines sont des niveaux d'organisation plus complexes de la structure secondaire. Ce sont des sections globulaires isolées reliées les unes aux autres par de courtes sections dites charnières de la chaîne polypeptidique. D. Birktoft fut l'un des premiers à décrire l'organisation des domaines de la chymotrypsine, notant la présence de deux domaines dans cette protéine.
Structure secondaire des protéines
La structure secondaire est la manière dont une chaîne polypeptidique est organisée en une structure ordonnée. La structure secondaire est déterminée par la structure primaire. Puisque la structure primaire est déterminée génétiquement, la formation d’une structure secondaire peut se produire lorsque la chaîne polypeptidique quitte le ribosome. La structure secondaire est stabilisée liaisons hydrogène, qui sont formés entre les groupes NH et CO des liaisons peptidiques.
Distinguer hélice a, structure b et conformation désordonnée (indice).
Structure hélices α a été proposé Pauling Et Corey(1951). Il s’agit d’un type de structure secondaire protéique qui ressemble à une hélice régulière (Fig.
Conformation de la chaîne polypeptidique. Structure secondaire de la chaîne polypeptidique
2.2). Une hélice α est une structure en forme de bâtonnet dans laquelle les liaisons peptidiques sont situées à l'intérieur de l'hélice et les radicaux d'acides aminés de la chaîne latérale sont situés à l'extérieur. L'hélice a est stabilisée par des liaisons hydrogène, qui sont parallèles à l'axe de l'hélice et se produisent entre le premier et le cinquième résidus d'acides aminés. Ainsi, dans les régions hélicoïdales étendues, chaque résidu d'acide aminé participe à la formation de deux liaisons hydrogène.

Riz. 2.2. Structure d'une hélice α.
Il y a 3,6 résidus d'acides aminés par tour d'hélice, le pas d'hélice est de 0,54 nm et il y a 0,15 nm par résidu d'acide aminé. L'angle d'hélice est de 26°. La période de régularité d'une hélice a est de 5 tours ou 18 résidus d'acides aminés. Les plus courantes sont les hélices a droites, c'est-à-dire La spirale tourne dans le sens des aiguilles d'une montre. La formation d'une hélice a est empêchée par la proline, des acides aminés à radicaux chargés et volumineux (obstacles électrostatiques et mécaniques).
Une autre forme de spirale est présente dans collagène . Dans l’organisme des mammifères, le collagène est la protéine quantitativement prédominante : il représente 25 % des protéines totales. Le collagène est présent sous diverses formes, principalement dans le tissu conjonctif. Il s'agit d'une hélice gauche avec un pas de 0,96 nm et 3,3 résidus par tour, plus plate que l'hélice α. Contrairement à l’hélice α, la formation de ponts hydrogène est ici impossible. Le collagène a une composition inhabituelle en acides aminés : 1/3 est de la glycine, environ 10 % de proline, ainsi que de l'hydroxyproline et de l'hydroxylysine. Les deux derniers acides aminés sont formés après la biosynthèse du collagène par modification post-traductionnelle. Dans la structure du collagène, le triplet gly-X-Y est constamment répété, la position X étant souvent occupée par la proline et la position Y par l'hydroxylysine. Il existe de bonnes preuves que le collagène est omniprésent sous la forme d’une triple hélice droite tordue à partir de trois hélices primaires gauches. Dans une triple hélice, un résidu sur trois aboutit au centre, où, pour des raisons stériques, seule la glycine rentre. La molécule entière de collagène mesure environ 300 nm de long.
b-Structure(couche pliée en B). On le trouve dans les protéines globulaires, ainsi que dans certaines protéines fibrillaires, par exemple la fibroïne de soie (Fig. 2.3).
Riz. 2.3. b-Structure
La structure a Forme plate. Les chaînes polypeptidiques sont presque complètement allongées, plutôt que étroitement tordues, comme dans une hélice a. Les plans des liaisons peptidiques sont situés dans l’espace comme les plis uniformes d’une feuille de papier. Il est stabilisé par des liaisons hydrogène entre les groupes CO et NH des liaisons peptidiques des chaînes polypeptidiques adjacentes. Si les chaînes polypeptidiques formant la structure b vont dans la même direction (c'est-à-dire que les extrémités C et N coïncident) – structure B parallèle; si c'est le contraire - structure B antiparallèle. Les radicaux latéraux d'une couche sont placés entre les radicaux latéraux d'une autre couche. Si une chaîne polypeptidique se plie et est parallèle à elle-même, alors cela structure B-cross antiparallèle. Des liaisons hydrogène dans la structure croisée B sont formées entre les groupes peptidiques des boucles de la chaîne polypeptidique.
Le contenu des hélices a dans les protéines étudiées à ce jour est extrêmement variable. Dans certaines protéines, par exemple la myoglobine et l'hémoglobine, l'hélice a sous-tend la structure et représente 75 %, dans le lysozyme - 42 %, dans la pepsine seulement 30 %. D'autres protéines, par exemple l'enzyme digestive chymotrypsine, sont pratiquement dépourvues de structure a-hélicoïdale et une partie importante de la chaîne polypeptidique s'inscrit dans des structures b en couches. Les protéines des tissus de soutien, le collagène (protéines des tendons et de la peau), la fibroïne (protéine de soie naturelle) ont une configuration b de chaînes polypeptidiques.
Il a été prouvé que la formation des hélices α est facilitée par les structures glu, ala, leu et β par met, val, ile ; aux endroits où la chaîne polypeptidique se plie - gly, pro, asn. On pense que six résidus groupés, dont quatre contribuent à la formation de l'hélice, peuvent être considérés comme le centre de l'hélicalisation. De ce centre se produit une croissance d'hélices dans les deux sens jusqu'à une section - un tétrapeptide, constitué de résidus qui empêchent la formation de ces hélices. Lors de la formation de la structure β, le rôle d'amorce est assuré par trois résidus d'acides aminés sur cinq qui contribuent à la formation de la structure β.
Dans la plupart des protéines structurelles, l'une des structures secondaires prédomine, qui est déterminée par leur composition en acides aminés. Une protéine structurale construite principalement sous la forme d'une hélice α est la α-kératine. Les poils (fourrure), les plumes, les piquants, les griffes et les sabots des animaux sont principalement composés de kératine. En tant que composant des filaments intermédiaires, la kératine (cytokératine) est un composant essentiel du cytosquelette. Dans les kératines, la majeure partie de la chaîne peptidique est repliée en une hélice α droite. Deux chaînes peptidiques forment une seule gauche super spirale. Les dimères de kératine superenroulés se combinent en tétramères, qui s'agrègent pour former protofibrilles d'un diamètre de 3 nm. Finalement, huit protofibrilles se forment microfibrilles d'un diamètre de 10 nm.
Les cheveux sont constitués des mêmes fibrilles. Ainsi, dans une seule fibre de laine d'un diamètre de 20 microns, des millions de fibrilles sont entrelacées. Les chaînes kératiniques individuelles sont réticulées par de nombreuses liaisons disulfure, ce qui leur confère une résistance supplémentaire. Lors de la permanente, les processus suivants se produisent : d'abord, les ponts disulfure sont détruits par réduction avec des thiols, puis, pour donner aux cheveux la forme souhaitée, ils sont séchés par chauffage. Dans le même temps, du fait de l'oxydation par l'oxygène de l'air, de nouveaux ponts disulfure se forment, qui conservent la forme de la coiffure.
La soie est obtenue à partir des cocons des chenilles du ver à soie ( Bombyx mori) et espèces apparentées. La principale protéine de la soie, fibroïne, a la structure d'une couche pliée antiparallèle, et les couches elles-mêmes sont situées parallèlement les unes aux autres, formant de nombreuses couches. Étant donné que dans les structures repliées, les chaînes latérales des résidus d'acides aminés sont orientées verticalement de haut en bas, seuls des groupes compacts peuvent s'insérer dans les espaces entre les couches individuelles. En fait, la fibroïne est composée à 80 % de glycine, d'alanine et de sérine, soit trois acides aminés caractérisés par des tailles de chaînes latérales minimales. La molécule de fibroïne contient un fragment répétitif typique (gli-ala-gli-ala-gli-ser)n.
Conformation désordonnée. Les régions d'une molécule protéique qui n'appartiennent pas à des structures hélicoïdales ou repliées sont appelées désordonnées.
Structure suprasecondaire. Les régions structurelles hélicoïdales alpha et bêta des protéines peuvent interagir entre elles et entre elles, formant des assemblages. Les structures supra-secondaires trouvées dans les protéines natives sont énergétiquement les plus préférables. Il s'agit notamment d'une hélice α superenroulée, dans laquelle deux hélices α sont tordues l'une par rapport à l'autre, formant une superhélice gauche (bactériorhodopsine, hémérythrine) ; alternance de fragments α-hélicoïdaux et β-structuraux de la chaîne polypeptidique (par exemple, le lien βαβαβ de Rossmann, trouvé dans la région de liaison NAD+ des molécules d'enzyme déshydrogénase) ; la structure β antiparallèle à trois brins (βββ) est appelée β-zigzag et se trouve dans un certain nombre d'enzymes microbiennes, protozoaires et vertébrées.
Précédent234567891011121314151617Suivant
VOIR PLUS :
PROTÉINES Option 1 A1. Les unités structurelles des protéines sont : ...
5 à 9 années
PROTÉINES
Option 1
A1. Les unités structurelles des protéines sont :
UN)
Amines
DANS)
Acides aminés
B)
Glucose
G)
Nucléotides
A2. La formation d'une spirale se caractérise par :
UN)
Structure protéique primaire
DANS)
Structure tertiaire des protéines
B)
Structure secondaire des protéines
G)
Structure protéique quaternaire
A3. Quels facteurs provoquent une dénaturation irréversible des protéines ?
UN)
Interaction avec des solutions de sels de plomb, de fer et de mercure
B)
Impact sur les protéines avec une solution concentrée d'acide nitrique
DANS)
Forte chaleur
G)
Tous les facteurs ci-dessus sont vrais
A4. Indiquez ce qui est observé lorsque de l'acide nitrique concentré est appliqué à des solutions protéiques :
UN)
Précipité blanc
DANS)
Coloration rouge-violet
B)
Précipité noir
G)
Coloration jaune
A5. Les protéines qui remplissent une fonction catalytique sont appelées :
UN)
Les hormones
DANS)
Enzymes
B)
Vitamines
G)
Protéines
A6. La protéine hémoglobine remplit la fonction suivante :
UN)
Catalytique
DANS)
Construction
B)
Protecteur
G)
Transport
Partie B
B1. Correspondre:
Type de molécule protéique
Propriété
1)
Protéines globulaires
UN)
La molécule est enroulée en boule
2)
Protéines fibrillaires
B)
Ne se dissout pas dans l'eau
DANS)
Se dissout dans l'eau ou forme des solutions colloïdales
G)
Structure filiforme
Structure secondaire
Protéines :
UN)
Construit à partir de résidus d'acides aminés
B)
Contient uniquement du carbone, de l'hydrogène et de l'oxygène
DANS)
Hydrolyse dans les environnements acides et alcalins
G)
Capable de dénaturation
D)
Ce sont des polysaccharides
E)
Ce sont des polymères naturels
Partie C
C1. Écrivez les équations de réaction par lesquelles la glycine peut être obtenue à partir d’éthanol et de substances inorganiques.