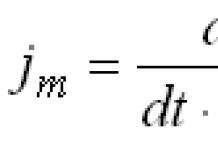Au début du 20ème siècle. Grâce à des expériences sur l'irradiation d'une feuille mince avec des particules alpha, E. Rutherford a déterminé la structure de l'atome. Il a montré que l'atome a un modèle planétaire (Fig. 3), c'est-à-dire qu'il est constitué d'un noyau dense chargé positivement, autour duquel tourne une couche électronique lâche.
Riz. 3. Modèle planétaire de la structure de l'atome par E. Rutherford
En général, un atome est la structure élémentaire électriquement neutre d’un élément chimique. La signification physique du numéro de série de l'élément Z dans tableau périodiqueéléments a été établi dans le modèle planétaire de l’atome de Rutherford. Z coïncide avec le nombre de charges élémentaires positives dans le noyau, qui augmentent naturellement de une lorsqu'on passe de l'élément précédent au suivant. Les propriétés chimiques des éléments et un certain nombre de leurs propriétés physiques s'expliquent par le comportement des électrons externes, appelés électrons de valence, de leurs atomes.
Par conséquent, la périodicité des propriétés des éléments chimiques doit être associée à une certaine périodicité dans la disposition des électrons dans les atomes des différents éléments. La théorie du tableau périodique repose sur les principes suivants :
a) le numéro de série d'un élément chimique est nombre total les électrons dans un atome d'un élément donné ;
b) l'état des électrons dans un atome est déterminé par l'ensemble de leurs nombres quantiques P,je, m Et m s . La répartition des électrons dans un atome à travers les états énergétiques doit satisfaire au principe de l'énergie potentielle minimale : avec une augmentation du nombre d'électrons, chaque électron suivant doit occuper un état énergétique possible avec l'énergie la plus basse ;
c) le remplissage des états énergétiques d'un atome avec des électrons doit se produire conformément au principe de Pauli.
Électrons dans un atome occupant un ensemble d'états avec la même valeur du nombre quantique principal P., forment une coque électronique, ou couche électronique. En fonction des valeurs n On distingue les coques suivantes : Àà n = 1,Là n = 2,M.à n= 3,Nà n = 4,À PROPOSà P.= 5, etc. Le nombre maximum d'électrons pouvant être dans les coquilles selon le principe de Pauli : en À-shell – 2 électrons, dans des coquilles L,M.,N Et À PROPOS 8, 18, 32 et 50 électrons, respectivement. Dans chaque couche, les électrons sont répartis en sous-groupes ou sous-couches, chacun correspondant à une certaine valeur du nombre quantique orbital. En physique atomique, il est d'usage de désigner l'état électronique d'un atome par le symbole P.je, indiquant la valeur de deux nombres quantiques. Électrons situés dans des états caractérisés par les mêmes nombres quantiques n Et je, sont appelés équivalents. Nombre Z-les électrons équivalents sont indiqués par l'exposant dans le symbole nl z. Si les électrons sont dans certains états avec certaines valeurs de nombres quantiques P. Et je, alors la configuration dite électronique est considérée comme donnée. Par exemple, l'état fondamental de l'atome d'oxygène peut être exprimé par la formule symbolique suivante : 1s 2, 2s 2, 2p 4. Cela montre que deux électrons sont dans des états avec n= 1 et je= 0, deux électrons ont des nombres quantiques n= 2 et je= 0 et quatre électrons occupent les états c n = 2 et je= 1.
L'ordre de remplissage des états électroniques dans les coques atomiques et au sein d'une coque - en sous-groupes (sous-couches) doit correspondre à la séquence d'arrangement des niveaux d'énergie avec les données P. Et je. Les États ayant l'énergie la plus faible possible sont remplis en premier, suivis par les États ayant une énergie de plus en plus élevée. Pour les atomes légers, cet ordre correspond au fait que la coquille de plus petite taille est remplie en premier. P. et ce n'est qu'alors que la couche suivante devrait être remplie d'électrons. Au sein d'une seule coque, les états avec je= 0, puis indique avec un grand je, jusqu'à je=P.– 1. L’interaction entre électrons conduit au fait que pour des nombres quantiques principaux suffisamment grands nÉtats avec beaucoup n et petit je peut avoir une énergie plus faible, c'est-à-dire être énergétiquement plus favorable que les états avec une énergie plus faible. P., mais avec plus je. De ce qui précède, il s'ensuit que la périodicité des propriétés chimiques des éléments s'explique par la répétabilité des configurations électroniques dans les sous-groupes électroniques externes d'atomes d'éléments apparentés.
Dualité onde-particule des propriétés de la lumière.
Résumons les résultats de la section « Optique ».
Dans optique géométrique la nature de la lumière n’est pas prise en compte. On utilise la notion de faisceau lumineux, pour lequel les lois de l'optique géométrique sont formulées. Ces lois permettent de calculer la trajectoire des rayons lumineux dans le cas où les tailles des différents obstacles sur le trajet du rayon sont suffisamment grandes. L'utilisation de ces lois a permis de créer divers systèmes et instruments optiques (objectif, microscope, télescope, caméra, projecteur de diapositives).
En considérant la lumière comme une onde électromagnétique, il était possible de comprendre des phénomènes tels que les interférences, la diffraction et la polarisation de la lumière. La nature ondulatoire de la lumière se manifeste lorsque la taille de l’obstacle sur le trajet de l’onde lumineuse est comparable à la longueur d’onde. Les phénomènes d'interférence, de diffraction, de polarisation de la lumière trouvent des utilisation pratique(spectrométrie, détection de défauts, holographie) Les propriétés ondulatoires de la lumière doivent être prises en compte lors de la conception des différents systèmes optiques.
En optique quantique, la lumière se manifeste sous la forme d'un flux de particules ou de quanta de lumière - photons. Dans le cadre des concepts quantiques, on trouve des explications à des phénomènes tels que le rayonnement thermique des corps, les effets photoélectriques externes et internes, l'effet Compton, etc.
Le fait que la lumière présente des propriétés ondulatoires dans certaines expériences et des propriétés corpusculaires dans d'autres signifie qu'elle a une double nature complexe, généralement caractérisée par le terme dualité onde-particule . Par la suite, l’existence d’une dualité onde-particule des particules de matière a été établie.
G.Ya.Myakishev, B.B.Bukhovtsev, V.M.Charugin. La physique. 11e année. Manuel pour les établissements d'enseignement général. - M. : « Prosveshchenie », 2009, etc. Chapitre 11.
Thème 18. (2 heures)
Physique atomique. Les expériences de Rutherford. Modèle planétaire de l'atome. Les postulats quantiques de Bohr. Lasers.
La découverte de la structure complexe de l'atome est l'étape la plus importante dans le développement de physique moderne, qui a marqué tout son développement ultérieur. Dans le processus de création d'une théorie quantitative de la structure de l'atome, la physique atomique est née, qui a permis d'expliquer les spectres atomiques, physiques et Propriétés chimiques diverses substances, qui ont donné naissance à d'autres branches de la physique. Les lois du mouvement des microparticules ont été découvertes : les lois de la mécanique quantique.
L'un des premiers modèles de la structure de l'atome a été proposé en 1903. J.J. Thomson . Il supposait que l’atome était sphérique ; la charge positive est répartie uniformément dans tout le volume de cette boule et les électrons chargés négativement se trouvent à l'intérieur. Le rayon d'un atome est d'environ 10 à 10 m, mais des résultats expérimentaux ont prouvé que ce modèle était erroné.
Les expériences de Rutherford. Un nouveau modèle de l'atome a été proposé par Rutherford à la suite de ses expériences d'étude de la diffusion des rayonnements rapides. α -des particules sur les atomes de la matière. Dans ces expériences, un médicament radioactif 2 (le radium, fig. 18.1) a été placé dans un récipient en plomb 1. Faisceau étroit 3 α -des particules (atomes d'hélium entièrement ionisés émis par le radium) ont été dirigées sur une fine feuille métallique 4 . Derrière lui était placé un écran 5, recouvert d'une couche de cristaux de sulfure de zinc, capable de briller sous l'impact de particules chargées rapidement. Des flashs sur l'écran ont été observés Fig. 18.1
en utilisant un microscope 6 .
Il s'est avéré que α -les particules pénètrent à travers de fines plaques métalliques sans presque aucun écart par rapport à une trajectoire rectiligne. Dans le même temps, une petite partie des particules alpha a été déviée selon des angles beaucoup plus grands (jusqu'à 180 ○).
Rutherford a suggéré que la diffusion des particules alpha à de grands angles s'explique par le fait que la charge positive dans l'atome n'est pas répartie uniformément dans une boule d'un rayon de 10 à 10 m, mais est concentrée dans la partie centrale de l'atome dans une région de dimensions beaucoup plus petites.
Presque toute la masse de l’atome est concentrée dans cette partie centrale chargée positivement de l’atome, le noyau atomique. Les calculs de Rutherford ont montré que pour expliquer les expériences sur la diffusion des particules alpha, il faut prendre le rayon du noyau égal à environ 10 -15 m. Avec un si petit rayon, la tension champ électrique le noyau près de sa surface est très gros. Dans ce domaine en mouvement α -la particule est soumise à une force importante, qui la dévie sous de grands angles, y compris dans la direction opposée.
Après la découverte d'un noyau chargé positivement dans les expériences de Rutherford, il était nécessaire de répondre à des questions sur l'emplacement des électrons dans l'atome et ce qui y occupe le reste de l'espace. Rutherford a suggéré que l'atome est structuré comme un système planétaire. Tout comme les planètes tournent autour du Soleil à de grandes distances de celui-ci, les électrons tournent autour du noyau nucléaire d’un atome. Le rayon orbital de l’électron le plus éloigné du noyau est le rayon de l’atome. Ce modèle de structure atomique a été appelé planétaire ou modèle nucléaire.
Cependant, les systèmes atomiques diffèrent des systèmes planétaires par la nature physique des forces qui maintiennent les planètes et les électrons sur leurs orbites : les planètes sont attirées vers les étoiles par les forces de gravité universelle, et dans l'interaction des électrons avec le noyau atomique, le rôle principal est joué par les forces d’attraction coulombienne de charges électriques opposées. Les forces d’attraction gravitationnelle entre un électron et un noyau atomique sont négligeables par rapport aux forces électromagnétiques.
Le modèle nucléaire de l'atome explique bien les lois fondamentales de la diffusion des particules chargées. Puisque la majeure partie de l’espace entre le noyau atomique et les électrons en orbite autour de lui est vide, les particules chargées rapidement peuvent pénétrer presque librement à travers des couches de matière contenant plusieurs milliers de couches d’atomes.
Lors d'une collision avec un électron, une particule alpha ne se dissipe pratiquement pas, puisque sa masse est d'environ 8 000 fois plus de masseélectron. Cependant, dans le cas où une particule alpha vole à proximité d’un des noyaux atomiques, sous l’influence du champ électrique du noyau atomique, elle peut être diffusée sous n’importe quel angle jusqu’à 180°. Mais en raison de la petite taille du noyau par rapport à celle de l’atome, de tels événements se produisent très rarement.
Le modèle nucléaire de l’atome a permis d’expliquer les résultats d’expériences sur la diffusion des particules alpha dans la matière, mais il s’est heurté à une autre difficulté fondamentale : les lois de Rutherford sur le mouvement des électrons dans l’atome contredisaient les lois de l’électrodynamique.
Comme on le sait, tout mouvement accéléré de charges électriques s'accompagne de l'émission d'ondes électromagnétiques. Le mouvement circulaire est un mouvement accéléré, donc un électron dans un atome doit émettre des ondes électromagnétiques d'une fréquence égale à la fréquence de révolution autour du noyau. Cela devrait conduire à une diminution de l'énergie de l'électron, à son approche progressive du noyau atomique et à sa chute sur le noyau.
Ainsi, un atome constitué d'un noyau atomique et d'électrons tournant autour de lui, selon les lois de la physique classique, est instable. Mais en réalité, les atomes sont stables et n’émettent pas de lumière lorsqu’ils sont non excités.
Jusqu’à la fin du XIXe siècle, on croyait que l’atome était indivisible. Mais après que le physicien anglais Joseph John Thomson ait découvert l’électron en 1897, il est devenu évident que les scientifiques avaient tort.
Ainsi, après avoir découvert l’électron, Thomson est arrivé à la conclusion qu’il avait une masse et une charge négative. On pensait que l’électron faisait partie intégrante de l’atome. Mais comme il a une charge négative, l’atome doit donc contenir des particules qui ont une charge positive, puisqu’en général l’atome est neutre.
Le modèle atomique de Thomson
Thomson a proposé son modèle de l'atome. Il croyait que l’atome avait la forme d’une boule. À l’intérieur de cette boule se trouve une substance chargée positivement dans laquelle existent des électrons chargés négativement. Thomson a appelé en plaisantant son modèle un « petit pain aux raisins ». Autrement dit, dans son modèle, les électrons sont, pour ainsi dire, entrecoupés d'une masse chargée positivement, comme des raisins secs dans un petit pain.
L'expérience de Rutherford

L'expérience de Rutherford
D'autres études de l'atome par des scientifiques ont montré que le modèle proposé par Thomson était incorrect.
En 1909, le physicien anglais Ernest Rutherford a mené une expérience sur la diffusion de particules alpha, qui se forment lors de la désintégration de l'élément chimique radium. La masse des particules alpha est 8 000 fois supérieure à la masse d’un électron.
Dans l'expérience de Rutherford, un faisceau de particules alpha a traversé une fine feuille d'or. Il faut dire que la feuille était si fine que son épaisseur était presque celle d'une couche de molécules. Si Thomson avait raison et que l'atome était constitué d'une sorte de nuage d'électrons, alors les particules alpha, qui ont une masse importante, devraient facilement traverser la feuille. Mais en fait, il s'est avéré que certaines des particules alpha passaient réellement à travers, déviant seulement selon un petit angle, et certaines semblaient rencontrer une sorte d'obstacle et rebondir. C'était incroyable. Rutherford a ensuite comparé son expérience au tir d'un obus de 15 pouces sur du papier de soie. Le résultat de son expérience était comme si le projectile non seulement ne parvenait pas à pénétrer le papier de soie, mais rebondissait également dessus. Autrement dit, il y avait quelque chose à l’intérieur de l’atome qui empêchait les particules alpha de traverser l’atome. Puisque les particules alpha avaient une charge positive, elles ont probablement traversé d’autres particules ayant une charge positive. Et la taille de ces particules était bien inférieure à la taille de l’atome lui-même. L’atome d’or était censé être constitué d’un noyau chargé positivement et entouré d’électrons chargés négativement.
On peut dire que ce fut la naissance de la physique nucléaire.
Modèle planétaire de l'atome

Le modèle atomique de Rutherford
Rutherford a proposé son modèle de l'atome, qui expliquait la structure de l'atome. Il pensait que la totalité de l’atome était concentrée dans un noyau chargé positivement. Et les électrons chargés négativement tournent autour de ce noyau, tout comme les planètes tournent autour du Soleil. Et les électrons tournent sous l'influence de la force coulombienne agissant sur eux depuis le noyau. Le modèle de Rutherford s'appelait planétaire.
Les électrons d’un atome tournent à une telle vitesse qu’ils forment une sorte de nuage au-dessus de la surface du noyau. Tous les atomes sont situés à une certaine distance les uns des autres. Et ils ne «collent pas ensemble», car autour du noyau de chaque atome se trouve son propre «nuage» d'électrons chargés négativement. Et ce « nuage » est repoussé du « nuage » d’électrons chargés négativement d’un autre atome.
Mais le modèle atomique de Rutherford présentait des défauts. C’était incompatible avec les lois de la physique classique. Pourquoi un électron ne tombe-t-il pas sur le noyau ? Parce que ça tourne autour de lui. Mais en tournant, il doit émettre des ondes électromagnétiques et perdre de l’énergie. Et, après avoir progressivement dépensé toute l'énergie, l'électron doit tomber sur le noyau. Mais cela n'arrive pas dans la réalité. Autrement dit, les processus qui se produisent dans l’atome n’obéissent pas aux lois classiques.
Par la suite, le physicien danois Niels Bohr a donné une explication à ce phénomène. Il a suggéré que les électrons d’un atome se déplacent uniquement sur des orbites stationnaires sur lesquelles ils n’émettent pas d’énergie. Et Bohr avait raison.
Structure atomique
Unités de charge, de masse et d'énergie en physique atomique.
Ainsi, la charge de toute particule contient toujours un nombre entier de charges élémentaires. Pour une particule de taille atomique, ce nombre entier sera également petit. Compte tenu de cela, en physique atomique, il convient de prendre la charge élémentaire e = 1,60 10-19 C comme unité de charge électrique. En physique atomique, une unité de masse correspond à 1/12 de la masse d’un atome de l’isotope du carbone 12C. La masse atomique de cet isotope est de 12 et la masse molaire M = 12 10-3 kg/mol. Par conséquent, l’unité de masse atomique (a.m.u.) est égale à
Une unité de masse atomique peut également être définie comme la masse d'un atome d'un élément de masse atomique 1. Par conséquent, la masse d'un atome (plus précisément, sa valeur moyenne), exprimée en unités de masse atomique, est égale à la masse atomique de l'élément.
Notez qu'un élément ayant une masse atomique égal à un, n'existe pas dans la nature. La masse atomique de l'hydrogène est proche de l'unité, mais légèrement supérieure : elle est égale à 1,008. Ainsi, la masse de l’atome le plus léger est de 1,008 a. manger.
L'unité d'énergie adoptée en physique atomique est l'énergie acquise par une particule de charge e (par exemple, un électron) lors du passage par une différence de potentiel de 1 V. Cette unité est appelée électronvolt et est notée eV. L'énergie acquise par une charge lors d'un mouvement dans un champ électrique est égale au produit de la charge et de la différence de potentiel entre les points de départ et d'arrivée du chemin, donc
1 eV=1,6 10-19 C 1V=1,6 10-19J.
De la définition de l'électronvolt, il résulte qu'un électron accéléré par une différence de potentiel U [V] a une énergie numériquement égale à U [eV]. Un ion de charge 2e, ayant traversé la même différence de potentiel, acquiert une énergie de 2U [eV], etc.
L’énergie des particules non seulement chargées mais aussi neutres peut être mesurée en électronvolts. Par exemple, exprimons en électrons-volts l’énergie d’un atome d’oxygène (m=16 amu) se déplaçant à une vitesse v=103 m/s :
Des unités multiples de l'électronvolt sont également utilisées :
1 keV=103 eV, 1 MeV=106 eV, 1 GeV=109 eV, 1 TeV=1012 eV.
Modèle de Rutherford-Bohr de l'atome.
Toute matière est composée de particules élémentaires. Mais la matière n’est pas directement constituée de particules élémentaires. Les éléments constitutifs ou éléments à partir desquels toute matière est construite sont des atomes. Jusqu’en 1912, les scientifiques représentaient l’atome comme une boule chargée positivement contenant des électrons chargés négativement. Le design, semblable à un cupcake aux raisins secs électroniques, a été proposé par les homonymes des Thomson, Joseph John et William Lord Kelvin.

En général, les charges positives et négatives d’un tel atome sont compensées et l’atome est électriquement neutre. On pensait que toute la masse d’un atome était concentrée en électrons. Puisqu’un électron est beaucoup plus léger qu’un atome, même les atomes les plus simples doivent contenir des milliers d’électrons.
En 1909, Rutherford chargea Marsden, alors jeune physicien, d'étudier la diffusion des rayons alpha lorsqu'ils traversent de fines plaques métalliques. La plupart des particules élémentaires ont subi des déflexions mineures après avoir traversé les plaques. Cependant, Marsden a pu détecter des particules très fortement déviées. Il est vrai qu’il y en avait très peu, mais il était surprenant qu’ils existent. Bien sûr, Marsden aurait pu l’imaginer. Pour enregistrer les particules alpha, un spinthariscope a été utilisé - un petit écran transparent recouvert d'une substance fluorescente spéciale. Lorsqu'une particule élémentaire heurte un tel écran, un faible labour se produit. Le flash est très petit et faible. On l'observe au microscope. Pour que l’œil le remarque, il faut s’habituer à l’obscurité. Pour ce faire, avant de commencer à travailler, c'est-à-dire à enregistrer et à compter les flashs, il doit rester assis pendant une demi-heure dans l'obscurité totale. Il est donc naturel de supposer que Marsden aurait pu se tromper.
Rutherford demande à Marsden de répéter les expériences, mais cette fois en surveillant spécifiquement les particules qui ont reçu une déviation importante jusqu'à 90°.
Lorsque, quelques jours plus tard, Marsden entra dans le bureau de Rutherford et déclara : « Il y a de telles particules », Rutherford laissa tomber le téléphone, surpris. Rutherford, bien qu'il ait suggéré que Marsden mène ces expériences, ne s'attendait pas lui-même à un tel résultat.
Rutherford a rappelé plus tard : « c'était l'événement le plus incroyable de ma vie. C'était presque aussi incroyable que de tirer un obus de 15 pouces sur un morceau de papier de soie et de voir l'obus revenir et vous frapper.".
Les expériences ont été revérifiées à nouveau, mais cette fois Geiger s'est joint aux expériences. Le phénomène a été étudié expérimentalement et les matériaux expérimentaux ont été publiés la même année. Cependant, la signification des résultats était mystérieuse. L'atome de Thomson ne pouvait pas empêcher une particule alpha de voler à grande vitesse.
En 1911, Rutherford publie son article « La diffusion des particules alpha et bêta par la matière et la structure de l'atome », dans lequel il propose son célèbre modèle planétaire de l'atome.

Au centre de l'atome de Rutherford se trouve un petit noyau très massif chargé positivement, à partir duquel la particule alpha a rebondi dans les expériences décrites. Les électrons légers chargés négativement tournent autour du noyau. La majeure partie de l’espace à l’intérieur d’un atome est remplie de vide. Dans l’ensemble, le modèle est très similaire à notre système solaire.
Au grand regret de Rutherford, l'article est resté silencieux. Rutherford, bien sûr, comprenait pourquoi. Son atome fut de courte durée. Un électron, en rotation autour d’un noyau, doit émettre des ondes électromagnétiques et perdre ainsi de l’énergie. En même temps, sa vitesse devrait ralentir et il devrait tomber sur le noyau. Cependant, l’expérience montre que presque tous les atomes de la nature sont stables.
Niels Bohr a corrigé la situation.
La théorie de Bohr
Les postulats de Bohr sont de nature similaire aux lois de Kepler, qui sont également au nombre de trois. Les deux sont des modèles devinés obtenus sur la base de faits expérimentaux. C'était peut-être encore plus difficile pour Kepler. Comment, par exemple, arriver au résultat que (formule) ? Ce n’est qu’après que Newton ait formulé les lois de la mécanique que les lois de Kepler sont devenues possibles à expliquer.
Le principal défaut du modèle de Rutherford était qu'un électron se déplaçant sur une orbite circulaire autour d'un noyau devrait émettre des ondes électromagnétiques, mais les preuves suggèrent que ce n'est pas le cas. Les scientifiques, dont Rutherford, n’ont pas pu expliquer cette contradiction. Bohr ne pouvait pas non plus faire cela. Il s’est simplement rangé du côté des faits : puisque les électrons n’émettent pas, alors cela devrait être ainsi. C'est ainsi qu'est apparu le premier postulat. Au total, comme nous l'avons déjà dit, il y en a trois.
Les postulats de Bohr
1. Les électrons se déplacent dans un atome sur des orbites stationnaires, alors qu'ils n'émettent ni n'absorbent d'énergie.
2. Les orbites stationnaires seront celles pour lesquelles le moment cinétique de l'électron mvr est égal à un multiple entier.
![]() , où k = 1, 2, 3, 4...
, où k = 1, 2, 3, 4...
3. Lorsqu'il se déplace d'une orbite à une autre, un électron émet ou absorbe de l'énergie sous forme de photon.
Étant sur des orbites plus éloignées, un électron a plus d'énergie, donc, se déplaçant vers une orbite plus proche du noyau, il émet un photon avec l'énergie

Lorsqu’un atome absorbe un photon, l’électron peut s’élever à un niveau supérieur.
Dimensions d'un atome d'hydrogène
Un électron, en rotation autour d'un noyau, subit une force d'attraction coulombienne vers lui :

où est la charge du noyau atomique de numéro atomique Z.
Cette force, conformément à la deuxième loi de Newton, doit être égale, donc :  ou
ou  .
.
Le deuxième postulat de Bohr nous dit que le rayon de l'orbite ne peut pas être arbitraire, mais doit obéir à l'équation :
où nous désignerons la kème orbite stationnaire. De là, nous obtenons

 .
.
Nous avons obtenu le rayon de la kème orbite stationnaire d'un atome de numéro de série Z. Pour l'hydrogène Z=1. Trouvons le rayon de la première (k = 1) orbite la plus intérieure dans laquelle l'électron a une quantité minimale d'énergie.
Par conséquent, le diamètre de l’atome d’hydrogène est d’environ , ce qui est en bon accord avec les données expérimentales.
Trouvons l'énergie de l'électron sur la kième orbite.
Son énergie vient de énergie cinétique mouvement orbital et énergie électrostatique potentielle d'interaction avec le noyau.
Ils constituent une étape importante dans le développement de la physique. Le modèle de Rutherford était d'une grande importance. L'atome en tant que système et les particules qui le composent ont été étudiés de manière plus précise et plus détaillée. Cela a conduit au développement réussi d’une science telle que la physique nucléaire.
Idées anciennes sur la structure de la matière
L’hypothèse selon laquelle les corps environnants sont constitués de minuscules particules remonte à l’Antiquité. Les penseurs de l’époque imaginaient l’atome comme la particule la plus petite et indivisible de toute substance. Ils ont soutenu qu’il n’y a rien dans l’Univers plus petit qu’un atome. De tels points de vue étaient partagés par les grands scientifiques et philosophes grecs antiques - Démocrite, Lucrèce, Épicure. Les hypothèses de ces penseurs sont aujourd’hui réunies sous le nom d’« atomisme antique ».
Spectacles médiévaux
Les temps de l'Antiquité sont révolus et au Moyen Âge, des scientifiques faisaient également diverses hypothèses sur la structure des substances. Cependant, la prédominance religieuse vues philosophiques et le pouvoir de l'Église à cette période de l'histoire a tué dans l'œuf toutes les tentatives et aspirations de l'esprit humain vers des conclusions et découvertes scientifiques matérialistes. Comme vous le savez, l'Inquisition médiévale s'est comportée de manière très hostile envers les représentants du monde scientifique de l'époque. Reste à dire que les esprits brillants de l’époque ont eu l’idée del’indivisibilité de l’atome, venue de l’Antiquité.
Études des XVIIIe et XIXe siècles
Le XVIIIe siècle est marqué par de sérieuses découvertes dans le domaine de la structure élémentaire de la matière. En grande partie grâce aux efforts de scientifiques tels qu'Antoine Lavoisier, Mikhaïl Lomonossov et Indépendamment les uns des autres, ils ont pu prouver que les atomes existent réellement. Mais la question à leur sujet structure interne est resté ouvert. La fin du XVIIIe siècle a été marquée par un événement aussi important monde scientifique, comme la découverte du tableau périodique par D.I. Mendeleev éléments chimiques. Ce fut une percée vraiment puissante à cette époque et leva le voile sur la compréhension que tous les atomes ont une nature unique, qu'ils sont liés les uns aux autres. Plus tard, au XIXe siècle, une autre étape importante vers la découverte de la structure de l’atome fut la preuve que chacun d’entre eux contient un électron. Le travail des scientifiques durant cette période a préparé un terrain fertile pour les découvertes du XXe siècle.

Les expériences de Thomson
Le physicien anglais John Thomson a prouvé en 1897 que les atomes contiennent des électrons chargés négativement. À ce stade, les fausses idées selon lesquelles l’atome serait la limite de divisibilité de toute substance ont été complètement détruites. Comment Thomson a-t-il réussi à prouver l’existence des électrons ? Dans ses expériences, le scientifique a placé des électrodes dans des gaz hautement raréfiés et a réussi électricité. En conséquence, des rayons cathodiques sont apparus. Thomson a soigneusement étudié leurs caractéristiques et a découvert qu'il s'agissait d'un flux de particules chargées qui se déplacent à une vitesse énorme. Le scientifique a pu calculer la masse de ces particules et leur charge. Il a également découvert qu’elles ne peuvent pas être converties en particules neutres, puisque la charge électrique est à la base de leur nature. Ainsi, Thomson fut également le créateur du premier modèle au monde de la structure de l'atome. Selon lui, un atome est un amas de matière chargée positivement dans lequel les électrons chargés négativement sont uniformément répartis. Cette structure explique la neutralité générale des atomes, puisque des charges opposées s'équilibrent. Les expériences de John Thomson sont devenues inestimables pour l'étude plus approfondie de la structure de l'atome. Cependant, de nombreuses questions restaient sans réponse.

Les recherches de Rutherford
Thomson a découvert l'existence des électrons, mais il n'a pas pu trouver de particules chargées positivement dans l'atome. corrigea ce malentendu en 1911. Au cours d'expériences étudiant l'activité des particules alpha dans les gaz, il a découvert que l'atome contenait des particules chargées positivement. Rutherford a constaté que lorsque les rayons traversaient un gaz ou une fine plaque métallique, un petit nombre de particules s'écartaient fortement de la trajectoire du mouvement. Ils ont été littéralement rejetés. Le scientifique a deviné que ce comportement s'expliquait par des collisions avec des particules chargées positivement. De telles expériences ont permis au physicien de créer un modèle de la structure de l'atome de Rutherford.

Modèle planétaire
Or, les idées du scientifique étaient quelque peu différentes des hypothèses formulées par John Thomson. Leurs modèles atomiques sont également devenus différents. lui a permis de créer une théorie complètement nouvelle dans ce domaine. Les découvertes du scientifique ont été cruciales pour la poursuite du développement la physique. Le modèle de Rutherford décrit un atome comme ayant un noyau situé au centre et des électrons se déplaçant autour de lui. Le noyau a une charge positive et les électrons une charge négative. Le modèle de l'atome de Rutherford supposait la rotation des électrons autour du noyau le long de certaines trajectoires - des orbites. La découverte du scientifique a contribué à expliquer la raison de la déviation des particules alpha et a donné l’impulsion au développement de la théorie nucléaire de l’atome. Le modèle de l'atome de Rutherford montre une analogie avec le mouvement des planètes système solaire autour du Soleil. Il s’agit d’une comparaison très précise et vivante. Par conséquent, le modèle de Rutherford, dans lequel l'atome se déplace autour du noyau sur une orbite, était appelé planétaire.

Œuvres de Niels Bohr
Deux ans plus tard, le physicien danois Niels Bohr a tenté de combiner les idées sur la structure de l'atome avec les propriétés quantiques. flux lumineux. Le scientifique a utilisé le modèle nucléaire de l’atome de Rutherford comme base de sa nouvelle théorie. Selon Bohr, les atomes tournent autour du noyau sur des orbites circulaires. Cette trajectoire de mouvement conduit à l’accélération des électrons. De plus, l'interaction coulombienne de ces particules avec le centre de l'atome s'accompagne de la création et de la dépense d'énergie pour maintenir le champ électromagnétique spatial résultant du mouvement des électrons. Dans de telles conditions, des particules chargées négativement tomberont un jour sur le noyau. Mais cela ne se produit pas, ce qui indique une plus grande stabilité des atomes en tant que systèmes. Niels Bohr s'est rendu compte que les lois de la thermodynamique classique, décrites par les équations de Maxwell, ne fonctionnent pas dans des conditions intra-atomiques. Le scientifique s'est donc donné pour tâche de déduire de nouvelles lois qui seraient valables dans le monde des particules élémentaires.

Les postulats de Bohr
En grande partie grâce au fait que le modèle de Rutherford existait et que l’atome et ses composants étaient bien étudiés, Niels Bohr a pu aborder la création de ses postulats. Le premier d'entre eux affirme que l'atome a une énergie dans laquelle il ne change pas, tandis que les électrons se déplacent sur des orbites sans changer de trajectoire. Selon le deuxième postulat, lorsqu’un électron se déplace d’une orbite à une autre, de l’énergie est libérée ou absorbée. Elle est égale à la différence entre les énergies des états précédent et suivant de l’atome. De plus, si un électron saute sur une orbite plus proche du noyau, alors un rayonnement se produit et vice versa. Malgré le fait que le mouvement des électrons ressemble peu à une trajectoire orbitale située strictement dans un cercle, la découverte de Bohr a permis d'obtenir une excellente explication de l'existence d'un spectre de raies. Vers la même époque, les physiciens Hertz et Frank, qui vécu en Allemagne, a confirmé l'enseignement de Niels Bohr sur l'existence d'états stationnaires et stables de l'atome et la possibilité de modifier les valeurs de l'énergie atomique.

Collaboration entre deux scientifiques
À propos, Rutherford n'a pas pu déterminer pendant longtemps. Les scientifiques Marsden et Geiger ont essayé de revérifier les déclarations d'Ernest Rutherford et, à la suite d'expériences et de calculs détaillés et approfondis, sont arrivés à la conclusion que c'est le noyau qui est la caractéristique la plus importante atome, et toute sa charge y est concentrée. Par la suite, il a été prouvé que la valeur de la charge nucléaire est numériquement égale au nombre ordinal de l’élément dans le système périodique d’éléments de D. I. Mendeleïev. Il est intéressant de noter que Niels Bohr a rapidement rencontré Rutherford et a été entièrement d’accord avec son point de vue. Par la suite, les scientifiques ont longtemps travaillé ensemble dans le même laboratoire. Le modèle de Rutherford, l'atome en tant que système constitué de particules élémentaires chargées - tout cela, Niels Bohr a considéré comme juste et a mis de côté pour toujours son modèle électronique. Articulation activité scientifique les scientifiques ont eu beaucoup de succès et ont porté leurs fruits. Chacun d'eux s'est plongé dans l'étude des propriétés des particules élémentaires et a fait des découvertes importantes pour la science. Plus tard, Rutherford a découvert et prouvé la possibilité d'une décomposition nucléaire, mais c'est le sujet d'un autre article.