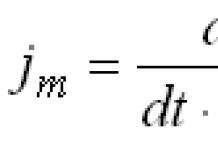Ce document normatif directeur établit des méthodes de détermination de la composition chimique des calcaires fondants.
Les méthodes indiquées dans ce document sont utilisées par le fabricant lors de l'expédition et par le consommateur lors de la réception des produits.
1. EXIGENCES GÉNÉRALES
1.1. Tous les réactifs doivent être au moins de qualité analytique. L'eau distillée pour préparer les solutions réactives et effectuer les analyses est conforme à GOST 6709-72 et désionisée.
1.2. La détermination de la fraction massique des éléments est réalisée sur deux échantillons parallèles, pesés avec une erreur aléatoire de 0,0002 g.
1.3. La valeur de l'erreur totale du résultat d'analyse moyen est surveillée au moins une fois par équipe en analysant un échantillon standard simultanément à l'analyse de l'échantillon et dans les mêmes conditions. Pour le contrôle, sélectionner un échantillon standard dont la composition chimique répond aux exigences de ce document sur la méthode de détermination de la fraction massique des éléments. Le résultat moyen de l'analyse d'un échantillon standard ne doit pas différer de la valeur de la fraction massique de l'élément, étant déterminé de plus de la moitié de la valeur de l'écart admissible pour l'intervalle correspondant de la fraction massique de l'élément. Sinon, la détermination de la fraction massique de l'élément de l'échantillon analysé dans l'échantillon standard est répétée. Les résultats de la réanalyse sont considérés comme définitifs.
1.4. Le résultat final de l'analyse est considéré comme la moyenne arithmétique des résultats de deux mesures parallèles, à condition que l'écart entre les résultats de mesures parallèles ne dépasse pas les écarts autorisés avec une probabilité de confiance de 0,95, indiqués dans le tableau. .
Tableau 1
|
Fraction massique de l'élément, % |
Différences admissibles, abdominaux. % |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Oxyde de calcium |
de 40,0 à 50,0 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
St. 50,0 « 60,0 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
L'oxyde de magnésium |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
St. 2,0 « 5,0 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Résidu insoluble |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
St. 0,5 « 1,0 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
de 0,005 à 0,01 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
St. 0,01 « 0,02 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
de 0,015 « 0,03 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
St. 0,03 « 0,05 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Une solution avec une fraction volumique d'acide chlorhydrique de 0,5 ; 0,06 - selon GOST 3118-77. Bateaux rectangulaires en porcelaine - selon GOST 9147-80 K, creusets bas en porcelaine - selon GOST 9147-80 E. Filtres à « ruban blanc » décendrés, papier filtre à teneur en cendres connue ou filtres à densité moyenne. 2.2.3. Algorithme d'opérations de préparation de solutions pour analyse Une solution avec une fraction volumique d'acide chlorhydrique de 0,5 est préparée comme suit : une partie volumique d'une solution d'acide chlorhydrique avec une concentration massique de 1,19 g/cm3 est mélangée avec le même volume d'eau et soigneusement agitée. Une solution avec une fraction volumique d'acide chlorhydrique de 0,05 est préparée comme suit : cinq parties en volume d'une solution d'acide chlorhydrique avec une concentration massique de 1,19 g/cm3 sont mélangées avec 95 volumes identiques d'eau et agitées. 2.2.4. Algorithme pour effectuer des mesures Un échantillon de 1 g d'échantillon séché à l'air est placé dans une fiole conique de 100 cm3, préalablement humidifiée avec de l'eau. Versez délicatement 15 cm3 de solution avec une fraction volumique d'acide chlorhydrique de 0,5, portez à ébullition et faites bouillir pendant 3 minutes. Le précipité est lavé par filtration sur un filtre à ruban blanc sans cendre ou sur un papier filtre. Laver les parois du ballon deux fois avec une solution chaude avec une fraction volumique d'acide chlorhydrique de 0,06, essuyer avec un morceau de filtre et laver le précipité cinq fois avec de l'eau chaude. Le filtre avec le résidu insoluble est placé dans une nacelle ou un creuset en porcelaine suspendu, incendié et percé à une température de 900 °C pendant 20 minutes. Le sédiment refroidi est pesé. 2.2.5. Traitement des résultats de l'analyse La fraction massique du résidu insoluble (X) en pourcentage est calculée à l'aide de la formule où m est la masse trouvée du résidu insoluble, g ; M1 est la masse de sédiments de l'expérience témoin, g ; M - poids de l'échantillon, g. 2.3. Détermination de la fraction massique d'oxyde de calcium 2.3.1. Méthode de mesure La méthode est basée sur la détermination de l'oxyde de calcium par titrage métrique complexe avec un indicateur acide chrome-bleu foncé à pH 12. L'influence du fer ferrique et de l'aluminium est éliminée avec un mélange masquant ou de la triéthylamine, les liant dans un complexe fluorure. Il est permis d'utiliser les indicateurs fluorexone et murexide. 2.3.2. Instruments de mesure, appareils auxiliaires, réactifs GOST 1770-74 E. GOST 25336-82 E. GOST 3760-79. Une solution avec une fraction volumique d'acide chlorhydrique de 0,33 - selon GOST 3118-77. Une solution d'oxyde de potassium hydraté avec une concentration massique de 20 g/cm3. Sel disodique de l'acide éthylènediaminetétraacétique (trilon B), la concentration molaire de l'équivalent du trilon B est de 0,025 mol/dm3 - selon GOST 10652-73. Zinc granulé. Triéthanolamine - selon TU 6-09-2448-86. Papier Congo. L'utilisation de réactifs et de verrerie importés est autorisée. 2.3.3. Algorithme d'opérations de préparation de solutions pour analyse Une solution d'une concentration molaire en équivalent sel de zinc égale exactement à 0,05 mol/dm3 est préparée comme suit : 1,6345 g de zinc métallique sont pesés avec une erreur aléatoire de ± 0,0002 g, placés dans une tasse en porcelaine et dissous par chauffage dans une eau bain dans un mélange de 100 cm3 d'eau et 15 cm3 d'acide nitrique, en recouvrant la tasse de verre. Lavez ensuite soigneusement le verre avec de l'eau, récupérez-le dans la même tasse et évaporez la solution à 3 - 4 cm3. Le résidu du gobelet est transféré quantitativement, en lavant les parois du gobelet avec de l'eau, dans une fiole jaugée d'une capacité de 1 dm3 et le volume est ajusté au trait avec de l'eau. La solution est bonne pendant un mois. Une concentration molaire en équivalent Trilon B égale à 0,025 mol/dm3 est préparée comme suit : 9,31 g de Trilon B sont dissous dans l'eau et le volume est ajusté à 1 dm3 avec de l'eau. La solution est conservée dans des récipients en polyéthylène ou en verre, cirés à l'intérieur. Une solution tampon pH 9,5 ... 10 est préparée comme suit : 70 g de chlorure d'ammonium sont dissous dans 1000 cm3 d'ammoniaque, solution 1:1. Le mélange de masquage est préparé comme suit : 15 g de fluorure de sodium sont dissous dans 1 dm3 d'eau à chaud et 20 cm3 de triéthanolamine sont ajoutés. Les indicateurs sont préparés comme suit : 0,250 g d'indicateur est broyé dans un mortier avec 25 g de chlorure de sodium ou 1 g d'indicateur est dissous dans 10 cm3 d'une solution tampon pH 9,5... 10 et le volume est ajusté à 100 cm3 avec eau distillée. La concentration molaire de l'équivalent de Trilon B, égale à 0,5 mol/dm3, est déterminée à partir d'une solution de sel de zinc de la façon suivante : à 25 cm3 de sel de zinc de concentration molaire de l'équivalent de 0,05 mol/dm3 ajouter 5 cm3 de une solution tampon, environ 0,1 g d'indicateur ériochrome noir T et 70 cm3 d'eau. La solution est agitée et titrée avec la solution Trilon B jusqu'à ce que la couleur rouge violet vire au bleu. La concentration molaire en équivalent Trilon B, égale à 0,05 mol/dm3, est calculée à l'aide de la formule où V est le volume de Trilon B avec une concentration molaire équivalente à 0,005 mol/dm3, consommé pour le titrage, cm3. La concentration massique de Trilon B (T) pour l'oxyde de calcium en g/cm3 est calculée à l'aide de la formule
où N est la concentration molaire de l'équivalent ; 28,04 - équivalent gramme d'oxyde de calcium. En plus de cette méthode, il est possible de régler la concentration massique du Trilon B en fonction d'un échantillon standard. 2.3.4. Algorithme pour effectuer des mesures Un échantillon de 0,5 g de l'échantillon séché à l'air est dissous dans 30 cm3 d'une solution dans une fraction volumique d'acide chlorhydrique de 0,33 dans une fiole conique d'une capacité de 250 cm3 lorsqu'elle est chauffée et bouillie pendant 3 minutes. La solution est transférée dans une fiole jaugée de 250 cm3, le volume est ajouté au trait avec de l'eau et bien mélangé. Pour déterminer la fraction massique d'oxyde de calcium, prélever 50 cm3 de la solution préparée dans une fiole conique d'une capacité de 500 cm3, diluer avec de l'eau à 200 cm3, ajouter 5 cm3 d'un mélange de masquage ou 5 ... 7 gouttes de triéthanolamine , ajouter (15 ... 20) cm3 de solution Trilon B, neutraliser avec une solution de potasse de concentration massique de 20 g/cm3 sur papier indicateur Congo, ajouter environ 10 cm3 d'alcali en excès (pH 12 - 13) ; 0,10 à 0,15 g ou 4 à 6 gouttes d'indicateur bleu foncé au chrome acide et continuez à ajouter du Trilon B jusqu'à ce que la couleur passe du pourpre au violet. Le titrage peut être effectué non seulement, mais également avec différents types de titreurs dans des récipients appropriés. 2.3.5. Traitement des résultats La fraction massique d'oxyde de calcium (X) en pourcentage est obtenue par la formule
où V est le volume de Trilon B consommé pour le titrage, cm3 ; T - concentration massique de Trilon B pour l'oxyde de calcium, g/cm3 ; M est le poids de l'échantillon contenu dans la partie aliquote de la solution, g. 2.4. Détermination de la fraction massique d'oxyde de magnésium 2.4.1. Méthode de mesure La méthode est basée sur le dosage tétramétrique des ions magnésium après précipitation du calcium sous forme d'oxalate. 2.4.2. Instruments de mesure, appareils auxiliaires, réactifs Balances analytiques avec poids. Béchers et flacons en verre de laboratoire - selon GOST 25336-82 E. Verrerie de laboratoire. Cylindres, béchers, flacons - selon GOST 1770-74 E. Instruments de mesure du verre de laboratoire. Pipettes, burettes - selon GOST 20292-74E. Une solution avec une fraction volumique d'acide chlorhydrique de 0,5 - selon GOST 3118-77. Sulfate de magnésium - selon TU 6-09-2540-87. Solution d'oxalate d'ammonium avec une fraction massique de 4% - selon GOST 5712-78. Solution d'ammoniaque avec une concentration massique de 25 g/cm3 - selon GOST 3760-79. Indicateur méthylorange - selon TU 6-09-5171-84. Indicateur ériochrome noir T - selon TU 6-09-1760-72. Indicateur de chrome acide bleu foncé - selon TU 6-09-3870-84. Filtres sans cendres « ruban blanc » ou papier filtre avec une teneur en cendres connue. L'utilisation de réactifs et de verrerie importés est autorisée. 2.4.3. Algorithme d'opérations de préparation de solutions pour analyse Une solution tampon d'ammoniaque de pH 9,5 est préparée comme suit : 70 g de chlorure d'ammonium sont dissous dans 1000 cm3 d'ammoniaque, solution 1:1. La concentration molaire de l'équivalent de sulfate de magnésium, égale exactement à 0,1 mol/dm3, est préparée comme suit : le contenu d'une ampoule de sulfate de magnésium fixanal est transféré quantitativement dans une fiole jaugée d'une capacité de 1 dm3 et dilué avec de l'eau pour la marque. La concentration molaire en équivalent Trilon B, égale à 0,025 mol/dm3, est préparée comme suit : 9,31 g de Trilon B sont dissous dans l'eau et ajustés à 1 dm3. Les indicateurs sont préparés comme suit : 0,250 g d'indicateur est broyé dans un mortier avec 25 g de chlorure de sodium ou 1 g d'indicateur est dissous dans 10 cm3 d'une solution tampon pH 9,5 - 10 et le volume est ajusté à 100 cm3 avec de l'eau distillée. . La concentration molaire de l'équivalent de Trilon B, égale à 0,5 mol/dm3, est déterminée à partir d'une solution de sel de zinc de la façon suivante : à 25 cm3 de sel de zinc de concentration molaire de l'équivalent de 0,006 mol/dm3 ajouter 5 cm3 de une solution tampon, environ 0,1 g d'indicateur noir ériochrome T et 70 cm3 d'eau. La solution est agitée et titrée avec la solution Trilon B jusqu'à ce que la couleur rouge violet vire au bleu. La concentration molaire en équivalent Trilon B, égale à 0,05 mol/dm3, est calculée à l'aide de la formule où V est le volume de Trilon B avec une concentration molaire équivalente à 0,005 mol/dm3, consommé pour le titrage, cm3. La concentration massique de Trilon B (T) pour l'oxyde de magnésium en g/cm3 est calculée à l'aide de la formule
où N est la concentration molaire de l'équivalent ; 20,16 - équivalent gramme d'oxyde de magnésium. Il est également possible de régler la concentration massique du Trilon B en fonction d'un échantillon standard et des résines synthétiques d'échantillons standards. 2.4.4. Algorithme pour effectuer des mesures Un échantillon de 0,5 g de l'échantillon séché à l'air est dissous dans 20 cm3 d'une solution avec une fraction volumique d'acide chlorhydrique de 0,5 dans une fiole conique d'une capacité de 250 cm3 lorsqu'elle est chauffée et bouillie pendant 3 minutes. 50 cm3 d'eau chaude, 20 cm3 de solution d'oxalate d'ammonium avec une concentration massique de 4 g/cm3 sont ajoutés à la solution, laissés bouillir, 1 à 2 gouttes d'indicateur méthylorange sont introduites et neutralisées avec une solution d'ammoniaque de masse fraction de 0,5. Le précipité est filtré sur un filtre moyenne densité, les parois du ballon et le filtre avec le précipité sont lavés à l'eau froide. Le filtrat et l'eau de lavage sont récupérés dans une fiole jaugée de 250 cm3, dilués au trait avec de l'eau et bien mélangés. Dans une fiole conique d'une capacité de 250 cm3, prélever 50 cm3 de filtrat, ajouter 50 cm3 d'eau, 5 cm3 de solution tampon ammoniaquée, 0,1 - 0,2 g de mélange indicateur de chrome acide bleu foncé ou 4 - 5 gouttes de solution indicatrice et titrer avec la solution Trilon B jusqu'à la transition de couleur du rose au violet. 2.4.6. Traitement des résultats La fraction monétaire de l'oxyde de magnésium (X) en pourcentage est calculée à l'aide de la formule
où V est le volume de Trilon B consommé pour le titrage, cm3 ; T - concentration massique de Trilon B pour l'oxyde de magnésium, g/cm3 ; M est le poids de l'échantillon contenu dans la partie aliquote de la solution, g. 2.5. Détermination de la fraction massique de soufre - selon GOST 23581.20-81 ou selon les méthodes des entreprises d'extraction de flux approuvées par ISO TsNIICHM. 2.6. Détermination de la fraction massique de phosphore 2.6.1. Méthode de mesure La méthode est basée sur la formation d’un composé complexe phosphoroanadium-molybdène en présence d’acide et sur la photométrie de la solution colorée. 2.6.2. Instruments de mesure, appareils auxiliaires, réactifs Balances analytiques avec poids Béchers et flacons en verre de laboratoire - selon GOST 25366-82 E. Verrerie de laboratoire. Cylindres, béchers, flacons - selon GOST 1770-74 E. Instruments de mesure du verre de laboratoire. Pipettes, burettes - selon GOST 20292-74E. Une solution avec une fraction volumique d'acide nitrique de 0,33 - selon GOST 4461-77. Phosphate de potassium monosubstitué - selon GOST 4198-75. Molybdate d'ammonium - selon GOST 3765-78. Acide ammonium vanadium - selon GOST 9336-75. L'utilisation de réactifs et de verrerie importés est autorisée. 2.6.3. Algorithme d'opérations de préparation de solutions pour analyse Une solution d'acide vanadium molybdique ammonium est préparée comme suit : 10 g d'acide molybdate d'ammonium sont dissous dans 100 cm3 d'eau chaude, puis 2 cm3 d'acide nitrique sont ajoutés et filtrés si un précipité se forme. Dissoudre séparément 0,3 g d'acide ammonium vanadium dans 50 cm3 d'eau à 50 - 60°C, refroidir et ajouter 50 cm3 d'une solution avec une fraction volumique d'acide nitrique de 0,33. La solution de molybdate d'ammonium préparée est versée sous agitation dans la solution d'acide ammonium vanadium, puis 16 cm3 d'acide nitrique sont ajoutés et agités. La solution est conservée dans un flacon fermé dans un endroit sombre. Une solution étalon de phosphore est préparée comme suit : 0,1917 g de phosphate de potassium monosubstitué doublement recristallisé est dissous dans une petite quantité d'eau dans une fiole jaugée de 1 dm3, additionné d'eau jusqu'au trait et mélangé. 1 cm3 de solution étalon correspond à 0,1 mg de pentoxyde de phosphore. La solution expérimentale témoin est préparée comme suit : 15 cm3 d'acide nitrique chauffé à 60 - 80 °C sont placés dans une fiole jaugée de 100 cm3, puis 10 cm3 de solution de molybdate d'ammonium vanadium sont ajoutés, complétés au trait avec de l'eau et mélangés. . 2.6.4. Algorithme pour effectuer des mesures Un échantillon de 1,0 g d'échantillon séché à l'air est humidifié avec de l'eau et placé dans un verre d'une capacité de 100 cm3, 5 cm3 d'eau régale sont ajoutés et évaporés à sec. Le résidu est humidifié avec 3 cm3 d'acide chlorhydrique et évaporé à sec. Ajouter 5 cm3 d'acide nitrique et évaporer jusqu'à obtenir une consistance de sirop, à laquelle le liquide se recouvre d'un film. Le volume de la solution ne doit pas dépasser 1 à 1,5 cm3. Si en fin d'évaporation des oxydes d'azote bruns continuent de se dégager, ce qui indique la présence de composés organiques, alors ajouter à nouveau 5 cm3 d'acide nitrique et évaporer à nouveau jusqu'à consistance de sirop. 15 cm3 d'une solution chauffée à 60 - 80 °C avec une fraction volumique d'acide nitrique de 0,33 sont ajoutés à la solution évaporée, chauffée pendant plusieurs minutes, filtrée sur un filtre à ruban blanc ou un filtre de densité moyenne dans un volumétrique de 100 cm3. ballon. Le gâteau de filtration est lavé 2 à 3 fois à l'eau froide. 10 cm3 de solution de molybdate d'ammonium vanadium sont ajoutés au réactif dans le ballon, dilués au trait avec de l'eau et mélangés. La densité optique de la solution est mesurée sur un photochromatographe à 413 nm, à l'aide du filtre n°3 avec une plage de transmission de 400 - 500 nm et d'une cuvette d'épaisseur de couche colorimétrique de 50 nm par rapport à une solution ne contenant pas d'étalon. solution de phosphore. Pour construire une courbe d'étalonnage, 0, 1, 2, 3, 4 et 5 cm3 d'une solution étalon de phosphore sont prélevés dans une série de fioles jaugées d'une capacité de 100 cm3, ce qui correspond à 0 ; 0,1 ; 0,2 ; 0,3 ; 0,4 et 0,5 mg d'oxyde de phosphore. Versez 5 cm3 d'acide nitrique et 8 cm3 de molybdate d'ammonium vanadium dans chaque flacon, ajoutez de l'eau jusqu'au trait et mélangez. Après 3 à 4 minutes. mesurer la densité optique de la solution. Comme solution de référence, une solution expérimentale témoin préparée simultanément avec la solution analysée est utilisée. Sur la base de la densité optique de la solution analysée, la fraction massique de pentoxyde de phosphore est déterminée selon la courbe d'étalonnage. 2.6.5. Traitement des résultats La fraction massique de phosphore en termes de pentoxyde (X) en pourcentage est calculée à l'aide de la formule
où M1 est la masse de pentoxyde de phosphore trouvée à partir de la courbe d'étalonnage, en mg ; M - masse de l'échantillon, g ; V1 est le volume d'une aliquote de la solution analysée, cm3 ; V est le volume de la solution entière analysée, cm3. La fraction massique de phosphore (X1) est déterminée par la formule où 2,29 est le facteur de conversion du pentoxyde de phosphore en phosphore. 2.7. Il est permis d'effectuer une analyse chimique des calcaires fluxants en utilisant d'autres méthodes et techniques certifiées par ISO TsNIIChM, garantissant pas moins de précision que ce RD. En cas de désaccord sur l'appréciation de la qualité du calcaire fondant, l'analyse est réalisée selon le RD 14-16-3-90. 2.8. Détermination de la conformité du calcaire de qualité KDU-1 aux exigences techniques de NTD pour la stabilité de la teneur en oxyde de magnésium (MgO). 2.8.1. Cette détermination est effectuée statistiquement pour chaque lot de calcaire sur la base des résultats d'analyse chimique. 2.8.2. Les principales caractéristiques statistiques de la fraction massique d'oxyde de magnésium dans un lot de calcaire sont : xi est la fraction massique d'oxyde de magnésium dans je-ième échantillon prélevé sur un lot de calcaire ( je = 1, 2, ..., n), %; Fraction massique moyenne arithmétique d'oxyde de magnésium dans un lot de calcaire, % σ - écart type des échantillons par rapport à la valeur moyenne dans un lot de calcaire, %
2.8.3. Un lot de calcaire répond aux exigences techniques du NTD pour la fraction massique d'oxyde de magnésium dans le cas où tous les échantillons (X1, X2, ..., Xn) se situent dans l'intervalle standard de 7 à 12 %, et la norme réelle L'écart type (σf) ne dépasse pas l'écart type maximum admissible (σм), indiqué dans le tableau. . 2.8.4. Si l'écart type réel (σф) est supérieur à l'écart maximum admissible (σм), alors le calcaire de ce lot est du calcaire dolomitisé non moyenné. 2.8.5. Une diminution de la plage de fluctuations de la fraction massique d'oxyde de magnésium dans un lot de calcaire est déterminée dans le cas où l'écart type réel (σф) est inférieur à l'écart type type égal à ± 0,5 % (σм = 0,5 %) . En supposant que les résultats sont garantis avec une probabilité de 0,95, la réduction de la plage de fluctuations de la fraction massique d'oxyde de magnésium dans un lot de calcaire (D) par rapport à la norme calculée (± 1,0 %) est égale à
Tableau 2
FAIRE DÉFILER |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Minerais de fer, concentrés, anglomérats et pellets. Méthodes de détermination du soufre |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
TU 6-09-3870-84 |
Indicateur bleu foncé chromé (chrome acide bleu foncé), indicateur ; Sel disodique de l'acide 2-(5-chloro-2-hydroxyphényl)-AEO-1,8-dioxynaphtalène-3,6-disulfonique) pur pour analyse |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
TU 6-09-2448-86 |
NITILotriéthanol |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
TU 6-09-2540-87 |
Titres standards (fixanals, normadoses) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
TU 6-09-5171-84 |
Indicateur méthylorange (acide paradiméthylaminoazobenzènesulfonique de sodium) pur pour analyse |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
La pierre calcaire fournie aux sucreries pour la production de chaux et de gaz de carbonatation présente certaines exigences concernant la taille des morceaux et la composition chimique.
Selon les normes b. Glavsakhara, agréée en mars 1957, la pierre calcaire doit être livrée aux sucreries en morceaux d'une taille allant de 80 à 180 mm (poids des morceaux respectivement de 1 à 3 kg) triés en fractions : 80-120 mm et 120-180 mm. Les morceaux de pierre de plus de 180 mm ne doivent pas dépasser 3 %. Les morceaux de pierre de taille inférieure à 80 mm sont considérés comme des fines dont le montant ne doit pas dépasser 3 %. La pierre calcaire à comparer doit être propre, exempte de sable, d'argile et d'autres roches et avoir une humidité normale (3 à 5 %).
Composition chimique de la pierre calcaire selon les spécifications techniques approuvées par b. Ministère de l'Industrie alimentaire de l'URSS en avril 1956, devrait être le suivant :
Pour les sucreries d'Asie centrale, il est permis de fournir du calcaire avec une teneur en carbonate de magnésium allant jusqu'à 12 %, mais à condition que la quantité avec le carbonate de calcium soit d'au moins 96,5 %.
Les spécifications techniques prévoient la composition chimique suivante de la craie (en % du poids de matière sèche) :
La teneur en humidité de la craie fraîchement extraite peut atteindre 15 à 25 %. La forte humidité de la craie entraîne des difficultés lors de sa cuisson et doit être prise en compte lors du dosage du combustible (anthracite).
Les calcaires pour la production de chaux aérienne de construction conformément à GOST 5331-50 sont divisés par composition chimique en trois classes - A, B et C (tableau 49) et par la taille des morceaux en grands, moyens et petits (tableau 50). ).
Ainsi, la pierre calcaire destinée à la production de sucre répond aux exigences du calcaire de classe A en termes de composition chimique et est classée parmi les morceaux de taille moyenne.
Conformément à GOST 5331-50, les règles d'acceptation, d'échantillonnage et de préparation des échantillons pour l'analyse du calcaire sont les suivantes.
La taille du lot accepté est fixée à 100 tonnes, le solde supérieur à 50 tonnes étant également considéré comme un lot. Le reliquat inférieur à 50 tonnes est ajouté au lot précédent. Pour les livraisons de calcaire inférieures à 100 tonnes, toute quantité livrée est considérée comme un lot.
Lors de la compilation d'un échantillon, des morceaux pesant environ 1 kg chacun sont sélectionnés à 20 endroits différents dans un lot de calcaire, ou des morceaux de ce poids sont séparés des morceaux plus gros, ou un nombre égal de petits morceaux en poids sont sélectionnés avec une pelle. de manière à obtenir un échantillon moyen pesant au moins 20 kg.
Le calcaire sélectionné est broyé en morceaux mesurant 10 à 15 mm dans sa plus grande dimension, soigneusement mélangé et réduit en quartiers pour obtenir un échantillon moyen pesant environ 5 à 6 kg. L'échantillon moyen obtenu est divisé en deux parties égales de 2,5 à 3 kg chacune. Une partie est soumise à des tests, et l'autre, scellée du sceau d'usine, est stockée pendant 2 mois en cas de tests d'arbitrage.
L'échantillon de calcaire destiné à l'essai est réduit en quartiers pour obtenir un échantillon pesant 1 kg, broyé dans un mortier jusqu'à passage complet au tamis avec un côté de trou de 0,75 mm, puis soumis à une nouvelle réduction en quartiers pour obtenir un échantillon pesant 100g.
Cet échantillon est broyé dans un mortier jusqu'à son passage complet à travers un tamis dont le côté du trou est de 0,2 mm, et des échantillons sont prélevés sur cet échantillon broyé pour analyse.
Lors de l'analyse de la pierre calcaire, la teneur en humidité, SiO2 et autres impuretés insolubles dans HCl, les oxydes de fer et d'aluminium (Fe2O3 + Al2O3), le carbonate de calcium (CaCO3), le carbonate de magnésium (MgCO3), le sulfate de calcium (CaSO4), les oxydes de potassium et de sodium ( K2O) sont déterminés + Na2O).
La composition chimique de la pierre calcaire de certains gisements est donnée dans le tableau. 51.
Objectif du travail : déterminer l'activité de la chaux, la vitesse d'extinction et la température.
Concepts de base
La chaux pneumatique de construction est un produit obtenu en brûlant des roches calco-magnésiennes jusqu'à ce que le dioxyde de carbone soit libéré le plus complètement possible. La chaux est utilisée en mélange avec divers additifs pour produire divers liants : chaux-quartz, chaux-laitier, chaux-argile, etc. Les briques silico-calcaires, les blocs de silicate, les pièces renforcées de silicate de grandes dimensions et divers autres produits de construction sont fabriqués à partir de il.
Le principal processus de production de chaux aérienne est la calcination, dans laquelle le calcaire est décarbonisé et transformé en chaux par la réaction suivante :
CaCO 3 + 178,58 kJ →CaO + CO 2
En laboratoire, la dissociation du carbonate de calcium se produit à environ 900 °C ; en production, la température de cuisson est de 1 000 à 1 200 °C.
La chaux vive se présente sous forme de morceaux et de poudre. Il est obtenu sous forme de morceaux de couleur jaune clair ou gris. Il absorbe intensément l'humidité et il est donc recommandé de le stocker dans un état hermétiquement fermé. Si la matière première contient plus de 6 % d'impuretés argileuses, le produit calciné présente des propriétés hydrauliques et est appelé chaux hydraulique.
La qualité de la chaux obtenue est évaluée par l'activité, qui montre la teneur totale en oxydes de calcium et de magnésium libres à l'état actif. En plus d'eux, la chaux peut contenir des oxydes MgO et CaO à l'état inactif ; il s'agit d'inclusions de carbonates non décomposés et de cristaux grossiers (burnout).
En fonction de la teneur en CaO et MgO actifs, la chaux est produite en trois qualités (tableau 9.1).
Tableau 9.1
Classification de la chaux par qualité
La chaux aérienne peut être utilisée sous forme éteinte.
La chaux éteinte se présente sous forme de peluches, de pâte ou de lait. La teneur en humidité des peluches ne dépasse pas 5 %, dans la pâte elle est inférieure à 45 %. Le processus de trempe se déroule selon le schéma suivant :
CaO + H 2 Ô ↔ Californie(OH) 2 +65,1 kJ
et s'accompagne d'un dégagement de chaleur, qui provoque une élévation de température pouvant enflammer l'arbre. L'hydratation de l'oxyde de calcium est une réaction réversible, son sens dépend de la température et de la pression de la vapeur d'eau dans l'environnement. L'élasticité de dissociation de Ca(OH) 2 en CaO et H 2 O atteint la pression atmosphérique à 547°C ; à des températures plus élevées, l'hydroxyde de calcium peut se décomposer partiellement. Pour que le processus aille dans la bonne direction, il est nécessaire de s'efforcer d'augmenter l'élasticité de la vapeur d'eau sur Ca(OH) 2 et d'éviter que la température soit trop élevée. Dans le même temps, il convient d'éviter un refroidissement excessif de la chaux d'extinction, car cela ralentit considérablement l'extinction. Plus de la moitié de ses grains ont une taille ne dépassant pas 0,01 mm. La vaporisation protège le matériau d’une élévation excessive de la température.
Le volume de peluches lors de l'extinction de la chaux est 2 à 3 fois supérieur au volume de la chaux vive d'origine en raison d'une augmentation du volume des vides (pores) entre les grains individuels du matériau résultant. La densité de la chaux vive est en moyenne de 3200, et celle de la chaux éteinte est de 2200 kg/m3.
Pour éteindre la chaux, il faut théoriquement ajouter 32,13% d'eau en poids. En pratique, selon la composition de la chaux, son degré de combustion et le mode d'extinction, ils consomment environ deux et parfois trois fois plus d'eau, car sous l'influence de la chaleur dégagée lors de l'extinction, une vaporisation se produit et une partie de l'eau est supprimé.
En fonction de la température développée lors de la trempe, on distingue entre une exothermie élevée (t d'extinction >50 °C) et une faible exothermie (t d'extinction).<50 °C) известь, а по скорости гашения: быстрогасящуюся (не более 8 мин.), среднегасящуюся (8-25 мин.) и медленногасящуюся (более 25 мин.) известь.
Pour accélérer le processus d'extinction de la chaux, on utilise des additifs CaCl 2, NaCl, NaOH, qui interagissent avec l'oxyde de calcium pour former des composés plus solubles par rapport au Ca(OH) 2, et pour le ralentir, des additifs de tensioactifs, des sels de soufre , les acides phosphorique, oxalique et carbonique sont utilisés.
ÉTABLISSEMENT D'ENSEIGNEMENT MUNICIPAL ÉCOLE SECONDAIRE a. OKTYABRSKOYE
DISTRICT DE STERLITAMAK DE LA RÉPUBLIQUE DU BACHKORTOSTAN
Section : Monde de la Chimie
Catégorie : Le monde qui nous entoure
Effectué :Zaydullina Alsou, une élève de 7e année de l'école secondaire de l'établissement d'enseignement municipal du village. Oktiabrskoïe
Responsable scientifique : Iskhakova R.U., professeur de chimie au lycée MOBU. Oktiabrskoïe
2015
Introduction
étudier la littérature sur cette question ;
étudier les propriétés physiques du calcaire;
étudier les propriétés chimiques du calcaire;
procurez-vous du calcaire vous-même ;
conclure.
ÉTUDE DE LITTERATURE. Qu’est-ce que le calcaire ?
Calcaire -roche sédimentaire d'origine organique, constituée principalement de carbonate de calcium ( CaCO3 ) sous forme de cristaux de calcite de différentes tailles.
Le calcaire, constitué principalement de coquilles d'animaux marins et de leurs fragments, est appelé coquillage. De plus, il existe des calcaires nummulitiques, bryozoaires et marbrés - en couches massives et en couches minces.
Sur la base de leur structure, les calcaires se distinguent comme étant cristallins, organo-clastiques, détritiques-cristallins (structure mixte) et frittés (travertin). Parmi les calcaires cristallins, selon la taille des grains, ils se distinguent en grossiers, fins et cryptocristallins (aphanitiques), et selon l'éclat de la fracture - recristallisés (semblables à du marbre) et caverneux (travertin). Calcaire cristallin - massif et dense, légèrement poreux ; travertin - caverneux et très poreux.
Parmi les calcaires organo-clastiques, selon la composition et la taille des particules, on distingue : les calcaires récifaux ; calcaire coquillier (coquillage), constitué principalement de coquilles entières ou concassées maintenues ensemble par du carbonate, de l'argile ou un autre ciment naturel ; calcaire détritique composé de fragments de coquilles et d'autres fragments organogènes cimentés par du ciment de calcite ; calcaire algal. Les calcaires organo-clastiques comprennent également de la craie blanche (dite écriture).
Les calcaires organoclastiques se caractérisent par une porosité et une masse importantes et sont faciles à traiter (sciés et polis). Le calcaire clastique-cristallin est constitué de détritus carbonatés de formes et de tailles diverses (morceaux, caillots et nodules de calcite à grains fins), avec l'inclusion de grains individuels et de fragments de diverses roches et minéraux, lentilles de chert. Parfois le calcaire est composé de grains oolithiques dont les noyaux sont représentés par des fragments de quartz et de silex. Ils se caractérisent par de petits pores de formes différentes, une masse volumétrique variable, une faible résistance et une absorption d'eau élevée. Le calcaire fritté (travertin, tuf calcaire) est constitué de calcite frittée. Il se caractérise par sa cellulérance, sa faible masse volumétrique et est facile à traiter et à scier.
Le calcaire a des applications universelles dans l’industrie, l’agriculture et la construction :
En métallurgie, le calcaire sert de fondant.
Dans la production de chaux et de ciment, le calcaire est le composant principal.
Le calcaire est utilisé dans les industries chimiques et alimentaires : comme matériau auxiliaire dans la production de soude, de carbure de calcium, d'engrais minéraux, de verre, de sucre et de papier.
Il est utilisé dans la purification des produits pétroliers, la distillation sèche du charbon, dans la fabrication de peintures, mastics, caoutchouc, plastiques, savons, médicaments, laine minérale, pour le nettoyage des tissus et le traitement du cuir, et pour le chaulage des sols.
Le calcaire est utilisé comme matériau de construction depuis l’Antiquité ; et au début c'était assez « naïf » : ils trouvèrent une grotte et l'aménagèrent selon leurs besoins.
2. ETUDE DES PROPRIÉTÉS PHYSIQUES.
(Annexe 2).
Chaque minéral a ses propres caractéristiques qui lui sont propres ; j'ai considéré les signes suivants :
Briller
mat
Dureté
moyenne
Couleur
blanc-gris
Densité
2000-2800kg / m 3
Conductivité électrique
10~5 à 10~~4
Conductivité thermique
0,470 m*K
Solubilité. (Annexe 3)
solubilité dans l'eau
Le calcaire ne se dissout pas dans l'eau
Solubilité dans l'acétone (solvant organique)
Le calcaire ne se dissout pas dans l'acétone
ÉTUDIER LES PROPRIÉTÉS CHIMIQUES
(Annexe 4)
Expérience n°1. Interaction du calcaire avec les acides (chlorhydrique, acétique, nitrique).
Produits chimiques et équipements :
Acides forts : HCI (chlorhydrique), HNO 3 (azote).
Faible CH 3 COOH (acétique).
Support avec tubes à essai, lampe à alcool, support.
Réactif
Observations
Conclusion
HCI(sel),
La réaction est violente
Interagit bien avec l'acide chlorhydrique
HNO 3 (azote)
Des gouttelettes d'eau sont apparues sur les parois du tube à essai et du dioxyde de carbone s'est libéré.
La réaction est violente
Interagit bien avec l'acide nitrique. Mieux avec de l'eau salée.
CH 3 COOH(acétique)
Des gouttelettes d'eau sont apparues sur les parois du tube à essai et du dioxyde de carbone s'est libéré.
La réaction est lente, mais lorsqu'elle est chauffée, la vitesse de réaction augmente.
Interagit mal avec l'acide acétique. Parce que acide faible.
CaCO 3 +2HCl=CO 2 +H 2 O+CaCl 2
CaCO 3 +2CH 3 COOH= (CH 3 ROUCOULER) 2 Ca + H 2 O + CO 2
CaCO 3 + 2HNO 3 =Ca(NON 3 ) 2 + CO 2 +H 2 Ô
Conclusion : Le calcaire réagit avec les acides pour libérer du dioxyde de carbone et de l'eau. Avec des acides forts, la réaction était violente, mais avec un acide faible, la réaction ne commençait qu'après chauffage.
Expérience n°2. Interaction avec les alcalis (bases solubles dans l'eau).
(Annexe 4)
Produits chimiques et équipements :
Hydroxyde de sodium - NaOH , support avec tubes à essai, lampe à alcool, support.
Description de l'expérience : Une certaine quantité de calcaire a été ajoutée dans un tube à essai et de l'hydroxyde de sodium a été ajouté. Il n'y a eu aucune réaction, après 15 minutes, j'ai ajouté plus de réactif et je l'ai chauffé. Aucune réaction n'a été observée.
Conclusion : Le calcaire ne réagit pas avec les alcalis.
Expérience n°3. Décomposition du calcaire.
(Annexe n°5).
Produits chimiques et équipements : calcaire, trépied, tube de sortie de gaz, flacon, torche, lampe à alcool.
Description de l'expérience : Le calcaire a été placé dans un tube à essai et fermé par un tube de sortie de gaz dont l'extrémité a été descendue dans le ballon. Ils allumèrent la lampe à alcool et commencèrent à la chauffer. La présence de dioxyde de carbone a été déterminée à l’aide d’un éclat en feu.
Observations : Le calcaire se décompose. La couleur est devenue blanche. Des gouttelettes d'eau sont apparues sur les parois du tube à essai et du dioxyde de carbone s'est libéré.
CaCO 3 CaO+ CO 2
Conclusion: Lorsqu'il est chauffé, le calcaire se décompose pour former de l'oxyde de calcium et de l'eau.
Expérience n°4. Fabriquer du calcaire à la maison.
Pour réaliser l'expérience, vous aurez besoin de :
seau en plastique
gobelets en plastique
plâtre sec
mélange de gypse
Il est temps de réaliser l’expérience : 15 minutes pour préparer l'expérience et 5 jours pour obtenir du calcaire.
Pour obtenir du calcaire :
J'ai versé le mélange obtenu dans des gobelets en plastique.
Placez les tasses dans un endroit chaud. Je l'ai laissé tranquille pendant 5 jours.
Le cinquième jour, j'ai extrait le calcaire obtenu.
Note:
Les coquilles peuvent être de n’importe quelle taille, mais utilisez des coquilles plus petites pour obtenir un calcaire de la meilleure qualité.
Observation: Le calcaire obtenu ressemble-t-il à un calcaire naturel ?
Résultat:
Le calcaire est un type de roche sédimentaire. Lorsque des animaux marins microscopiques meurent, ils tombent au fond de l’océan où ils sont récupérés par des coquillages. Ainsi, les coquilles collectent ces particules au fil du temps et du calcaire se forme..
Calcaire est une roche sédimentaire molle d'origine organo-chimique ou organique, constituée principalement de calcite (carbonate de calcium) et contenant souvent des impuretés de quartz, de silicium, de phosphate, de particules de sable et d'argile, ainsi que des restes de squelettes calcaires de micro-organismes. Le plus souvent, il a une couleur blanche, jaunâtre, gris clair ou beige clair, moins souvent il est rosâtre. Le calcaire blanc-jaune et blanc-rose est considéré comme le plus précieux. Selon leur structure, les calcaires sont divisés en marbres, denses et poreux. Considérant que la pierre calcaire est l'une des options les plus économiques lors du choix d'une pierre naturelle, commander des produits fabriqués à partir de celle-ci est une excellente solution à un problème commercial.
Marbré Les roches constituent un lien intermédiaire entre le calcaire et le marbre, et sont utilisées dans la construction d'édifices et la création de sculptures.
Roches denses largement utilisé pour la fabrication de dalles de bardage (utilisées pour le revêtement extérieur et intérieur des bâtiments). Cette pierre est populaire depuis l'Antiquité ; même les anciennes pyramides égyptiennes sont recouvertes d'une épaisse couche de calcaire. Dans notre pays, il était souvent utilisé pour la construction de temples. On trouve souvent des variétés de roches durables résistantes au gel, qui ont permis aux structures anciennes de survivre jusqu'à nos jours, en conservant leur apparence presque inchangée.
Calcaires poreux avoir plusieurs types, différant les uns des autres par le degré et la nature de la granularité : oolithique, pisolite, coquillier, tuf calcaire et autres. Les roches oolithiques sont composées de petites boules contenant chacune un grain de sable, un fragment de coquille ou un autre corps étranger au centre. Les plus grosses perles sont appelées calcaire pisolite. Les coquillages sont une accumulation de petits fragments de coquillages. Certaines variétés de coquillages sont considérées comme un matériau décoratif et peuvent être facilement traitées et même polies. Les coquillages, constitués de coquilles microscopiques, sont appelés craie. Les roches poreuses sont utilisées comme matériau de construction pour la construction de murs, ainsi que pour le revêtement interne et externe des bâtiments. Les dépôts très poreux sont appelés tufs calcaires.
Composition chimique du calcaire : Chimique. la composition du calcaire pur est proche de la calcite (CaO 56%, CO2 44,0%). La composition de la partie carbonatée du calcaire comprend également de la dolomite CaMg(CO3)2, FeCO3 et MnCO3 (moins de 1%), des impuretés non carbonatées - des aluminosilicates argileux et des minéraux de silice (opale, calcédoine, quartz), en petites quantités d'oxydes, hydroxydes et sulfures de Fe , Ca3(PO4)2, CaSO4, org. dans-dans. Bal de promo. La classification des calcaires est basée sur le rapport entre la teneur en calcite et les principales impuretés, dolomie et substances argileuses, dont les quantités peuvent varier de façon continue jusqu'à une prédominance complète. Les calcaires sont généralement classés comme des roches contenant au moins 50 % de calcite.
Propriétés physiques du calcaire : Principal propriétés physiques du calcaire sont la plasticité, qui permet de donner aux produits fabriqués à partir de celui-ci n'importe quelle forme, durabilité, pureté de couleur, résistance, uniformité de structure, ainsi que des propriétés d'isolation thermique élevées. Il peut être scié, coupé et poignardé dans n'importe quelle direction, traité sur un tour ou à la main, incarnant n'importe quelle idée architecturale. Ce matériau réagit violemment aux composés acides et se dissout dans l'eau. À la suite de sa décomposition, du dioxyde de carbone se forme.
Densité 2700-2900 kg/m3,
Masse volumétrique :
Pour les coquillages - environ 800 kg/m3
Pour calcaires cristallins jusqu'à 2800 kg/m3
Résistance à la compression:
Pour coquillages 0,4 MPa
Pour calcaire cristallin et aphanitique 300 MPa
Absorption d'eau – de 0,1% à 2,1%
Porosité – de 0,5% à 35%
Dureté sur l'échelle de Mohs - environ 3
Résistance au gel des calcaires cristallins, 300-400 cycles
Caractéristiques de la formation calcaire : La grande majorité de ces roches se sont formées dans des bassins marins peu profonds (bien que certaines d’entre elles se soient également formées dans des étendues d’eau douce) et se présentent sous forme de strates et de sédiments. Selon leur origine, les calcaires sont divisés en organogènes (issus de résidus organiques), chimiogènes (résultant de la précipitation de calcite) et clastiques (produit de la destruction d'autres calcaires).
Extraction de calcaire : Production pierre calcaire naturelle Elle est réalisée de manière ouverte, à l'aide de pieds-de-biche et de marteaux spéciaux qui brisent la couche supérieure de roche, et d'excavatrices qui soulèvent des blocs de pierre. En Russie, l'extraction de cette pierre naturelle est réalisée dans les régions de Léningrad, Arkhangelsk, Vologda, Toula, Belgorod, Voronej, dans la région de Moscou, dans l'Oural, dans la région de la Volga, dans le territoire de Krasnodar, dans le Caucase du Nord, dans le Oural et dans plusieurs régions de la Sibérie orientale. Certains des plus courants sont les calcaires de l'horizon Myachkovsky (région de Riazan) et le calcaire de Vladimir.
Champ d'application du calcaire : 28 siècles avant JC, sur la rive gauche du Nil, la plus grande structure architecturale de tous les temps a été érigée - la Pyramide de Khéops, pour la construction de laquelle 2,5 millions de m3 de blocs de calcaire ont été extraits. La pyramide suscite l'admiration pour sa taille colossale, ses proportions strictes et la grande perfection du travail des anciens constructeurs. Il a une hauteur de 147 m.
En Europe, la pierre blanche (calcaire et grès) a commencé à être utilisée pour la construction d'édifices religieux et civils par les anciens Grecs et Romains, à partir des Ve-VIIe siècles avant JC (la première Acropole d'Athènes a été construite au VIe siècle avant JC). ).
Les produits en pierre de parement naturelle calcaire sont utilisés pour la construction de bâtiments et de structures et leur revêtement, utilisés dans la fabrication de plateaux, colonnes, portails de cheminée et autres éléments décoratifs, indispensables à la décoration intérieure des sols et des murs, des ouvertures de portes et fenêtres, y compris dans les pièces très humides (salles de bains, piscines). Ces produits sont utilisés en aménagement paysager pour la conception d'allées, de fontaines, de terrasses, de murs décoratifs et d'autres objets de jardin, ainsi que pour la conception de clôtures et la construction de toboggans alpins (retient la chaleur, laisse passer l'eau et l'air, normalise la composition du sol). Les coquillages et les tuiles qui en sont constituées sont utilisés pour la décoration extérieure et intérieure des locaux (appartements, restaurants, bureaux, saunas), ainsi que pour la fabrication d'éléments architecturaux décoratifs, d'habillage de cheminées et de poêles. C'est le seul matériau qui offre une radioprotection à 100 %. Le calcaire est l’une des solutions de revêtement de sol les plus durables et est idéal pour une utilisation dans les cuisines et les salles de bains car il est imperméable et ne deviendra pas glissant lorsqu’il est mouillé. Ces dernières années, l’utilisation de carreaux de pierre calcaire pour les revêtements de sol a gagné en popularité. En plus des revêtements de sol, la pierre calcaire peut également être utilisée pour de nombreuses autres surfaces. Le calcaire est couramment utilisé comme plan de travail pour les comptoirs de cuisine, les dessus de bar, les appuis de fenêtre, les revêtements extérieurs, les garnitures de murs intérieurs, l'aménagement paysager, les piscines et pour créer de superbes escaliers.