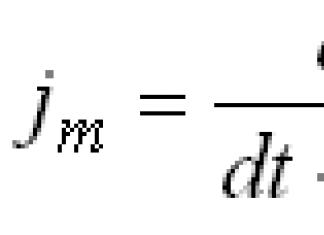L'insuline est une hormone produite par les cellules bêta des îlots de Langerhans du pancréas. Le nom insuline vient du latin insula – île. Effets de l'insuline
Bien que l’insuline ait de nombreux effets sur divers tissus du corps humain, son principal effet est de stimuler le mouvement du glucose du sang vers les cellules, ce qui entraîne une diminution des concentrations de glucose dans le sang.
D'autres effets de l'insuline stimulent la synthèse du glycogène à partir du glucose dans le foie et les muscles, augmentent la création de graisses et de protéines et suppriment l'activité des enzymes qui décomposent les graisses et les protéines. Ainsi, l’insuline a un effet anabolisant car elle favorise la formation de graisses et de protéines tout en ralentissant leur dégradation.
Le principal effet de l’insuline est d’améliorer le transport du glucose à travers la membrane cellulaire jusqu’à la cellule. Il n’existe aucune autre hormone qui abaisse la glycémie dans le corps humain. Les principaux effets de l’insuline se produisent dans les muscles et les tissus adipeux, c’est pourquoi ces tissus sont appelés insulino-dépendants. La glycémie diminue lorsqu'elle est exposée à l'insuline et augmente lorsqu'elle est exposée à ce qu'on appelle. hormones hyperglycémiques (glucagon, hormone de croissance, glucocorticoïdes).
Les effets supplémentaires de l'insuline sont une augmentation de l'intensité de la formation de glycogène, une diminution de la formation de glucose dans le foie et une augmentation de l'absorption par les cellules des acides aminés nécessaires à la synthèse des protéines. Dans le même temps, l’insuline réduit la destruction des protéines et des graisses. Ainsi, l’effet global de l’insuline est anabolisant – visant à la formation de tissu adipeux et musculaire.
La structure de l'insuline
L'insuline est une hormone polypeptidique constituée de deux chaînes d'acides aminés : les chaînes A et B. Les chaînes polypeptidiques sont reliées par des ponts disulfure. L'insuline humaine est structurellement similaire à l'insuline porcine et bovine, bien qu'elle en diffère respectivement par un et trois résidus d'acides aminés.
Découverte de l'insuline
Les îlots pancréatiques ont été découverts en 1869 par Paul Langerhans lors d'un examen microscopique de la structure du pancréas. En 1889, Oscar Malinowski en Allemagne, alors qu'il retirait le pancréas d'un chien, provoqua des symptômes de diabète sucré. En 1921, F. Banting et C. Best isolèrent l'insuline des cellules des îlots pancréatiques et D. Collip développa une méthode pour sa purification.
En 1922, l’insuline a été administrée pour la première fois à un patient diabétique. Son effet thérapeutique a montré que ce type de thérapie est le plus efficace. Au cours des années suivantes, les principaux efforts des scientifiques visèrent à organiser la production en grande quantité. En 1923, le prix Nobel fut décerné pour la découverte et l'isolement de l'insuline. Par la suite, la structure des acides aminés de l'insuline a été complètement déchiffrée par F. Sanger.
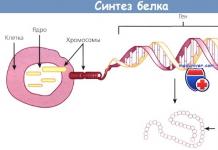
Synthèse d'insuline
Dans les cellules des îlots pancréatiques, l’insuline est synthétisée en plusieurs étapes. Lors de la première étape, la synthèse de la molécule précurseur de l’insuline, la préproinsuline, a lieu. Lors de la deuxième étape, le peptide signal est séparé de la molécule de préproinsuline, après quoi la proinsuline est formée. Après maturation, la molécule d’insuline finale se forme. Au stade de la maturation, le peptide C est séparé de la molécule de proinsuline, ce qui n'a aucun effet biologique. Après séparation du peptide C, la forme active de l'insuline est formée.
L'insuline est libérée dans le sang lorsque le taux de glucose dans le sang augmente. De plus, la production d’insuline est régulée de manière autonome système nerveux. L'insuline est détruite dans le foie et les reins par l'enzyme insulinase.
Préparations d'insuline
Actuellement, l'industrie pharmaceutique produit un nombre important de préparations d'insuline ayant divers effets biologiques. Il existe des insulines humaines, porcines et bovines. Selon le degré de purification, on distingue les insulines traditionnelles, monopic et monocomposantes. En fonction de la durée d'action, les insulines sont divisées en insulines à action courte et à action prolongée. Ces dernières sont divisées en insulines à action moyenne, longue et extra-longue. Il existe également des insulines ultra-courtes et des insulines à dépôt, qui sont libérées lentement par le tissu sous-cutané.
La sélection d’un schéma thérapeutique à l’insuline est une entreprise complexe et très responsable. Le succès de la compensation du diabète sucré et, par conséquent, la qualité de vie du patient dépendent du choix correct de la forme d’insuline et de son schéma posologique.
Types de diabète
Actuellement, il existe deux principaux types de diabète sucré, qui diffèrent par la cause et le mécanisme d'apparition, ainsi que par les principes de traitement.
Diabète sucré de type 1
Le diabète sucré de type 1 est une maladie du système endocrinien, caractérisée par une concentration accrue de glucose dans le sang, qui se développe en raison de processus destructeurs dans des cellules pancréatiques spécifiques qui sécrètent l'hormone insuline, entraînant un manque absolu d'insuline. dans le corps
Diabète sucré de type 2
Le diabète sucré de type 2 est l'un des types de diabète sucré - une maladie métabolique qui résulte d'une diminution de la sensibilité des cellules à l'insuline, ainsi que d'un manque relatif d'insuline dans le corps.
Diabète sucré gestationnel pendant la grossesse
Le diabète sucré gestationnel peut se développer pendant la grossesse (dans environ 4 % des cas). Elle est basée sur une diminution de la capacité à absorber le glucose
Hypoglycémie
L'hypoglycémie est un état pathologique caractérisé par une diminution de la concentration plasmatique de glucose en dessous de 2,8 mmol/l, survenant avec certains symptômes cliniques, ou en dessous de 2,2 mmol/l, indépendamment de la présence ou de l'absence de signes cliniques.
Coma avec diabète sucré
Les informations sur la complication la plus dangereuse du diabète sucré, qui nécessite des soins médicaux d'urgence, sont le coma. Les types de comas associés au diabète sucré, leurs symptômes spécifiques et les tactiques de traitement sont décrits.
Syndrome du pied diabétique
Le syndrome du pied diabétique est l'une des complications du diabète sucré, avec l'ophtalmopathie diabétique, la néphropathie, etc., qui est un état pathologique résultant de lésions du système nerveux périphérique, artériel et microvasculaire, se manifestant par des processus et des lésions purulentes-nécrotiques, ulcéreuses. aux os et aux articulations du pied
À propos du diabète
Le diabète sucré est un terme qui regroupe les maladies endocriniennes, caractéristique ce qui est un manque d’action de l’hormone insuline. Le principal symptôme du diabète sucré est le développement d'une hyperglycémie - une augmentation persistante de la concentration de glucose dans le sang.
(de lat. Insule- île) est une hormone peptidique produite dans les cellules bêta des îlots de Langerhans du pancréas. Affecte de nombreux aspects du métabolisme dans presque tous les tissus. Le principal effet de l’insuline est de réduire la concentration de glucose dans le sang.
L'insuline augmente la perméabilité des membranes plasmiques au glucose, active enzymes clés la glycolyse, stimule la conversion du glucose en glycogène dans le foie et les muscles, améliore la synthèse des graisses et des protéines. De plus, l'insuline inhibe l'activité des enzymes qui décomposent le glycogène et les graisses. Autrement dit, en plus de son effet anabolisant, l’insuline a également un effet anti-catabolique.
L’altération de la sécrétion d’insuline due à la destruction des cellules bêta – un déficit absolu en insuline – est un élément clé dans la pathogenèse du diabète de type 1. L’action altérée de l’insuline sur les tissus – déficit relatif en insuline – joue un rôle important dans le développement du diabète sucré de type 2.
La structure de la molécule d'insuline
L'insuline est une petite protéine d'un poids moléculaire de 5,8 kDa. Il se compose de deux chaînes polypeptidiques : A (21 acides aminés) et B (30 acides aminés). La molécule d'insuline contient trois liaisons disulfure : deux d'entre elles relient les chaînes A et B, et la troisième est située à l'intérieur de la chaîne A. L'insuline bovine a la structure primaire suivante :
La structure de l'insuline est restée presque inchangée au cours de l'évolution des vertébrés supérieurs ; en particulier, la position des liaisons disulfure, des acides aminés et de la région carboxy-terminale de la chaîne A, ainsi que des acides aminés hydrophobes près de l'extrémité C-terminale de la chaîne B. -chain sont variables. L'insuline humaine diffère de l'insuline bovine par deux substitutions d'acides aminés dans la chaîne A : en 8ème position, la thréonine au lieu de l'alanine, et en 10ème position, l'isoleucine au lieu de la valine. L'hormone porcine est encore plus proche de l'hormone humaine ; elle n'en diffère que par un seul acide aminé : l'alanine en 30ème position de la chaîne B au lieu de la thréonine.
Dans une solution diluée, les molécules d'insuline existent à l'état monomère, chacune de ces molécules étant constituée d'un noyau hydrophobe et d'une surface principalement hydrophile, à l'exception de deux régions non polaires. Ces régions sont impliquées dans la formation de dimères et d'hexamères. Dans les solutions concentrées, telles que les préparations injectables, et les cristaux, comme à l’intérieur des vésicules sécrétoires des cellules β, six monomères d’insuline ainsi que deux atomes de zinc forment des hexamères. Ainsi, après administration sous-cutanée d’insuline, celle-ci est absorbée lentement dans le sang, car il faut plus de temps pour que les hexamères se dissocient.
Formation et sécrétion
Synthèse d'insuline dans la cellule
L'insuline est synthétisée dans les cellules β des îlots de Langerhans du pancréas. Le gène précurseur de l’insuline, la préproinsuline, est localisé chez l’homme sur le bras court du chromosome 11. Il contient 3 exons et 2 introns. D’autres animaux, comme les souris, les rats et trois espèces de poissons, possèdent deux gènes d’insuline.
La préproinsuline humaine est constituée de 110 acides aminés : 24 d'entre eux constituent la séquence leader hydrophobe N-terminale (peptide signal), suivie du point B, suivi de la séquence Arg-Arg, le peptide C de connexion (de l'anglais. Peptide de connexion- avec « peptide de connexion »), la séquence Lys-Arg, et la chaîne A en C-terminale. La séquence leader est nécessaire au transport co-traductionnel de la préproinsuline dans la lumière du réticulum endoplasmique rugueux. Après avoir traversé la membrane, la séquence leader est coupée par une signal peptidase spéciale et se dégrade rapidement. La proinsuline résultante est constituée de 86 résidus d’acides aminés et n’a pas d’activité hormonale. Dans le réticulum endoplasmique, il coagule et forme trois liaisons disulfure à l'intérieur de la molécule.
Après la formation du bon structure spatiale la proinsuline est transportée dans des vésicules de transport vers cis-côtés du complexe de Golgi. Pendant le mouvement, la prohormone de cis- avant transe-Golgi est trié dans le compartiment des granules sécrétoires. Ici, dans les granules immatures, la proinsuline est soumise à d'autres modifications, à savoir une protéolyse limitée, qui commence par l'action de deux prohormones convertases (PC2 et PC3). Ces enzymes agissent spécifiquement du côté carboxykine d’une séquence de deux acides aminés chargés positivement. Il existe deux sites de ce type dans la molécule de proinsuline : Arg31-Arg32 (site d'action de PC2) et entre Lys64-Arg65 (site d'action de PC3), où les liaisons peptidiques sont rompues. Immédiatement après les prohormones convertases, la carboxypeptidase-H présente une activité enzymatique qui clive les acides aminés basiques des extrémités formées. Les produits finaux de la protéolyse sont une molécule d’insuline et un peptide C long de 31 acides aminés. Comparé aux chaînes A et B de l'insuline, le peptide C est beaucoup plus variable chez les vertébrés, sa longueur varie de 28 (chez les vaches) à 38 chez les représentants de la famille des baudroies.
Les vésicules sécrétoires des cellules β matures contiennent de l'insuline cristalline sous forme d'hexamères avec des atomes de zinc et des quantités équimolaires de peptide C. Ils constituent un pool hormonal destiné à l'exocytose en réponse à un stimulus. La demi-vie des granules β est de plusieurs jours, et s'ils ne sécrètent pas leur contenu, ils sont sujets à dégradation par fusion avec les lysosomes. Avec un besoin accru d’insuline dans l’organisme, la dégradation se produit plus lentement.
La régulation de la synthèse de l'insuline s'effectue à plusieurs niveaux, notamment au niveau de la transcription, de l'épissage pré-ARNm, de la dégradation de l'ARNm, de la traduction et de la modification post-traductionnelle. Le stimulateur le plus puissant de ces processus est le glucose, mais la biosynthèse de la proinsuline peut également être incluse dans d'autres sucres, des acides aminés, notamment la leucine, des produits intermédiaires de la glycolyse, des corps cétoniques, de l'hormone de croissance, du glucagon et de certains autres facteurs.
Sécrétion d'insuline
Les cellules bêta pancréatiques, comme les cellules endocriniennes typiques, sécrètent la majorité (95 %) de leur principal produit, l'insuline, de manière régulée. L’activateur le plus important de cette voie est le glucose. Les membranes des cellules bêta contiennent en permanence les transporteurs de glucose GLUT2, à travers lesquels il peut diffuser librement. De ce fait, une augmentation de la concentration de glucose dans le sang entraîne une augmentation similaire de son niveau dans les cellules bêta. Ici, il devient immédiatement un substrat pour la réaction hexokinase, dont le produit est le glucose-6-phosphate. Dans les cellules synthétisant l'insuline du pancréas, l'une des isoenzymes hexokinase est exprimée - l'hexokinase IV ou glucokinase ; elle se caractérise par une faible affinité pour le substrat : la constante de Michaelis est de 10 mm, ce qui dépasse la glycémie normale (4- 5mm). Grâce à cela, la glucokinase peut fonctionner comme un « capteur de glucose », étant activée uniquement dans des conditions d'hyperglycémie.
Le glucose-6-phosphate entre dans des réactions de glycolyse, dont les produits sont ensuite oxydés dans les mitochondries, entraînant la formation d'une grande quantité d'ATP dans la cellule. Une augmentation de la concentration d’ATP entraîne la fermeture des canaux potassiques dépendants de l’ATP. Canaux K+ dépendants de l'ATP, KATP) dans le plasmalemme. En raison d'une diminution de l'écoulement de potassium de la cellule, la membrane est dépolarisée, ce qui conduit à l'ouverture de canaux calciques voltage-dépendants et à l'afflux de calcium dans la cellule. Une augmentation initiale de la concentration d'ions Ca 2+ dans le cytosol conduit à leur libération ultérieure du réticulum endoplasmique. Le calcium provoque la fusion des granules bêta bordés de clathrine à partir du plasmalemme et la libération de leur contenu dans l'espace intercellulaire, d'où l'insuline pénètre dans le sang à travers les fenestrations des parois capillaires.
En plus de l’ATP lui-même, d’autres substances peuvent influencer l’activité des canaux potassiques dépendants de l’ATP. Ces protéines transmembranaires sont constituées de huit sous-unités : quatre identiques à Kir6.2 et quatre identiques à SUR1. Les premiers forment un tunnel hydrophile et sont responsables de la sensibilité à l'ATP, et les seconds sont des récepteurs de la sulfonylurée (eng. Récepteur de sulfonylurée) et peut inactiver le canal après s'être lié à son ligand. Ainsi, les sulfonylurées activent la synthèse de l'insuline, c'est pourquoi des hypoglycémiants oraux sont utilisés pour le diabète sucré.
En plus de la voie régulée, il existe une « voie constitutive » de sécrétion d'insuline par les cellules bêta, qui fonctionne dans certains troubles, comme l'insulinome et le diabète de type 2. Dans ce cas, une grande quantité d’hormone immature (proinsuline ou formes intermédiaires « clivées ») est libérée directement à partir des vésicules formées dans le réticulum endoplasmique.
Régulation de la sécrétion d'insuline
Les îlots de Langerhans sont à proximité innervés par des fibres nerveuses autonomes et peptidergiques. Les terminaisons cholinergiques du nerf buccal, qui fait partie du système nerveux parasympathique, stimulent la sécrétion d'insuline, tandis que les terminaisons adrénergiques du système nerveux sympathique suppriment ce processus. D'autres nerfs sécrètent le peptide intestinal vasoactif, qui stimule la sécrétion de toutes les hormones pancréatiques, et le neuropeptide Y, qui bloque la libération d'insuline.
Les hormones du pancréas affectent également la sécrétion d'insuline : le glucagon la stimule et la somatostatine la déprime. De plus, l’insuline agit de manière autocrine en activant la transcription de son propre gène et du gène de la glucokinase.
Lors de la prise alimentaire, la sécrétion d'insuline augmente non seulement sous l'influence du glucose ou des glucides, mais aussi des acides aminés, notamment la leucine et l'arginine, de certaines hormones du système digestif : la cholécystokinine, peptide insulinotrope glucose-dépendant, ainsi que d'hormones comme le glucagon, ACTH, œstrogènes et autres. De plus, la sécrétion d'insuline est renforcée par une augmentation du taux de potassium ou de calcium, libre Les acides gras dans le plasma sanguin.
Effet encreur
L'effet incrétine est le phénomène de libération de quantités d'insuline significativement plus importantes en réponse à l'ingestion orale de glucose qu'à son administration. Les hormones du tube digestif sécrétées lors des repas sont responsables de ce phénomène et favorisent la libération d'insuline stimulée par le glucose. Les hormones incrétines comprennent notamment le glucagon-like peptide-1 et le polypeptide inhibiteur gastrique, dont le premier est sécrété par les cellules L et le second par les cellules K de la partie supérieure de l'intestin grêle.
Action physiologique de l'insuline
|
Effet métabolique |
Molécule cible |
|
Absorption du glucose (muscles et tissus adipeux) |
Transporteur de glucose GLUT4 |
|
Absorption du glucose (foie) |
Glucokinase (surexpression) |
|
Synthèse du glycogène (foie et muscles) |
Glycogène synthase |
|
↓ Dégradation du glycogène (foie et muscles) |
↓ glycogène phosphorylase |
|
Glycolyse, production d'acétyl-CoA (foie et muscles) |
Complexe phosphofructokinase-1 (via PFC-2) pyruvate déshydrogénase |
|
Synthèse des acides gras (foie) |
Acétyl-COA carboxylase |
|
Synthèse des triacylgylcérols (tissu adipeux) |
Lipoprotéine lipase |
Le principal effet physiologique de l’insuline est de réduire la glycémie, mais il ne se limite pas à cela ; l’hormone affecte également le métabolisme des protéines et des lipides. L’un des principaux effets de l’insuline est qu’elle stimule une absorption accrue du glucose dans les muscles et le tissu adipeux, mais n’affecte pas ce processus dans le foie, les reins et le cerveau, dont les cellules peuvent transporter le glucose même en l’absence de stimulation hormonale. L'insuline bloque également les voies métaboliques dont le produit final est le glucose, en particulier la gluconéogenèse et la dégradation du glycogène, et stimule celles dans lesquelles elle est utilisée. La première priorité dans ce cas appartient à la satisfaction besoins énergétiques, en particulier, l'apparition d'une glycolyse, dont le produit final est le pyruvate, et l'oxydation ultérieure du pyruvate en acétyl-CoA, qui peut être utilisé dans le cycle acides tricarboxyliques. Le reste du glucose est utilisé pour reconstituer les réserves de glycogène dans le foie et les muscles. Dans le foie, l'insuline stimule également la synthèse d'acides gras avec l'acétyl-CoA ; le NADPH nécessaire à cela est produit dans voie du pentose phosphate. Les acides gras sont ensuite transportés sous forme de triglycérides vers le tissu adipeux. L’insuline affecte également indirectement le métabolisme par l’intermédiaire du cerveau. Il affecte les noyaux de l’hypothalamus d’une manière qui supprime la prise alimentaire et améliore la thermogenèse.
Dans les tissus musculaires, l’insuline stimule l’absorption des acides aminés et la synthèse des protéines. Le reste des acides aminés est converti dans le foie en pyruvate et acétyl-CoA et est utilisé pour la synthèse des graisses.
L'absorption du potassium dans les cellules est également activée par l'insuline. Par conséquent, ses préparations, associées au glucose, sont utilisées pour réduire temporairement l'hypercalcémie chez les patients souffrant d'insuffisance rénale. Le mécanisme moléculaire exact de cette action de l’insuline n’est pas clair, mais on sait qu’elle peut activer les Na+/K+-ATPases.
Les effets à long terme de l’insuline sur le corps comprennent une croissance accélérée, due à ses effets généraux anabolisants et de stockage des protéines. Par conséquent, les enfants atteints de diabète de type 1 présentent un retard de croissance. L'insuline peut stimuler la croissance chez les rats hypophysectomisés immatures avec presque la même intensité que l'hormone de croissance, à condition qu'ils consomment de grandes quantités de glucides. On sait également que dans la culture cellulaire, l'insuline accélère la division cellulaire, comme les facteurs de croissance peptidiques, tels que le facteur de croissance épidermique, le facteur de croissance des fibroblastes et le facteur de croissance dérivé des plaquettes, et peut en outre renforcer leurs effets biologiques.
Maladies associées
Cependant, dans le contexte du problème considéré, il convient de noter le rôle particulier de l'insuline dans la régulation du métabolisme énergétique en général, y compris le métabolisme non seulement des glucides, mais également des graisses. Cela concerne les mécanismes de stockage et d’utilisation coordonnés des molécules combustibles dans le tissu adipeux, le foie et les muscles squelettiques. Après la digestion des aliments, une grande quantité de glucides pénètre dans l'organisme, mais leur concentration dans le sang périphérique et l'espace intercellulaire en raison de l'activation de l'excrétion d'insuline n'atteint pas des valeurs critiques. Cette hormone stimule le flux de glucose vers les organes et tissus insulino-dépendants et supprime en même temps la formation de glucose endogène en raison de la suppression de la gluconéogenèse et de la glycogénolyse. En parallèle, l'insuline stimule la synthèse du glycogène. L’insuline a également un effet similaire sur le métabolisme des graisses. Cela se manifeste par une stimulation de l'accumulation de graisse dans le tissu adipeux et une inhibition de la mobilisation des graisses du dépôt suite à l'activation de la lipoprotéine lipase par l'insuline, aide à nettoyer le sang des triglycérides et inhibe l'activité de la lipase hormono-sensible. Parallèlement, l'insuline stimule l'entrée du glucose dans les lipocytes et stimule la synthèse des triglycérides intracellulaires, c'est-à-dire active la lipogenèse. À cet égard, le tissu adipeux remplit une sorte de fonction tampon, assurant la normalisation de la concentration de graisses dans le plasma, notamment pendant la période postprandiale. En état de repos ou de faim de courte durée, la concentration d'insuline dans le sang diminue, le niveau d'hormones contrainsulaires augmente et la fonction du système nerveux sympathique est stimulée, ce qui conduit à la mobilisation du glucose hépatique et à l'activation de la lipolyse. avec libération de FFA non estérifiés des adipocytes dans la circulation sanguine. Dans ces conditions, le glucose est principalement utilisé par les tissus insulino-indépendants tels que le système nerveux et les globules rouges, tandis que les muscles squelettiques obtiennent également de l’énergie grâce à l’oxydation des acides gras. Lors d'un état de faim prolongé, le foie convertit également les acides gras en corps cétoniques et l'acétyl-CoA en glucose. Des changements similaires se produisent lors de l'activité physique du corps, mais avec une augmentation du flux de glucose vers les muscles. Ainsi, l’accumulation et la consommation de graisse sont un processus dynamique qui se produit différemment selon l’état du corps et ses besoins énergétiques. Il convient également de noter que l’insuline n’est pas la seule hormone qui régule le métabolisme énergétique. Il existe un certain nombre d'hormones contre-insulaires (glucagon, adrénaline, hormone de croissance et glucocorticoïdes), dont l'activité vise à augmenter la concentration de glucose dans la circulation. Un autre antagoniste de l'insuline est le système nerveux sympathique, dont la stimulation conduit à la libération de FIV par les cellules adipeuses. La présence d'un mécanisme de régulation aussi complexe prévoit la possibilité de dommages ou d'une diminution de la sensibilité des tissus aux facteurs de régulation dans les processus d'accumulation et d'utilisation. ressources énergétiquesà différents niveaux.
Utilisation de l'insuline comme médicament
Découverte de la fonction endocrinienne du pancréas
En 1869 à Berlin, Langerhans, étudiant en médecine de 22 ans, utilisant un nouveau microscope pour examiner la structure du pancréas, a attiré l'attention sur des groupes de cellules jusqu'alors inconnus, répartis uniformément dans ses tissus. Il n'a fait aucune hypothèse quant à leur objectif. Ce n'est qu'en 1893 qu'Eduard Lages découvrit qu'ils étaient responsables de la fonction endocrinienne du pancréas et les nomma « îlots de Langerhans » en l'honneur du découvreur.
En 1889, Oskar Minkowski et Joseph von Mehring étudièrent les fonctions de la glande pancréatique. Ils ont pratiqué une pancréatomie sur un chien en bonne santé et, quelques jours plus tard, l'animal a commencé à présenter des symptômes de diabète, notamment une soif accrue, une production accrue d'urine riche en sucre, une consommation alimentaire excessive et une perte de poids. Après un certain temps, les chercheurs ont réussi à « guérir » le chien en transplantant du tissu pancréatique sous la peau.
La prochaine étape importante fut franchie en 1901, Eugène Opie (Eugène Opie) a clairement montré que "Le diabète sucré est causé par la destruction des îlots pancréatiques et ne survient que lorsque ces petits corps sont partiellement ou complètement détruits." Le lien entre le diabète sucré et le pancréas était connu auparavant, mais jusqu'alors il n'était pas clair que le diabète était spécifiquement associé aux îlots de Langerhans. Ceci, ainsi que de nombreuses autres études sur les pathologies pancréatiques, ont conduit des scientifiques tels que Jean de Meyer (1909) et Edward Charpy-Schafer (1916) à la conclusion que les îlots de Langenhars doivent produire une substance ayant un effet hypoglycémiant. Meyer l'appelait insuline du lat. Insule- île.
Premières tentatives pour isoler l’insuline
Au cours des deux décennies suivantes, plusieurs tentatives ont été faites pour isoler les sécrétions des îlots comme remède potentiel. En 1907, Georg Sulzer (Georg Ludwig Zülzer) a obtenu un certain succès en réduisant la glycémie chez des chiens expérimentaux avec un extrait pancréatique et a même réussi à sauver un patient dans le coma diabétique. Cependant, son médicament a eu de graves effets secondaires, probablement dus à une mauvaise purification, ce qui a conduit à son abandon.
Ernest Scott, entre 1911 et 1912 à l'Université de Chicago, utilisa un extrait aqueux du pancréas et nota « une certaine amélioration de la glycosurie », mais il ne parvint pas à convaincre son superviseur de l'importance de ces études, et les expériences furent bientôt abandonnées. . Le même effet a été démontré par Israel Kleiner à l’Université Rockefeller en 1919, mais son travail a été interrompu par le déclenchement de la Première Guerre mondiale et il n’a pas pu le terminer. Travail similaire après des expériences en France, Nicolas Paulesco, professeur de physiologie à l'École roumaine de médecine, l'a publié en 1921, et beaucoup, notamment en Roumanie, le considèrent comme le découvreur de l'insuline.
Le travail de Bunting et Best
La plupart des extraits de pancréas réalisés par divers chercheurs avant 1921 présentaient le même problème : ils contenaient de nombreuses impuretés, notamment des produits de la partie exocrine de la glande, et provoquaient des abcès chez les patients. Pour la première fois, un groupe de scientifiques de l'Université de Toronto a réussi à l'isoler et à le purifier à un niveau approprié pour une utilisation en thérapie humaine en 1921.
Frederick Banting, après la fin de la Première Guerre mondiale, a travaillé comme chirurgien orthopédiste et a enseigné à l'Université Western Ontario. L'un des sujets de ces conférences était le métabolisme des glucides. Tout en se familiarisant avec le sujet, Banting a lu les travaux du Dr Moses Barron, dans lesquels il décrivait la mort de la partie exocrine du pancréas dans les cas où son canal était obstrué par des calculs. Cela lui a donné l'idée d'une nouvelle méthode pour isoler les sécrétions endocriniennes du pancréas ; Banting écrit dans ses notes :
Avec son idée, Banting s'est tourné vers John McLeod, professeur à l'Université de Toronto et chercheur de renommée internationale dans le domaine du métabolisme des glucides. McLeod était conscient des difficultés rencontrées par les chercheurs précédents en essayant d'isoler un extrait pancréatique médicinal, mais il pensait que même un résultat négatif des travaux de Banting serait utile, et a donc accepté de lui fournir un espace de laboratoire, des chiens expérimentaux et un assistant. Deux étudiants en physiologie, Charles Best et Clark Noble, ont postulé pour le poste d'assistant. Pour décider lequel d’entre eux aiderait Bunting, ils ont lancé une pièce de monnaie. Même si l'on croyait largement que Best avait gagné, sa connaissance Robert WALL a insisté sur le fait qu'il avait perdu parce qu'aucun des étudiants ne voulait travailler avec le mélancolique et irritable Bunting.
À l'été 1921, Banting et Best commencèrent leurs expériences et, peu de temps après, le pancréas s'atrophia. L'extrait a été obtenu de la manière suivante : le tissu a été coupé en morceaux, broyé dans un mortier et la solution a été filtrée, puis administrée à des chiens diabétiques. Bien qu'ils aient réussi à réduire le taux de glucose dans le sang des animaux, Banting et Best ont rencontré le même problème que leurs prédécesseurs : un abcès stérile développé au site d'injection et une intoxication générale. À la fin de l’été et à l’automne 1921, ils découvrirent qu’un extrait de pancréas atrophié de chiens n’avait aucun avantage sur un extrait de glandes fœtales de veaux d’abattoir. C’est ainsi qu’ils ont commencé à utiliser ce tissu, beaucoup plus facile à obtenir.
À la fin de 1921, McLeod invita le biochimiste James Collip à rejoindre le groupe de Banting et Best et à travailler sur de nouvelles méthodes de purification de l'extrait. Collipom a accepté et a également montré par la suite que l'extrait pancréatique stimule le dépôt de glycogène dans le foie, réduit l'acidocétose chez les animaux diabétiques et réduit la glycémie chez les animaux en bonne santé. Il a ensuite utilisé des lapins normaux plutôt que des chiens pancréatiques pour tester le médicament. En novembre 1921, Banting et MacLeod assistèrent à une réunion de l'American Physiological Society, où ils présentèrent leurs résultats.
Le 11 janvier 1922, Banting et Best testèrent pour la première fois l'un des extraits actifs du pancréas de veau, qu'ils appelèrent « aylétine » des Anglais. Île- île, sur le patient - Leonardi Thompson, 14 ans. On lui a injecté 7,5 ml du médicament dans chaque muscle fessier et on a obtenu le résultat escompté : le taux de glucose dans le sang a diminué, mais un abcès et un empoisonnement général se sont développés. Quelques semaines après cet échec, Collipom rapporta à Banting qu'il avait finalement réussi à obtenir un extrait non toxique, mais hésitait à révéler les détails du procédé (sans doute dans l'espoir d'un futur brevet), ce qui faillit conduire à une bagarre entre les chercheurs.
Collip McLeod a donné au nouvel extrait le nom « insuline » (sans probablement savoir que le même nom a été utilisé par Meyer 1909). Il a été testé le 23 janvier sur le même patient. Cette fois, le traitement a réussi : la glycémie de Thompson est passée de 520 à 120 mg/dL et aucun symptôme n'a été observé. Effets secondaires. Mais il s’est avéré plus tard que Collipom avait oublié le protocole de préparation de l’insuline. Au cours des semaines suivantes, avec l'aide d'Eli Lilly, il tente de redécouvrir la méthode, ce qu'il réussit finalement.
Parmi les premiers patients traités par Banting et Best se trouvait Elizabeth Hughes, fille du secrétaire d'État Charles Hughes. Elle a décrit le changement dans son état de santé après l’injection d’insuline comme étant « incroyablement merveilleux ». Les diabétologues célèbres de l’époque, Elliot Joslin et Frederick Allen, ont également été étonnés par la puissance du nouveau médicament. Décrivant ses impressions, Joslin a comparé l'action de l'insuline à une scène de la Bible Eze. 37 : 1-10 :
| La main du Seigneur était sur moi, et le Seigneur m'a fait sortir en esprit et m'a placé au milieu d'un champ, et c'était plein d'os... ils étaient très secs. Et il m'a dit : " Fils de l’homme ! » Ces os prendront-ils vie ? J'ai dit : Seigneur Dieu ! Tu sais Et m'a dit : prophétise sur les os, et dis-leur : les os sont secs ! Écoutez la parole du Seigneur... Prophétie comme commandé. Et le bruit cessa lorsque je l'avais prédit, et voici, il y eut un rugissement, des os se rassemblant, os contre os. Et je vis, et voici, ils vivaient d'eux, et la chair grandissait, et la peau s'étendait sur eux d'en haut, mais il n'y avait pas d'esprit en eux. Et il me dit : Prophétise à l'esprit, fils de l'homme, et dis à l'esprit : Ainsi parle le Seigneur Dieu : Viens, ô esprit, des quatre vents, et souffle sur ces tués, et ils vivront. Et moi ils ont prophétisé comme Il me l'a ordonné, et ils sont entrés dans leur esprit, et ils ont repris vie, et se sont tenus debout, très, très grands... |
Pour la découverte révolutionnaire de l'insuline, McLeod et Banting ont reçu prix Nobel en physiologie et en médecine. Bunting était d'abord très indigné que son assistant Best n'ait pas été nominé pour le prix avec lui, et au début il a même ostensiblement refusé le prix, mais il a néanmoins accepté d'accepter le prix et a solennellement partagé sa part avec Best. MacLeod a fait de même, partageant son prix selon Collip. Le brevet pour la production d'insuline pour veaux a été obtenu par Best et Collip, en tant que membres non médicaux du groupe, car la participation des médecins aux affaires commerciales était considérée comme contraire à l'éthique. Ils ont cédé le brevet à l'Université de Toronto, qui l'a concédé sous licence à de nombreuses sociétés médicales à travers le monde. En particulier, aux États-Unis, la société pharmaceutique Eli Lilly a reçu le droit de produire de l'insuline et en Europe, la société fondée au Danemark, August Krogh, est devenue le plus grand fabricant.
Etude de la structure de l'insuline
L'insuline a été la première molécule protéique dont la séquence d'acides aminés, c'est-à-dire la structure primaire, a été complètement établie. Ces travaux ont été réalisés en 1953 par le biologiste moléculaire britannique Sanger, pour lesquels il a reçu le prix Nobel de chimie en 1958. Et près de 40 ans plus tard, Dorothy Crowfoot Hodgkin, en utilisant la méthode de diffraction des rayons X, a déterminé la structure spatiale (structure tertiaire) de la molécule d'insuline. Son travail a également reçu le prix Nobel.
Depuis les années 1980, l'insuline humaine a été génétiquement modifiée à partir de cellules d'E. coli ou de levure de bière.
La synthèse naturelle de l'insuline et la biochimie de sa production dans l'organisme se produisent à chaque repas. L'hormone polypeptidique insuline est produite dans le pancréas et participe activement à l'absorption des nutriments et à la synthèse des protéines et des acides gras. Les glucides contenus dans les aliments sont transformés en glucose, principale source d'énergie.
L'insuline favorise l'absorption du glucose et d'autres sucres du plasma sanguin dans les tissus musculaires. L'excédent est transformé en tissu adipeux. L'insuline présente dans le foie aide à convertir les acides gras du sang en amas graisseux et nourrit activement les tissus adipeux existants.
La biochimie de l'insuline est bien étudiée, il ne reste presque plus de taches blanches. Plusieurs prix Nobel ont déjà été reçus pour des recherches dans le domaine de la structure et de la structure de l'insuline et de la biochimie. Il s’agit de la première hormone synthétisée artificiellement et obtenue sous forme cristalline.
L'insuline artificielle est produite à l'échelle industrielle, des systèmes et des dispositifs pratiques de contrôle de la glycémie sont en cours de développement pour assurer l'introduction la plus indolore de l'hormone dans le corps.
La biochimie de l'insuline consiste à améliorer et à accélérer la pénétration du glucose à travers les membranes cellulaires. Une stimulation supplémentaire de l'insuline accélère le transport du glucose des dizaines de fois.

Le mécanisme d’action de l’insuline et la biochimie du processus sont les suivants :
- Après l'administration d'insuline, le nombre de substances spéciales augmente. protéines de transport dans les membranes cellulaires. Cela vous permet d'éliminer le glucose du sang le plus rapidement possible et avec un minimum de pertes d'énergie et de transformer l'excès en cellules adipeuses. En cas de déficit dans la production d'insuline par l'organisme, une stimulation supplémentaire par l'insuline est nécessaire pour maintenir la quantité requise de protéines de transport.
- L'insuline augmente l'activité des enzymes impliquées dans la synthèse du glycogène grâce à une chaîne complexe d'interactions et inhibe les processus de sa dégradation.
La biochimie de l'insuline n'inclut pas seulement sa participation au métabolisme du glucose. L'insuline participe activement au métabolisme des graisses, des acides aminés et à la synthèse des protéines. L'insuline a également un effet positif sur les processus de transcription et de réplication des gènes. Dans le cœur et les muscles squelettiques humains, l’insuline sert à transcrire plus de 100 gènes
Dans le foie et directement dans les tissus adipeux, l'insuline ralentit le mécanisme de dégradation des graisses, ce qui entraîne une diminution de la concentration d'acides gras directement dans le sang. Ainsi, le risque de dépôts de cholestérol dans les vaisseaux sanguins est réduit et la capacité des parois vasculaires est restaurée.
La synthèse des graisses dans le foie sous l'influence de l'insuline est stimulée par les enzymes acétylCoA carboxylase et lipoprotéine lipase. De cette façon, le sang est purifié et les graisses sont éliminées du flux sanguin général.
La participation au métabolisme lipidique comprend les points clés suivants :
- La synthèse des acides gras est améliorée par l'activation de l'acétyl-CoA carboxylase ;
- L'activité de la lipase tissulaire diminue, le processus de lipolyse est inhibé ;
- La formation de corps cétoniques est inhibée puisque toute l’énergie est redirigée vers la synthèse des lipides.
L'hormone sous forme de préproinsuline est synthétisée dans les cellules bêta spéciales des îlots de Langerhanz, situés dans le pancréas. Le volume total des îlots représente environ 2 % de la masse totale de la glande. Lorsque l'activité des îlots diminue, un déficit en hormones synthétisées, une hyperglycémie et le développement de maladies endocriniennes se produisent.
Après le clivage des chaînes de signal spéciales de la préproinsuline, il se forme de la proinsuline, constituée de chaînes A et B avec un peptide C de connexion. Au fur et à mesure que l'hormone mûrit, les protéinases capturent la chaîne peptidique, qui est remplacée par deux ponts disulfure. La maturation se produit dans l'appareil de Golgi et dans le granule sécrétoire des cellules bêta.
L'hormone mature contient 21 acides aminés dans la chaîne A et 30 acides aminés dans la deuxième chaîne. La synthèse prend en moyenne environ une heure, comme pour la plupart des hormones à action immédiate. La molécule est stable ; les acides aminés de substitution se trouvent dans des parties insignifiantes de la chaîne polypeptidique. 
Les récepteurs responsables du métabolisme de l'insuline sont des glycoprotéines situées directement sur membrane cellulaire. Après la capture et les processus métaboliques, la structure de l'insuline est détruite et le récepteur retourne à la surface cellulaire.
Le stimulus qui déclenche la libération d’insuline est une augmentation du taux de glucose. En l'absence d'une protéine transporteuse spéciale dans le plasma sanguin, la demi-vie peut aller jusqu'à 5 minutes. Besoin de protéine supplémentaire il n'y a pas de transport, puisque les hormones entrent directement dans la veine pancréatique et de là dans la veine porte. Le foie est la cible principale de l’hormone. Lorsqu'elle pénètre dans le foie, jusqu'à 50 % de l'hormone est produite.
Malgré le fait que les principes d'action fondés sur des preuves - un chien atteint de diabète artificiellement induit lors de l'ablation du pancréas - ont été présentés à la fin du 19ème siècle, au niveau moléculaire, le mécanisme d'interaction continue de susciter des débats houleux et n’est pas entièrement compris. Cela s'applique à toutes les réactions avec les gènes et le métabolisme hormonal. L'insuline de porc et de veau a commencé à être utilisée pour traiter le diabète dans les années 20 du 20e siècle.
Quel est le danger d'un manque d'insuline dans le corps ?
En cas de manque de production naturelle d'insuline ou d'excès de glucides provenant des aliments, des conditions préalables au développement du diabète sucré, une maladie métabolique systémique, se présentent.
Les symptômes suivants deviennent des signes caractéristiques du stade initial des troubles métaboliques :

Comprendre le mécanisme d'action de l'insuline et la biochimie générale des processus de l'organisme aide à établir des schémas nutritionnels corrects et à ne pas mettre l'organisme en danger en consommant des doses accrues de glucose sous sa forme pure, par exemple comme stimulant léger, ou des doses accrues de glucose. glucides rapides.
Pourquoi une concentration élevée d’insuline est-elle dangereuse ?
Avec une nutrition accrue, une teneur accrue en glucides dans les aliments, une activité physique extrême, la production naturelle d'insuline augmente. Les médicaments à base d'insuline sont utilisés dans le sport pour augmenter la croissance musculaire, augmenter l'endurance et améliorer la tolérance à l'exercice.
Lorsque vous arrêtez de faire de l'exercice ou affaiblissez votre programme d'entraînement, les muscles deviennent rapidement flasques et des dépôts de graisse se produisent. L'équilibre hormonal est perturbé, ce qui conduit également au diabète.
Dans le diabète de type 2, la production d’insuline dans l’organisme reste faible. niveau normal, mais les cellules deviennent résistantes à ses effets. Pour obtenir un effet normal, une augmentation significative de la quantité d'hormone est nécessaire. En raison de la résistance des tissus, on observe un tableau clinique général similaire à un déficit de l'hormone, mais avec sa production excessive. 
Pourquoi, du point de vue des processus biochimiques, est-il nécessaire de maintenir la glycémie à des niveaux normaux ?
Il semblerait que l'insuline synthétisée soit capable de résoudre complètement le problème des complications du diabète, d'éliminer rapidement le glucose et de normaliser le métabolisme. Il ne sert donc à rien de contrôler les niveaux de sucre. Mais ce n'est pas vrai.
L'hyperglycémie affecte les tissus dans lesquels le glucose pénètre librement sans la participation de l'insuline. Le système nerveux, le système circulatoire, les reins et les organes de la vision en souffrent. Une augmentation des taux de glucose affecte les fonctions de base des protéines tissulaires et l'apport d'oxygène aux cellules se détériore en raison de modifications de l'hémoglobine.
La glycosylation perturbe les fonctions du collagène - la fragilité et la vulnérabilité des vaisseaux sanguins augmentent, ce qui conduit au développement de l'athérosclérose. Les complications typiques de l'hyperglycémie comprennent le gonflement du cristal oculaire, les lésions de la rétine et le développement de cataractes. Les tissus et capillaires des reins sont également touchés. En raison du risque de complications, lors du traitement du diabète sucré, il est conseillé de maintenir le taux de sucre à des niveaux normaux.
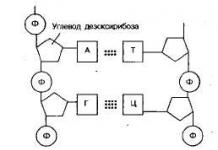
L'insuline est une protéine constituée de deux chaînes peptidiques UN(21 acides aminés) et DANS(30 acides aminés) liés par des ponts disulfure. Au total, l'insuline humaine mature contient 51 acides aminés et son poids moléculaire est de 5,7 kDa.
La synthèse
L'insuline est synthétisée dans les cellules β du pancréas sous forme de préproinsuline, à l'extrémité N de laquelle se trouve une séquence signal terminale de 23 acides aminés, qui sert de conducteur à la molécule entière dans la cavité du système endoplasmique. réticulum. Ici, la séquence terminale est immédiatement coupée et la proinsuline est transportée vers l'appareil de Golgi. A ce stade, la molécule de proinsuline contient Une chaîne, Chaîne B Et Peptide C(Anglais) de liaison- classeur). Dans l’appareil de Golgi, la proinsuline est conditionnée en granules sécrétoires avec les enzymes nécessaires à la « maturation » de l’hormone. Au fur et à mesure que les granules se déplacent vers la membrane plasmique, des ponts disulfure se forment, le peptide C de connexion (31 acides aminés) est excisé et la molécule finie est formée. insuline. Dans les granules finis, l'insuline est à l'état cristallin sous la forme d'un hexamère formé avec la participation de deux ions Zn 2+.
Régulation de la synthèse et de la sécrétion
La sécrétion d'insuline se produit de manière continue et environ 50 % de l'insuline libérée par les cellules β n'est pas liée à la prise alimentaire ou à d'autres influences. Durant la journée, le pancréas sécrète environ 1/5 de l'insuline qu'il contient.
Le principal stimulant la sécrétion d'insuline est une augmentation de la concentration de glucose dans le sang au-dessus de 5,5 mmol/l, la sécrétion atteint son maximum entre 17 et 28 mmol/l. Une caractéristique de cette stimulation est une augmentation en deux phases de la sécrétion d'insuline :
- première phase dure 5 à 10 minutes et la concentration de l'hormone peut augmenter de 10 fois, après quoi sa quantité diminue,
- seconde phase commence environ 15 minutes après le début de l'hyperglycémie et se poursuit tout au long de sa période, entraînant une augmentation des niveaux d'hormones de 15 à 25 fois.
Plus une concentration élevée de glucose reste longtemps dans le sang, plus plus grand nombre Les cellules β sont impliquées dans la sécrétion d'insuline.
Induction de la synthèse La production d'insuline se produit à partir du moment où le glucose pénètre dans la cellule jusqu'à la traduction de l'ARNm de l'insuline. Il est régulé par une transcription accrue du gène de l’insuline, une stabilité accrue de l’ARNm de l’insuline et une traduction accrue de l’ARNm de l’insuline.
Activation de la sécrétion insuline
1. Une fois que le glucose pénètre dans les cellules β (via GluT-1 et GluT-2), il est phosphorylé par l'hexokinase IV (glucokinase, a une faible affinité pour le glucose),
2. Ensuite, le glucose est oxydé en aérobie et le taux d'oxydation du glucose dépend linéairement de sa quantité,
3. En conséquence, de l'ATP est produit, dont la quantité dépend également directement de la concentration de glucose dans le sang,
4. L'accumulation d'ATP stimule la fermeture des canaux ioniques K +, ce qui conduit à une dépolarisation membranaire,
5. La dépolarisation de la membrane conduit à l'ouverture de canaux Ca 2+ dépendants de la tension et à l'afflux d'ions Ca 2+ dans la cellule,
6. Les ions Ca 2+ entrants activent la phospholipase C et déclenchent le mécanisme de transmission du signal calcium-phospholipide avec la formation de DAG et d'inositol triphosphate (IP 3),
7. L'apparition de IF 3 dans le cytosol ouvre les canaux Ca 2+ dans le réticulum endoplasmique, ce qui accélère l'accumulation d'ions Ca 2+ dans le cytosol,
8. Une forte augmentation de la concentration d'ions Ca 2+ dans la cellule entraîne le mouvement des granules sécrétoires vers la membrane plasmique, leur fusion avec elle et l'exocytose des cristaux d'insuline matures vers l'extérieur,
9. Ensuite, les cristaux se désintègrent, les ions Zn 2+ se séparent et les molécules d'insuline actives pénètrent dans la circulation sanguine.

Schéma de régulation intracellulaire de la synthèse de l'insuline avec la participation du glucose
Le mécanisme d'orientation décrit peut être ajusté dans un sens ou dans un autre sous l'influence d'un certain nombre d'autres facteurs, tels que acides aminés, acides gras, hormones Tractus gastro-intestinal et autres hormones, régulation neuronale.
Parmi les acides aminés, la sécrétion hormonale est la plus significativement affectée par lysine Et arginine. Mais à eux seuls, ils ne stimulent guère la sécrétion ; leur effet dépend de la présence d'une hyperglycémie, c'est-à-dire les acides aminés ne font que potentialiser l’effet du glucose.
Acides gras libres sont également des facteurs qui stimulent la sécrétion d'insuline, mais également uniquement en présence de glucose. Lors d’hypoglycémie, ils ont l’effet inverse, supprimant l’expression du gène de l’insuline.
La sensibilité positive de la sécrétion d'insuline à l'action des hormones est logique tube digestif – incrétines(entéroglucagon et polypeptide insulinotrope glucose-dépendant), cholécystokinine, sécrétine, gastrine, polypeptide inhibiteur gastrique.
L'augmentation de la sécrétion d'insuline en cas d'exposition prolongée est cliniquement importante et quelque peu dangereuse. hormone de croissance, ACTH Et glucocorticoïdes, œstrogène, progestatifs. Cela augmente le risque de déplétion des cellules β, de diminution de la synthèse d'insuline et de survenue d'un diabète sucré insulino-dépendant. Ceci peut être observé lorsque ces hormones sont utilisées en thérapie ou dans des pathologies associées à leur hyperfonctionnement.
La régulation neuronale des cellules β pancréatiques comprend adrénergique Et cholinergique régulation. Tout stress (stress émotionnel et/ou physique, hypoxie, hypothermie, blessure, brûlures) augmente l'activité du système nerveux sympathique et supprime la sécrétion d'insuline en raison de l'activation des récepteurs α 2 -adrénergiques. D'autre part, la stimulation des récepteurs β 2 -adrénergiques entraîne une augmentation de la sécrétion.
La sécrétion d'insuline augmente également n.vagus , à son tour sous le contrôle de l'hypothalamus, qui est sensible aux concentrations de glucose dans le sang.
Cibles
Les récepteurs d'insuline se trouvent sur presque toutes les cellules du corps, à l'exception des cellules nerveuses, mais en quantités variables. Les cellules nerveuses n'ont pas de récepteurs pour l'insuline, parce que... ce dernier ne pénètre tout simplement pas la barrière hémato-encéphalique.
La concentration la plus élevée de récepteurs est observée sur la membrane des hépatocytes (100 à 200 000 par cellule) et des adipocytes (environ 50 000 par cellule), dans les cellules Muscle squelettique possède environ 10 000 récepteurs et les globules rouges n'ont que 40 récepteurs par cellule.
Mécanisme d'action
Une fois que l’insuline se lie au récepteur, elle est activée domaine enzymatique récepteur. Puisqu'il a tyrosine kinase activité, il phosphoryle les protéines intracellulaires - substrats du récepteur de l'insuline. Les développements ultérieurs sont déterminés par deux directions : la voie de la MAP kinase et les mécanismes d'action de la phosphatidylinositol 3-kinase.
Lorsqu'il est activé phosphatidylinositol 3-kinase résultats du mécanisme effets rapides– activation de GluT-4 et entrée de glucose dans la cellule, modifications de l'activité des enzymes « métaboliques » – TAG lipase, glycogène synthase, glycogène phosphorylase, glycogène phosphorylase kinase, acétyl-SCoA carboxylase et autres.
Lors de la mise en œuvre MAP kinase mécanisme (anglais) protéine activée par un mitogène) sont réglementés effets lents– prolifération et différenciation des cellules, processus d'apoptose et d'anti-apoptose.

Deux mécanismes d'action de l'insuline
Vitesse des effets de l'insuline
Les effets biologiques de l'insuline se répartissent selon la vitesse de développement :
Effets très rapides (secondes)
Ces effets sont associés à des changements transports transmembranaires:
1. Activation de Na + /K + -ATPase, qui provoque la libération d'ions Na + et l'entrée d'ions K + dans la cellule, ce qui conduit à hyperpolarisation membranes des cellules sensibles à l'insuline (sauf les hépatocytes).
2. Activation de l'échangeur Na + /H + sur la membrane cytoplasmique de nombreuses cellules et libération d'ions H + de la cellule en échange d'ions Na +. Cet effet est important dans la pathogenèse de l'hypertension artérielle dans le diabète sucré de type 2.
3. L'inhibition de la Ca 2+ -ATPase membranaire conduit à la rétention des ions Ca 2+ dans le cytosol de la cellule.
4. Libération du transporteur de glucose GluT-4 sur la membrane des myocytes et des adipocytes et augmentation du volume de transport de glucose dans la cellule de 20 à 50 fois.
Effets rapides (minutes)
Les effets rapides incluent le changement de vitesse phosphorylation Et déphosphorylation enzymes métaboliques et protéines régulatrices.
Foie
- freinage effets de l'adrénaline et du glucagon (phosphodiestérase),
- accélération glycogénogenèse(glycogène synthase),
- Activation glycolyse
- conversion du pyruvate en acétyl-SCoA(PVC déshydrogénase),
- gagner synthèse des acides gras(acétyl-SCoA carboxylase),
- formation VLDL,
- promotion synthèse du cholestérol(HMG-SCoA réductase),
Muscles
- freinage effets de l'adrénaline (phosphodiestérase),
- GluT-4),
- stimulation glycogénogenèse(glycogène synthase),
- Activation glycolyse(phosphofructokinase, pyruvate kinase),
- conversion du pyruvate en acétyl-SCoA(PVC déshydrogénase),
- améliore le transport des neutres acides aminés dans les muscles
- stimule diffuser(synthèse des protéines ribosomales).
Tissu adipeux
- stimule le transport du glucose dans les cellules (activation Glut-4),
- active le stockage des acides gras dans les tissus ( lipoprotéine lipase),
- Activation glycolyse(phosphofructokinase, pyruvate kinase),
- gagner synthèse des acides gras(activation de l'acétyl-SCoA carboxylase),
- créer des opportunités pour ÉTIQUETTE de bas(inactivation de la lipase hormono-sensible).
Effets lents (minutes à heures)
Les effets lents consistent à modifier le taux de transcription des gènes des protéines responsables du métabolisme, de la croissance et de la division cellulaire, par exemple :
1. Induction synthèse enzymatique dans le foie
- glucokinase et pyruvate kinase (glycolyse),
- ATP citrate lyase, acétyl SCoA carboxylase, synthase d'acide gras, malate déshydrogénase cytosolique ( synthèse des acides gras),
- glucose-6-phosphate déshydrogénase ( voie du pentose phosphate),
2. Induction dans les adipocytes, la synthèse de la glycéraldéhyde phosphate déshydrogénase et de la synthase des acides gras.
3. Répression synthèse d'ARNm, par exemple pour la PEP carboxykinase (gluconéogenèse).
4. Fournit des processus émissions, augmentant la phosphorylation par la sérine de la protéine ribosomale S6.
Effets très lents (heures à jours)
Des effets très lents sont réalisés par la mitogenèse et la reproduction cellulaire. Par exemple, ces effets incluent
1. Augmentation de la synthèse de somatomédine dans le foie, dépendante de l'hormone de croissance.
2. Augmentation de la croissance et de la prolifération cellulaire en synergie avec les somatomédines.
3. Transition de la cellule de la phase G1 à la phase S du cycle cellulaire.
C'est l'ensemble des effets lents qui explique le « paradoxe » de la présence d'une résistance à l'insuline dans les adipocytes (dans le diabète sucré de type 2) et l'augmentation simultanée de la masse du tissu adipeux et du stockage des lipides dans celui-ci sous l'influence de l'hyperglycémie. et l'insuline.
Inactivation de l'insuline
L'élimination de l'insuline de la circulation se produit après sa liaison au récepteur et l'internalisation ultérieure (endocytose) du complexe hormone-récepteur, principalement dans foie Et muscles. Après absorption, le complexe est détruit et les molécules protéiques sont lysées en acides aminés libres. Le foie capte et détruit jusqu'à 50 % de l'insuline lors du premier passage du sang sortant du pancréas. DANS reins L'insuline est filtrée dans l'urine primaire et, après réabsorption dans les tubules proximaux, est détruite.
Pathologie
Hypofonction
Diabète sucré insulino-dépendant et non insulino-dépendant. Pour diagnostiquer ces pathologies, la clinique utilise activement des tests d'effort et la détermination de la concentration d'insuline et de peptide C.
L'insuline est la plus populaire
molécule du 20ème siècle
Dans l'histoire de la chimie, il y a eu des événements qui, dans leur drame, rappelaient l'assaut d'un sommet imprenable, que des groupes indépendants d'alpinistes tentent simultanément de gravir le long de différentes voies. Tout cela s'accompagne d'une atmosphère de compétition : qui grimpera en premier au sommet ?
Nous parlerons ensuite de la synthèse de l'insuline - un événement qui est devenu une réalisation notable en science chimique. Tout comme les alpinistes créent des camps de base, intermédiaires et d'assaut avant de prendre d'assaut un sommet, la synthèse de l'insuline a été bien préparée, non pas par ceux qui sont allés conquérir le sommet, mais par le travail approfondi des chercheurs précédents. Nous pouvons affirmer avec certitude que la création de la tête de pont initiale n’est pas moins impressionnante que l’assaut qui a suivi. L’insuline peut à juste titre être considérée comme la molécule la plus populaire du XXe siècle ; Les noms de sept (!) lauréats du prix Nobel sont associés à la recherche de ce composé.
Protéine qui sauve des vies
Au milieu du 20ème siècle. l’insuline a été l’une des substances les plus étudiées. La raison en est qu'il a été possible d'expliquer l'origine de l'une des maladies les plus graves - le diabète sucré. La maladie survient lorsqu’il n’y a pas suffisamment d’hormone* insuline dans l’organisme. L'insuline déclenche les processus qui assurent l'entrée du glucose (sucre) dans les cellules, et stimule également les mécanismes intracellulaires qui permettent l'absorption du glucose.
En cas de manque d'insuline, le glucose n'est pas consommé par les cellules, il s'accumule dans le sang et commence à s'écouler par les reins dans l'urine. Niveau augmenté Le glucose dans le sang et son excrétion dans l'urine entraînent une perte de poids, une miction excessive et une sensation constante de soif et de faim extrêmes. L'organisme tente de compenser le déficit calorique qu'il perd dans les urines sous forme de glucose et commence à utiliser les réserves de graisse et les protéines des tissus (musculaires principalement). De la fatigue, de la somnolence, des nausées surviennent, les processus métaboliques sont perturbés, ce qui peut conduire au coma diabétique et, s'ils ne sont pas traités, à la mort.
Le diabète sucré survient parmi la population de tous les pays et chez les représentants de toutes les races. Le plus première description cette maladie est apparue il y a environ 3000 ans dans l'Inde ancienne. Des symptômes détaillés de la maladie (miction excessive, soif excessive et perte de poids) ont été décrits au 1er siècle. ANNONCE La maladie tire son nom du grec diabète, ce qui signifie « je fuis, je passe à travers » (en référence à une miction excessive).
L'étude systématique de cette maladie a duré des siècles. Au 17ème siècle Le médecin anglais T. Willis a attiré l'attention sur le fait que l'urine des patients présentant de tels symptômes a un goût sucré (seul un vrai scientifique pourrait effectuer une telle analyse). Le tableau a commencé à devenir plus clair après les expériences du physiologiste français Claude Bernard (1813-1878), dans lesquelles il a observé des chiens dont le pancréas avait été retiré. Ses expériences furent poursuivies en 1889 par les physiologistes allemands Joseph von Mehring et Oskar Minkowski. Ils ont retiré chirurgicalement le pancréas de chiens et ont ensuite observé une forte augmentation de la concentration de glucose dans leur sang, son apparition dans les urines et d'autres signes de diabète. Ainsi, ils ont prouvé expérimentalement le lien entre le pancréas et le diabète.
Certains physiologistes ont suggéré que le pancréas produit une substance qui favorise l’absorption du glucose dans l’organisme. En 1916, le physiologiste allemand Charpy-Schafer nomme cette substance hypothétique insuline (du latin île- îlot, puisque les groupes de cellules pancréatiques clairement observés à cet endroit étaient appelés îlots de Langerhans). Ce n’était alors qu’une hypothèse, qui a ensuite été complètement confirmée.
Le 11 janvier 1922 (fait marquant dans l'histoire de la médecine mondiale), une préparation d'insuline plus pure et plus active fut administrée au premier patient, un adolescent souffrant d'une forme sévère de diabète. Après reçu effet positif Des essais similaires ont été réalisés sur plusieurs autres patients. Une nouvelle direction de la science médicale a émergé : l'hormonothérapie.
En 1923, MacLeod et Banting reçurent le prix Nobel de physiologie ou médecine « pour la découverte de l’insuline ». Best ne figurait pas sur la liste des lauréats et Banting lui remit la moitié de l'argent reçu (un geste digne d'un vrai scientifique).
En 1926, la production en série d’insuline a été mise en place. Plusieurs milliers de patients diabétiques, auparavant voués à la mort, ont été sauvés et ont pu mener une vie relativement normale grâce à une prise régulière de médicaments.
De la médecine à la chimie
Les physiologistes McLeod et Banting ont utilisé de l'extrait de pancréas animal pour traiter leurs patients. Cependant, les chimistes se sont toujours intéressés à la manière exacte dont tel ou tel composé est structuré. L'insuline sous forme cristalline a été obtenue pour la première fois en 1926 par J. Abel. C'est grâce à son travail qu'il a été possible d'établir une production industrielle du médicament. Abel a également déterminé la composition de l'insuline et il est devenu clair que cette substance est une molécule protéique. À partir de ce moment, la recherche sur l’insuline passe de la médecine au domaine de la chimie, plus précisément entre les mains des biochimistes.
 |
F. Sanger
|
Tous les travaux évoqués ci-dessus ont préparé l’étape décisive qui a permis de découvrir le fonctionnement de la molécule qui a attiré l’attention de tant de chercheurs. Le biochimiste américain Frederick Sanger a réussi à résoudre ce problème. Initialement, il a développé une méthode pour identifier les groupes aminés terminaux dans une molécule protéique en la traitant avec du dinitrofluorobenzène en milieu alcalin (plus tard cette méthode est devenue classique). Ensuite, il a littéralement démonté la molécule d'insuline entière et a déterminé la composition des acides aminés résultants en utilisant le plus méthodes modernes– l'électrophorèse, développée par A. Tiselius (Prix Nobel, 1948) et la chromatographie, améliorée par A. Martin et R. Singh (lauréats Nobel, 1952). Cependant, déterminer à partir de quels acides aminés une molécule de protéine est assemblée ne représente que la moitié de la bataille, et en plus elle est moins compliquée. L'essentiel est de connaître leur séquence dans le circuit.
Sanger a développé un plan selon lequel, à l'aide d'enzymes spécialement sélectionnées (catalyseurs biologiques), il a divisé la chaîne protéique en petits segments dans des zones prédéfinies, puis a comparé leur composition. Ce travail était une combinaison parfaite de logique et de compétences expérimentales et, en 1958, le scientifique reçut le prix Nobel « pour ses travaux sur la structure des protéines, en particulier de l'insuline ». Sanger a littéralement perfectionné sa méthode ; au fil du temps, sa technique est devenue principe généralétudes de la structure des protéines.
 |
Vincent
|
Notons au passage que Sanger, utilisant des constructions logiques, mais après avoir légèrement modifié la technique et les réactifs utilisés, il a pu établir la séquence des fragments dans la structure de la fameuse double hélice d'ADN. Pour ces études, en 1980, Sanger (avec W. Gilbert et P. Berg) reçut un autre prix Nobel « pour sa contribution à la détermination de la séquence de bases dans les acides nucléiques ». Ainsi, Sanger est le seul à deux reprises Lauréat du Prix Nobel en chimie. Personne n’aurait pu imaginer que ces études sur l’ADN ouvriraient à terme une nouvelle page dans la chimie de l’insuline, mais nous en reparlerons un peu plus tard.
 |
Dorothée
|
Le biochimiste américain Vincent Du Vigneault, qui étudiait l’insuline depuis plusieurs années, a découvert les travaux de Sanger et a décidé d’utiliser sa technique pour décrypter la structure de deux autres hormones (vasopressine et ocytocine). Cependant, il a non seulement établi la structure, mais a également synthétisé les molécules de ces hormones. En fait, il fut le premier à synthétiser des polypeptides naturels. Ce travail du scientifique a reçu le prix Nobel en 1955, c'est-à-dire il a reçu le prix trois ans avant Sanger, dont les idées l'ont aidé à obtenir un résultat aussi magnifique. Les travaux de Du Vigneault ont en effet ouvert la voie à la synthèse de l'insuline.
Pendant ce temps, l’étude de l’insuline se poursuivait. Une étude des propriétés médicinales de l'insuline a révélé que son complexe de zinc composé de plusieurs molécules, appelé Zn-insuline, a un effet thérapeutique plus long. La structure de ce complexe s'est avérée très complexe (il contient près de 800 atomes), des méthodes d'analyse physico-chimiques ont donc été utilisées. En 1972, la biophysicienne anglaise Dorothy Crowfoot-Hodgkin (lauréate du prix Nobel 1964 pour la détermination des structures de substances biologiquement actives à l'aide de rayons X) a établi la structure tridimensionnelle de ce complexe inhabituellement complexe.
Langage simplifié des biochimistes
Avant d'examiner la structure de la molécule d'insuline, familiarisons-nous avec la façon dont les biochimistes représentent les molécules de protéines.
Toutes les protéines sont des polymères dont les chaînes sont assemblées à partir de fragments d'acides aminés. Les acides aminés sont des composés organiques contenant le groupe amino NH 2 et le groupe carboxyle COOH. Seuls les acides aminés qui n'ont qu'un seul atome de carbone entre le groupe amino et le groupe carboxyle participent à la formation des protéines. En général, ils peuvent être représentés par la formule H 2 N – CH(R) – COOH. Le groupe R attaché à l'atome de carbone (celui entre les groupes amino et carboxyle) détermine la différence entre les acides aminés qui forment les protéines. Ce groupe ne peut être constitué que d'atomes de carbone et d'hydrogène, mais contient le plus souvent divers groupes fonctionnels en plus de C et H. Parmi toute la variété des acides aminés existants (théoriquement, le nombre d'acides aminés possibles est illimité), seuls une vingtaine d'acides aminés, dits « fondamentaux », participent à la formation des protéines. Pour « construire » l’insuline, la nature a utilisé 16 acides aminés (sur les vingt autorisés) (tableau 1).
Tableau 1
Acides aminés impliqués dans la création de l'insuline
| Nom | Structure | Désignation* |
| Glycine | Gli | |
| Alanine |  |
Hélas |
| Valin |  |
Arbre |
| Leucine |  |
Lei |
| Isoleucine |  |
Île |
| Sérine |  |
Ser |
| Cystéine |  |
Cis |
| Lysine |  |
Liz |
| Arginine |  |
Arg |
| Asparagine |  |
Asn |
| Acide glutamique |  |
Glu |
| Glutamine |  |
Gln |
| Phénialanine |  |
Sèche-cheveux |
| Tyrosine |  |
Champ de tir |
| Histidine |  |
Giés |
| Proline |  |
À propos |
* Dans la pratique internationale, la désignation abrégée des acides aminés répertoriés utilisant des abréviations latines à trois lettres est acceptée, par exemple glycine - Gly, alanine - Ala, etc.
Molécule de protéine se forme à la suite de la connexion séquentielle d’acides aminés, tandis que le groupe carboxyle d’un acide interagit avec le groupe amino d’une molécule voisine, entraînant la formation d’une liaison peptidique –CO – NH– et la libération d’une molécule d’eau . Dans le diagramme 1
(voir p. 6) montre une combinaison séquentielle d'alanine, de valine et de glycine.
Schéma 1

D'après les transformations présentées dans le schéma 1, il s'ensuit que pour un nombre quelconque d'acides aminés connectés, il y aura certainement un groupe amino à une extrémité de la chaîne résultante et un groupe carboxyle à l'autre. Les fragments d'acides aminés connectés sont désignés (sous accolades) par les combinaisons de lettres abrégées indiquées dans le tableau. 1. Ainsi, au lieu de formule structurelle nous pouvons utiliser un raccourci pour le tripeptide résultant : ala-val-gly. Étant donné que le nombre d'acides aminés utilisés par la nature n'est que de vingt, de telles abréviations permettent d'écrire de manière compacte la formule de n'importe quelle protéine, et aucune ambiguïté ne surgira.
La molécule d'insuline, telle qu'établie par Sanger, est constituée de 51 résidus d'acides aminés (c'est l'une des protéines à chaîne la plus courte) et se compose de deux chaînes parallèles de longueur inégale reliées entre elles. Le schéma 2 montre la séquence d'acides aminés dans la molécule d'insuline : la chaîne A contient 21 résidus d'acides aminés, la chaîne B – 30.
Schéma 2
Les résidus d'acides aminés cystéine contenus dans la molécule (en abrégé Cys) forment des ponts disulfure S-S-, qui relient les deux chaînes polymères de la molécule et forment en outre un pont à l'intérieur de la chaîne A. Avec une image aussi compacte d'une molécule de protéine, les symboles éléments chimiques utilisé uniquement pour indiquer les ponts disulfure et les groupes terminaux (NH 2 et COOH).
Schéma 3

Convenez que les biochimistes ont choisi une méthode compacte et extrêmement facile à écrire pour représenter les molécules de protéines.
Du démontage au montage
Il semblerait qu’une fois la structure d’une molécule établie, sa synthèse à nouveau ne serait pas difficile.
La principale difficulté de l’assemblage d’une molécule protéique est de s’assurer que les acides aminés nécessaires sont combinés dans un ordre strictement défini. Il faut tenir compte du fait qu'un acide aminé peut réagir non seulement avec un autre acide aminé, mais aussi avec lui-même, et le résultat peut être une molécule qui n'a rien de commun avec ce qu'un organisme vivant synthétise.
Au moment où la question de la synthèse de l’insuline a été tranchée, plusieurs méthodes appropriées avaient été développées. Pour garantir que l'acide aminé destiné à être attaché à la chaîne en croissance ne réagisse pas avec lui-même, ses extrémités réactives (le groupe aminé NH 2 et le groupe carboxyle COOH) ont été bloquées d'une manière particulière : le groupe carboxyle a été transféré vers P.-nitrophényléther, et un groupe carboxybenzyle a été ajouté au groupe amino. Une telle molécule bloquée a réagi avec le groupe amino situé à l'extrémité de la chaîne en croissance selon le schéma 4 ( cm. c. 8).
Schéma 4
En conséquence, la chaîne en croissance a été prolongée d’une unité peptidique. Cependant, un groupe carboxybenzyle bloquant se trouve désormais en fin de chaîne. Pour rendre la « queue d’amine » réactive, c’est-à-dire la convertir en forme active, ont été traités avec du bromure d'hydrogène et de l'acide acétique selon le schéma 5 ( cm. c. 8).
Schéma 5
En conséquence, le groupe amino à l’extrémité de la chaîne (représenté par un sel d’ammonium avec HBr) était à nouveau prêt à réagir avec l’acide aminé suivant (contenant naturellement également des groupes bloquants). En parallèle, d’autres méthodes d’assemblage de chaînes polypeptidiques ont été développées.
Assaut au sommet
En 1962, trois groupes de chercheurs entreprennent presque simultanément la synthèse complète de l'insuline : le groupe de P. Katsoyannis à Pittsburgh (USA), le groupe de G. Zahn à Aix-la-Chapelle (Allemagne), ainsi qu'un groupe de chimistes chinois (Shanghai et Pékin). Les trois groupes ont suivi des stratégies très similaires : ils ont assemblé des chaînes courtes et longues séparées à partir de fragments préfabriqués, puis ont connecté les deux chaînes avec des ponts disulfure.
 |
Les trois groupes de chercheurs ont assemblé la chaîne A courte à partir de deux blocs identiques.
1er bloc : gly-ile-val-glu-gln-cis-cis-tyr-ser ;
2ème bloc : ile-cis-ser-ley-tir-gln-lay-glu-asn-tir-cis-asn.
La longue chaîne B a été assemblée à partir de quatre blocs polypeptidiques, mais la longueur de ces blocs variait légèrement selon les différents groupes de scientifiques (Tableau 2).
Tableau 2
Blocs polypeptidiques pour l'assemblage de la chaîne B de l'insuline
| Recherche Groupe de télévision |
1er bloc | 2ème bloc | 3ème bloc | 4ème bloc |
| Aix-la-Chapelle | Fen-val-asn-gln- gis-lei-cis-gly |
Ser-gis-lay- val-glu-ala |
Ley-tir-lay- val-cis-glu |
Glu-arg-glu-fen-fen- stand de tir-pro-liz-stand de tir |
| Pittsburgh | Fen-val-asn-gln- gis-leu-cis-gly-ser |
Gis-ley-val-glu | Ala-ley-tir-lay- val-cis-glu |
Glu-arg-glu-fen-fen- stand de tir-pro-liz-stand de tir |
| Pékin- Shanghai |
Fen-val-asn-gln- gis-lei-cis-gly |
Ser-gis-ley-val- glu-ala-lay-tir |
Ley-val-cis-glu | Glu-arg-glu-fen-fen- stand de tir-pro-liz-stand de tir |
Les différences sont dues au fait que les méthodes de connexion par blocs et les méthodes de protection intermédiaire utilisées par chaque groupe de recherche n'étaient pas les mêmes. Naturellement, lors de la dernière étape, tous les groupes se sont retrouvés avec des chaînes identiques. Il a fallu environ un an pour créer les premiers blocs. Encouragé par l'atmosphère de compétition, le groupe d'Aix-la-Chapelle intensifie ses travaux et annonce en décembre 1963 la synthèse réussie de l'insuline. Ce groupe a littéralement arraché le championnat aux chimistes de Pittsburgh, qui ont rapporté un résultat positif en mars 1964. Le rendement final en produit pur variait de 0,02 à 0,07 %. Les chimistes chinois ont obtenu un rendement légèrement supérieur (1,2 à 2,5 %) ; Bien entendu, la production d’insuline à l’aide de telles méthodes était hors de question.
 |
Groupe de Pittsburgh de P. Katsoyannis
|
La synthèse de l’insuline a constitué une victoire convaincante pour la chimie classique des peptides synthétiques. Malgré le faible rendement du produit, tout le monde a reconnu qu'un travail remarquable avait été réalisé, qui a permis de changer la façon de penser des chimistes, de formuler de nouveaux principes d'assemblage de grosses molécules, de développer une stratégie de synthèse et de sélectionner des méthodes optimales. Tout cela a considérablement augmenté le niveau général de la chimie organique. Néanmoins, il n'y a pas eu de véritable triomphe, car presque simultanément à la réussite de ces travaux, une méthode fondamentalement différente et plus avancée d'assemblage de molécules de protéines est apparue.
L'essentiel est de sécuriser la queue
Robert Merrifield, professeur à l'Université Rockefeller (New York), alors qu'il travaillait sur la chimie des protéines, a eu une idée originale : le premier acide aminé peut être fixé à une extrémité sur une surface insoluble (support). L'acide aminé suivant doit ensuite être attaché à l'autre extrémité afin que les sous-produits indésirables et les intermédiaires n'ayant pas réagi puissent être éliminés du récipient de réaction après chaque étape, laissant le polypeptide en croissance attaché au support inchangé. Les molécules des polypeptides en croissance seront suspendues « par la queue » à la surface solide du support, et lorsque le processus de synthèse est terminé, le polypeptide final peut être séparé du support.
Merrifield a réussi à concrétiser cette idée. Le premier acide aminé est fixé sur un gel polymère insoluble (polystyrène réticulé) dans lequel sont introduits des groupes chlorométhyle CH 2 Cl, capables de réagir avec les groupes COOH de l'acide aminé. Pour éviter que l'acide aminé utilisé pour la réaction ne réagisse avec lui-même et ne joigne le groupe amino au substrat, le groupe NH 2 de cet acide est d'abord bloqué par un substituant volumineux - [(C 4 H 9) 3 ] 3 OS ( O) groupe. Après que l'acide aminé s'est fixé au support polymère, le groupe bloquant est éliminé et un autre acide aminé, qui possède également un groupe NH 2 préalablement bloqué, est introduit dans le mélange réactionnel. Dans un tel système, seule l'interaction du groupe NH 2 du premier acide aminé et du groupe COOH du deuxième acide aminé est possible, qui s'effectue en présence de catalyseurs (sels de phosphonium). Ensuite, le schéma d'addition est répété en introduisant le troisième acide aminé. L'ensemble du schéma de synthèse des chaînes polypeptidiques, qui permet d'alterner les résidus d'acides aminés dans un ordre donné, est le suivant (Schéma 6).
Schéma 6

Lors de la dernière étape, les chaînes polypeptidiques résultantes sont séparées du support polystyrène par action de HBr en présence d'acide trifluoroacétique F 3 CCOOH.
Merrifield a non seulement testé expérimentalement l'efficacité de la méthode proposée, mais a également conçu un appareil permettant d'automatiser pratiquement la synthèse peptidique. Cet appareil était un conteneur pour les acides aminés et les réactifs - un récipient de réaction avec des vannes d'entrée et de sortie automatiques et un mécanisme logiciel qui régulait la séquence des processus et la durée de chaque étape.
À l'aide de l'appareil construit, Merrifield et ses collègues ont synthétisé l'insuline en seulement 20 jours (avec un rendement de plusieurs dizaines de pour cent), tandis que les « pionniers » - les groupes d'Aix-la-Chapelle, de Pittsburgh et de Shanghai - y ont consacré plus d'un an.
En 1985, Merrifield a reçu le prix Nobel « pour le développement de la méthodologie de synthèse chimique en phase solide ».
Copier la nature
En effectuant les travaux décrits ci-dessus, les chimistes étaient hantés par l'idée que les problèmes que les scientifiques résolvent avec tant de difficulté sont résolus par la nature facilement et avec une extrême précision. La synthèse des protéines dans les organismes vivants se produit dans des conditions douces, rapidement et sans formation de sous-produits. Jusqu'à un certain point, les chimistes ne pouvaient qu'observer de telles « synthèses » avec surprise et intérêt, mais le développement rapide de la biochimie a permis d'intervenir activement dans ces processus, y compris la découverte fondamentale nouvelle façon synthèse d'insuline.
On a déjà dit que F. Sanger (qui a établi la structure de l'insuline) était capable de déterminer la séquence de fragments dans la structure de l'ADN, pour laquelle il a reçu le deuxième prix Nobel. Ces travaux ont permis aux biochimistes de passer à l'étape suivante : intégrer des fragments prédéfinis dans le code génétique de l'ADN. L’idée de base était d’inclure des gènes provenant d’organismes supérieurs dans l’ADN de certaines bactéries. En conséquence, les bactéries acquièrent la capacité de synthétiser des composés qui ne pouvaient auparavant être synthétisés que par des organismes supérieurs. Cette technologie est appelée « génie génétique ».
En 1981, le biochimiste canadien Michael Smith a été invité à devenir cofondateur scientifique de la nouvelle société de biotechnologie Zimos. L'un des premiers contrats de l'entreprise a été conclu avec la société pharmaceutique danoise Novo pour développer une technologie de production d'insuline humaine dans une culture de levure. Grâce à des efforts conjoints, l'insuline obtenue à partir de nouvelle technologie, a été mis en vente en 1982. En 1993, M. Smith (avec K. Mullis) a reçu le prix Nobel pour une série de travaux dans ce domaine. Actuellement, l’insuline produite par génie génétique a pratiquement remplacé l’insuline animale.
Quel travail est le plus important ?
 |
Ainsi, nous avons fait connaissance avec quatre méthodes de production d'insuline : l'extraction à partir du pancréas d'animaux (groupe de D. McLeod), la synthèse en plusieurs étapes (groupe de G. Tsang), l'assemblage automatisé (R. Merrifield) et le génie génétique (M. Forgeron). Laissons de côté le médical aspect du problème, concentrons-nous sur la chimie. On pourrait avoir l'impression que les travaux de Smith ont rendu inutiles toutes les recherches antérieures. En fait, ce n'est pas le cas, toutes les méthodes sont inextricablement liées, aucune étape de la recherche mentionnée ne peut être « jetée ». L'insuline isolée du pancréas des animaux a permis à Sanger de déterminer sa structure, et sans cette synthèse ultérieure aurait été impossible. Le groupe de Tsang a développé des techniques chimiques d'assemblage de chaînes et des méthodes de blocage intermédiaire de groupes fonctionnels, que Merrifield a utilisées pour créer une unité de synthèse automatique. Les travaux de Smith reposaient essentiellement sur toute l'expérience accumulée dans l'étude de l'insuline. Dans la synthèse de certaines hormones à chaîne courte, l'installation automatique de Merrifield était techniquement préférable au « génie génétique ».
En résumé, on peut dire que toutes les étapes que nous avons envisagées constituent une voie naturelle, traditionnelle et, si l'on n'a pas peur des mots solennels, la voie majestueuse de la science.
* Hormones (du grec - je mets en action, j'induit) - physiologiquement spécifiques substances actives, produit par des organes ou tissus endocriniens spéciaux, sécrétés dans le sang ou la lymphe et agissant sur la structure et les fonctions de l'organisme.
L'article a été préparé avec le soutien du site "www.limanskaya.cn". La langue chinoise est complexe et spécifique, la traduction ne doit donc être effectuée que par un spécialiste. Si vous avez un besoin urgent d'un traducteur du chinois vers le russe, ne paniquez pas. Sur le site Internet situé à l'adresse « www.Limanskaya.Сn », vous pouvez, sans quitter l'écran du moniteur, connaître l'adresse et le numéro de téléphone du traducteur, ainsi que consulter la liste des prix des services fournis.