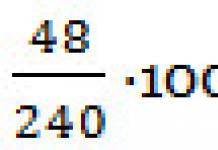Knoop a avancé l'hypothèse de la β-oxydation en 1904 Les acides gras basé sur des expériences sur l'alimentation de lapins avec divers acides gras dans lesquels un atome d'hydrogène dans le groupe méthyle terminal (au niveau de l'atome de carbone ω) a été remplacé par un radical phényle (C 6 H 5 -).
Knoop a suggéré que l'oxydation de la molécule d'acide gras dans les tissus corporels se produit en position β ; En conséquence, il y a une coupure séquentielle des fragments à deux carbones de la molécule d'acide gras du côté du groupe carboxyle.
Les acides gras, qui font partie des graisses naturelles des animaux et des plantes, appartiennent à une série comportant un nombre pair d'atomes de carbone. Tout acide de ce type, éliminant une paire d'atomes de carbone, passe finalement par l'étape de l'acide butyrique qui, après la prochaine β-oxydation, devrait donner de l'acide acétoacétique. Ce dernier est ensuite hydrolysé en deux molécules d'acide acétique.
La théorie de la β-oxydation des acides gras, proposée par Knoop, n'a pas perdu de son importance à ce jour et constitue en grande partie la base idées modernes sur le mécanisme d’oxydation des acides gras.
Idées modernes sur l'oxydation des acides gras
Il a été établi que l'oxydation des acides gras dans les cellules se produit dans les mitochondries avec la participation d'un complexe multienzymatique. On sait également que les acides gras sont initialement activés avec la participation de l'ATP et du HS-KoA ; Les esters CoA de ces acides servent de substrats à toutes les étapes ultérieures de l'oxydation enzymatique des acides gras ; Le rôle de la carnitine dans le transport des acides gras du cytoplasme vers les mitochondries a également été clarifié.
Le processus d’oxydation des acides gras comprend les étapes principales suivantes.
Activation des acides gras et leur pénétration du cytoplasme vers les mitochondries. Éducation " forme active"L'acide gras (acyl-CoA) issu de la coenzyme A et de l'acide gras est un processus endergonique qui se produit grâce à l'utilisation de l'énergie ATP :
La réaction est catalysée par l'acyl-CoA synthétase. Il existe plusieurs de ces enzymes : l'une d'elles catalyse l'activation des acides gras contenant de 2 à 3 atomes de carbone, une autre - de 4 à 12 atomes, la troisième - de 12 atomes de carbone ou plus.
Comme déjà indiqué, l'oxydation des acides gras (acyl-CoA) se produit dans les mitochondries. DANS dernières années Il a été démontré que la capacité de l'acyl-CoA à pénétrer du cytoplasme dans les mitochondries augmente fortement en présence d'une base azotée - la carnitine (γ-triméthylamino-β-hydroxybutyrate). L'acyl-CoA, se combinant à la carnitine, avec la participation d'une enzyme cytoplasmique spécifique (carnitine acyl-CoA transférase), forme l'acylcarnitine (un ester de carnitine et d'acide gras), qui a la capacité de pénétrer dans les mitochondries :

Après que l'acylcarnitine ait traversé la membrane mitochondriale, une réaction inverse se produit - le clivage de l'acylcarnitine avec la participation de HS-CoA et de la carnitine acyl-CoA transférase mitochondriale :

Dans ce cas, la carnitine retourne dans le cytoplasme cellulaire et l'acyl-CoA subit une oxydation dans les mitochondries.
Première étape de déshydrogénation. L'acyl-CoA dans les mitochondries est principalement soumise à une déshydrogénation enzymatique ;
dans ce cas, l'acyl-CoA perd deux atomes d'hydrogène en positions α et β, se transformant en ester CoA d'un acide insaturé :

Il semble exister plusieurs acyl-CoA déshydrogénases contenant des FAD, chacune ayant une spécificité pour l'acyl-CoA d'une longueur de chaîne carbonée spécifique.
Étape d'hydratation. L'acyl-CoA insaturé (énoyl-CoA), avec la participation de l'enzyme énoyl-CoA hydratase, fixe une molécule d'eau. En conséquence, il se forme du β-hydroxyacyl-CoA :

Deuxième étape de déshydrogénation. Le β-hydroxyacyl-CoA résultant est ensuite déshydrogéné. Cette réaction est catalysée par les déshydrogénases NAD-dépendantes. La réaction se déroule selon l'équation suivante :
Dans cette réaction, la β-cétoacyl-CoA interagit avec la coenzyme A. En conséquence, la β-cétoacyl-CoA est clivée et une acyl-CoA raccourcie par deux atomes de carbone et un fragment de deux carbones sous forme d'acétyl-CoA se forment. . Cette réaction est catalysée par l'acétyl-CoA acyltransférase (ou thiolase) :

L'acétyl-CoA résultant subit une oxydation dans le cycle acides tricarboxyliques(cycle de Krebs), et l'acyl-CoA, raccourci de deux atomes de carbone, parcourt à nouveau à plusieurs reprises tout le chemin de la β-oxydation jusqu'à la formation du butyryl-CoA (composé à 4 carbones), qui à son tour est oxydé en deux molécules d'acétyle. -CoA (voir .scheme).

Par exemple, dans le cas de l'acide palmitique (C 16), 7 cycles d'oxydation sont répétés. Rappelons que lors de l'oxydation d'un acide gras contenant n atomes de carbone, il se produit n/2 - 1 cycles de β-oxydation (soit un cycle de moins que n/2, puisque l'oxydation du butyryl-CoA produit immédiatement deux molécules d'acétyle -CoA) et un total de n/2 molécules d'acétyl-CoA seront obtenues.
Par conséquent, l’équation globale de la p-oxydation de l’acide palmitique peut s’écrire comme suit :
Palmitoyl-CoA + 7 FAD + 7 NAD + 7H 2 O + 7HS-KoA --> 8 Acétyl-CoA + 7 FADH 2 + 7 NADH 2 .
Bilan énergétique. A chaque cycle de β-oxydation, 1 molécule de FADH 2 et 1 molécule de NADH 2 sont formées. Ce dernier en cours d'oxydation en chaîne respiratoire et la phosphorylation associée donnent : FADH 2 - deux molécules d'ATP et NADH 2 - trois molécules d'ATP, soit au total 5 se forment en un cycle Molécules d'ATP. Dans le cas de l'oxydation de l'acide palmitique, 7 cycles de β-oxydation (16/2 - 1 = 7) se produisent, ce qui conduit à la formation de 5X7 = 35 molécules d'ATP. Au cours du processus de β-oxydation de l'acide palmitique, des molécules d'acétyl-CoA se forment, dont chacune, brûlant dans le cycle de l'acide tricarboxylique, produit 12 molécules d'ATP, et 8 molécules produiront 12X8 = 96 molécules d'ATP.
Ainsi, au total, avec l'oxydation complète de l'acide palmitique, 35 + 96 = 131 molécules d'ATP se forment. Cependant, en tenant compte d'une molécule d'ATP dépensée au tout début pour la formation de la forme active de l'acide palmitique (palmitoyl-CoA), le rendement énergétique total pour l'oxydation complète d'une molécule d'acide palmitique dans des conditions animales sera de 131-1. = 130 molécules d'ATP (notez qu'avec l'oxydation complète d'une molécule de glucose, cela ne produit que 36 molécules d'ATP).
Il est calculé que si la variation de l'énergie libre du système (ΔG) lors de la combustion complète d'une molécule d'acide palmitique est de 9797 kJ et que la liaison phosphate terminale riche en énergie de l'ATP est caractérisée par une valeur d'environ 34,5 kJ, alors il s'avère qu'environ 45 % de l'énergie potentielle totale de l'acide palmitique lors de son oxydation dans le corps peut être utilisée pour la régénération Synthèse d'ATP, et le reste est apparemment perdu sous forme de chaleur.
Les glucides constituent l’essentiel de l’alimentation humaine et fournissent une part importante des besoins énergétiques de l’organisme. Avec une alimentation équilibrée, la quantité quotidienne de glucides est en moyenne 4 fois supérieure à la quantité de protéines et de graisses.
Le rôle des glucides dans la nutrition :
1. Les glucides font fonction énergétique. Lorsque 1 g de glucides est oxydé, 4,1 kcal d'énergie sont libérées. Le glucose, dans lequel la majeure partie des glucides est décomposée, est le principal substrat énergétique de l'organisme.
2. Activité musculaire accompagnée d'une consommation importante de glucose. Lors d'un travail physique, les glucides sont consommés en premier, et ce n'est que lorsque leurs réserves (glycogène) sont épuisées que les graisses sont incluses dans l'échange.
3. Les glucides sont essentiels au fonctionnement normal système nerveux central, dont les cellules sont très sensibles à un manque de glucose dans le sang.
4. Les glucides font fonction structurelle. Les glucides simples servent de source de formation de glycoprotéines, qui constituent la base du tissu conjonctif.
5. Les glucides sont impliqués dans le métabolisme des protéines et des graisses. Les graisses peuvent être formées à partir des glucides.
6. Les glucides d'origine végétale (cellulose, substances pectiques) stimulent la motilité intestinale et favorisent l'élimination des produits toxiques qui s'y accumulent.
Sources les glucides servent principalement les produits végétaux, notamment les produits à base de farine, les céréales, les sucreries. Dans la plupart des aliments, les glucides se présentent sous forme d'amidon et, dans une moindre mesure, sous forme de disaccharides (lait, betteraves sucrières, fruits et baies). Pour une meilleure absorption des glucides, il est nécessaire que la plupart d'entre eux pénètrent dans l'organisme sous forme d'amidon.
L'amidon est progressivement décomposé dans le tractus gastro-intestinal en glucose, qui pénètre dans le sang en petites portions, ce qui améliore son utilisation et maintient un taux de sucre dans le sang constant. Lorsque de grandes quantités de sucre sont administrées en une seule fois, la concentration de glucose dans le sang augmente fortement et il commence à être excrété dans l'urine. Les conditions les plus favorables sont considérées lorsque 64 % des glucides sont consommés sous forme d'amidon et 36 % sous forme de sucres.
Taux de consommation les glucides dépendent de l’intensité du travail. Lors d'un travail physique, les glucides sont nécessaires plus. En moyenne, pour 1 kg de poids corporel est nécessaire 4-6-8 g de glucides par jour, soit environ 4 fois plus que les protéines et les graisses.
Apport excessif de glucides peut conduire à l'obésité et à une surcharge excessive du tractus gastro-intestinal, car les aliments végétaux riches en glucides sont généralement plus volumineux, provoquent une sensation de lourdeur et nuisent à la digestibilité globale des aliments.
Manque de glucides dans les aliments est également indésirable en raison du risque de développer des conditions hypoglycémiques. En règle générale, une carence en glucides s'accompagne d'une faiblesse générale, d'une somnolence, d'une diminution de la mémoire, des performances mentales et physiques, de maux de tête, d'une diminution de la digestibilité des protéines, des vitamines, d'une acidose, etc. À cet égard, la quantité de glucides dans l'alimentation quotidienne ne doit pas être inférieur à 300 g
Les substances peu digestibles par le corps humain présentes dans la plupart des aliments végétaux sont étroitement liées au groupe des glucides - les substances pectines (glucides non digestibles) et les fibres.
Les substances pectiques sont substances gélifiantes végétales à haute capacité de sorption (absorption). Ils ont un effet bénéfique dans le traitement des maladies du système digestif, des brûlures et des ulcères, et ont également la capacité de neutraliser certaines substances toxiques (en particulier en éliminant activement les sels du corps). métaux lourds, par exemple les composés du plomb).
Il y a beaucoup de pectine dans les oranges, les pommes, les cassis et autres fruits et baies.
Cellulose(autres noms - légume grossier, ou indigeste, ou aliment, ou fibre alimentaire) est un polysaccharide qui fait partie des parois cellulaires massives des aliments végétaux. Il a une structure fibreuse plutôt grossière.
Les sources courantes de fibres alimentaires sont le son, le pain et les céréales (en particulier le sarrasin et la farine d'avoine). On en trouve de grandes quantités dans de nombreux légumes, fruits, feuilles et tiges de plantes ; il y en a surtout beaucoup dans les coques des grains et dans la peau des fruits. Lors de la mise en conserve de légumes et de fruits, les fibres alimentaires sont entièrement préservées (sauf pour les jus sans pulpe).
Sans avoir une teneur élevée en calories, la plupart des légumes et des fruits contribuent cependant, du fait de leur forte teneur en glucides non digestibles, à une sensation de satiété rapide et assez persistante : les fibres alimentaires ayant la capacité d'absorber beaucoup de liquide, elles gonflent en l'estomac, remplit une partie de son volume - et par conséquent la saturation se produit plus rapidement. Les fibres elles-mêmes ne transportent pas une seule calorie dans le corps.
L'intérêt des fibres réside dans le fait que, étant un élément assez volumineux de l'alimentation quotidienne, elles ne sont pas digérées par le corps humain. La présence d'une grande quantité de fibres réduit quelque peu la digestibilité globale des aliments. Cependant, son absence totale a un effet néfaste sur le fonctionnement du tractus gastro-intestinal.
Les fibres provoquent un péristaltisme approprié (mouvement des parois) des intestins et favorisent ainsi le mouvement des aliments dans le canal digestif et l'élimination des nutriments non digérés du corps.
La quantité requise de fibres dans les aliments est assurée par la combinaison correcte de produits d'origine animale et végétale dans l'alimentation quotidienne.
Après dégradation, les fibres, comme les autres polysaccharides, se transforment en sucres. Cependant, aucune enzyme dans le tube digestif humain ne pourrait provoquer une telle dégradation. Seule une petite partie peut être digérée sous l'influence de micro-organismes présents dans les intestins, mais la majeure partie est éliminée du corps sans modification. Grâce à cette inutilité extérieure, les fibres et les pectines sont appelées substances de ballast.
Les substances de ballast remplissent également une fonction importante dans le processus de digestion : les fibres sont fermentées par les bactéries intestinales et aident littéralement à broyer les aliments ; en irritant les terminaisons nerveuses des parois intestinales, ils augmentent le péristaltisme. Si la nourriture est pauvre en substances de lest, la motilité intestinale est perturbée. Par conséquent, pour éviter ces troubles, il est recommandé d'utiliser des aliments fourragers riches en fibres.
De plus, les fibres alimentaires ont la capacité de stimuler le métabolisme, car les fibres empêchent l'absorption des toxines présentes dans les aliments ou se forment lors de leur transformation, et servent en quelque sorte de fouet : en se déplaçant le long du tube digestif, elles emportent avec elles tout ce qui a collé aux murs et retiré du corps.
Un autre avantage des fibres alimentaires est qu'elles ont la capacité de réduire le taux de cholestérol endogène (c'est-à-dire le cholestérol qui ne nous pénètre pas avec les aliments, mais qui est produit par l'organisme lui-même dans le foie à partir des acides biliaires qui pénètrent dans le foie par les intestins). ).
Hémicellulose : comme les fibres ou la cellulose, elles font partie des parois cellulaires des produits céréaliers et on en trouve de petites quantités dans la pulpe des fruits et légumes. Il est capable de retenir l’eau et de lier les métaux.
Oxydation des acides gras (bêta-oxydation). Rôle H.S. – Ko dans ce processus. Énergie d'oxydation complète de l'acide stéorique en CO 2 c H 2 Ô . Calculez le nombre de molécules d'ATP formées lors de l'oxydation.
L'activation de l'AF se produit dans le cytoplasme et la bêta-oxydation se produit dans les mitochondries.
L'acyl-CoA ne peut pas traverser la membrane mitochondriale. Par conséquent, il existe un mécanisme spécial pour le transport des AF du cytoplasme vers la mitochondrie avec la participation de la substance « carnitine ». Dans la membrane interne des mitochondries se trouve une protéine de transport spéciale qui assure le transfert. Grâce à cela, l'acylcarnitine pénètre facilement dans la membrane mitochondriale.
Les carnitine acyltransférases cytoplasmiques et mitochondriales ont une structure différente et diffèrent également les unes des autres par leurs caractéristiques cinétiques. Le Vmax de l'acylcarnitine transférase cytoplasmique est inférieur au Vmax de l'enzyme mitochondriale, et également inférieur au Vmax des enzymes de β-oxydation. Par conséquent, l’acylcarnitine transférase cytoplasmique est une enzyme clé dans la dégradation des acides gras.
Si un acide gras pénètre dans les mitochondries, il subira nécessairement un catabolisme en acétyl-CoA.
Le « carburant » le plus compact qui satisfait les besoins énergétiques de l’organisme sont les acides gras, qui sont déterminés par les caractéristiques de leur structure chimique. Pour 1 mole, l'oxydation complète des acides gras libère plusieurs fois plus d'énergie chimique utilisable que l'oxydation des glucides ; par exemple, l'oxydation de 1 mole d'acide palmitique produit 130 moles d'ATP, tandis que l'oxydation de 1 mole de glucose produit 38 moles d'ATP. Par unité de poids, la production d'énergie diffère également de plus de deux fois (9 kcal pour 1 g de graisse contre 4 kcal pour 1 g de glucides ou de protéines). Ce rendement énergétique élevé repose sur la même raison qui fait de l’essence, du pétrole et d’autres produits pétroliers des carburants si efficaces pour générer de l’énergie thermique et mécanique, à savoir le degré élevé de réduction du carbone dans les longues chaînes alkyles. La partie principale de la molécule d’acide gras est constituée d’unités répétitives (CH2)n, c’est-à-dire une structure enrichie au maximum en hydrogène. Comme nous l'avons vu lors de la présentation précédente, l'énergie stockée lors des processus biologiques d'oxydation se forme principalement en relation avec le transfert contrôlé d'électrons des atomes d'hydrogène de la chaîne respiratoire, couplé à la phosphorylation de l'ADP en ATP. Étant donné que les acides gras sont principalement composés de carbone et d’hydrogène et contiennent donc beaucoup moins d’atomes d’oxygène que les glucides, l’oxydation des acides gras s’accompagne de l’absorption proportionnellement plus d’oxygène et, par conséquent, de la formation de plus d’ATP lors de la phosphorylation oxydative.
Il a été établi que l'oxydation des acides gras se produit le plus intensément dans le foie, les reins, les muscles squelettiques et cardiaques et dans le tissu adipeux. Dans le tissu cérébral, le taux d’oxydation des acides gras est très faible, car La principale source d’énergie du tissu cérébral est le glucose.
La β-oxydation est une voie spécifique du catabolisme des acides gras, dans laquelle 2 atomes de carbone sont séquentiellement séparés de l'extrémité carboxyle d'un acide gras sous forme d'acétyl-CoA. La voie métabolique - β-oxydation - est ainsi nommée parce que les réactions d'oxydation des acides gras se produisent au niveau de l'atome de carbone β. Les réactions de β-oxydation et d'oxydation ultérieure de l'acétyl-CoA dans le cycle du TCA constituent l'une des principales sources d'énergie pour la synthèse de l'ATP via le mécanisme de phosphorylation oxydative. La β-oxydation des acides gras ne se produit que dans des conditions aérobies.
Activation des acides gras
Avant d'entrer dans diverses réactions, les acides gras doivent être activés, c'est-à-dire sont reliés par une liaison macroergique avec la coenzyme A :
RCOOH + HSKoA + ATP → RCO ~ CoA + AMP + PPi.
La réaction est catalysée par l'enzyme acyl-CoA synthétase. Le pyrophosphate libéré lors de la réaction est hydrolysé par l'enzyme pyrophosphatase : H 4 P 2 O 7 + H 2 O → 2 H 3 PO 4.
La libération d'énergie lors de l'hydrolyse de la liaison à haute énergie du pyrophosphate déplace l'équilibre de la réaction vers la droite et assure l'intégralité de la réaction d'activation.
Acyl-CoA synthétase se trouvent à la fois dans le cytosol et dans la matrice mitochondriale. Ces enzymes diffèrent par leur spécificité pour les acides gras ayant différentes longueurs de chaînes hydrocarbonées. Les acides gras à chaîne courte et moyenne (de 4 à 12 atomes de carbone) peuvent pénétrer dans la matrice mitochondriale par diffusion. L'activation de ces acides gras se produit dans la matrice mitochondriale. Les acides gras à longue chaîne, prédominants dans le corps humain (12 à 20 atomes de carbone), sont activés par les acyl-CoA synthétases situées sur la membrane externe des mitochondries.
La dégradation des acides gras activés se produit conformément à l'hypothèse b - oxydation F. Knoop, proposé en 1904 b - l'oxydation se produit à l'intérieur des mitochondries
β- Oxydation des acides gras- une voie spécifique de catabolisme des acides gras, se produisant dans la matrice mitochondriale uniquement en conditions aérobies et aboutissant à la formation d'acétyl-CoA. L'hydrogène provenant des réactions de β-oxydation pénètre dans le CPE et l'acétyl-CoA est oxydé dans le cycle du citrate, qui fournit également de l'hydrogène au CPE. Par conséquent, la β-oxydation des acides gras est la voie métabolique la plus importante assurant la synthèse de l’ATP dans la chaîne respiratoire.
La β-oxydation commence par la déshydrogénation de l'acyl-CoA par l'acyl-CoA déshydrogénase dépendante du FAD, formant une double liaison entre les atomes de carbone α et β dans le produit de réaction, l'énoyl-CoA. Le coenzyme FADH 2, restauré dans cette réaction, transfère les atomes d'hydrogène du CPE au coenzyme Q. En conséquence, 2 molécules d'ATP sont synthétisées (Fig. 8-27). Dans la réaction de p-oxydation suivante, une molécule d'eau est ajoutée au site de la double liaison de sorte que le groupe OH soit situé au niveau de l'atome de carbone β de l'acyle, formant ainsi le β-hydroxyacyl-CoA. La β-hydroxyacyl-CoA est ensuite oxydée par la déshydrogénase dépendante du NAD+. Le NADH réduit, oxydé en CPE, fournit de l'énergie pour la synthèse de 3 molécules d'ATP. La β-cétoacyl-CoA résultante subit un clivage thiolytique par l'enzyme thiolase, car au site de rupture Connexions SS une molécule de coenzyme A est ajoutée via un atome de soufre. À la suite de cette séquence de 4 réactions, un résidu à deux carbones, l'acétyl-CoA, est séparé de l'acyl-CoA. Un acide gras raccourci de 2 atomes de carbone subit à nouveau les réactions de déshydrogénation, d'hydratation, de déshydrogénation et d'élimination de l'acétyl-CoA. Cette séquence de réactions est généralement appelée « cycle de β-oxydation », ce qui signifie que les mêmes réactions sont répétées avec le radical acide gras jusqu'à ce que tout l'acide soit converti en résidus acétyle.
β -Oxydation des acides gras.
Le processus de b-oxydation est cyclique. Pour chaque tour du cycle, 2 atomes de carbone sont séparés de l'acide gras sous la forme d'un résidu acétyle.
Après cela, l'acyl-CoA, raccourci de 2 atomes de carbone, subit à nouveau une oxydation (entre dans un nouveau cycle de réactions de b-oxydation). L'acétyl-CoA résultant peut entrer davantage dans le cycle de l'acide tricarboxylique. Vous devez être capable de calculer le rendement énergétique de la dégradation des acides gras. La formule présentée est vraie pour tout acide gras saturé contenant n atomes de carbone. La dégradation des acides gras insaturés produit moins d’ATP. Chaque double liaison dans un acide gras entraîne la perte de 2 molécules d'ATP. La b-oxydation se produit le plus intensément dans les tissus musculaires, les reins et le foie.À la suite de la b-oxydation du FA, de l’acétyl-CoA se forme. Le taux d'oxydation est déterminé par le taux des processus de lipolyse. L'accélération de la lipolyse est caractéristique d'un état de famine en glucides et d'un travail musculaire intense. L’accélération de la β-oxydation est observée dans de nombreux tissus, dont le foie. Le foie produit plus d’acétyl-CoA qu’il n’en a besoin. Le foie est un « organe altruiste » et c’est pourquoi il envoie du glucose vers d’autres tissus.
Le foie s’efforce d’envoyer son propre acétyl-CoA vers d’autres tissus, mais n’y parvient pas, car les membranes cellulaires sont imperméables à l’acétyl-CoA. Par conséquent, des substances spéciales appelées « corps cétoniques » sont synthétisées dans le foie à partir de l’acétyl-CoA. Les corps cétoniques sont une forme de transport spéciale de l'acétyl-CoA.
La molécule d'acide gras est décomposée en mitochondries par l'élimination progressive de fragments à deux carbones sous forme d'acétylcoenzyme A (acétyl-CoA).
C17H35COOH + 26 O2 = 18 CO2 + 18 H2O.
Lorsque l’acide stéarique est oxydé, la cellule recevra 146 molécules d’ATP.
Les triacylglycérols sont progressivement dégradés par les lipases tissulaires.
L’enzyme clé de la lipolyse est la lipase TAG hormono-dépendante. Le glycérol et les acides gras formés à ce stade de la dégradation des graisses sont oxydés dans les tissus pour produire de l'énergie.
Il existe plusieurs options pour l'oxydation des acides gras : α - oxydation, β - oxydation, ω - oxydation. Le principal mode d’oxydation des acides gras est la β-oxydation. Il se produit le plus activement dans le tissu adipeux, le foie, les reins et le muscle cardiaque.
Β - oxydation consiste en la coupure progressive de deux atomes de carbone d'un acide gras sous forme d'acétyl-CoA, libérant ainsi de l'énergie. L'apport d'acides gras est concentré dans le cytosol, où l'activation des acides gras se produit avec la formation d'acyl-CoA.


L'efficacité énergétique de la bêta-oxydation des acides gras comprend l'énergie de l'oxydation de l'acétyl-CoA dans le cycle de Krebs et l'énergie libérée dans le cycle bêta lui-même. Plus la chaîne carbonée est longue, plus l’énergie d’oxydation d’un acide gras est élevée. Le nombre de molécules d'acétyl-CoA d'un acide gras donné et le nombre de molécules d'ATP formées à partir d'elles sont déterminés par les formules :
n = N/2, où n est le nombre de molécules d'acétyl-CoA, N est le nombre d'atomes de carbone dans l'acide gras.
Nombre de molécules d'ATP dues à l'oxydation des molécules d'acétyl-CoA = (N/2)*12
Le nombre de cycles d'oxydation β est inférieur d'un au nombre de molécules d'acétyl-CoA formées, car au cours du dernier cycle, l'acide butyrique est converti en deux molécules d'acétyl-CoA en un cycle et est calculé par la formule
Nombre de β - cycles = (N/2)-1
Le nombre de molécules d'ATP dans le cycle β est calculé sur la base de l'oxydation ultérieure du NADH 2 (3 ATP) et du FADH 2 (2 ATP) qui y sont formés selon la formule
Nombre de molécules d'ATP formées dans les cycles bêta = ((N/2)-1)*5
2 liaisons macroergiques de l'ATP sont dépensées pour l'activation des acides gras
La formule récapitulative pour calculer le rendement en ATP lors de l'oxydation d'un acide gras saturé est : 17(N/2)-7.
Lorsque des acides gras avec un nombre impair d'atomes de carbone sont oxydés, du succinyl-CoA se forme, qui entre dans le cycle de Krebs.
Oxydation des acides gras insaturés dans les étapes initiales, il s'agit d'une bêta-oxydation ordinaire jusqu'au site de la double liaison. Si cette double liaison est en position bêta, alors l'oxydation de l'acide gras continue à partir de la deuxième étape (en contournant l'étape de réduction FAD → FADN 2). Si la double liaison n'est pas en position bêta, alors la liaison est déplacée vers la position bêta par les enzymes énoyltransférase. Ainsi, lors de l'oxydation des acides gras insaturés, moins d'énergie est formée selon la formule (la formation de FADH2 est perdue) :
7(N/2)-7-2m, où m est le nombre de doubles liaisons.
La condition principale de la vie de tout organisme est un approvisionnement continu en énergie, qui est dépensée pour divers processus cellulaires. Dans ce cas, une certaine partie des composés nutritionnels ne peut pas être utilisée immédiatement, mais transformée en réserves. Le rôle d'un tel réservoir est assuré par les graisses (lipides), constituées de glycérol et d'acides gras. Ces derniers sont utilisés par la pile comme combustible. Dans ce cas, les acides gras sont oxydés en CO 2 et H 2 O.
Informations de base sur les acides gras
Les acides gras sont des chaînes carbonées de longueurs variables (de 4 à 36 atomes), dont nature chimique faire référence à acides carboxyliques. Ces chaînes peuvent être ramifiées ou non et contenir différents nombres de doubles liaisons. Si ces derniers sont totalement absents, les acides gras sont dits saturés (typiques de nombreux lipides d'origine animale), et sinon, insaturés. Sur la base de la disposition des doubles liaisons, les acides gras sont divisés en monoinsaturés et polyinsaturés.
La plupart des chaînes contiennent un nombre pair d'atomes de carbone, ce qui est dû à la particularité de leur synthèse. Il existe cependant des connexions avec un nombre impair de liens. L'oxydation de ces deux types de composés est quelque peu différente.
caractéristiques générales
Le processus d’oxydation des acides gras est complexe et comporte plusieurs étapes. Cela commence par leur pénétration dans la cellule et se termine par étapes finales répéter en fait le catabolisme des glucides (cycle de Krebs, la conversion de l'énergie du gradient transmembranaire en Produits finaux processus sont l'ATP, le CO 2 et l'eau.
L'oxydation des acides gras dans les cellules eucaryotes se produit dans les mitochondries (l'emplacement le plus typique), les peroxysomes ou le réticulum endoplasmique.
Variétés (types) d'oxydation
Il existe trois types d'oxydation des acides gras : α, β et ω. Le plus souvent, ce processus se produit via le mécanisme β et est localisé dans les mitochondries. La voie oméga est une alternative mineure au mécanisme β et se produit dans le réticulum endoplasmique, tandis que le mécanisme alpha n'est caractéristique que d'un seul type d'acide gras (l'acide phytanique).
Biochimie de l'oxydation des acides gras dans les mitochondries
Pour plus de commodité, le processus de catabolisme mitochondrial est classiquement divisé en 3 étapes :
- activation et transport vers les mitochondries ;
- oxydation;
- oxydation de l'acétyl-coenzyme A résultant à travers le cycle de Krebs et la chaîne de transport électrique.
L'activation est un processus préparatoire qui convertit les acides gras en une forme disponible pour les transformations biochimiques, puisque ces molécules elles-mêmes sont inertes. De plus, sans activation, ils ne peuvent pas pénétrer dans les membranes mitochondriales. Cette étape se produit au niveau de la membrane externe des mitochondries.
En fait, l’oxydation est une étape clé du processus. Il comprend quatre étapes, à l'issue desquelles l'acide gras est transformé en molécules d'Acétyl-CoA. Le même produit se forme également lors de l’utilisation des glucides, de sorte que les étapes ultérieures sont similaires aux dernières étapes de la glycolyse aérobie. Formation d'ATP se produit dans la chaîne de transport d’électrons, où l’énergie du potentiel électrochimique est utilisée pour former une liaison à haute énergie.

Au cours du processus d'oxydation des acides gras, en plus de l'acétyl-CoA, des molécules NADH et FADH 2 se forment également, qui pénètrent également dans la chaîne respiratoire en tant que donneurs d'électrons. En conséquence, la production d’énergie totale du catabolisme des lipides est assez élevée. Ainsi, par exemple, l'oxydation de l'acide palmitique par le mécanisme β produit 106 molécules d'ATP.
Activation et transfert dans la matrice mitochondriale
Les acides gras eux-mêmes sont inertes et ne peuvent pas être oxydés. L'activation les amène sous une forme disponible pour les transformations biochimiques. De plus, ces molécules ne peuvent pas pénétrer inchangées dans les mitochondries.
L'essence de l'activation est la conversion d'un acide gras en son thioester Acyl-CoA, qui subit ensuite une oxydation. Ce processus est réalisé par des enzymes spéciales - les thiokinases (Acyl-CoA synthétases), attachées à la membrane externe des mitochondries. La réaction se déroule en 2 étapes, impliquant la dépense d'énergie de deux ATP.
Trois composants sont requis pour l'activation :
- HS-CoA;
- Mg2+.
Premièrement, l’acide gras réagit avec l’ATP pour former un acyladénylate (un intermédiaire). Celui-ci réagit à son tour avec HS-CoA, dont le groupe thiol déplace l'AMP, formant une liaison thioéther avec le groupe carboxyle. Il en résulte la formation d’une substance acyl-CoA, un dérivé d’acide gras, qui est transportée dans les mitochondries.
Transport vers les mitochondries
Cette étape est appelée transestérification avec la carnitine. Le transfert de l'acyl-CoA dans la matrice mitochondriale se produit à travers les pores avec la participation de la carnitine et d'enzymes spéciales - les carnitine acyltransférases.
Pour le transport à travers les membranes, la CoA est remplacée par la carnitine pour former l'acyl-carnitine. Cette substance est transférée dans la matrice par diffusion facilitée avec la participation du transporteur acyl-carnitine/carnitine.

À l'intérieur des mitochondries, une réaction inverse se produit, consistant en un décollement du rétinien, qui pénètre à nouveau dans la membrane, et en une restauration de l'acyl-CoA (dans ce cas, on utilise la coenzyme A « locale », et non celle avec laquelle la liaison s'est formé au stade de l'activation).
Réactions basiques de l'oxydation des acides gras par le mécanisme β
Au très type simple L'utilisation énergétique des acides gras comprend la β-oxydation des chaînes qui n'ont pas de doubles liaisons, dans lesquelles le nombre d'unités carbone est pair. Le substrat de ce processus, comme indiqué ci-dessus, est l'acyle du coenzyme A.
Le processus de β-oxydation des acides gras comprend 4 réactions :
- La déshydrogénation est l'extraction d'hydrogène de l'atome de carbone β avec formation d'une double liaison entre les unités de chaîne situées en positions α et β (premier et deuxième atomes). En conséquence, de l’énoyl-CoA se forme. L'enzyme de réaction est l'acyl-CoA déshydrogénase, qui agit en combinaison avec le coenzyme FAD (cette dernière est réduite en FADH2).
- L'hydratation est l'ajout d'une molécule d'eau à l'énoyl-CoA, entraînant la formation de L-β-hydroxyacyl-CoA. Réalisée par l'énoyl-CoA hydratase.
- La déshydrogénation est l'oxydation du produit de la réaction précédente par la déshydrogénase NAD-dépendante avec formation de β-cétoacyl coenzyme A. Dans ce cas, le NAD est réduit en NADH.
- Clivage de la β-cétoacyl-CoA en acétyl-CoA et acyl-CoA raccourcie de 2 atomes de carbone. La réaction s'effectue sous l'action de la thiolase. Une condition préalable est la présence de HS-CoA libre.
Puis tout recommence avec la première réaction.

Toutes les étapes sont répétées de manière cyclique jusqu'à ce que toute la chaîne carbonée de l'acide gras soit convertie en molécules d'acétylcoenzyme A.
Formation d'acétyl-CoA et d'ATP à l'aide de l'exemple de l'oxydation du palmitoyl-CoA
À la fin de chaque cycle, les molécules acyl-CoA, NADH et FADH2 se forment en une seule quantité, et la chaîne thioester acyl-CoA devient plus courte de deux atomes. En transférant des électrons vers la chaîne de transport électrique, FADH2 produit une molécule et demie d'ATP et NADH - deux. En conséquence, 4 molécules d'ATP sont obtenues à partir d'un cycle, sans compter la production d'énergie de l'acétyl-CoA.

La chaîne d'acide palmitique contient 16 atomes de carbone. Cela signifie qu'au stade d'oxydation, 7 cycles doivent se produire avec la formation de huit acétyl-CoA, et la production d'énergie de NADH et FADH 2 dans ce cas sera de 28 molécules d'ATP (4 × 7). L'oxydation de l'acétyl-CoA produit également de l'énergie, qui est stockée suite à l'entrée des produits du cycle de Krebs dans la chaîne de transport électrique.

Rendement total des étapes d'oxydation et du cycle de Krebs
À la suite de l'oxydation de l'acétyl-CoA, 10 molécules d'ATP sont obtenues. Puisque le catabolisme du palmitoyl-CoA produit 8 acétyl-CoA, le rendement énergétique sera de 80 ATP (10 × 8). Si l'on ajoute cela au résultat de l'oxydation du NADH et du FADH 2, on obtient 108 molécules (80+28). De cette quantité, vous devez soustraire 2 ATP, qui ont permis d'activer l'acide gras.
L'équation finale pour l'oxydation de l'acide palmitique sera : palmitoyl-CoA + 16 O 2 + 108 Pi + 80 ADP = CoA + 108 ATP + 16 CO 2 + 16 H 2 O.
Calcul de la libération d'énergie
La production d'énergie issue du catabolisme d'un acide gras particulier dépend du nombre d'unités de carbone dans sa chaîne. Le nombre de molécules d'ATP est calculé par la formule :
où 4 est la quantité d'ATP formée au cours de chaque cycle en raison du NADH et du FADH2, (n/2 - 1) est le nombre de cycles, n/2×10 est le rendement énergétique de l'oxydation de l'acétyl-CoA et 2 est le coût de l'activation.
Caractéristiques des réactions
L'oxydation présente quelques particularités. Ainsi, la difficulté d'oxyder des chaînes à doubles liaisons réside dans le fait que ces dernières ne peuvent pas être affectées par l'énoyl-CoA hydratase du fait qu'elles sont en position cis. Ce problème est éliminé par l'énoyl-CoA isomérase, qui amène la liaison à acquérir une configuration trans. En conséquence, la molécule devient totalement identique au produit de la première étape de la bêta-oxydation et peut subir une hydratation. Les sites ne contenant que des liaisons simples sont oxydés de la même manière que les acides saturés.

Parfois, il n’y a pas assez d’énoyl-CoA isomérase pour poursuivre le processus. Ceci s'applique aux chaînes dans lesquelles la configuration cis9-cis12 est présente (doubles liaisons aux 9ème et 12ème atomes de carbone). Ici, l'interférence n'est pas seulement la configuration, mais aussi la position des doubles liaisons dans la chaîne. Cette dernière est corrigée par l'enzyme 2,4-diénoyl-CoA réductase.
Catabolisme des acides gras à nombre impair d'atomes
Ce type d'acide est caractéristique de la plupart des lipides d'origine naturelle. Cela crée une certaine complexité, puisque chaque cycle implique un raccourcissement d'un nombre pair de maillons. Pour cette raison, l'oxydation cyclique des acides gras supérieurs de ce groupe se poursuit jusqu'à ce que le produit apparaisse comme un composé à 5 carbones, qui est divisé en acétyl-CoA et propionyl-coenzyme A. Les deux composés entrent dans un autre cycle de trois réactions, ce qui entraîne dans la formation de succinyl-CoA. C'est lui qui entre dans le cycle de Krebs.
Caractéristiques de l'oxydation dans les peroxysomes
Dans les peroxysomes, l’oxydation des acides gras se produit via un mécanisme bêta, similaire mais non identique au mécanisme mitochondrial. Il comprend également 4 étapes aboutissant à la formation du produit acétyl-CoA, mais présente plusieurs différences clés. Ainsi, l'hydrogène séparé lors de l'étape de déshydrogénation ne restaure pas le FAD, mais est transféré à l'oxygène avec formation de peroxyde d'hydrogène. Cette dernière est immédiatement clivée par la catalase. De ce fait, l’énergie qui aurait pu être utilisée pour synthétiser l’ATP dans la chaîne respiratoire est dissipée sous forme de chaleur.
Une deuxième différence importante est que certaines enzymes peroxysomales sont spécifiques de certains acides gras moins abondants et ne sont pas présentes dans la matrice mitochondriale.
La particularité des peroxysomes des cellules hépatiques est qu'ils sont dépourvus de l'appareil enzymatique du cycle de Krebs. Par conséquent, à la suite de la bêta-oxydation, des produits à chaîne courte se forment, qui sont transportés vers les mitochondries pour y être oxydés.
Le tissu adipeux, constitué d'adiposocytes, joue un rôle spécifique dans le métabolisme lipidique. Environ 65 % de la masse du tissu adipeux est constitué de triacylglycérols (TAG) qui y sont déposés. Ils représentent une forme de stockage d'énergie et remplissent la même fonction dans le métabolisme des graisses que le glycogène hépatique dans le métabolisme des glucides. Les graisses stockées dans le tissu adipeux servent de source d’eau endogène et de réserve d’énergie pour le corps humain. Le TAG est utilisé dans l'organisme après une dégradation préalable (lipolyse), au cours de laquelle le glycérol et les acides gras libres sont libérés.
Dans les cellules du tissu adipeux, la dégradation des TAG se produit avec la participation des lipases. La lipase est sous une forme inactive ; elle est activée par des hormones (adrénaline, noradrénaline, glucagon, thyroxine, glucocorticoïdes, hormone de croissance, ACTH) en réponse au stress, au jeûne et au refroidissement ; les produits de réaction sont le monoacylglycérol et l'IVH.
Les IVH, à l'aide d'albumines, sont transportées par le sang vers les cellules des tissus et des organes où se produit leur oxydation.
Oxydation des acides gras supérieurs.
Sources de la RDC :
Lipides du tissu adipeux
Lipoprotéines
Triacylglycérols
Phospholipides des biomembranes cellulaires
L'oxydation de la FIV se produit dans les mitochondries des cellules et est appelée bêta-oxydation. Leur acheminement vers les tissus et les organes se fait avec la participation de l'albumine et leur transport du cytoplasme vers les mitochondries avec la participation de la carnitine.
Le processus de bêta-oxydation de l’IVLC comprend les étapes suivantes :
Activation de l'IVFA sur la surface externe de la membrane mitochondriale avec la participation des ions ATP, conzyme A et magnésium avec formation de la forme active de l'IVFA (acyl-CoA).
Le transport des acides gras dans les mitochondries est possible en attachant la forme active de l'acide gras à la quarantaine située sur la surface externe de la membrane mitochondriale interne. Il se forme de l'acyl-carnitine qui a la capacité de traverser la membrane. Sur la surface interne, le complexe se désintègre et la carnitine retourne à la surface externe de la membrane.
L'oxydation intramitochondriale des acides gras consiste en des réactions enzymatiques séquentielles. À la suite d'un cycle d'oxydation terminé, une molécule d'acétyl-CoA est séparée de l'acide gras, c'est-à-dire raccourcissement de la chaîne des acides gras de deux atomes de carbone. De plus, à la suite de deux réactions de déshydrogénase, le FAD est réduit en FADH 2 et le NAD + en NADH 2.
riz. Oxydation des acides gras supérieurs
Que. complétant 1 cycle de fonctionnement - oxydation de l'IVLC, à la suite de quoi l'IVLC a été raccourcie de 2 unités de carbone. Lors de la bêta-oxydation, du 5ATP a été libéré et du 12ATP a été libéré lors de l'oxydation de l'ACETIL-COA dans le cycle du TCA et des enzymes associées de la chaîne respiratoire. L'oxydation de l'IVFA se produira cycliquement de la même manière, mais seulement jusqu'à la dernière étape - l'étape de conversion de l'acide butyrique (BUTYRYL-COA), qui a ses propres caractéristiques qui doivent être prises en compte lors du calcul de l'effet énergétique total de Oxydation IVLC, lorsqu'à la suite d'un cycle 2 molécules d'ACETYL-COA se forment, l'une d'elles a subi une bêta-oxydation avec libération de 5ATP, et l'autre non.
riz. La dernière étape d'oxydation des acides gras supérieurs
OXYDATION DES IVLC AVEC UN NOMBRE IMPAIR D'UNITES CARBONE DANS LA CHAINE
De tels IVH pénètrent dans le corps humain dans le cadre d’aliments contenant de la viande de ruminants, de plantes et d’organismes marins. L'oxydation de ces IVLC se produit de la même manière que celle des IVLC qui ont nombre pair maillons carbonés de la chaîne, mais seulement jusqu'à la dernière étape - l'étape de transformation du PROPIONYL-COA. qui a ses propres caractéristiques.

Que. Il se forme du SUCCINIL-COA, qui est ensuite oxydé dans les MITOCHONDRIES avec la participation des enzymes du cycle KREB TCA et des enzymes associées de la chaîne respiratoire.