Un mot peut exister tout seul. Par exemple, dans une entrée de dictionnaire. Cependant, lorsque vous utilisez un mot, vous devez être capable de le relier à d’autres mots.
Tous les mots d’une phrase sont liés les uns aux autres par leur sens et leur grammaire. Une telle connexion est créée par les conjonctions, l'ordre des mots, les terminaisons et les prépositions. Il existe deux types de connexions : la coordination et la subordination.
Une connexion coordonnée implique la combinaison de mots d’égale validité : pluie et neige ; parfois du gel, parfois du dégel.
Cette connexion est nécessaire à la propagation de la phrase par membres homogènes : I s'assit sur le moignon et commencé à regarder sur fleurs Et des arbres.
Le rapport de subordination repose sur la mise en évidence des mots principaux et dépendants : grand aide, s'asseoir sur la côte, lire hier. C'est ainsi que les phrases sont formées à partir de phrases.
Les prépositions avec des mots ne sont pas des phrases : entre nous, près de l'école, en face de la pharmacie. Lignes membres homogènes ou des membres isolés d'une phrase, ainsi que la base grammaticale. À partir du sujet et du prédicat, vous pouvez poser des questions sur d'autres mots.
Par exemple, dans la phrase « Dans notre rue, très bruyante les jours ordinaires, il y avait du silence », il y a des phrases différents types: coordination (dans notre rue, dans une rue bruyante, les jours ordinaires), contrôle (se tenait dans la rue, se tenait les jours), attenant (très bruyant).
Selon le mot principal, les phrases peuvent être verbales, nominales et adverbiales.
A partir du mot dépendant, vous pouvez déterminer la nature des relations sémantiques entre les mots : attributives (répondez aux questions « laquelle ? », « à qui ? », comme définitions), objectives (questions de cas indirects, comme ajouts), adverbiales ( questions d'adverbes).
Lorsqu'ils sont d'accord, les mots principaux et dépendants s'accordent entre eux en genre, en nombre et en cas : mon ami, mon ami, mon ami, à propos de mon ami.
Il est facile de reconnaître ce type de connexion, il suffit de se poser les questions : « laquelle ? », « à qui ? », « laquelle ? ». Ces questions reçoivent le plus souvent des réponses par des adjectifs et des pronoms, des chiffres et des participes. Ils dépendent tous du nom : du bleu glace, aviaire chorale, ton trousse, un autre maison, d'abord une fois, résolu tâche.
Lors du contrôle, le mot principal commande le mot dépendant et l'oblige à se présenter sous la forme d'un cas. En changeant le mot principal, nous ne pouvons pas changer le cas dépendant (je pense - pense - pensé - penserai - pense à toi). Selon le mot principal, le contrôle est verbal ( Je viens le long du chemin) ou nommé ( doux avec moi).
Un mot dépendant est un nom avec ou sans préposition (contrôle prépositionnel ou non prépositionnel). Les questions que l'on pose à partir du mot principal, exprimé plus souvent par un verbe que par un nom, sont appelées questions de cas indirects. Même si certains mots peuvent être posés avec une question sémantique. Mais il faut rappeler qu'un mot dépendant est un mot modifié : a écrit ami, penseà propos de maman, en chantant des oiseaux, histoireécrivain, écrivain marché pour vous, recherche toi, riche des lacs, Un peu livres.
La contiguïté est basée sur des conditions particulières. Le mot dépendant jouxte le mot principal, étant une partie immuable du discours, et répond à des questions sémantiques (comment, où, quand, d'où, d'où, pourquoi, pourquoi). Adverbes adjacents ( courir rapidement), les gérondifs ( assis penché), forme indéfinie du verbe ( est alléétude, souhait peinture), pronoms possessifs le sien, elle, le leur (son stylo).
Ainsi, si vous souhaitez déterminer facilement le type de connexion dans une phrase, apprenez à isoler les phrases d'une phrase, trouvez rapidement le mot principal, posez une question à ce sujet et faites attention aux parties du discours.
La procédure d'analyse détaillée de la phrase
- Trouvez le mot principal et déterminez sa partie du discours.
- Indiquez le type de phrase en fonction du mot principal (verbe, nom, adverbe).
- Trouvez le mot dépendant, déterminez sa partie du discours.
- Déterminer les relations sémantiques entre les mots en fonction du mot dépendant (attributif, objectif ou complémentaire, adverbial).
- Posez la question du mot principal au mot dépendant.
- Nommez le type de connexion de la phrase.
Exemple d'analyse d'une phrase
Dans le minibus, papa regardait silencieusement et pensivement par la fenêtre, comme s'il se souvenait de l'enfance de toute l'humanité (Yu. Aleshkovsky).
1. Dans un taxi minibus, le mot principal « taxi » est un nom, un syntagme nominal. Le mot dépendant « itinéraire » est un adjectif. Quel taxi ? – relations attributives, les deux mots s'accordent en genre, nombre et cas – c'est l'accord.
2. Il a regardé pensivement - le mot principal est « regardé » - verbe, phrase verbale. Le mot dépendant « pensivement » est un adverbe. Est ce que tu l'as regardé? - relations adverbiales, le dépendant jouxte le principal - c'est une adjonction.
3. Je me suis souvenu de mon enfance – le mot principal est « souvenir » – un verbe, une phrase verbale. Le mot dépendant « enfance » est un nom sans préposition dans le cas accusatif. Tu te souviens de quoi ? – objet ou relations supplémentaires, l'essentiel contrôle le mot dépendant – c'est la gestion.
4. Toute l’humanité – le mot principal de « humanité » est un nom, une phrase nominale. Le mot dépendant « total » est un pronom. Quelle humanité ? - relations attributives, les deux mots s'accordent en genre, nombre et cas - ce qui signifie qu'il s'agit d'un accord.
5. Enfance de l'humanité – le mot principal est « enfance », un nom, une phrase nominale. Le mot dépendant de « humanité » est un nom sans préposition dans Génitif. L'enfance de qui ? – des relations supplémentaires, l'essentiel contrôle le mot dépendant – c'est la gestion.
Entraînement
Notez les expressions des phrases et déterminez le type de connexion.
La période précédant notre départ a duré très, très longtemps. Encore plus longtemps que le dernier jour du quatrième trimestre.
Ensuite, une belle fille nous a apporté de l'eau minérale et des bonbons, qui se mangent dans le ciel, et a de nouveau ordonné à tous les passagers d'attacher leur ceinture de sécurité.
En regardant au loin, il est remonté dans la voiture et nous avons continué notre route.
Au fond de la cour se dressait une petite maison blanche. Un chemin fait de la même pierre que la clôture et des marches y conduisaient. Et des deux côtés du chemin il y avait des roses colorées.
Travail indépendant "Types de phrases"
OPTION 1
Maisons
Les branches inférieures du vieil épicéa s'étalaient largement et, sous elles, comme pour le spectacle, toute une constellation de champignons rouges coulait sur la pelouse ombragée.
3. Déterminez le type lien de subordination: nos voix brillaient encore, résonnaient dans les hauteurs, faisaient des nœuds, des mains impuissantes, depuis quelques temps, je souriais comme ça, complètement impossible, tant bien que mal j'en reconnaissais l'auteur.
OPTION 2
1. Écrivez toutes les expressions de la phrase et triez-les selon l'exemple : chez moi (à Maisons[à qui ?] le mien) – accord nominal avec une signification définitive.
Les cloches bleu-violet se balancent dans la brise et il semble qu'elles provoquent une symphonie d'adieu de rêves d'été dans la forêt silencieuse d'automne.
2. Transformez les phrases en synonymes selon l'exemple : robe chintz - robe chintz.
Un combiné téléphonique, une canette métallique, derrière un guide touristique, une curiosité de la ville, ça fait mal de s'en souvenir, des bobines de fil.
3. Déterminez le type de lien de subordination : à peine perceptible, souriant à quelqu'un, à cette fille, sentant quelque chose, physiquement agréable, devenant témoin, faisant une note mentale, d'autres personnes, leurs paroles, établies au cours de l'été.
OPTION 3
1. Écrivez toutes les expressions de la phrase et triez-les selon l'exemple : chez moi (à Maisons[à qui ?] le mien) – accord nominal avec une signification définitive.
Une semaine passera, puis une autre, la brise soufflera - et maintenant une ronde dorée, rouge et brune tournera sur la terre.
2. Transformez les phrases en synonymes selon l'exemple : robe chintz - robe chintz.
Aux fenêtres de la ville, vêtements européens, décrits en détail, nids d'oiseaux, soupe de poisson, avec couvercle en verre.
3. Déterminer le type de lien de subordination : à bout de souffle, je l'ai ramené de Turquie, je m'en occupe encore, l'ami d'un ami, pour te soigner, je l'ai sorti de derrière le poêle, mon écharpe, c'était long il y a quelque temps, leur travail, c'est dommage.
OPTION 4
1. Écrivez toutes les expressions de la phrase et triez-les selon l'exemple : chez moi (à Maisons[à qui ?] le mien) – accord nominal avec une signification définitive.
Il s'avère qu'avant de prendre une noix, le casse-noix la tape légèrement avec son bec et détermine par le son si elle est vide ou non.
2. Transformez les phrases en synonymes selon l'exemple : robe chintz - robe chintz.
Blagues téléphoniques, muscles du visage, collègues du père, photo souvenir, dans la cheminée, non sans tristesse, arrachées.
3. Déterminez le type de lien subordonné : pleurez de rire, toutes les personnes, exceptionnellement utiles, parlent allemand, tombent les feuilles, partent à l'heure, promettent de soigner, d'un seul klaxon, ils parlent de lui, les yeux gris.
OPTION 5
1. Écrivez toutes les expressions de la phrase et triez-les selon l'exemple : chez moi (à Maisons[à qui ?] le mien) – accord nominal avec une signification définitive.
Et il me semble que l’air est rempli du mince tintement doré et arachnéen de l’automne qui passe.
2. Transformez les phrases en synonymes selon l'exemple : robe chintz - robe chintz.
Peigne de coq, rayons de soleil, oiseau de la forêt, tapis rayés, amour maternel, soigneusement nettoyés.
3. Déterminer le type de lien de subordination : un autre pour eux, bien connu, après cette découverte, non visible des autres, des odeurs de brouillard, des gouttes de rosée, cette queue, derrière son épaule, une vache bien nourrie, très mémorable.
OPTION 6
1. Écrivez toutes les expressions de la phrase et triez-les selon l'exemple : chez moi (à Maisons[à qui ?] le mien) – accord nominal avec une signification définitive.
Des troupeaux entiers de tétras paissent sur les éboulis et les cailloux, picorant lentement les petits cailloux.
2. Transformez les phrases en synonymes selon l'exemple : robe chintz - robe chintz.
Tige de menthe, boîte en bois, sur ruban de papier, ciel coucher de soleil, difficile à voir, maison en brique.
3. Déterminer le type de lien de subordination : peu de temps avant, maintenant il est confus, sur l'autre rive, dans la cime de la forêt, s'essuyant les mains, son parfum, il le savait, il s'en ira en toute confiance, le pauvre, trop petit.
Rarement substances chimiques sont constitués d’atomes individuels et non liés d’éléments chimiques. Dans des conditions normales, seul un petit nombre de gaz appelés gaz rares ont cette structure : l'hélium, le néon, l'argon, le krypton, le xénon et le radon. Le plus souvent, les substances chimiques ne sont pas constituées d’atomes isolés, mais de leurs combinaisons en divers groupes. De telles associations d’atomes peuvent compter quelques atomes, des centaines, des milliers, voire davantage. La force qui maintient ces atomes dans de tels groupes est appelée liaison chimique.
En d'autres termes, on peut dire qu'une liaison chimique est une interaction qui assure la connexion d'atomes individuels en structures plus complexes (molécules, ions, radicaux, cristaux, etc.).
La raison de la formation d'une liaison chimique est que l'énergie des structures plus complexes est inférieure à l'énergie totale des atomes individuels qui la forment.
Ainsi, en particulier, si l'interaction des atomes X et Y produit une molécule XY, cela signifie que l'énergie interne des molécules de cette substance est inférieure à l'énergie interne des atomes individuels à partir desquels elle a été formée :
E(XY)< E(X) + E(Y)
Pour cette raison, lorsque des liaisons chimiques se forment entre des atomes individuels, de l’énergie est libérée.
Électrons de la couche électronique externe ayant la plus faible énergie de liaison avec le noyau, appelés valence. Par exemple, dans le bore, ce sont des électrons du 2ème niveau d'énergie - 2 électrons pour 2 s- orbitales et 1 par 2 p-orbitales :
Lorsqu'une liaison chimique se forme, chaque atome tend à obtenir la configuration électronique des atomes de gaz rares, c'est-à-dire de sorte qu'il y a 8 électrons dans sa couche électronique externe (2 pour les éléments de la première période). Ce phénomène est appelé la règle de l'octet.
Il est possible pour les atomes d’atteindre la configuration électronique d’un gaz rare si initialement des atomes uniques partagent certains de leurs électrons de valence avec d’autres atomes. Dans ce cas, des paires d’électrons communes se forment.
Selon le degré de partage électronique, on peut distinguer des liaisons covalentes, ioniques et métalliques.
Une liaison covalente
Les liaisons covalentes se produisent le plus souvent entre des atomes d'éléments non métalliques. Si les atomes non métalliques formant une liaison covalente appartiennent à différents éléments chimiques, une telle liaison est appelée liaison covalente polaire. La raison de ce nom réside dans le fait que les atomes de différents éléments ont également des capacités différentes à attirer une paire d'électrons commune. Évidemment, cela conduit à un déplacement de la paire d'électrons commune vers l'un des atomes, ce qui entraîne la formation d'une charge négative partielle sur celle-ci. À son tour, un atome partiel se forme sur un autre atome charge positive. Par exemple, dans une molécule de chlorure d’hydrogène, la paire d’électrons est déplacée de l’atome d’hydrogène vers l’atome de chlore :
Exemples de substances avec des liaisons covalentes polaires :
CCl 4, H 2 S, CO 2, NH 3, SiO 2, etc.
Une liaison covalente non polaire se forme entre des atomes non métalliques du même élément chimique. Puisque les atomes sont identiques, leur capacité à attirer les électrons partagés est également la même. A cet égard, aucun déplacement de la paire électronique n'est observé :
Le mécanisme ci-dessus pour la formation d'une liaison covalente, lorsque les deux atomes fournissent des électrons pour former des paires d'électrons communes, est appelé échange.
Il existe également un mécanisme donneur-accepteur.
Lorsqu'une liaison covalente est formée par le mécanisme donneur-accepteur, une paire d'électrons partagée est formée en raison de l'orbitale remplie d'un atome (avec deux électrons) et de l'orbitale vide d'un autre atome. Un atome qui fournit une paire d’électrons non liants est appelé donneur, et un atome avec une orbitale vacante est appelé accepteur. Les atomes qui ont des paires d'électrons, par exemple N, O, P, S, agissent comme donneurs de paires d'électrons.
Par exemple, selon le mécanisme donneur-accepteur, la formation du quatrième covalent Connexions NH dans le cation ammonium NH 4 + :
En plus de la polarité, les liaisons covalentes sont également caractérisées par l'énergie. L’énergie de liaison est l’énergie minimale requise pour rompre une liaison entre atomes.
L'énergie de liaison diminue avec l'augmentation des rayons des atomes liés. Puisque nous savons que les rayons atomiques augmentent dans les sous-groupes, nous pouvons, par exemple, conclure que la force de la liaison halogène-hydrogène augmente dans la série :
SALUT< HBr < HCl < HF
De plus, l’énergie de la liaison dépend de sa multiplicité : plus la multiplicité de la liaison est grande, plus son énergie est grande. La multiplicité des liaisons fait référence au nombre de paires d'électrons partagées entre deux atomes.
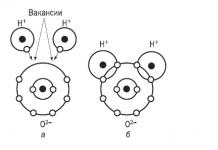
Liaison ionique
Une liaison ionique peut être considérée comme un cas extrême de liaison covalente polaire. Si, dans une liaison covalente-polaire, la paire d'électrons commune est partiellement déplacée vers l'un des deux atomes, alors dans une liaison ionique, elle est presque entièrement « donnée » à l'un des atomes. L'atome qui donne un ou plusieurs électrons acquiert une charge positive et devient cation, et l'atome qui lui a pris des électrons acquiert une charge négative et devient anion.
Ainsi, liaison ionique est une liaison formée en raison de l’attraction électrostatique des cations vers les anions.
La formation de ce type de liaison est typique lors de l'interaction d'atomes de métaux typiques et de non-métaux typiques.
Par exemple, le fluorure de potassium. Le cation potassium est formé par la suppression d'un électron d'un atome neutre, et l'ion fluor est formé par l'ajout d'un électron à l'atome de fluor :

Une force d’attraction électrostatique apparaît entre les ions résultants, entraînant la formation d’un composé ionique.
Lorsqu'une liaison chimique s'est formée, les électrons de l'atome de sodium sont passés à l'atome de chlore et des ions de charges opposées se sont formés, qui ont un niveau d'énergie externe complet.
Il a été établi que les électrons de l’atome métallique ne sont pas complètement détachés, mais sont simplement déplacés vers l’atome de chlore, comme dans une liaison covalente.
La plupart des composés binaires contenant des atomes métalliques sont ioniques. Par exemple, oxydes, halogénures, sulfures, nitrures.
La liaison ionique se produit également entre des cations simples et des anions simples (F −, Cl −, S 2-), ainsi qu'entre des cations simples et des anions complexes (NO 3 −, SO 4 2-, PO 4 3-, OH −). Par conséquent, les composés ioniques comprennent les sels et les bases (Na 2 SO 4, Cu(NO 3) 2, (NH 4) 2 SO 4), Ca(OH) 2, NaOH).
Connexion métallique
Ce type de liaison se forme dans les métaux.
Les atomes de tous les métaux ont des électrons dans leur couche électronique externe qui ont une faible énergie de liaison avec le noyau de l'atome. Pour la plupart des métaux, le processus de perte d’électrons externes est énergétiquement favorable.
En raison d'une si faible interaction avec le noyau, ces électrons dans les métaux sont très mobiles et le processus suivant se produit continuellement dans chaque cristal métallique :
M 0 - ne - = M n + , où M 0 est un atome de métal neutre et M n + est un cation du même métal. La figure ci-dessous fournit une illustration des processus en cours.
C'est-à-dire que les électrons « se précipitent » à travers un cristal métallique, se détachant d'un atome métallique, formant un cation à partir de celui-ci, rejoignant un autre cation, formant un atome neutre. Ce phénomène était appelé « vent électronique » et la collection d’électrons libres dans un cristal d’atome non métallique était appelée « gaz électronique ». Ce type d'interaction entre les atomes métalliques est appelé liaison métallique.
Liaison hydrogène
Si un atome d'hydrogène dans une substance est lié à un élément à forte électronégativité (azote, oxygène ou fluor), cette substance est caractérisée par un phénomène appelé liaison hydrogène.
Puisqu’un atome d’hydrogène est lié à un atome électronégatif, une charge partielle positive se forme sur l’atome d’hydrogène et une charge partielle négative se forme sur l’atome de l’élément électronégatif. À cet égard, l’attraction électrostatique devient possible entre un atome d’hydrogène partiellement chargé positivement d’une molécule et un atome électronégatif d’une autre. Par exemple, des liaisons hydrogène sont observées pour les molécules d'eau :
C’est la liaison hydrogène qui explique le point de fusion anormalement élevé de l’eau. En plus de l'eau, de fortes liaisons hydrogène se forment également dans des substances telles que le fluorure d'hydrogène, l'ammoniac, les acides contenant de l'oxygène, les phénols, les alcools et les amines.
La chimie est une science étonnante et, certes, déroutante. Pour une raison quelconque, il est associé à des expériences lumineuses, à des tubes à essai colorés et à d’épais nuages de vapeur. Mais peu de gens se demandent d’où vient cette « magie ». En fait, aucune réaction ne se produit sans formation de composés entre les atomes des réactifs. D’ailleurs, ces « cavaliers » se retrouvent parfois dans des éléments simples. Ils influencent la capacité des substances à réagir et expliquent certaines de leurs propriétés physiques.
Quels types de liaisons chimiques existe-t-il et comment affectent-elles les composés ?
Théorie
Nous devons commencer par les choses les plus simples. Une liaison chimique est une interaction dans laquelle des atomes de substances se combinent pour former des substances plus complexes. C'est une erreur de croire que cela n'est caractéristique que de composés tels que les sels, les acides et les bases - même les substances simples dont les molécules sont constituées de deux atomes ont ces « ponts », si c'est ainsi qu'on peut appeler une liaison. À propos, il est important de se rappeler que seuls les atomes avec des charges différentes peuvent s'unir (c'est la base de la physique : les particules de même charge se repoussent et les particules opposées s'attirent), donc dans les substances complexes, il y aura toujours un cation (un ion avec une charge positive) et un anion (une particule négative), et la connexion elle-même sera toujours neutre.
Essayons maintenant de comprendre comment se produit la formation d'une liaison chimique.
Mécanisme éducatif
Toute substance possède un certain nombre d’électrons répartis dans les couches d’énergie. La couche externe est la plus vulnérable, car elle contient généralement la plus petite quantité de ces particules. Vous pouvez connaître leur numéro en regardant le numéro de groupe (la ligne avec les chiffres de un à huit en haut du tableau périodique) dans lequel il se trouve. élément chimique, et le nombre de couches d'énergie est égal au numéro de période (de un à sept, ligne verticale à gauche des éléments).
Idéalement, il y a huit électrons dans la couche d’énergie externe. S'il n'y en a pas assez, l'atome essaie de les récupérer sur une autre particule. C’est lors du processus de sélection des électrons nécessaires pour compléter la couche d’énergie externe que se forment les liaisons chimiques des substances. Leur nombre peut varier et dépend du nombre de particules de valence, ou non appariées (pour savoir combien il y en a dans un atome, vous devez créer sa formule électronique). Le nombre d’électrons qui n’ont pas de paire sera égal au nombre de liaisons formées.

Un peu plus sur les types
Les types de liaisons chimiques formées lors de réactions ou simplement dans une molécule d'une substance dépendent entièrement de l'élément lui-même. Il existe trois types de « ponts » entre les atomes : ioniques, métalliques et covalents. Ce dernier, à son tour, est divisé en polaire et non polaire.
Afin de comprendre par quelle liaison les atomes sont connectés, ils utilisent une sorte de règle : si les éléments sont à droite et à gauche du tableau (c'est-à-dire qu'il s'agit d'un métal et d'un non-métal, par exemple NaCl), alors leur connexion est un excellent exemple de liaison ionique. Deux non-métaux forment une liaison polaire covalente (HCl) et deux atomes de la même substance, se combinant en une seule molécule, forment une liaison covalente non polaire (Cl 2, O 2). Les types de liaisons chimiques ci-dessus ne conviennent pas aux substances constituées de métaux - on n'y trouve que des liaisons métalliques.

Interaction covalente
Comme mentionné précédemment, les types de liaisons chimiques ont un certain effet sur les substances. Par exemple, un « pont » covalent est très instable, c'est pourquoi les connexions avec lui sont facilement détruites par la moindre influence extérieure, par exemple le chauffage. Certes, cela ne s'applique qu'aux substances moléculaires. Ceux qui ont une structure non moléculaire sont pratiquement indestructibles (un exemple idéal est un cristal de diamant - une combinaison d'atomes de carbone).

Revenons aux liaisons covalentes polaires et non polaires. Avec le non polaire, tout est simple - les électrons, entre lesquels un « pont » se forme, sont à égale distance des atomes. Mais dans le second cas, ils sont déplacés vers l'un des éléments. Le vainqueur du « tir à la corde » sera la substance dont l’électronégativité (capacité à attirer les électrons) est la plus élevée. Elle est déterminée à l'aide de tableaux spéciaux, et plus la différence de cette valeur entre deux éléments est grande, plus la relation entre eux sera polaire. Certes, la seule chose pour laquelle la connaissance de l'électronégativité des éléments peut être utile est la détermination d'un cation (une charge positive - une substance dans laquelle cette valeur sera plus petite) et d'un anion (une particule négative avec une meilleure capacité à attirer électrons).
Liaison ionique
Tous les types de liaisons chimiques ne conviennent pas pour assembler un métal et un non-métal. Comme mentionné ci-dessus, si la différence d'électronégativité des éléments est énorme (et c'est ce qui se produit lorsqu'ils sont situés dans des parties opposées du tableau), une liaison ionique se forme entre eux. Dans ce cas, les électrons de valence se déplacent d’un atome ayant une électronégativité inférieure vers un atome ayant une électronégativité supérieure, formant un anion et un cation. Le plus un exemple brillant Une liaison similaire est un composé d'un halogène et d'un métal, par exemple AlCl 2 ou HF.
Connexion métallique
Avec les métaux, c'est encore plus facile. Les types de liaisons chimiques ci-dessus leur sont étrangers, car ils ont les leurs. Il peut relier à la fois des atomes d'une même substance (Li 2) et des atomes différents (AlCr 2), dans ce dernier cas des alliages se forment. Si tu parles de propriétés physiques, alors les métaux allient plasticité et résistance, c'est-à-dire qu'ils ne s'effondrent pas au moindre impact, mais changent simplement de forme.

Liaison intermoléculaire
À propos, les liaisons chimiques existent également dans les molécules. Ils sont appelés intermoléculaires. Le type le plus courant est une liaison hydrogène, dans laquelle un atome d'hydrogène emprunte des électrons à un élément à forte électronégativité (une molécule d'eau, par exemple).
Relation dans une phrase- c'est une manière de donner à une phrase un sens, une complétude de pensée, ainsi qu'une complétude logique, lexicale et syntaxique. Il existe deux types de connexions dans une phrase : la coordination et la subordination.
Connexion de coordination dans une phrase est une combinaison d'éléments dans une phrase qui ne dépendent pas les uns des autres : membres homogènes dans un simple ou phrases simples dans le cadre d'un composé.
Lien de subordination dans une phrase est une combinaison d'éléments qui dépendent les uns des autres : des mots dans une phrase, une phrase ou des phrases simples faisant partie d'une phrase complexe.
Comment déterminer le type de connexion dans une phrase ?
Tout d'abord, il faut écarter base grammaticale, puisque le sujet est toujours lié au prédicat, il vaut également la peine d'exclure les mots d'introduction.
Exemple. Je voulais sortir, mais la porte était verrouillée.
Une phrase complexe avec deux parties indépendantes, composées. Sur cette base, dans cette offre utilisé coordination des communications.
Je voulais sortir parce que l'air de la pièce était très vicié.
Une phrase complexe dans laquelle il y a lien de subordination- une phrase indique la raison de ce qui est dit dans l'autre. La phrase est complexe.
Types de liens de subordination.
Existe trois types de liens de subordination:
Coordination- il s'agit d'un type de connexion lorsque les mots dépendants et principaux (un nom ou une autre partie du discours dans le rôle d'un nom) sont comparés les uns aux autres en genre, en nombre et en cas. Le plus exemples simples accords - en phrases : une pluie dégoûtante, un moi joyeux, quelqu'un d'invisible, un passant au hasard, un « zy » retentissant.
Comme mots dépendants une fois convenues, toutes les parties modifiables du discours peuvent apparaître : adjectifs, pronoms (possessifs, attributifs, démonstratifs, négatifs, indéfinis) et nombres ordinaux.
Pas d'argent, au joyeux conteur, à votre sœur, à la première personne que vous rencontrez.
Contrôle- type de communication dans lequel mot principal nécessite une forme particulière du mot dépendant. Formulaire de cas en même temps, elle est déterminée par certaines normes morphologiques de la langue russe. Le principal signe de la présence de contrôle dans une phrase ou une phrase est l'utilisation d'une préposition, bien qu'il existe également une forme de contrôle sans préposition. S'il y a contrôle, le mot dépendant répondra toujours aux questions des cas indirects.
Regardez la lune, admirez la lune, signez le reçu, signez les documents, oubliez les problèmes, oubliez la formule.
Vous devez d'abord comprendre que phrase ne peut être considéré qu'une combinaison de mots basée sur lien de subordination. Qu'est-ce que ça veut dire? L'un des composants inclus dans la phrase est subordonné à un autre. En termes simples, d'un mot à l'autre, vous pouvez poser une question.
Le mot à partir duquel nous posons la question est La chose principale. Le mot sur lequel nous posons la question est dépendant:
Quels types de liens existe-t-il entre les mots d’une phrase ? Il y en a trois : coordination, contrôle et contiguïté. Comment déterminer à quel type de lien de subordination appartient une phrase particulière ? La façon la plus simple de procéder est de déterminer quelle partie du discours est le mot dépendant.
Coordination
À accord mot dépendant - adjectif ou mots avec des caractéristiques adjectives :

Contrôle
À gestion mot dépendant - nom ou mots avec les caractéristiques d'un nom :

Proximité
À proximité mot dépendant - partie immuable du discours . Le plus souvent ceci adverbe, gérondif ou forme infinitive d'un verbe .