Corps de cristal- des solides dans lesquels les atomes sont disposés régulièrement, formant un arrangement spatial périodique tridimensionnel - un réseau cristallin. L’ordre des atomes peut être à longue ou à courte portée.
Les corps amorphes n'ont pas de structure cristalline et, contrairement aux cristaux, ne se divisent pas pour former des faces cristallines. Ils sont également généralement isotropes (ne présentent pas de propriétés différentes dans différentes directions). Ils n'ont pas de point de fusion spécifique.
Les cristaux sont caractérisés par une périodicité spatiale dans la disposition des positions d'équilibre des atomes. Dans les corps amorphes, les atomes vibrent autour de points situés au hasard.
2. Qu’est-ce qu’un réseau cristallin ?
Le réseau cristallin est une image géométrique auxiliaire introduite pour analyser la structure du cristal. Le treillis est similaire à un canevas ou à une grille, ce qui donne lieu à l'appel de nœuds de points de treillis. Un réseau est un ensemble de points (atomes) qui proviennent d’un point distinct sélectionné au hasard d’un cristal sous l’action d’un groupe de traduction. Cette disposition est remarquable en ce que par rapport à chaque point, tous les autres sont situés exactement de la même manière. L'application de l'une de ses traductions inhérentes au réseau dans son ensemble conduit à son transfert et à sa combinaison parallèles. Pour faciliter l'analyse, les points du réseau sont généralement combinés avec les centres de tous les atomes inclus dans le cristal ou avec les centres des molécules.
3.Que sont les nœuds réseau cristallin?
Points de placement des particules
sont appelés nœuds du réseau cristallin.
Selon le type de particules présentes dans
nœuds du réseau cristallin et la nature
Il existe 4 types de connexions entre eux
réseaux cristallins : ioniques, atomiques,
moléculaire, métallique.
4.Quelle est la différence entre les monocristaux et les polycristaux ?
Monocristal - un cristal homogène séparé ayant un réseau cristallin continu et caractérisé par une anisotropie de propriétés
Un polycristal est un agrégat de petits cristaux d'une substance, parfois appelés cristallites ou grains de cristal en raison de leur forme irrégulière.
5.Comment les cristaux peuvent-ils être classés ?
Types de cristaux
Il faut séparer le cristal idéal du cristal réel.
Un cristal idéal est, en fait, un objet mathématique qui possède une symétrie complète et inhérente et des bords lisses et idéalisés.
Un vrai cristal contient toujours divers défauts dans la structure interne du réseau, des distorsions et des irrégularités sur les faces et présente une symétrie réduite du polyèdre en raison des conditions de croissance spécifiques, de l'hétérogénéité du milieu d'alimentation, des dommages et des déformations. Un vrai cristal n'a pas nécessairement des faces cristallographiques et Forme correcte, mais il conserve sa propriété principale : la position régulière des atomes dans le réseau cristallin.
6.Qu’est-ce qu’une liaison ionique ?
Liaison ionique, liaison électrovalente, liaison hétérovalente, un des types liaison chimique, qui est basé sur l'interaction électrostatique entre des ions de charges opposées.
7.Qu’est-ce qu’une liaison covalente ?
Une liaison covalente est l'un des types de liaisons chimiques entre deux atomes, qui est réalisée par une paire d'électrons commune (un électron de chaque atome). K. s. existe à la fois dans les molécules (dans n’importe quel état d’agrégation) et entre les atomes qui forment le réseau cristallin.
8. Quels types de cristaux. les systèmes, vous connaissez ?
En fonction de la symétrie spatiale, tous les réseaux cristallins sont divisés en sept systèmes cristallins.
1. système triclinique - la moindre symétrie, il n'y a pas d'angles identiques, pas d'axes de même longueur ;
2. système monoclinique - deux angles droits, pas d'axes de même longueur ;
3. système rhombique - trois angles droits (donc orthogonaux), pas d'axes de même longueur ;
4. système hexagonal - deux axes d'égale longueur dans un plan formant un angle de 120°, le troisième axe étant à angle droit ;
5. système tétragonal - deux axes de même longueur, trois angles droits ;
6. système trigonal - trois axes d'égale longueur et trois angles égaux différents de 90° ;
7. système cubique - le plus haut degré de symétrie, trois axes d'égale longueur à angle droit.
Corps cristallins et leurs propriétés
Dans les solides, les particules (molécules, atomes et ions) sont si proches les unes des autres que les forces d'interaction entre elles ne leur permettent pas de se séparer.
Ces particules ne peuvent effectuer que des mouvements oscillatoires autour de la position d'équilibre. Les solides conservent donc leur forme et leur volume.
Selon leur structure moléculaire, les solides sont divisés en cristalline Et amorphe.
Structure des corps cristallins

Cellule de cristal
Les cristallins sont les solides, molécules, atomes ou ions dans lesquels ils sont disposés dans un ordre géométrique strictement défini, formant une structure dans l'espace appelée réseau cristallin .
Cet ordre est répété périodiquement dans toutes les directions espace tridimensionnel. Il persiste sur de longues distances et n'est pas limité dans l'espace. Il est appelé sur un long chemin .
Types de réseaux cristallins
Un réseau cristallin est un modèle mathématique qui peut être utilisé pour représenter la façon dont les particules sont disposées dans un cristal. En reliant mentalement les points de l'espace où se trouvent ces particules avec des lignes droites, nous obtenons un réseau cristallin.
La distance entre les atomes situés aux sites de ce réseau est appelée le paramètre de maille .
Selon les particules situées aux nœuds, les réseaux cristallins sont moléculaire, atomique, ionique et métallique.
Les propriétés des corps cristallins telles que le point de fusion, l'élasticité et la résistance dépendent du type de réseau cristallin.
Lorsque la température atteint une valeur à laquelle commence la fusion d’un solide, le réseau cristallin est détruit.
Les molécules gagnent plus de liberté et la substance cristalline solide passe au stade liquide. Plus les liaisons entre molécules sont fortes, plus le point de fusion est élevé.
Réseau moléculaire

Dans les réseaux moléculaires, les liaisons entre molécules ne sont pas fortes. Par conséquent, dans des conditions normales, ces substances sont à l’état liquide ou gazeux.
L'état solide n'est possible pour eux que lorsque basses températures. Leur point de fusion (passage du solide au liquide) est également bas. Et dans des conditions normales, ils sont à l’état gazeux.
Des exemples sont l'iode (I2), la « glace carbonique » (dioxyde de carbone CO2).
Réseau atomique

Dans les substances possédant un réseau cristallin atomique, les liaisons entre les atomes sont fortes.
Les substances elles-mêmes sont donc très dures. Ils fondent à haute température. Le silicium, le germanium, le bore, le quartz, les oxydes de certains métaux et la substance la plus dure de la nature, le diamant, possèdent un réseau atomique cristallin.
Réseau ionique

Les substances dotées d'un réseau cristallin ionique comprennent les alcalis, la plupart des sels et les oxydes de métaux typiques.
La force d’attraction des ions étant très forte, ces substances ne peuvent fondre qu’à des températures très élevées. On les appelle réfractaires. Ils ont une résistance et une dureté élevées.
Grille métallique

Aux nœuds du réseau métallique que possèdent tous les métaux et leurs alliages, se trouvent à la fois des atomes et des ions.
Grâce à cette structure, les métaux ont une bonne malléabilité et ductilité, une conductivité thermique et électrique élevée.
Le plus souvent, la forme du cristal est un polyèdre régulier.
Les faces et les bords de ces polyèdres restent toujours constants pour une substance particulière.
Un monocristal s’appelle monocristal . Il a une forme géométrique régulière, un réseau cristallin continu.
Des exemples de monocristaux naturels sont le diamant, le rubis, le cristal de roche, le sel gemme, le spath d'Islande et le quartz. Dans des conditions artificielles, les monocristaux sont obtenus par le processus de cristallisation, lorsque, en refroidissant des solutions ou en fondant à une certaine température, une substance solide sous forme de cristaux en est isolée.
Avec un taux de cristallisation lent, la coupe de ces cristaux a une forme naturelle. De cette manière, dans des conditions industrielles particulières, on obtient des monocristaux de semi-conducteurs ou de diélectriques.
Les petits cristaux fusionnés au hasard sont appelés polycristaux . L'exemple le plus clair polycristal - pierre de granit. Tous les métaux sont également polycristallins.
Anisotropie des corps cristallins

Dans les cristaux, les particules sont situées avec différentes densités dans différentes directions.
Si nous connectons les atomes dans l'une des directions du réseau cristallin avec une ligne droite, alors la distance entre eux sera la même dans toute cette direction. Dans toute autre direction, la distance entre les atomes est également constante, mais sa valeur peut déjà différer de la distance dans cas précédent. Cela signifie que des forces d’interaction de différentes ampleurs agissent entre les atomes dans des directions différentes. Par conséquent, les propriétés physiques de la substance dans ces directions seront également différentes.
Ce phénomène est appelé anisotropie - dépendance des propriétés de la matière à la direction.
La conductivité électrique, la conductivité thermique, l'élasticité, l'indice de réfraction et d'autres propriétés d'une substance cristalline varient en fonction de la direction dans le cristal. Réalisé différemment dans différentes directions électricité, la substance est chauffée différemment, les rayons lumineux sont réfractés différemment.
Dans les polycristaux, le phénomène d'anisotropie n'est pas observé.
Les propriétés de la substance restent les mêmes dans toutes les directions.
Caractéristiques des solides.
Les molécules (ou atomes) sont disposées de manière strictement ordonnée. La distance entre les molécules est ≈ le diamètre de la molécule. Les atomes ou molécules de solides vibrent autour de certaines positions d'équilibre.
Par conséquent, les solides conservent non seulement leur volume, mais aussi leur forme. Si vous connectez les centres de positions d'équilibre avec un atome ou des ions d'un solide, vous obtenez un réseau spatial régulier, appelé réseau cristallin.
Les solides dans lesquels les atomes ou les molécules sont disposés de manière ordonnée et forment une structure interne se répétant périodiquement sont appelés cristaux. Par conséquent, les cristaux ont des bords plats (un grain de sel de table a des bords plats qui forment des angles droits les uns avec les autres).
Les propriétés physiques des corps cristallins ne sont pas les mêmes dans des directions différentes, mais les mêmes dans des directions parallèles.
Anisotropie des cristaux – C'est une dépendance propriétés physiques de la direction sélectionnée dans le cristal.
Par exemple, résistance mécanique différente des cristaux dans différentes directions (Un morceau de mica s'exfolie facilement dans une direction, mais il est beaucoup plus difficile de le briser dans la direction perpendiculaire aux plaques). De nombreux cristaux conduisent la chaleur et le courant électrique différemment dans différentes directions. Les propriétés optiques des cristaux dépendent également de la direction. Par exemple, les cristaux de quartz et de tourmaline réfractent la lumière différemment selon la direction des rayons qui les frappent.
Lorsqu'un cristal de sel de table est fendu, il est broyé en parties limitées par des surfaces planes se coupant à angle droit.
Ces plans sont perpendiculaires à des directions particulières de l'échantillon ; le long de ces directions, sa résistance est minime.
L'anisotropie des propriétés mécaniques, thermiques, électriques et optiques des cristaux s'explique par le fait qu'avec un arrangement ordonné d'atomes, de molécules ou d'ions, les forces d'interaction entre eux et les distances interatomiques s'avèrent inégales dans différentes directions.
Les corps cristallins sont divisés en monocristaux Et poly-cristaux.
Monocristaux – ces monocristaux ont une forme géométrique régulière et leurs propriétés sont différentes dans différentes directions (anisotropie).
Les monocristaux ont parfois une forme externe géométriquement régulière, mais la principale caractéristique d'un monocristal est une répétition périodique. structure interne dans son intégralité.
Un corps polycristallin est une collection de petits cristaux d’orientation chaotique – des cristallites – fusionnés les uns avec les autres. La structure polycristalline de la fonte, par exemple, peut être détectée en examinant un échantillon fracturé à la loupe. Chaque petit monocristal d'un corps polycristallin est anisotrope, mais le corps polycristallin est isotrope.
Polycristaux– ce sont des solides constitués d'un grand nombre de petits cristaux fondus (des métaux, un morceau de sucre).
Toutes les directions à l’intérieur des polycristaux sont égales et les propriétés des polycristaux sont les mêmes dans toutes les directions (isotropie).
Amorphe on appelle des corps dont les propriétés physiques sont les mêmes dans toutes les directions. Des exemples de corps amorphes comprennent des morceaux de résine durcie, de l'ambre et de la verrerie. Les corps amorphes sont isotrope corps.
L'isotropie des propriétés physiques des corps amorphes s'explique par la disposition désordonnée de leurs atomes et molécules constitutifs. Les corps amorphes n'ont pas d'ordre strict dans la disposition des atomes, il n'y a pas de répétabilité stricte dans toutes les directions du même élément structurel.
Contrairement aux corps cristallins, il n’y a pas de point de fusion spécifique pour les corps amorphes.
Propriétés des corps amorphes. Tous les corps amorphes sont isotropes, c'est-à-dire leurs propriétés physiques sont les mêmes dans toutes les directions (verre, résine, plastique…).
Sous des influences extérieures, les corps amorphes présentent à la fois des propriétés élastiques, comme celles des solides, et de la fluidité, comme celles des liquides (avec un fort impact, un morceau de résine se brise en morceaux, et lorsque la résine reste longtemps sur une surface solide, la résine progressivement se propage, et plus la température est élevée, plus cela se produit rapidement.).
Thème 5.2 Propriétés mécaniques des solides. Types de déformations. Élasticité, force, ductilité, fragilité. La loi de Hooke. Fusion et cristallisation.
Structure interne de la Terre et des planètes*
Déformation d'un corps solide s'appelle un changement dans la forme ou le volume d'un corps sous l'influence de forces extérieures.
Types de déformation.
Déformations élastiques– ce sont des déformations qui disparaissent complètement après que l'action des forces extérieures (ressort, cordon en caoutchouc) cesse et que le corps retrouve sa forme initiale.
Déformations plastiques– ce sont des déformations qui ne disparaissent pas après que l'action des forces extérieures (pâte à modeler, argile, plomb) cesse et que le corps ne retrouve pas sa forme d'origine.
Stress mécaniqueest appelé le rapport du module de force élastique F à la section transversale S du corps :
 ;
; 
La loi de Hooke:aux petites déformations, la contrainte est directement proportionnelle à l'allongement.
La loi de Hooke est satisfaite pour les petites déformations (section du diagramme OA).
1)  , Où
, Où  — le module d'élasticité ou module d'Young (il caractérise la résistance du matériau à la déformation élastique) ;
— le module d'élasticité ou module d'Young (il caractérise la résistance du matériau à la déformation élastique) ;  — déformation relative (allongement relatif) ; est la longueur initiale, ∆l est l'allongement absolu du corps.
— déformation relative (allongement relatif) ; est la longueur initiale, ∆l est l'allongement absolu du corps.
2)  , Où
, Où  — coefficient de rigidité.
— coefficient de rigidité.
Diagramme de tension. (riz.) Pour étudier la déformation en traction, la tige est soumise à une tension à l'aide de dispositifs spéciaux, puis l'allongement de l'échantillon et la contrainte qui y apparaît sont mesurés. Sur la base des résultats des expériences, un graphique est tracé de la dépendance de la contrainte sur l'allongement relatif, appelé diagramme d'étirement (Fig.).
 Zone OA – déformation proportionnelle ; — limite de proportionnalité (tension maximale à laquelle la loi de Hooke est toujours satisfaite) ; si vous augmentez la charge, la déformation devient non linéaire, mais après avoir supprimé la charge, la forme et la taille du corps sont pratiquement restaurées.
Zone OA – déformation proportionnelle ; — limite de proportionnalité (tension maximale à laquelle la loi de Hooke est toujours satisfaite) ; si vous augmentez la charge, la déformation devient non linéaire, mais après avoir supprimé la charge, la forme et la taille du corps sont pratiquement restaurées.
(Tracé AB - déformation élastique) ; — limite élastique; À mesure que la charge augmente, la déformation augmente plus vite et à une certaine valeur de contrainte correspondant au point C sur le diagramme, l'allongement augmente pratiquement sans augmenter la charge.
Ce phénomène est appelé fluidité matériel (section CD). La rupture de l'échantillon se produit lorsque la contrainte atteint une valeur maximale, appelée résistance ultime (l'échantillon est étiré sans augmenter la charge externe jusqu'à la rupture).
Informations connexes :
Rechercher sur le site :
STRUCTURE ET PROPRIÉTÉS DES SOLIDES
Informations théoriques
Une substance peut exister dans trois états d'agrégation : gazeux, liquide et solide.
Le plasma est souvent appelé le quatrième état de la matière. Dépendance des propriétés d'une substance sur état d'agrégation indiqué dans le tableau. 33.
Tableau 1
Propriétés des substances dans différents états d'agrégation
L'état d'agrégation d'une substance est déterminé par les forces agissant entre les molécules, la distance entre les particules et la nature de leur mouvement.
DANS dur Dans cet état, les particules occupent une certaine position les unes par rapport aux autres.
La substance a une faible compressibilité et résistance mécanique, car les molécules n'ont pas de liberté de mouvement, mais seulement des vibrations. Les molécules, atomes ou ions qui forment un solide sont appelés unités structurelles.
Les solides sont divisés en amorphe et cristallin
(Tableau
34). Les substances cristallines fondent à une température de fusion strictement définie, les substances amorphes n'ont pas de point de fusion clairement défini ; lorsqu'ils sont chauffés, ils se ramollissent (caractérisés par un intervalle de ramollissement) et passent à un état liquide ou visqueux (Fig.
Tableau 2
Caractéristiques comparatives des substances amorphes et cristallines

18. Modification du volume des substances lorsqu'elles sont chauffées : UN– cristallin ; b– amorphe
 |
La structure interne des substances amorphes est caractérisée par un arrangement aléatoire de molécules (Tableau. 34). L'état cristallin d'une substance présuppose la disposition correcte dans l'espace des particules qui composent le cristal, et la formation cristallin (spatial)grilles La principale caractéristique des corps cristallins est leur anisotropie– dissimilarité des propriétés (conductivité thermique et électrique, résistance mécanique, vitesse de dissolution, etc.) d.) dans différentes directions, tandis que les corps amorphes - isotrope. Cristaux durs– formations tridimensionnelles caractérisées par une stricte répétabilité du même élément structurel (cellule unitaire) dans toutes les directions. Cellule unitaire représente le plus petit volume d'un cristal en forme de parallélépipède, répété dans le cristal un nombre infini de fois. La cellule unitaire est définie à l'aide d'axes et d'angles (Fig. 19). |
Il existe des paramètres de base des réseaux cristallins.
Énergie du réseau cristallin Ecr., kJ/mol,– c’est l’énergie libérée lors de la formation d’1 mole de cristal à partir de microparticules (atomes, molécules, ions) qui sont à l’état gazeux et séparées les unes des autres à une distance qui exclut leur interaction.
Constante de réseau d,– la plus petite distance entre le centre de deux particules dans un cristal reliées par une liaison chimique.
Numéro de coordination c.n.
– le nombre de particules entourant la particule centrale dans l'espace, reliées à elle par une liaison chimique.
Les points où se trouvent les particules cristallines sont appelés nœuds du réseau cristallin
Malgré la variété des formes cristallines, ils peuvent être classés de manière stricte et sans ambiguïté. La systématisation des formes cristallines a été introduite par l'académicien russe UN V. Gadoline(1867), elle est basée sur les caractéristiques de symétrie des cristaux. Conformément à la forme géométrique des cristaux, les systèmes (systèmes) suivants sont possibles : cubique, tétragonal, orthorhombique, monoclinique, triclinique, hexagonal et rhomboédrique (Fig.

Riz. 20. Systèmes cristallins de base
La même substance peut avoir différentes formes cristallines, qui diffèrent par leur structure interne, et donc par leur proprietes physiques et chimiques. Ce phénomène est appelé polymorphisme .
Isomorphisme– deux substances de nature différente forment des cristaux de même structure. Ces substances peuvent se remplacer dans le réseau cristallin, formant des cristaux mixtes.
Selon le type de particules situées aux nœuds du réseau cristallin et le type de liaisons entre elles, les cristaux sont de quatre types : moléculaires, atomiques, ioniques et métalliques (Fig.

21. Types de cristaux
Les réseaux cristallins constitués de molécules (polaires et non polaires) sont appelés moléculaire . Les molécules de ces réseaux cristallins sont reliées les unes aux autres par des forces hydrogène, intermoléculaires et électrostatiques relativement faibles. Par conséquent, les substances possédant un réseau moléculaire ont une faible dureté et de faibles points de fusion. Ils sont légèrement solubles dans l’eau, ne conduisent pas l’électricité et sont très volatils.
Des exemples de substances dotées de réseaux moléculaires sont la glace, le solide gaz carbonique(« glace carbonique »), halogénures d'hydrogène solides, substances simples solides formées par un- (gaz rares), deux- (F2, Cl2, Br2, J2, H2, N2, O2), trois- (O3), quatre- ( P4 ), huit molécules atomiques (S8).
La plupart des composés organiques cristallins possèdent également un réseau moléculaire.
Les réseaux cristallins contenant des atomes individuels à leurs nœuds sont appelés atomique (covalent) .
Les atomes de ces réseaux sont reliés les uns aux autres par de fortes liaisons covalentes.
Un exemple de cristal avec un réseau cristallin atomique est le diamant (Fig. 21), l'une des modifications du carbone. Ce cristal est constitué d’atomes de carbone dont chacun est lié à quatre atomes voisins (cn = 4).
Le nombre de substances possédant un réseau cristallin atomique est important.
Tous ont un point de fusion élevé, sont insolubles dans les liquides, ont une résistance et une dureté élevées et ont une large gamme de conductivité électrique (des isolants et semi-conducteurs aux conducteurs électroniques). Le réseau cristallin atomique est caractéristique des éléments des groupes III et IV des sous-groupes principaux (Si, Ge, B, C).
Les réseaux cristallins constitués d'ions sont appelés ionique . Ils sont formés de substances possédant des liaisons ioniques. Un exemple de formation d'un réseau cristallin ionique est un cristal de chlorure de sodium (Na Cl) (riz.
21). Les substances dotées d'un réseau cristallin ionique ont une dureté et une fragilité élevées, sont réfractaires et peu volatiles. La fusion des cristaux ioniques entraîne une violation de l'orientation géométriquement correcte des ions les uns par rapport aux autres et un affaiblissement de la force de liaison entre eux. Par conséquent, les masses fondues et les solutions de ces cristaux conduisent le courant électrique. Les substances dotées de réseaux cristallins ioniques se dissolvent facilement dans les liquides polaires et sont diélectriques.
Les réseaux cristallins ioniques forment de nombreux sels, oxydes et bases.
Un réseau cristallin constitué d'atomes métalliques et d'ions reliés par une liaison métallique (Fig. 21) est appelé métal .
La grille métallique est généralement très résistante. Cela explique la dureté, la faible volatilité et les points de fusion et d’ébullition élevés caractéristiques de la plupart des métaux.
Il détermine également les propriétés caractéristiques des métaux telles que la conductivité électrique et thermique, la brillance, la malléabilité, la plasticité, l'opacité et l'effet photoélectrique. Les métaux et alliages purs ont un réseau cristallin métallique.
4. . 5. . 6. . 7. .
Tout le monde peut facilement diviser les corps en solides et liquides. Toutefois, cette répartition ne se fera qu'en fonction signes extérieurs. Afin de découvrir les propriétés des solides, nous allons les chauffer. Certains corps vont commencer à brûler (bois, charbon) - ceci matière organique. D'autres se ramolliront (résine) même à basse température - ceux-ci sont amorphes. Un groupe spécial de solides est constitué de ceux pour lesquels la dépendance de la température sur le temps de chauffage est présentée à la figure 12. Ce sont des solides cristallins. Ce comportement des corps cristallins lorsqu'ils sont chauffés s'explique par leur structure interne. Corps de cristal- ce sont des corps dont les atomes et les molécules sont disposés dans un certain ordre, et cet ordre est conservé sur une assez grande distance. La disposition spatiale périodique des atomes ou des ions dans un cristal est appelée réseau cristallin. Les points du réseau cristallin où se trouvent les atomes ou les ions sont appelés nœuds du réseau.
Les corps cristallins sont soit des monocristaux, soit des polycristaux. Monocristal possède un réseau monocristallin dans tout son volume.
Anisotropie Les monocristaux résident dans la dépendance de leurs propriétés physiques à l'égard de la direction. Polycristal Il s’agit d’une combinaison de petits monocristaux (grains) orientés différemment et n’a pas d’anisotropie de propriétés. La plupart des solides ont une structure polycristalline (minéraux, alliages, céramiques).
Les principales propriétés des corps cristallins sont : la certitude du point de fusion, l'élasticité, la résistance, la dépendance des propriétés sur l'ordre de disposition des atomes, c'est-à-dire sur le type de réseau cristallin.
Amorphe sont des substances qui n'ont aucun ordre dans la disposition des atomes et des molécules dans tout le volume de cette substance. Contrairement aux substances cristallines, les substances amorphes isotrope. Cela signifie que les propriétés sont les mêmes dans toutes les directions. Le passage de l'état amorphe à l'état liquide se fait progressivement, il n'y a pas de point de fusion spécifique. Les corps amorphes n'ont pas d'élasticité, ils sont plastiques. Diverses substances sont à l'état amorphe : verre, résines, plastiques, etc.
Élasticité- la propriété des corps de retrouver leur forme et leur volume après la cessation des forces extérieures ou d'autres raisons ayant provoqué la déformation des corps. Selon la nature du déplacement des particules d'un corps solide, les déformations qui se produisent lorsque sa forme change sont divisées en : traction - compression, cisaillement, torsion et flexion. Pour les déformations élastiques, la loi de Hooke est valable, selon laquelle les déformations élastiques sont directement proportionnelles aux influences extérieures qui les provoquent. Pour la déformation en traction-compression, la loi de Hooke a la forme : , où est la contrainte mécanique, est l'allongement relatif, est l'allongement absolu, est le module d'Young (module élastique). L'élasticité est due à l'interaction et au mouvement thermique des particules qui composent la substance.
Selon les propriétés physiques et la structure moléculaire, il existe deux principales classes de solides : cristallins et amorphes.
Définition 1
Les corps amorphes ont une caractéristique telle que l'isotropie. Ce concept signifie qu'ils sont relativement indépendants des propriétés optiques, mécaniques et autres propriétés physiques ainsi que de la direction dans laquelle les forces externes agissent sur eux.
La principale caractéristique des corps aphmoriques est la disposition chaotique des atomes et des molécules, qui ne se rassemblent qu'en petits groupes locaux, ne contenant pas plus de quelques particules chacun.
Cette propriété rapproche les corps amorphes des liquides. Ces solides comprennent l'ambre et d'autres résines solides, différentes sortes plastique et verre. Sous l'influence de températures élevées, les corps amorphes se ramollissent, mais une forte chaleur est nécessaire pour les transformer en liquide.
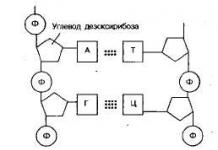
Tous les corps cristallins ont une structure interne claire. Des groupes de particules dans le même ordre se répètent périodiquement dans tout le volume d'un tel corps. Pour visualiser une telle structure, des réseaux cristallins spatiaux sont généralement utilisés. Ils sont constitués d'un certain nombre de nœuds qui forment les centres de molécules ou d'atomes d'une substance particulière. Généralement, un tel réseau est construit à partir d’ions qui font partie des molécules souhaitées. Ainsi, dans le sel de table, la structure interne est constituée d'ions sodium et chlore, combinés par paires en molécules. De tels corps cristallins sont appelés ioniques.
Figure 3. 6. 1 . Réseau cristallin de sel de table.
Définition 2
Dans la structure de chaque substance, un composant minimal peut être distingué - cellule unitaire.
L'ensemble du réseau qui compose le corps cristallin peut être composé par translation (transfert parallèle) d'une telle cellule dans certaines directions.
Le nombre de types de réseaux cristallins n’est pas infini. Il existe 230 espèces au total, dont la plupart sont créées artificiellement ou trouvées dans des matériaux naturels. Les réseaux structurels peuvent prendre la forme de cubes centrés sur le corps (par exemple pour le fer), de cubes à faces centrées (pour l'or, le cuivre) ou d'un prisme à six faces (magnésium, zinc).
À leur tour, les corps cristallins sont divisés en polycristaux et monocristaux. La plupart des substances appartiennent aux polycristaux, car ils sont constitués de ce qu'on appelle des cristallites. Ce sont de petits cristaux fusionnés et orientés de manière aléatoire. Les substances monocristallines sont relativement rares, même parmi les matériaux artificiels.
Définition 3
Les polycristaux ont la propriété d'isotropie, c'est-à-dire les mêmes propriétés dans toutes les directions.
La structure polycristalline du corps est clairement visible au microscope et pour certains matériaux, comme la fonte, même à l'œil nu.
Définition 4
Polymorphisme– est la capacité d’une substance à exister en plusieurs phases, c’est-à-dire modifications cristallines qui diffèrent les unes des autres par leurs propriétés physiques.
Le processus de passage à une autre modification est appelé transition polymorphe.
Un exemple d'un tel phénomène pourrait être la transformation du graphite en diamant, qui dans des conditions industrielles se produit à haute pression (jusqu'à 100 000 atmosphères) et à haute température.
(jusqu'à 2000K).
Pour étudier la structure du réseau d'un échantillon monocristallin ou polycristallin, la diffraction des rayons X est utilisée.
Des réseaux cristallins simples sont illustrés dans la figure ci-dessous. Il faut tenir compte du fait que la distance entre les particules est si petite qu’elle est comparable à la taille des particules elles-mêmes. Pour plus de clarté, les diagrammes montrent uniquement les positions des centres.

Figure 3. 6. 2. Réseaux cristallins simples : 1 – réseau cubique simple ; 2 – réseau cubique à faces centrées ; 3 – réseau cubique centré sur le corps ; 4 – réseau hexagonal.
Le plus simple est le réseau cubique : une telle structure est constituée de cubes avec des particules aux sommets. Un réseau centré sur les faces contient des particules non seulement aux sommets, mais également sur les faces. Par exemple, le réseau cristallin du sel de table est constitué de deux réseaux à faces centrées imbriqués l’un dans l’autre. Un réseau centré sur le corps comporte des particules supplémentaires au centre de chaque cube.
Les grilles métalliques ont une caractéristique importante. Les ions d’une substance sont maintenus en place par interaction avec un gaz d’électrons libres. Ce qu'on appelle le gaz électronique est formé par un ou plusieurs électrons cédés par les atomes. Ces électrons libres peuvent se déplacer dans tout le volume du cristal.

Figure 3. 6. 3. Structure d'un cristal métallique.
Si vous remarquez une erreur dans le texte, veuillez la surligner et appuyer sur Ctrl+Entrée
Un solide est l'un des quatre états fondamentaux matière autre que liquide, gaz et plasma. Il se caractérise par une rigidité structurelle et une résistance aux changements de forme ou de volume. Contrairement à un liquide, un objet solide ne s’écoule pas et ne prend pas la forme du récipient dans lequel il est placé. Un solide ne se dilate pas pour remplir tout le volume disponible comme le fait un gaz.
Les atomes d'un solide sont étroitement liés les uns aux autres, sont dans un état ordonné aux nœuds du réseau cristallin (il s'agit de métaux, de glace ordinaire, de sucre, de sel, de diamant) ou sont disposés de manière irrégulière, n'ont pas de répétabilité stricte dans le structure du réseau cristallin (il s'agit de corps amorphes, tels que le verre à vitre, la colophane, le mica ou le plastique).
Corps de cristal
Les solides cristallins ou les cristaux ont une caractéristique interne distinctive - une structure en forme de réseau cristallin, dans laquelle les atomes, les molécules ou les ions d'une substance occupent une certaine position.
Le réseau cristallin conduit à l’existence de faces plates spéciales dans les cristaux, qui distinguent une substance d’une autre. Lorsqu’il est exposé aux rayons X, chaque réseau cristallin émet un motif caractéristique qui peut être utilisé pour identifier la substance. Les bords des cristaux se croisent selon certains angles qui distinguent une substance d'une autre. Si le cristal est fendu, les nouvelles faces se croiseront aux mêmes angles que l'original.
Ils ont deux propriétés caractéristiques : l'isotropie et l'absence de point de fusion spécifique.
L'isotropie des corps amorphes fait référence aux mêmes propriétés physiques d'une substance dans toutes les directions.
Dans un solide amorphe, la distance aux nœuds voisins du réseau cristallin et le nombre de nœuds voisins varient dans tout le matériau. Par conséquent, différentes quantités d’énergie thermique sont nécessaires pour rompre les interactions intermoléculaires. Par conséquent, les substances amorphes se ramollissent lentement sur une large plage de températures et n'ont pas de point de fusion clair.
Une caractéristique des solides amorphes est qu'à basse température, ils ont les propriétés des solides et, lorsque la température augmente, ils ont les propriétés des liquides.