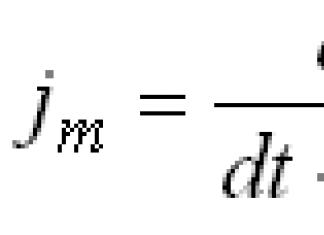Les amines ont une structure similaire à celle de l'ammoniac et présentent des propriétés similaires. Dans l’ammoniac et les amines, l’atome d’azote possède une seule paire d’électrons. Les amines se caractérisent par des propriétés basiques prononcées. Les solutions aqueuses d'amines aliphatiques présentent une réaction alcaline. Les amines aliphatiques sont des bases plus fortes que l'ammoniac. Les amines aromatiques sont des bases plus faibles que l'ammoniac car la seule paire d'électrons de l'atome d'azote se déplace vers le cycle benzénique, s'appariant à ses électrons π.
La basicité des amines est influencée par divers facteurs : effets électroniques des radicaux hydrocarbonés, protection spatiale de l'atome d'azote par les radicaux, ainsi que la capacité des ions résultants à se stabiliser grâce à la solvatation dans un environnement solvant. En raison de l'effet donneur des groupes alkyles, la basicité des amines aliphatiques en phase gazeuse (sans solvant) augmente dans la série : primaire< вторичные < третичные. Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители (-F, -Cl, -NO2 и т. п.) уменьшают основные свойства ариламина по сравнению с анилином, а электронодонорные (алкил R-, -OCH3, -N(CH3)2 и др.), напротив, увеличивают.
1. CH3-NH 2 + H2O → OH (interaction avec l'eau)
2. (CH 3)2NH + HCl → [(CH3)2NH2]Cl chlorure de diméthylammonium (réaction avec les acides)
[(CH 3)2NH 2]Cl + NaOH → (CH 3)2NH + NaCl + H2O (réaction des sels d'amines avec les alcalis)

(acytulation, ne fonctionne pas avec les amines tertiaires)
4. R-NH2 + CH3I → I¯ → NH3→ CH3NHR + NH4I (alkylation)
5. Interaction avec l'acide nitreux : la structure des produits de réaction avec l'acide nitreux dépend de la nature de l'amine. Par conséquent, cette réaction est utilisée pour distinguer les amines primaires, secondaires et tertiaires.
a) R-NH2 + HNO2 → R-OH + N2 + H2O (amines grasses primaires)
b) С6Н5-NH2 + NaNO2 + HCl → [С6Н5-N≡N]+Cl¯ – sel de diazonium (amines aromatiques primaires)
c) R2NH + Н-О-N=O → R2N-N=O (N-nitrosamine) + Н2O (amines grasses et aromatiques secondaires)
d) R3N + H-O-N=O → pas de réaction à basse température (amines grasses tertiaires)

(amines aromatiques tertiaires)
Propriétés de l'aniline. L'aniline est caractérisée par des réactions à la fois au niveau du groupe amino et au niveau du cycle benzénique. Le cycle benzénique affaiblit les propriétés fondamentales du groupe amino par rapport aux amines aliphatiques et à l'ammoniac, mais sous l'influence du groupe amino, le cycle benzénique devient plus actif dans les réactions de substitution que le benzène.
C6H5-NH2 + HCl → Cl = C6H5NH2 HCl
C6H5NH2 HCl + NaOH → C6H5NH2 + NaCl + H2O
C6H5NH2 + CH3I → t→ +Je¯

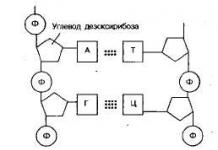
Acides aminés
Acides aminés sont appelés composés hétérofonctionnels dont les molécules contiennent à la fois un groupe amino et un groupe carboxyle. En fonction de la position relative des groupes amino et carboxyle, les acides aminés sont divisés en α-, β-, γ–, etc. Selon l'IUPAC, lors de la dénomination des acides aminés, le groupe NH2- est appelé le préfixe amino-, indiquant par un chiffre le numéro de l'atome de carbone auquel il est lié, suivi du nom de l'acide correspondant.

Acide 2-aminopropanoïque (α-aminopropanoïque, α-alanine)
La propriété la plus commune de tous les composés organiques est leur capacité à brûler. L'ammoniac lui-même brûle et, en général, facilement, mais y mettre le feu n'est pas toujours facile. En revanche, les amines s’enflamment facilement et brûlent le plus souvent avec une flamme incolore ou légèrement colorée. Dans ce cas, l'azote des amines est traditionnellement oxydé en azote moléculaire, car les oxydes d'azote sont instables.
Les amines s'enflamment plus facilement dans l'air que l'ammoniac.
4NH 3 + 3O 2 = 2N 2 + 6H 2 O ;
4C 2 H 5 NH 2 + 15O 2 = 8CO 2 + 14H 2 O + 2N 2.
Propriétés de base
Amines primaires, secondaires et tertiaires contiennent nécessairement un doublet libre d'électrons, comme il sied à l'azote trivalent. Autrement dit, les amines en solution présentent des propriétés basiques ou leurs solutions sont des bases. C’est pourquoi les amines dans une solution aqueuse deviennent bleues tournesol et cramoisies phénolphtaléine. Riz. 12.
Riz. 1 .
Riz. 2 .

Grâce à cette paire d'électrons, une liaison donneur-accepteur avec un ion hydrogène peut se former :
C 2 H 5 NH 2 + H + = C 2 H 5 NH 3 +.
Ainsi, comme l'ammoniac, les amines présentent les propriétés des bases :
NH 3 + H 2 O NH 4 OH;
C 2 H 5 NH 2 + H 2 O C 2 H 5 NH 3 OH.
L'ammoniac forme des sels avec les acides l'ammonium et les amines sont des alkylammonium :
NH 3 + HBr = NH 4 Br ( bromure d'ammonium)
C 2 H 5 NH 2 + HBr = C 2 H 5 NH 3 Br ( bromure d'éthylammonium)
Tout comme l'ammoniac forme des sels d'ammonium avec les acides, les amines forment les sels correspondants. Ces sels peuvent se former, comme dans le cas de l'ammoniac, non seulement lors de la réaction de solutions aqueuses, mais également en phase gazeuse si les amines sont suffisamment volatiles.
Autrement dit, si vous placez des récipients contenant de l'acide chlorhydrique concentré ou même un acide volatil organique, tel que l'acide acétique, et un récipient contenant une amine volatile l'un à côté de l'autre, alors bientôt quelque chose ressemblant à de la fumée sans feu apparaîtra dans l'espace entre eux, c'est-à-dire que des cristaux correspondant à un sel d'alkylamine se formeront. Riz. 3.

Riz. 3 .
Les alcalis remplacent les amines , qui, comme l'ammoniac, faible bases, à partir de sels d'alkylammonium :
NH 4 Cl + KOH = NH 3 - + KCl + H 2 O;
CH 3 NH 3 Cl + KOH = CH 3 NH 2 - + KCl + H 2 O.
Les propriétés fondamentales des amines sont supérieures à celles de l'ammoniac. Pourquoi? La formation d'une liaison donneur-accepteur avec un ion hydrogène se produit plus facilement, plus la densité électronique sur l'atome d'azote est élevée. Les radicaux hydrocarbonés contiennent de nombreux électrons et les « partagent » facilement avec l’atome d’azote (Fig. 4).

Riz. 4. Liaison donneur-accepteur avec un ion hydrogène
Cependant, les propriétés basiques des amines tertiaires sont inférieures à celles des secondaires (comparer les constantes de basicité). Pourquoi? Dans une amine tertiaire, l’atome d’azote est entouré de tous côtés par des radicaux hydrocarbonés et sa capacité à réagir est entravée.
Les amines, comme l'ammoniac, sont capables de réagir avec les haloalcanes, remplaçant l'atome d'halogène :
CH 3 Br + NH 3 = CH 3 NH 2 + HBr;
CH 3 NH 2 + CH 3 Br = (CH 3) 2 NH + HBr;
(CH 3) 2 NH + CH 3 Br = (CH 3) 3 N + HBr.
Les amines tertiaires peuvent également remplacer l'halogène, ce qui permet d'aller plus loin dans la réaction. Un sel d'ammonium quaternaire se forme - bromure de tétraméthylammonium (CH 3) 4 NBr :
(CH 3) 3 N + CH 3 Br = (CH 3) 4 N+ + Br-.
Résumer la leçon
Cette leçon couvrait le sujet « Composés aminés. Classification, isomérie, noms et propriétés physiques." Vous avez revu la genèse des composés organiques contenant de l’oxygène et rappelé certaines propriétés générales de l’ammoniac et de l’eau. Nous avons ensuite examiné comment obtenir des composés aminés. Nous avons étudié leur classification, leur isomérie, leurs noms et leurs propriétés physiques inhérentes. .
Bibliographie
- Rudzitis G.E., Feldman F.G. Chimie : Chimie organique. 10e année : manuel pour les établissements d'enseignement général : niveau de base/G. E. Rudzitis, F.G. Feldman. - 14ème édition. - M. : Éducation, 2012.
- Chimie. 10 e année. Niveau de profil : académique. pour l'enseignement général institutions/V.V. Eremin, N.E. Kuzmenko, V.V. Lounine, A.A. Drozdov, V.I. Terénine. - M. : Outarde, 2008. - 463 p.
- Chimie. 11e année. Niveau de profil : académique. pour l'enseignement général institutions/ V.V. Eremin, N.E. Kuzmenko, V.V. Lounine, A.A. Drozdov, V.I. Terénine. - M. : Outarde, 2010. - 462 p.
- Khomchenko G.P., Khomchenko I.G. Recueil de problèmes de chimie pour ceux qui entrent à l'université. - 4e éd. - M. : RIA « Nouvelle Vague » : Editeur Umerenkov, 2012. - 278 p.
- site web ().
- Chimie.ssu.samara.ru ().
- Khimik.ru ().
- Promobud.ua ().
Devoirs
- N° 3, 4 (p. 14) Rudzitis G.E., Feldman F.G. Chimie : Chimie organique. 10e année : manuel pour les établissements d'enseignement général : niveau de base/G. E. Rudzitis, F.G. Feldman. - 14ème édition. - M. : Éducation, 2012.
- Comparez les propriétés des amines limitantes et des alcools.
- Écrivez des équations de réaction confirmant la basicité des amines.
Amines
Classement et nomenclature
Les amines sont des dérivés organiques de l'ammoniac, dans la molécule desquels un, deux ou trois atomes d'hydrogène sont remplacés par des radicaux. Sur cette base, ils distinguent primaire (RNH2), secondaire (R 2 NH) et tertiaire (R 3 N) amines
Selon la nature du radical, les amines peuvent être saturées ou aromatiques, ainsi que saturées aromatiques (respectivement méthylamine, aniline et méthylaniline). Un radical ramifié peut également être associé à un atome d'azote (par exemple, frotte butylamine), et polycondensée, comme le démontre l'exemple de l'adamantylamine (aminoadamantane), qui a un effet biologique et est utilisée en médecine


Selon les principes de la nomenclature rationnelle, le nom de cette classe de substances est constitué du nom des radicaux présents sur l'atome d'azote, appelés amine. Dans les noms d'amines primaires selon la nomenclature internationale, l'atome d'azote de l'amine reçoit le nom suis-je-Mais, utilisé en indiquant son emplacement avant le nom de la chaîne hydrocarbonée. Cependant, de nombreuses amines ont conservé leurs noms triviaux, par exemple : aniline".
En plus du groupe amino, les molécules de substances organiques peuvent contenir d'autres substituants, comme c'est par exemple le cas de l'acide sulfanilique. L'atome d'azote de l'amine peut également être inclus dans le cycle saturé. Parmi les amines hétérocycliques saturées se trouve une structure à trois chaînons construite avec une tension l'éthylèneimine, ayant un fort effet mutagène. Le cycle éthylèneimine fait partie des molécules de certains médicaments. Les cycles tétrahydropyrrole et pipéridine présents dans les molécules d'un certain nombre d'alcaloïdes (y compris la nicotine et l'anabasine, voir section 20.4) sont construits sans tension. Avec leur participation, ainsi qu'avec l'aide du cycle morpholine, les molécules de nombreux médicaments sont construites.




Les aminés aromatiques hétérocycliques sont par exemple le pyrrole et la pyridine. Enfin, le groupe amino peut également être associé à un hétérocycle, comme l'illustre l'exemple de l'adénine (6-aminopurine), fragment essentiel des acides nucléiques.


Les dérivés de l'ammoniac comprennent également des substances organiques qui peuvent être construites à partir de sels d'ammonium ou de son hydroxyde en remplaçant les quatre atomes d'hydrogène par divers radicaux hydrocarbonés, comme on peut le voir dans l'exemple de l'hydroxyde de tétraméthylammonium :

Un autre exemple de dérivés d'ammonium tétra-substitués - les bases d'ammonium quaternaire ou leurs sels - est neurine, une substance toxique formée lors de la décomposition des tissus animaux.
L'atome d'azote quaternaire peut faire partie d'hétérocycles, par exemple le sel correspondant de la série pyridine - le sel de N-alkylpyridinium. Ces sels quaternaires comprennent certains alcaloïdes. De plus, l’atome d’azote quaternaire se retrouve dans de nombreuses substances médicinales et certaines biomolécules.
Les exemples ci-dessus démontrent la diversité des composés aminés et leur grande importance médicale et biologique. Il faut ajouter à cela que le groupe amino fait partie de classes de biomolécules telles que les acides aminés et les protéines, les acides nucléiques, et est présent dans un certain nombre de dérivés naturels de glucides appelés sucres aminés. Le groupe amino est le groupe fonctionnel le plus important des alcaloïdes et de nombreux médicaments à des fins diverses. Quelques exemples de telles substances seront donnés ci-dessous.
24.3.2. Amines comme bases organiques

 La présence d'une paire d'électrons libres d'azote confère aux amines les propriétés des bases. Par conséquent, une caractéristique des amines est la réaction avec les acides avec formation des sels d'ammonium correspondants, comme le montre la réaction pour l'amine saturée primaire :
La présence d'une paire d'électrons libres d'azote confère aux amines les propriétés des bases. Par conséquent, une caractéristique des amines est la réaction avec les acides avec formation des sels d'ammonium correspondants, comme le montre la réaction pour l'amine saturée primaire :
De même, l'aniline est formée à partir d'aniline, le sel de pyridinium est formé à partir de pyridine, etc. Comme l'ammoniac, les amines dans les solutions aqueuses créent un environnement alcalin, selon l'équation :
Quantitativement, la basicité des bases azotées du milieu aquatique se traduit par la valeur de la constante d'équilibre (À b ) (le plus souvent, ils utilisent la valeur rK b ) yl/С а (ВН +), caractérisant l'acidité de l'acide conjugué d'une base donnée.

Les bases les plus fortes seront les composés contenant un atome d'azote dans lesquels le doublet isolé d'azote est situé dans l'orbitale hybride solitaire 5p 3 (amines aliphatiques, ammoniac, acides aminés), et les plus faibles seront celles dans lesquelles ce couple est impliqué dans p ,n conjugaison (amides, pyrrole, pyridine).
Les substituants donneurs d'électrons, qui comprennent des groupes alkyle, devraient augmenter la basicité des amines car ils augmentent la densité électronique au niveau de l'atome d'azote. Oui, la méthylamine (pk b = 3.27) est une base plus forte que l'ammoniac (pk b = 4,75), et diméthylamine (pk b = 3.02) est une base plus forte que la méthylamine. Cependant, en passant à la triméthylamine, contrairement aux attentes, la basicité diminue légèrement (pk b = 4,10). La raison en est qu’à mesure que le nombre de substituants sur l’atome d’azote augmente, l’approche du proton devient de plus en plus difficile. Ainsi, nous ne parlons pas ici de l'influence électronique, mais de l'influence spatiale des substituants. Cet effet des substituants est appelé stérique facteur.
Les amines aromatiques sont des bases plus faibles que les bases saturées en raison de l’effet attracteur d’électrons du cycle aromatique. Par conséquent, la basicité de la pyridine est également faible. L'accumulation de substituants phényle supprime sensiblement l'activité de la paire électronique de l'atome d'azote. Donc, RK, la diphénylamine est de 13,12 et la triphénylamine ne présente pas du tout les propriétés d'une base.
La basicité extrêmement faible du pyrrole est due au fait que dans sa molécule, la paire électronique de l'atome d'azote est impliquée dans la formation d'une liaison aromatique d'électron b. Sa liaison avec un proton nécessite une dépense énergétique supplémentaire importante. En raison de la formation de sels de pyrrolium, la liaison aromatique et, par conséquent, la stabilité de la molécule disparaissent. Ceci explique le fait que le pyrrole devient rapidement résineux en milieu acide.
Il est intéressant de noter que le fort effet attracteur d'électrons exercé par le cycle pyrrole sur l'atome d'azote conduit à un affaiblissement de la liaison N-H, grâce auquel le pyrrole est capable de présenter les propriétés d'un acide faible. (pk UN = 17,5).
![]()
Sous l'influence d'un métal aussi actif que le potassium, son sel de potassium, le pyrrole-potassium, peut être préparé.
Les propriétés acides de la liaison N-H du cycle pyrrole expliquent notamment la capacité de la porphine et de ses dérivés naturels à former des sels avec les cations métalliques. Deux cycles pyrrole de la molécule de porphyrine sont coordonnés avec le cation en raison des paires électroniques de leurs atomes d'azote, et les deux autres sont coordonnés en remplaçant les atomes d'hydrogène, comme la molécule de pyrrole elle-même lors de la formation du pyrrole-potassium. Ces sels sont la chlorophylle et l'hémoglobine.

THÈME DE CONFÉRENCE : AMINES ET AMINO-ALCOOLS
Des questions:
Caractéristiques générales : structure, classification, nomenclature.
Méthodes de réception
Propriétés physiques
Propriétés chimiques
Représentants individuels. Méthodes d'identification.
Caractéristiques générales : structure, classification, nomenclature
Les amines sont des dérivés de l'ammoniac dont la molécule comporte des atomes d'hydrogène remplacés par des radicaux hydrocarbonés.
Classification
1– Les amines se distinguent selon le nombre d’atomes d’hydrogène substitués de l’ammoniac:
– primaire contiennent un groupe amino (–NH 2), formule générale : R–NH 2,
– secondaire contenir un groupe imino (–NH),
formule générale : R 1 –NH–R 2
– tertiaire contiennent un atome d'azote, formule générale : R 3 –N
On connaît également des composés comportant un atome d'azote quaternaire : l'hydroxyde d'ammonium quaternaire et ses sels.
2– Selon la structure du radical, on distingue les aminés :
– aliphatique (saturé et insaturé)
– alicyclique
– aromatique (contenant un groupe amino ou une chaîne latérale dans le noyau)
– hétérocyclique.
Nomenclature, isomérie des amines
1. Les noms d'amines selon la nomenclature rationnelle sont généralement dérivés des noms de leurs radicaux hydrocarbonés constitutifs avec l'ajout de la terminaison -amine : méthylamine CH 3 –NH 2, diméthylamine CH 3 –NH –CH 3, triméthylamine (CH 3) 3 N, propylamine CH 3 CH 2 CH 2 –NH 2, phénylamine C 6 H 5 – NH 2, etc.
2. Selon la nomenclature IUPAC, le groupe amino est considéré comme un groupe fonctionnel et son nom amino placé avant le nom de la chaîne principale :
L'isomérie des amines dépend de l'isomérie des radicaux.
Méthodes de production d'amines
Les amines peuvent être préparées de différentes manières.
A) Action sur l'ammoniac par les haloalkyles
2NH 3 + CH 3 I ––® CH 3 – NH 2 + NH 4 I
B) Hydrogénation catalytique du nitrobenzène avec de l'hydrogène moléculaire :
C 6 H 5 NO 2 ––® C 6 H 5 NH 2 + H 2 O
nitrobenzène chat aniline
B) Préparation d'amines inférieures (C 1 – C 4) par alkylation avec des alcools :
350 0 C, Al2O3
R–OH + NH 3 –––––––––––® R–NH 2 +H 2 O
350 0 C, Al2O3
2R–OH + NH 3 –––––––––––® R 2 –NH +2H 2 O
350 0 C, Al2O3
3R–OH + NH 3 –––––––––––® R 3 –N + 3H 2 O
Propriétés physiques des amines
La méthylamine, la diméthylamine et la triméthylamine sont des gaz, les membres intermédiaires de la série des amines sont des liquides et les membres supérieurs sont des solides. À mesure que le poids moléculaire des amines augmente, leur densité augmente, leur point d’ébullition augmente et leur solubilité dans l’eau diminue. Les amines supérieures sont insolubles dans l'eau. Les amines inférieures ont une odeur désagréable, rappelant quelque peu l'odeur du poisson avarié. Les amines supérieures sont inodores ou ont une très légère odeur. Les amines aromatiques sont des liquides ou des solides incolores qui ont une odeur désagréable et sont toxiques.
Propriétés chimiques des amines
Le comportement chimique des amines est déterminé par la présence d'un groupe amino dans la molécule. Il y a 5 électrons dans la couche électronique externe de l’atome d’azote. Dans une molécule d'amine, tout comme dans une molécule d'ammoniac, l'atome d'azote dépense trois électrons pour former trois liaisons covalentes, tandis que deux restent libres.
La présence d'une paire d'électrons libres sur l'atome d'azote lui donne la capacité de lier un proton, donc les amines sont similaires à l'ammoniac, présentent des propriétés basiques, forment des hydroxydes et des sels.
Formation de sel. Les amines avec des acides donnent des sels qui, sous l'influence d'une base forte, donnent à nouveau des amines libres :
Les amines donnent des sels même avec de l'acide carbonique faible :
Comme l'ammoniac, les amines ont des propriétés basiques dues à la liaison des protons en un cation ammonium substitué faiblement dissocié :
| |
Lorsqu'une amine est dissoute dans l'eau, une partie des protons de l'eau est consommée pour former un cation ; Ainsi, un excès d'ions hydroxyde apparaît dans la solution et possède des propriétés alcalines suffisantes pour colorer les solutions de bleu tournesol et de phénolphtaléine pourpre. La basicité des amines de la série limite varie dans de très faibles limites et est proche de la basicité de l'ammoniac.
L'effet des groupes méthyle augmente légèrement la basicité du méthyle et de la diméthylamine. Dans le cas de la triméthylamine, les groupements méthyle gênent déjà la solvatation du cation résultant et réduisent sa stabilisation, et donc sa basicité.
Les sels d'amine doivent être considérés comme des composés complexes. L'atome central en eux est un atome d'azote dont le numéro de coordination est quatre. Les atomes d'hydrogène ou d'alkyle sont liés à l'atome d'azote et sont situés dans la sphère interne ; le résidu acide est situé dans la sphère externe.
Acylation des amines. Lorsque certains dérivés d'acides organiques (halogénures d'acide, anhydrides, etc.) agissent sur les amines primaires et secondaires, des amides se forment :
Les amines secondaires avec l'acide nitreux donnent nitrosamines- liquides jaunâtres, peu solubles dans l'eau :
Les amines tertiaires résistent à l'action de l'acide nitreux dilué à froid (elles forment des sels d'acide nitreux) ; dans des conditions plus sévères, l'un des radicaux est clivé et de la nitrosoamine se forme.
Diamines
Les diamines jouent un rôle important dans les processus biologiques. En règle générale, ils sont facilement solubles dans l'eau, ont une odeur caractéristique, ont une réaction hautement alcaline et interagissent avec le CO 2 de l'air. Les diamines forment des sels stables avec deux équivalents d'acide.
Éthylènediamine (1,2-éthanediamine) H 2 NCH 2 CH 2 NH 2 . C'est la diamine la plus simple ; peut être obtenu par action de l'ammoniac sur le bromure d'éthylène :
Tétraméthylènediamine (1,4-butanediamine), ou putrescine, NH 2 CH 2 CH 2 CH 2 CH 2 NH 2 et pentaméthylènediamine (1,5-pentanediamine) NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2, ou cadavérine. Ils ont été découverts dans les produits de décomposition de substances protéiques ; sont formés par décarboxylation de diaminoacides et sont appelés ptomaïnes(du grec - cadavre), ils étaient auparavant considérés comme des « poisons cadavériques ». Il a maintenant été découvert que la toxicité des protéines en décomposition n'est pas causée par les ptomaines, mais par la présence d'autres substances.
La putrescine et la cadavérine se forment à la suite de l'activité vitale de nombreux micro-organismes (par exemple, les agents responsables du tétanos et du choléra) et de champignons ; on les trouve dans le fromage, l'ergot, l'agaric mouche et la levure de bière.
Certaines diamines sont utilisées comme matières premières pour la production de fibres de polyamide et de plastiques. Ainsi, à partir de l'hexa-méthylènediamine NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2, une fibre synthétique très précieuse a été obtenue - nylon(États-Unis) ou anid(Russie).
Alcools aminés
Alcools aminés- les composés à fonctions mixtes dont la molécule contient des groupes amino et hydroxy.
Aminoéthanol(éthanolamine) HO-CH 2 CH 2 -NH 2, ou colamine.
L'éthanolamine est un liquide huileux épais, miscible à tous égards à l'eau et possédant de fortes propriétés alcalines. Outre la monoéthanolamine, la diéthanolamine et la triéthanolamine sont également obtenues :
La choline est incluse dans lécithines- des substances grasses, très courantes dans les organismes animaux et végétaux, et qui peuvent en être isolées. La choline est une masse cristalline hautement hygroscopique qui se dissout facilement dans l'air. Il possède de fortes propriétés alcalines et forme facilement des sels avec les acides.
Lorsque la choline est acylée avec l'anhydride acétique, elle se forme l'acétate de choline, aussi appelé acétylcholine :
 |
L'acétylcholine joue un rôle biochimique extrêmement important, car c'est un médiateur (médiateur) qui transmet l'excitation des récepteurs nerveux aux muscles.
La classification des amines est variée et dépend de la caractéristique structurelle prise comme base.
Selon le nombre de groupes organiques associés à l'atome d'azote, on distingue :
amines primaires un groupe organique sur l'azote RNH 2
amines secondaires deux groupes organiques sur l'azote R 2 NH, les groupes organiques peuvent être différents R "R" NH
amines tertiaires trois groupes organiques sur l'azote R 3 N ou R"R"R""N
En fonction du type de groupe organique associé à l'azote, on distingue les CH 3 N6H 5 N aliphatiques
En fonction du nombre de groupes amino dans la molécule, les amines sont divisées en monoamines CH 3 NH 2, diamines H 2 N(CH 2) 2 NH 2, triamines, etc.
Nomenclature des amines.
le mot « amine » est ajouté au nom des groupes organiques associés à l'azote, et les groupes sont mentionnés par ordre alphabétique, par exemple CH 3 NHC 3 H 7 méthylpropylamine, CH 3 N (C 6 H 5) 2 méthyldiphénylamine. Les règles permettent également que le nom soit composé sur la base d'un hydrocarbure dans lequel le groupe amino est considéré comme substituant. Dans ce cas, sa position est indiquée à l'aide d'un index numérique : C 5 H 3 C 4 H 2 C 3 H(NH 2) C 2 H 2 C 1 H 3 3-aminopentane (les indices numériques supérieurs bleus indiquent l'ordre de numérotation des les atomes de C) . Pour certaines amines, des noms triviaux (simplifiés) ont été conservés : C 6 H 5 NH 2 aniline (le nom selon les règles de nomenclature est phénylamine).
Dans certains cas, des noms établis sont utilisés, qui sont des noms corrects déformés : H 2 NCH 2 CH 2 OH monoéthanolamine (correctement 2-aminoéthanol) ; (OHCH 2 CH 2) 2 NH diéthanolamine, le nom correct est bis(2-hydroxyéthyl)amine. Des noms triviaux, déformés et systématiques (compilés selon les règles de la nomenclature) cohabitent assez souvent en chimie.
Propriétés physiques des amines.
Les premiers représentants d'une série d'amines méthylamine CH 3 NH 2, diméthylamine (CH 3) 2 NH, triméthylamine (CH 3) 3 N et éthylamine C 2 H 5 NH 2 sont gazeux à température ambiante, puis avec une augmentation du nombre d'atomes dans R, les amines deviennent des liquides et avec une augmentation de la longueur de la chaîne R à 10 atomes de C, des substances cristallines. La solubilité des amines dans l'eau diminue à mesure que la longueur de chaîne R augmente et que le nombre de groupes organiques associés à l'azote augmente (transition vers les amines secondaires et tertiaires). L'odeur des amines ressemble à l'odeur de l'ammoniac ; les amines supérieures (avec un grand R) sont pratiquement inodores.
Propriétés chimiques des amines.
La capacité distinctive des amines à attacher des molécules neutres (par exemple, les halogénures d'hydrogène HHal, avec formation de sels organoammonium, similaires aux sels d'ammonium en chimie inorganique. Pour former une nouvelle liaison, l'azote fournit une paire d'électrons solitaires, agissant comme un donneur. Le proton H + impliqué dans la formation de la liaison (à partir de l'halogénure d'hydrogène) joue le rôle d'un accepteur (récepteur), une telle liaison est appelée donneur-accepteur (Fig. 1). La liaison NH covalente résultante est tout à fait équivalente à les liaisons NH présentes dans l'amine.
Les amines tertiaires ajoutent également du HCl, mais lorsque le sel résultant est chauffé dans une solution acide, il se décompose et R est clivé de l'atome d'azote :
(C2H5) 3 N+ HCl ® [(C 2 H 5) 3 N H]Cl
[(C 2 H 5) 3 N H]Cl ® (C 2 H 5) 2 N H + C 2 H 5 Cl
En comparant ces deux réactions, il est clair que le groupe C 2 H 5 et H semblent changer de place, de ce fait, une amine secondaire se forme à partir d'une amine tertiaire.
En se dissolvant dans l'eau, les amines captent un proton de la même manière, ce qui entraîne l'apparition d'ions OH dans la solution, ce qui correspond à la formation d'un environnement alcalin, détectable à l'aide d'indicateurs classiques.
C2H5 N H 2 + H 2 O ® + + OH
Avec la formation d'une liaison donneur-accepteur, les amines peuvent ajouter non seulement du HCl, mais également un haloalkyle RCl, formant ainsi une nouvelle liaison NR, également équivalente à celles existantes. Si l'on prend une amine tertiaire comme matière de départ, on obtient un sel de tétraalkylammonium (quatre groupes R sur un atome de N) :
(C2H5) 3 N+ C 2 H 5 I ® [(C 2 H 5) 4 N]JE
Ces sels, se dissolvant dans l'eau et certains solvants organiques, se dissocient (se désintègrent) en formant des ions :
[(C 2 H 5) 4 N]Je ® [(C 2 H 5) 4 N] + + je
De telles solutions, comme toutes les solutions contenant des ions, conduisent le courant électrique. Dans les sels de tétraalkylammonium, l'halogène peut être remplacé par un groupe HO :
[(CH 3) 4 N]Cl + AgOH ® [(CH 3) 4 N]OH + AgCl
L'hydroxyde de tétraméthylammonium résultant est une base forte avec des propriétés similaires à celles des alcalis.
Les amines primaires et secondaires réagissent avec l'acide nitreux HON=O, mais elles réagissent de différentes manières. Les alcools primaires sont formés à partir d'amines primaires :
C2H5 N H2+H N O 2 ® C 2 H 5 OH + N 2 +H2O
Contrairement aux amines primaires, les amines secondaires forment des nitrosamines jaunes peu solubles avec l'acide nitreux - des composés contenant le fragment >NN = O :
(C2H5) 2 N H + H N O 2 ® (C 2 H 5) 2 N N=O + H2O
Les amines tertiaires ne réagissent pas avec l'acide nitreux aux températures ordinaires, l'acide nitreux est donc un réactif qui permet de distinguer les amines primaires, secondaires et tertiaires.
Lorsque les amines se condensent avec des acides carboxyliques, des amides d'acide se forment - des composés avec le fragment C(O)N
La condensation des amines avec des aldéhydes et des cétones conduit à la formation de bases dites de Schiff - des composés contenant le fragment N=C2.
Lorsque les amines primaires interagissent avec le phosgène Cl 2 C=O, des composés avec le groupe N=C=O se forment, appelés isocyanates (Fig. 2D, préparation d'un composé avec deux groupes isocyanate).
Parmi les amines aromatiques, la plus connue est l'aniline (phénylamine) C 6 H 5 NH 2. Ses propriétés sont similaires à celles des amines aliphatiques, mais sa basicité est moins prononcée : dans les solutions aqueuses, elle ne forme pas de milieu alcalin. Comme les amines aliphatiques, elle peut former des sels d'ammonium [C 6 H 5 NH 3 ] + Cl avec des acides minéraux forts. Lorsque l'aniline réagit avec l'acide nitreux (en présence de HCl), il se forme un composé diazoïque contenant le fragment RN=N, obtenu sous la forme d'un sel ionique appelé sel de diazonium (Fig. 3A). Ainsi, l'interaction avec l'acide nitreux ne se déroule pas de la même manière que dans le cas des amines aliphatiques. Le cycle benzénique de l'aniline a une réactivité caractéristique des composés aromatiques ( cm. AROMATICITÉ), lors de l'halogénation, les atomes d'hydrogène dans ortho- Et paire-les positions du groupe amino sont remplacées, ce qui donne des chloroanilines avec différents degrés de substitution (Fig. 3B). L'action de l'acide sulfurique conduit à une sulfonation dans paire-en position par rapport au groupe amino, se forme ce qu'on appelle l'acide sulfanilique (Fig. 3B).
Préparation d'amines.
Lorsque l'ammoniac réagit avec des haloalkyles, tels que RCl, un mélange d'amines primaires, secondaires et tertiaires se forme. Le sous-produit HCl résultant se combine avec des amines pour former un sel d'ammonium, mais s'il y a un excès d'ammoniac, le sel se décompose, permettant au processus de passer à la formation de sels d'ammonium quaternaire (Fig. 4A). Contrairement aux halogénures d'alkyle aliphatiques, les halogénures d'aryle, par exemple C 6 H 5 Cl, réagissent très difficilement avec l'ammoniac ; la synthèse n'est possible qu'avec des catalyseurs contenant du cuivre. Dans l'industrie, les amines aliphatiques sont obtenues par l'interaction catalytique d'alcools avec NH 3 à 300-500°C et une pression de 1-20 MPa, ce qui donne un mélange d'amines primaires, secondaires et tertiaires (Fig. 4B).
Lorsque les aldéhydes et les cétones interagissent avec le sel d'ammonium de l'acide formique HCOONH 4, des amines primaires se forment (Fig. 4C) et la réaction des aldéhydes et des cétones avec des amines primaires (en présence d'acide formique HCOOH) conduit à des amines secondaires (Fig. 4C). .4D).
Les composés nitrés (contenant le groupe NO 2) lors de la réduction forment des amines primaires. Cette méthode, proposée par N.N. Zinin, est peu utilisée pour les composés aliphatiques, mais est importante pour la production d'amines aromatiques et a constitué la base de la production industrielle d'aniline (Fig. 4D).
Les amines sont rarement utilisées sous forme de composés individuels ; par exemple, la polyéthylènepolyamine [-C 2 H 4 NH-] est utilisée dans la vie quotidienne. n(nom commercial PEPA) comme durcisseur pour les résines époxy. Les amines sont principalement utilisées comme produits intermédiaires dans la préparation de diverses substances organiques. Le rôle principal appartient à l'aniline, sur la base de laquelle une large gamme de colorants à l'aniline est produite, et la « spécialisation » des couleurs est déjà établie au stade de l'obtention de l'aniline elle-même. L'aniline ultra pure sans homologues est appelée dans l'industrie « aniline pour le bleu » (c'est-à-dire la couleur du futur colorant). « Aniline pour le rouge » doit contenir, en plus de l'aniline, un mélange ortho- Et paire-toluidine (CH 3 C 6 H 4 NH 2).
Les diamines aliphatiques sont les composés de départ pour la production de polyamides, par exemple le nylon (Fig. 2), largement utilisé pour la fabrication de fibres, de films polymères, ainsi que de composants et pièces en construction mécanique (engrenages en polyamide).
À partir de diisocyanates aliphatiques (Fig. 2), on obtient des polyuréthanes qui possèdent un complexe de propriétés techniquement importantes : une résistance élevée combinée à une élasticité et une très haute résistance à l'abrasion (semelles de chaussures en polyuréthane), ainsi qu'une bonne adhérence sur une large gamme de matériaux (semelles de chaussures en polyuréthane). adhésifs). Ils sont également largement utilisés sous forme de mousse (mousses de polyuréthane).
Les sulfamides anti-inflammatoires sont synthétisés à base d'acide sulfanilique (Fig. 3).
Les sels de diazonium (Fig. 2) sont utilisés dans les matériaux photosensibles pour la photocopie, ce qui permet d'obtenir une image en contournant la photographie conventionnelle aux halogénures d'argent ( cm. COPIE NOIRE).
Mikhaïl Levitski