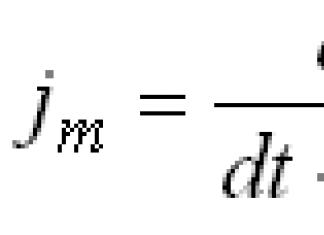Gaz carbonique
Monoxyde de carbone (dioxyde de carbone, dioxyde de carbone, dioxyde de carbone, anhydride carbonique, dioxyde de carbone
) — CO2, un gaz incolore, inodore, au goût légèrement aigre.
Concentration gaz carbonique dans l'atmosphère terrestre est en moyenne de 0,038 %.
Il ne convient pas pour supporter la vie. Or, c’est de cela que les plantes se « nourrissent » et le transforment en substances organiques. De plus, c'est une sorte de « couverture » pour la Terre. Si ce gaz disparaissait soudainement de l’atmosphère, la Terre deviendrait beaucoup plus froide et la pluie disparaîtrait virtuellement.
"Couverture de la Terre"
Gaz carbonique (dioxyde de carbone, dioxyde de carbone, CO 2
) est formé de la combinaison de deux éléments : le carbone et l’oxygène. Il se forme lors de la combustion de charbon ou de composés d'hydrocarbures, lors de la fermentation de liquides, ainsi que comme produit de la respiration des personnes et des animaux. On le trouve également en petites quantités dans l’atmosphère, d’où il est assimilé par les plantes qui, à leur tour, produisent de l’oxygène.
Le dioxyde de carbone est incolore et plus lourd que l'air. Gèle à −78,5°C pour former de la neige composée de dioxyde de carbone. En solution aqueuse, il forme de l'acide carbonique, mais il n'est pas suffisamment stable pour être facilement isolé.
Le dioxyde de carbone est la couverture de la Terre. Il transmet facilement les rayons ultraviolets qui chauffent notre planète et réfléchit les rayons infrarouges émis depuis sa surface vers l’espace. Et si le dioxyde de carbone disparaît soudainement de l’atmosphère, cela affectera avant tout le climat. Il fera beaucoup plus frais sur Terre et il pleuvra très rarement. Il n’est pas difficile de deviner où cela mènera finalement.
Il est vrai qu’une telle catastrophe ne nous menace pas encore. Bien au contraire. Brûlant matière organique: pétrole, charbon, gaz naturel, bois - augmente progressivement la teneur en dioxyde de carbone dans l'atmosphère. Cela signifie qu'avec le temps, nous devons nous attendre à un réchauffement et à une humidification importants. le climat de la Terre. D'ailleurs, les anciens pensent qu'il fait déjà nettement plus chaud qu'au temps de leur jeunesse...
Le dioxyde de carbone est libéré liquide à basse température, liquide à haute pression et gazeux. Il est obtenu à partir des gaz résiduaires provenant de la production d'ammoniac et d'alcool, ainsi que de la combustion de combustibles spéciaux et d'autres industries. Gaz carbonique- gaz incolore et inodore à une température de 20°C et une pression de 101,3 kPa (760 mm Hg), densité - 1,839 kg/m 3. Dioxyde de carbone liquide- juste un liquide incolore et inodore.
Gaz carbonique non toxique et non explosif. À des concentrations supérieures à 5 % (92 g/m3), le dioxyde de carbone a un effet nocif sur la santé humaine : il est plus lourd que l'air et peut s'accumuler dans les zones mal ventilées proches du sol. Cela réduit la fraction volumique d’oxygène dans l’air, ce qui peut provoquer un manque d’oxygène et une suffocation.
Produire du dioxyde de carbone
Dans l'industrie, le dioxyde de carbone est obtenu à partir des gaz de four, à partir des produits de décomposition des carbonates naturels (calcaire, dolomite). Le mélange de gaz est lavé avec une solution de carbonate de potassium, qui absorbe le dioxyde de carbone et se transforme en bicarbonate. Lorsqu'elle est chauffée, la solution de bicarbonate se décompose, libérant du dioxyde de carbone. À production industrielle le gaz est pompé dans des bouteilles.
Dans des conditions de laboratoire, de petites quantités sont obtenues en faisant réagir des carbonates et des bicarbonates avec des acides, par exemple du marbre avec de l'acide chlorhydrique.
Application
DANS Industrie alimentaire
le dioxyde de carbone est utilisé comme conservateur et est indiqué sur l'emballage sous le code E290
Dioxyde de carbone liquide(dioxyde de carbone alimentaire liquide) - dioxyde de carbone liquéfié stocké sous haute pression (~ 65-70 Atm). Liquide incolore. Lorsque du dioxyde de carbone liquide est libéré d’un cylindre dans l’atmosphère, une partie s’évapore et l’autre partie forme des flocons de neige carbonique.
Bouteilles de dioxyde de carbone liquide largement utilisé comme extincteur et pour la production d'eau gazeuse et de limonade.
Gaz carbonique Il est utilisé comme agent protecteur lors du soudage avec du fil, mais à haute température, il se dissocie et libère de l'oxygène. L'oxygène libéré oxyde le métal. A cet égard, il est nécessaire d'introduire dans le fil de soudure des agents désoxydants tels que le manganèse et le silicium. Une autre conséquence de l'influence de l'oxygène, également associée à l'oxydation, est une forte diminution tension superficielle, ce qui conduit entre autres à des projections de métal plus intenses que lors d'un soudage à l'argon ou à l'hélium.
Dioxyde de carbone dans les canettes utilisé dans les armes à air comprimé et comme source d'énergie pour les moteurs dans la modélisation aéronautique.
Dioxyde de carbone solide - neige carbonique- utilisé dans les glaciers. Le dioxyde de carbone liquide est utilisé comme réfrigérant et fluide de travail dans les centrales thermiques (réfrigérateurs, congélateurs, générateurs d'énergie solaire, etc.).
"Glace carbonique" et autres propriétés bénéfiques du dioxyde de carbone
Le dioxyde de carbone est largement utilisé dans la pratique quotidienne. Par exemple, l’eau gazeuse additionnée d’essences aromatiques est une merveilleuse boisson rafraîchissante. Dans l'industrie alimentaire, le dioxyde de carbone est également utilisé comme conservateur - il est indiqué sur l'emballage sous le code E290
, et également comme agent de levage de la pâte.
Des extincteurs à dioxyde de carbone sont utilisés en cas d'incendie. Les biochimistes ont découvert que fertiliser l'air avec du dioxyde de carbone est un moyen très efficace d'augmenter le rendement de diverses cultures. Cet engrais présente peut-être un inconvénient unique, mais important : il ne peut être utilisé que dans les serres. Dans les usines qui produisent du dioxyde de carbone, le gaz liquéfié est conditionné dans des bouteilles en acier et envoyé aux consommateurs. Si vous ouvrez la valve, la neige sort avec un sifflement. Quel genre de miracle ?
Tout est expliqué simplement. Le travail nécessaire à la compression du gaz est nettement inférieur à celui nécessaire à sa détente. Et afin de compenser d'une manière ou d'une autre le déficit qui en résulte, le dioxyde de carbone est fortement refroidi, se transformant en « neige carbonique ». Il est largement utilisé pour la conservation produits alimentaires et avant glace ordinaire présente des avantages significatifs : d'une part, sa « capacité de refroidissement » est deux fois plus élevée par unité de poids ; deuxièmement, il s'évapore sans laisser de trace.
Le dioxyde de carbone est utilisé comme milieu actif dans le soudage au fil, puisqu'à la température de l'arc, le dioxyde de carbone se décompose en monoxyde de carbone Le CO et l'oxygène, qui, à leur tour, interagissent avec le métal liquide et l'oxydent.
Le dioxyde de carbone contenu dans les canettes est utilisé dans les armes à air comprimé et comme source d'énergie pour les moteurs de modélisme aéronautique.
Indicateurs de qualité du dioxyde de carbone GOST 8050-85
|
Nom de l'indicateur |
Incolore et inodore. Le régulateur le plus important de la circulation sanguine et de la respiration. Non toxique. Sans cela, il n'y aurait pas de petits pains riches ni de boissons gazeuses agréablement acidulées. À partir de cet article, vous apprendrez ce qu'est le dioxyde de carbone et comment il affecte le corps humain. La plupart d'entre nous ne se souviennent pas bien du cours de physique et de chimie, mais nous le savons : les gaz sont invisibles et, en règle générale, intangibles, et donc insidieux. Par conséquent, avant de répondre à la question de savoir si le dioxyde de carbone est nocif pour le corps, rappelons-nous de quoi il s'agit. Couverture de terre- gaz carbonique. Il s'agit également du dioxyde de carbone, du monoxyde de carbone (IV) ou de l'anhydride carbonique. Dans des conditions normales, il s’agit d’un gaz incolore et inodore au goût aigre. Sous la pression atmosphérique, le dioxyde de carbone a deux état d'agrégation: gazeux (le dioxyde de carbone est plus lourd que l'air, peu soluble dans l'eau) et solide (à -78 ºС il se transforme en neige carbonique). Le dioxyde de carbone est l'un des principaux composants environnement. On le trouve dans l’air et les eaux minérales souterraines, est libéré lors de la respiration des humains et des animaux et participe à la photosynthèse des plantes. Le dioxyde de carbone influence activement le climat. Il régule les échanges thermiques de la planète : il transmet le rayonnement ultraviolet et bloque le rayonnement infrarouge. À cet égard, le dioxyde de carbone est parfois appelé la couverture terrestre. L'O2 est de l'énergie. CO2 - étincelleLe dioxyde de carbone accompagne une personne tout au long de sa vie. En tant que régulateur naturel de la respiration et de la circulation sanguine, le dioxyde de carbone fait partie intégrante du métabolisme.
En inhalant, une personne remplit ses poumons d'oxygène. Dans le même temps, un échange bidirectionnel se produit dans les alvéoles (« bulles » spéciales des poumons) : l'oxygène passe dans le sang et du dioxyde de carbone en est libéré. L'homme expire. Le CO2 est l'un des produits finaux métabolisme. Au sens figuré, l’oxygène est de l’énergie et le dioxyde de carbone est l’étincelle qui l’enflamme. En inhalant environ 30 litres d'oxygène par heure, une personne émet 20 à 25 litres de dioxyde de carbone. Le dioxyde de carbone n'est pas moins important pour le corps que l'oxygène. C'est un stimulant physiologique de la respiration : il agit sur le cortex cérébral et stimule le centre respiratoire. Le signal de la prochaine respiration n’est pas un manque d’oxygène, mais un excès de dioxyde de carbone. Après tout, le métabolisme des cellules et des tissus est continu et ses produits finaux doivent être constamment éliminés. De plus, le dioxyde de carbone affecte la sécrétion d'hormones, l'activité enzymatique et la vitesse des processus biochimiques. Équilibre des échanges gazeuxLe dioxyde de carbone est non toxique, non explosif et absolument inoffensif pour l'homme. Cependant, l’équilibre entre le dioxyde de carbone et l’oxygène est extrêmement important pour une vie normale. Le manque et l’excès de dioxyde de carbone dans le corps entraînent respectivement une hypocapnie et une hypercapnie. Hypocapnie- manque de CO2 dans le sang. Cela se produit à la suite d’une respiration profonde et rapide, lorsque plus d’oxygène pénètre dans le corps que nécessaire. Par exemple, lors d’une activité physique trop intense. Les conséquences peuvent varier : de légers étourdissements à la perte de conscience. Hypercapnie- un excès de CO2 dans le sang. Une personne (avec l'oxygène, l'azote, la vapeur d'eau et les gaz inertes) contient 0,04 % de dioxyde de carbone et en expire 4,4 %. Si vous êtes dans une petite pièce mal ventilée, la concentration de dioxyde de carbone peut dépasser la norme. En conséquence, des maux de tête, des nausées et une somnolence peuvent survenir. Mais le plus souvent l’hypercapnie accompagne des situations extrêmes : dysfonctionnement de l’appareil respiratoire, rétention de sa respiration sous l’eau, etc. Ainsi, contrairement à l’opinion de la plupart des gens, le dioxyde de carbone, dans les quantités fournies par la nature, est nécessaire à la vie et à la santé humaine. De plus, il a trouvé de nombreuses applications industrielles et apporte de nombreux avantages pratiques aux personnes. Des bulles pétillantes au service des chefsLe CO2 est utilisé dans de nombreux domaines. Mais c’est peut-être dans l’industrie alimentaire et la cuisine que le dioxyde de carbone est le plus demandé. Le dioxyde de carbone se forme dans la pâte levée sous l'influence de la fermentation. Ce sont ses bulles qui détendent la pâte, la rendant aérée et augmentant son volume.
Ces boissons sont populaires auprès de millions de consommateurs à travers le monde, en grande partie grâce aux bulles pétillantes qui éclatent si drôlement dans le verre et « piquent » le nez si agréablement. Le dioxyde de carbone contenu dans les boissons gazeuses peut-il contribuer à l'hypercapnie ou causer d'autres dommages à un corps sain ? Bien sûr que non! Premièrement, le dioxyde de carbone utilisé dans la préparation des boissons gazeuses est spécialement préparé pour être utilisé dans l'industrie alimentaire. Dans les quantités dans lesquelles il est contenu dans la soude, il est absolument inoffensif pour le corps des personnes en bonne santé. Deuxièmement, la majeure partie du dioxyde de carbone s’évapore immédiatement après l’ouverture de la bouteille. Les bulles restantes « s'évaporent » pendant le processus de consommation, ne laissant derrière elles qu'un sifflement caractéristique. En conséquence, une quantité négligeable de dioxyde de carbone pénètre dans l’organisme. « Alors pourquoi les médecins interdisent-ils parfois de boire des boissons gazeuses ? - tu demandes. Selon la candidate en sciences médicales, la gastro-entérologue Alena Alexandrovna Tyazheva, cela est dû au fait qu'il existe un certain nombre de maladies. tube digestif, dans lequel un régime strict spécial est prescrit. La liste des contre-indications comprend non seulement les boissons contenant des gaz, mais également de nombreux produits alimentaires. Une personne en bonne santé peut facilement inclure une quantité modérée de boissons gazeuses dans son alimentation et s'autoriser un verre de cola de temps en temps. ConclusionLe dioxyde de carbone est nécessaire à la vie de la planète et de chaque organisme. Le CO2 affecte le climat en agissant comme une sorte de couverture. Sans cela, le métabolisme est impossible : les produits métaboliques quittent le corps avec du dioxyde de carbone. C’est également un composant indispensable des boissons gazeuses préférées de tous. C'est le dioxyde de carbone qui crée des bulles ludiques qui vous chatouillent le nez. En même temps, il est absolument sans danger pour une personne en bonne santé. Le dioxyde de carbone (dioxyde de carbone, dioxyde de carbone, CO 2) est formé par l'interaction de deux éléments : l'oxygène et le carbone. Le dioxyde de carbone est produit par la combustion de composés d'hydrocarbures ou de charbon, par la fermentation de liquides, ainsi que par la respiration animale et humaine. On le trouve dans l'atmosphère en petites quantités. Les plantes absorbent le dioxyde de carbone de l’atmosphère et le transforment en composants organiques. Lorsque ce gaz disparaîtra de l’atmosphère, il n’y aura pratiquement plus de pluie sur Terre et la température deviendra sensiblement plus fraîche. Propriétés du dioxyde de carboneLe dioxyde de carbone est plus lourd que l'air. Il gèle à -78 °C. Lorsque le dioxyde de carbone gèle, il forme de la neige. En solution, le dioxyde de carbone forme de l'acide carbonique. En raison de certaines propriétés, le dioxyde de carbone est parfois appelé la « couverture » de la Terre. Il laisse passer facilement les rayons ultraviolets. Les rayons infrarouges sont émis depuis la surface du dioxyde de carbone vers l’espace. Le dioxyde de carbone est libéré sous forme liquide à basse température, sous forme liquide à haute pression et sous forme gazeuse. La forme gazeuse du dioxyde de carbone est obtenue à partir des gaz résiduaires lors de la production d'alcools, d'ammoniac et également à la suite de la combustion de carburants. Le dioxyde de carbone est un gaz non toxique et non explosif, inodore et incolore. Sous forme liquide, le dioxyde de carbone est un liquide incolore et inodore. Lorsque la teneur est supérieure à 5 %, le dioxyde de carbone s'accumule au sol dans les zones mal ventilées. Une diminution de la fraction volumique d'oxygène dans l'air peut entraîner un manque d'oxygène et une suffocation. Les embryologistes ont découvert que les cellules humaines et animales ont besoin d’environ 7 % de dioxyde de carbone et de seulement 2 % d’oxygène. Le dioxyde de carbone est un tranquillisant système nerveux et une excellente anesthésie. Le gaz présent dans le corps humain participe à la synthèse des acides aminés et a un effet vasodilatateur. Un manque de dioxyde de carbone dans le sang entraîne des spasmes des vaisseaux sanguins et des muscles lisses de tous les organes, une augmentation de la sécrétion dans les voies nasales, les bronches et le développement de polypes et de végétations adénoïdes, ainsi qu'un épaississement des membranes dû au dépôt de cholestérol. . Production de dioxyde de carboneIl existe plusieurs façons de produire du dioxyde de carbone. Dans l'industrie, le dioxyde de carbone est obtenu à partir de la dolomite, du calcaire - produits de la décomposition des carbonates naturels, ainsi que des gaz de four. Le mélange gazeux est lavé avec une solution de carbonate de potassium. Le mélange absorbe le dioxyde de carbone et se transforme en bicarbonate. La solution de bicarbonate est chauffée et se décompose, libérant du dioxyde de carbone. Dans la méthode de production industrielle, le dioxyde de carbone est pompé dans des cylindres. Dans les laboratoires, la production de dioxyde de carbone repose sur l'interaction des bicarbonates et des carbonates avec des acides. Applications du dioxyde de carboneDans la pratique quotidienne, le dioxyde de carbone est utilisé assez souvent. Dans l’industrie alimentaire, le dioxyde de carbone est utilisé comme agent levant pour la pâte et également comme conservateur. Il est indiqué sur l'emballage du produit sous le code E290. Les propriétés du dioxyde de carbone sont également utilisées dans la production d’eau gazeuse.
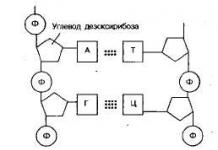
Dans l’industrie du parfum, le dioxyde de carbone est utilisé dans la fabrication des parfums. En médecine, le dioxyde de carbone est utilisé pour ses effets antiseptiques lors d'opérations ouvertes. Une fois refroidi, le dioxyde de carbone se transforme en « neige carbonique ». Le dioxyde de carbone liquéfié est conditionné dans des cylindres et envoyé aux consommateurs. Le dioxyde de carbone sous forme de « glace carbonique » est utilisé pour conserver les aliments. Lorsqu'elle est chauffée, cette glace s'évapore sans laisser de résidus. Le dioxyde de carbone est utilisé comme milieu actif dans le soudage au fil. Lors du soudage, le dioxyde de carbone se décompose en oxygène et monoxyde de carbone. L'oxygène interagit avec le métal liquide et l'oxyde. Dans la modélisation aéronautique, le dioxyde de carbone est utilisé comme source d’énergie pour les moteurs. Les cartouches de dioxyde de carbone sont utilisées dans les pistolets à air comprimé. Les processus les plus courants de formation de ce composé sont la pourriture des restes animaux et végétaux, la combustion divers types combustibles, respiration des animaux et des plantes. Par exemple, une personne émet chaque jour environ un kilogramme de dioxyde de carbone dans l’atmosphère. Le monoxyde et le dioxyde de carbone peuvent également se former dans la nature inanimée. Le dioxyde de carbone est libéré lors de l'activité volcanique et peut également être produit à partir de sources d'eau minérale. Le dioxyde de carbone se trouve en petites quantités dans l'atmosphère terrestre. Particularités structure chimique Ce composé lui permet de participer à de nombreuses réactions chimiques dont la base est le dioxyde de carbone. FormuleDans le composé de cette substance, l'atome de carbone tétravalent forme une liaison linéaire avec deux molécules d'oxygène. L’apparition d’une telle molécule peut être représentée comme suit :
La théorie de l'hybridation explique la structure de la molécule de dioxyde de carbone comme suit : les deux liaisons sigma existantes se forment entre les orbitales sp des atomes de carbone et les deux orbitales 2p de l'oxygène ; Les orbitales p du carbone, qui ne participent pas à l'hybridation, sont liées en conjonction avec des orbitales similaires de l'oxygène. DANS réactions chimiques le dioxyde de carbone s'écrit : CO 2. Propriétés physiquesDans des conditions normales, le dioxyde de carbone est un gaz incolore et inodore. Il est plus lourd que l’air, c’est pourquoi le dioxyde de carbone peut se comporter comme un liquide. Par exemple, il peut être versé d’un récipient à un autre. Cette substance est légèrement soluble dans l'eau - environ 0,88 litre de CO 2 se dissolvent dans un litre d'eau à 20 ⁰C. Une légère baisse de température change radicalement la donne : 1,7 litre de CO 2 peut se dissoudre dans le même litre d'eau à 17⁰C. Avec un fort refroidissement, cette substance précipite sous forme de flocons de neige - ce qu'on appelle la « glace carbonique » se forme. Ce nom vient du fait qu'à pression normale, la substance, contournant la phase liquide, se transforme immédiatement en gaz. Le dioxyde de carbone liquide se forme à une pression juste supérieure à 0,6 MPa et à température ambiante.
Propriétés chimiquesLorsqu'il interagit avec des agents oxydants puissants, le dioxyde de carbone 4 présente des propriétés oxydantes. La réaction typique de cette interaction est : C + CO2 = 2CO. Ainsi, à l'aide du charbon, le dioxyde de carbone est réduit à sa modification divalente - le monoxyde de carbone. Dans des conditions normales, le dioxyde de carbone est inerte. Mais certains métaux actifs peuvent y brûler, éliminant l’oxygène du composé et libérant du carbone. Une réaction typique est la combustion du magnésium : 2Mg + CO2 = 2MgO + C. Au cours de la réaction, de l'oxyde de magnésium et du carbone libre se forment.
Dans les composés chimiques, le CO 2 présente souvent les propriétés d'un oxyde d'acide typique. Par exemple, il réagit avec les bases et les oxydes basiques. Le résultat de la réaction est des sels d'acide carbonique. Par exemple, la réaction d'un composé d'oxyde de sodium avec du dioxyde de carbone peut être représentée comme suit : Na 2 O + CO 2 = Na 2 CO 3; 2NaOH + CO 2 = Na 2 CO 3 + H 2 O; NaOH + CO 2 = NaHCO 3. Solution d'acide carbonique et de CO 2Le dioxyde de carbone dans l'eau forme une solution avec dans une faible mesure dissociation. Cette solution de dioxyde de carbone est appelée acide carbonique. Il est incolore, faiblement exprimé et a un goût aigre. Enregistrer une réaction chimique : CO 2 + H 2 O ↔ H 2 CO 3. L'équilibre se déplace assez fortement vers la gauche : seulement 1 % environ du dioxyde de carbone initial est converti en acide carbonique. Plus la température est élevée, moins il y a de molécules d'acide carbonique dans la solution. Lorsque le composé bout, il disparaît complètement et la solution se désintègre en dioxyde de carbone et en eau. Formule structurelle l'acide carbonique est présenté ci-dessous.
Propriétés de l'acide carboniqueL'acide carbonique est très faible. Dans les solutions, il se décompose en ions hydrogène H+ et en composés HCO 3 -. Les ions CO 3 - se forment en très petites quantités. L'acide carbonique est dibasique, donc les sels qu'il forme peuvent être moyens et acides. Dans la tradition chimique russe, les sels moyens sont appelés carbonates et les sels forts sont appelés bicarbonates. Réaction qualitativeUn des moyens possibles la détection du dioxyde de carbone gazeux est un changement dans la transparence du mortier de chaux. Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O. Cette expérience est également connue de cours scolaire chimie. Au début de la réaction, une petite quantité de précipité blanc se forme, qui disparaît ensuite lorsque le dioxyde de carbone passe dans l'eau. Le changement de transparence se produit parce qu'au cours du processus d'interaction, un composé insoluble - le carbonate de calcium - est transformé en une substance soluble - le bicarbonate de calcium. La réaction se déroule selon ce chemin : CaCO 3 + H 2 O + CO 2 = Ca(HCO 3) 2. Production de dioxyde de carboneSi vous avez besoin d'obtenir une petite quantité de CO2, vous pouvez démarrer la réaction de l'acide chlorhydrique avec le carbonate de calcium (marbre). La notation chimique de cette interaction ressemble à ceci : CaCO 3 + HCl = CaCl 2 + H 2 O + CO 2. Également à cette fin, des réactions de combustion de substances contenant du carbone, par exemple l'acétylène, sont utilisées : CH 4 + 2O 2 → 2H 2 O + CO 2 -. Un appareil Kipp est utilisé pour collecter et stocker la substance gazeuse résultante. Pour les besoins de l'industrie et Agriculture l’échelle de production de dioxyde de carbone doit être importante. Une méthode populaire pour cette réaction à grande échelle consiste à brûler du calcaire, qui produit du dioxyde de carbone. La formule de la réaction est donnée ci-dessous : CaCO 3 = CaO + CO 2. Applications du dioxyde de carboneL’industrie alimentaire, après la production à grande échelle de « glace carbonique », s’est tournée vers une méthode fondamentalement nouvelle de conservation des aliments. Il est indispensable dans la production de boissons gazeuses et d'eau minérale. La teneur en CO 2 des boissons leur confère de la fraîcheur et augmente considérablement leur durée de conservation. Et la carbidisation des eaux minérales permet d'éviter le moisi et le goût désagréable.
En cuisine, le mode de remboursement est souvent utilisé. acide citrique vinaigre. Le dioxyde de carbone libéré au cours de ce processus confère du moelleux et de la légèreté aux produits de confiserie. Ce composé est souvent utilisé comme additif alimentaire pour augmenter la durée de conservation des produits alimentaires. Selon les normes internationales de classification des additifs chimiques contenus dans les produits, il est codé E 290, Le dioxyde de carbone en poudre est l'une des substances les plus populaires incluses dans les mélanges d'extinction d'incendie. Cette substance se retrouve également dans la mousse des extincteurs. Il est préférable de transporter et de stocker le dioxyde de carbone dans des cylindres métalliques. À des températures supérieures à 31⁰C, la pression dans la bouteille peut atteindre un niveau critique et le CO 2 liquide entrera dans un état supercritique avec une forte augmentation de la pression de fonctionnement jusqu'à 7,35 MPa. Le cylindre métallique peut résister à une pression interne jusqu'à 22 MPa, de sorte que la plage de pression à des températures supérieures à trente degrés est considérée comme sûre. 4,3 sur 5Gaz carbonique - composé chimique, qui est formé par l’interaction de l’oxygène et du carbone, cette substance est également appelée dioxyde de carbone, dioxyde de carbone ou anhydride carbonique. Propriétés du dioxyde de carbone, préparationComme vous le savez, le dioxyde de carbone est contenu dans l’atmosphère terrestre ; ce composé est libéré dans l’air à la suite du processus respiratoire des animaux et des humains. Les plantes absorbent le dioxyde de carbone pendant la photosynthèse, c'est-à-dire pendant la journée, et le libèrent également la nuit. De plus, le dioxyde de carbone est contenu dans les minéraux, et une certaine quantité doit certainement être présente dans les cellules du corps humain et animal, puisque, par exemple, il entretient et régule le tonus vasculaire. Selon leur propre propriétés physiques Le dioxyde de carbone est un gaz incolore et inodore au goût légèrement aigre. Lorsqu'elle est fortement refroidie, elle peut cristalliser et se transformer en ce qu'on appelle la « glace carbonique », que l'humanité a trouvé de nombreuses façons d'utiliser. Les propriétés chimiques du dioxyde de carbone sont les suivantes:
Dans la nature, le dioxyde de carbone existe à la suite de réactions oxydatives dans les organismes vivants et dans les minéraux. À l’échelle industrielle, le dioxyde de carbone est produit de plusieurs manières :
Comment le dioxyde de carbone est-il utilisé ?À ce jour, le dioxyde de carbone est activement utilisé dans de nombreux domaines et industries :
Comment le dioxyde de carbone affecte-t-il le corps humain ?
Comment complément alimentaire le dioxyde de carbone est reconnu comme « sans danger sous certaines conditions » et son utilisation est autorisée dans presque tous les pays du monde, y compris la Russie. Cependant, selon les experts, une consommation excessive, par exemple dans les boissons gazeuses, de dioxyde de carbone, dont le danger réside dans sa capacité à augmenter l'absorption intestinale, peut entraîner les conséquences désagréables suivantes :
Bien que le dioxyde de carbone ne soit pas toxique, des concentrations élevées dans l’air inhalé peuvent être dangereuses. Avec une légère augmentation des niveaux de dioxyde de carbone, une personne se sent faible et somnolente, mais si des symptômes tels qu'étouffement, vertiges, déficience auditive ou même perte de conscience sont observés, la concentration de dioxyde de carbone dans l'air est excessive. Le préjudice du dioxyde de carbone dans ce cas sera l'hypercapnie(une condition dans laquelle la concentration de dioxyde de carbone dans le sang augmente fortement), ce qui peut même entraîner la mort par suffocation. Articles populaires |
|---|


 A l'aide du dioxyde de carbone, diverses boissons rafraîchissantes sont fabriquées : kvas, eau minérale et autres sodas appréciés des enfants et des adultes.
A l'aide du dioxyde de carbone, diverses boissons rafraîchissantes sont fabriquées : kvas, eau minérale et autres sodas appréciés des enfants et des adultes. Les biochimistes ont découvert que pour augmenter le rendement de diverses cultures, il est très efficace de fertiliser l'air avec du dioxyde de carbone. Cependant, cette méthode de fertilisation ne peut être utilisée qu’en serre. En agriculture, le gaz est utilisé pour créer de la pluie artificielle. Lors de la neutralisation d'un environnement alcalin, le dioxyde de carbone remplace les acides minéraux puissants. Dans les installations de stockage de légumes, le dioxyde de carbone est utilisé pour créer un environnement gazeux.
Les biochimistes ont découvert que pour augmenter le rendement de diverses cultures, il est très efficace de fertiliser l'air avec du dioxyde de carbone. Cependant, cette méthode de fertilisation ne peut être utilisée qu’en serre. En agriculture, le gaz est utilisé pour créer de la pluie artificielle. Lors de la neutralisation d'un environnement alcalin, le dioxyde de carbone remplace les acides minéraux puissants. Dans les installations de stockage de légumes, le dioxyde de carbone est utilisé pour créer un environnement gazeux.