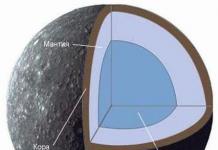
Elle peut être exprimée aussi bien en unités adimensionnelles (fractions, pourcentages) qu'en quantités dimensionnelles (fractions massiques, molarité, titres, fractions molaires).
Concentration- il s'agit de la composition quantitative de la substance dissoute (en unités spécifiques) par unité de volume ou de masse. Étiquetez le soluté - X, et le solvant - S. Le plus souvent j'utilise la notion de molarité (concentration molaire) et de fraction molaire.
1. (ou pourcentage de concentration d'une substance) est le rapport de la masse de la substance dissoute mà la masse totale de la solution. Pour une solution binaire constituée d’un soluté et d’un solvant :
ω - fraction massique de substance dissoute ;
m en va- masse de substance dissoute ;
msolution- masse de solvant.
La fraction massique est exprimée en fractions d'unité ou en pourcentage.
2. Concentration molaire ou molarité est le nombre de moles de soluté dans un litre de solution V:
 ,
,
C- concentration molaire de la substance dissoute, mol/l (la désignation est également possible M., Par exemple, 0,2 MHCl);
n
V- volume de solution, l.
La solution s'appelle molaire ou unimolaire, si 1 mole de substance est dissoute dans 1 litre de solution, décimolaire- 0,1 mole de la substance est dissoute, centimolaire- 0,01 mole de la substance sont dissoutes, millimolaire- 0,001 mole de la substance sont dissoutes.
3. Concentration molale(molalité) de la solution C(x) montre le nombre de taupes n substance dissoute dans 1 kg de solvant m:
 ,
,
C(x)- molalité, mol/kg ;
n- quantité de substance dissoute, mol ;
mr-la- masse de solvant, kg.
4. - teneur en substance en grammes dans 1 ml de solution :
 ,
,
T- titre de la substance dissoute, g/ml ;
m en va- masse de substance dissoute, g ;
Solution en V- volume de solution, ml.
5. - quantité sans dimension égale au rapport de la quantité de substance dissoute nà la quantité totale de substances en solution :
 ,
,
N- fraction molaire de la substance dissoute ;
n- quantité de substance dissoute, mol ;
nr-la- quantité de substance solvante, mol.
La somme des fractions molaires doit être égale à 1 :
N(X) + N(S) = 1.
Où N(X) X;
N(S) - fraction molaire du soluté S.
Parfois, lors de la résolution de problèmes, il est nécessaire de passer d'une unité d'expression à une autre :

ω(X) - fraction massique de substance dissoute, en % ;
M(X)- masse molaire de la substance dissoute ;
ρ = m/(1000 V) est la densité de la solution.6. - le nombre d'équivalents-grammes d'une substance donnée dans un litre de solution.
Gramme équivalent de la substance- le nombre de grammes d'une substance, numériquement égal à son équivalent.
Équivalent est une unité conventionnelle équivalente à un ion hydrogène dans les réactions acide-base ou à un électron dans les réactions redox.
Pour enregistrer la concentration de ces solutions, des abréviations sont utilisées n ou N. Par exemple, une solution contenant 0,1 mol-eq/l est appelée décinormale et s’écrit 0,1 n.
 ,
,
C N- concentration normale, équivalent molaire/l ;
z- numéro d'équivalence ;
Solution en V- volume de solution, l.
Solubilité substance S - la masse maximale d'une substance pouvant se dissoudre dans 100 g de solvant :

Coefficient de solubilité- le rapport de la masse d'une substance formant une solution saturée à une température déterminée à la masse du solvant :

Concentration de particules (molécules, atomes, etc.) d'un système homogène
où V - volume du système.
Équation de base de la théorie cinétique des gaz
p= 2 /зn< p >,
Où R. - Pression du gaz;< P.>- énergie cinétique moyenne* du mouvement de translation d'une molécule.
Énergie cinétique moyenne :
par degré de liberté de la molécule
attribuable à tous les degrés de liberté de la molécule (énergie totale de la molécule)
mouvement de translation d'une molécule
 ,
,
où k - constante de Boltzmann ; T - température thermodynamique ; i est le nombre de degrés de liberté de la molécule ;
mouvement de rotation de la molécule

Dépendance de la pression du gaz sur la concentration des molécules et de la température
p=n k T.
Vitesse des molécules :
carré moyen
 , ou
, ou  ;
;
moyenne arithmétique
 , ou
, ou  ;
;
le plus probable
 , ou
, ou  ,
,
où m 1 - masse d'une molécule.
Exemples de résolution de problèmes
Exemple 1. Une bouteille d'une capacité de V = 6,9 litres contient de l'azote d'une masse de m = 2,3 g. Lorsqu'elles sont chauffées, certaines molécules se dissocient en atomes. Coefficient de dissociation* =0,2. Déterminer : 1) le nombre total N 1 molécules et concentration n 1 molécules d'azote avant chauffage ; 2) concentration n 2 molécules et n 3 atomes d'azote après chauffage.
Solution. Par définition, la concentration de particules de gaz est le rapport entre le nombre de particules et la capacité du récipient occupé par le gaz :
n=N/V. (1)
1. Numéro N 1 molécules de gaz avant chauffage on trouve à partir de la relation
 .
(2)
.
(2)
Où v- quantité de substance azotée ; n un - constante d'Avogadro ; M. - masse molaire d'azote ; M. r - poids moléculaire relatif de l'azote ; k=10 -3 kg/mol (voir exemple 1 p. 114). En substituant les valeurs des quantités dans (2), on obtient
*Voir la note sur le problème 8.15.
Concentration n 1 sera trouvé en substituant les valeurs des quantités en (1) :
2. On trouve la concentration après chauffage à partir de la relation
 , (3)
, (3)
Où N- le nombre de molécules qui ne se sont pas décomposées en atomes.
Après avoir substitué les valeurs des quantités dans (3), on obtient
Concentration atomique après chauffage de l'azote
 . (4)
. (4)
Le chiffre 2 dans la formule (4) exprime le fait que chaque molécule après désintégration produit deux atomes.
Remplaçons les valeurs des quantités dans (4) et effectuons les calculs :
Exemple
2.
Un ballon d'une capacité de V = 0,5 l contient de l'oxygène dans des conditions normales. Déterminer l'énergie moyenne  mouvement de translation de toutes les molécules contenues dans le flacon.
mouvement de translation de toutes les molécules contenues dans le flacon.
Solution.Énergie moyenne  le mouvement de translation de toutes les molécules peut être exprimé par la relation
le mouvement de translation de toutes les molécules peut être exprimé par la relation
 ,
(1)
,
(1)
Où< п >- l'énergie moyenne du mouvement de translation d'une molécule ; N- le nombre de toutes les molécules contenues dans le flacon.
Comme on le sait,
 ,
(2)
,
(2)
où k - constante de Boltzmann ; T - température thermodynamique.
On trouve le nombre de molécules contenues dans le flacon à l'aide de la formule
N=vN A, (3)
Où v- quantité de substance oxygénée ; N A est la constante d'Avogadro.
Nous trouverons la quantité de substance v à partir des considérations suivantes : on sait que dans des conditions normales le volume molaire Vm est égal à 22,410-3 m3/mol. Puisque, selon les conditions du problème, l'oxygène dans le ballon est dans des conditions normales, la quantité d'oxygène dans le ballon est exprimée par la relation
v=V/Vm. (4)
Remplacer l'expression v de (4) à (3), on obtient
N=V N A/Vm . (5)
Compte tenu de (2) et (5), l'expression (1) de l'énergie de mouvement de translation des molécules prend la forme 
Vérifions si le côté droit de la formule de calcul donne l'unité d'énergie (joule). Pour ce faire, aux symboles des grandeurs, on substitue les unités dans lesquelles ces grandeurs sont exprimées :
En substituant les valeurs des quantités dans (6) et en effectuant les calculs, on trouve
Exemple 3. Trouvez l'énergie cinétique moyenne d'une molécule d'ammoniac NH 3 à une température t=27 °C et l'énergie moyenne de mouvement de rotation de cette molécule à la même température.
Solution. L'énergie totale moyenne d'une molécule est déterminée par Par formule
 (1)
(1)
Où je - nombre de degrés de liberté d'une molécule ; k - constante de Boltzmann ; T- température thermodynamique du gaz : T=t+ T 0 , où T 0 =273K.
Nombre de degrés de liberté je une molécule tétraatomique, comme la molécule d'ammoniac, est égale à 6.
Remplaçons les valeurs des quantités en (l) :
L'énergie moyenne du mouvement de rotation d'une molécule est déterminée par la formule
 ,
(2)
,
(2)
où le chiffre 3 signifie le nombre de degrés de liberté de mouvement de translation.
Remplaçons les valeurs des quantités dans (2) et calculons :
Notez que l’énergie du mouvement de rotation des molécules d’ammoniac pourrait être obtenue différemment en divisant l’énergie totale () en deux parties égales. Le fait est que pour trois (ou plus) molécules atomiques, le nombre de degrés de liberté par mouvement de translation et de rotation est le même (3 chacun), donc les énergies de mouvement de translation et de rotation sont les mêmes. Dans ce cas
La concentration mentale peut être définie comme la capacité de concentrer notre attention sur une chose à l’exclusion de tout le reste. Nous pouvons généralement nous concentrer uniquement sur les choses qui nous intéressent vraiment, mais nous avons du mal à prêter une attention constante aux choses qui ne nous intéressent pas particulièrement.
Contrairement aux idées reçues, une concentration intense sur une tâche particulière n’entraîne pas une dépense énergétique plus importante ; au contraire, elle la diminue. En pratique, lorsqu'une personne essaie d'économiser de l'énergie, elle effectue son travail sans désir, pensant que moins d'effort lui permet de dépenser moins d'énergie. Cependant, une personne ne se rend pas compte que le manque d'enthousiasme conduit à la coexistence de deux positions opposées : une réticence interne à travailler et un besoin vital de le faire.
La tension nerveuse est toujours le résultat de l’action de forces opposées, ce qui conduit à la rupture psychophysique d’une personne. En l’absence de dualité, une personne a un meilleur contrôle sur elle-même et évite le gaspillage d’énergie, inévitable lorsqu’on se concentre sur plusieurs objets en même temps. Nous savons que l'anxiété épuise considérablement les mécanismes de défense de l'organisme, créant une tension nerveuse et obligeant une personne à « travailler pour s'épuiser ». Tout ce sur quoi nous portons notre attention commence à nous « déranger » plus ou moins. Si notre attention est concentrée sur plusieurs choses à la fois, comme dans l’histoire de Charles M., donnée dans le chapitre « Existence réelle et vie imaginaire », cela augmente considérablement le degré d’anxiété. Beaucoup de nos perceptions, même subliminales, créent pour nous un problème, c'est-à-dire un stimulus pour une décision, une conclusion ou une certaine décision. état psychologique. Par exemple, un incident observé dans la rue et qui ne nous concerne pas directement provoque un travail intense du subconscient dans notre cerveau en réponse à une anxiété inconsciente.
Imaginons qu'en parcourant un journal, nous tombions sur un titre alarmant et que nous soyons vaguement conscients qu'il évoque une menace de guerre dans un certain point de la planète. Il peut arriver que notre subconscient, effrayé par une telle perspective, commence immédiatement à élaborer des plans pour assurer sa sécurité dans un tel cas. Pour l’imagination inconsciente, cela restera un problème non résolu qui devra être résolu d’une manière ou d’une autre et qui nous dérangera probablement pendant longtemps, surtout si d’autres nouvelles similaires nous parviennent. Ce n’est qu’une des nombreuses perceptions que nous avons tout au long de la journée. A ceux-ci, il faut ajouter tous ceux qui sont stockés dans notre mémoire et qui remontent facilement à la surface de la conscience si nous n'avons pas une certaine capacité de concentration mentale.
Plus une personne doit inclure de choses dans le champ de son attention à un moment donné, plus son « je » se fragmente. Pour cette raison, il devient impossible d'atteindre un niveau de conscience élevé, caractérisé par la présence d'un « je » indivisible, intégral et mature.
Il existe de nombreux degrés de concentration mentale, intensité correspondante attention. Laissant de côté cette gradation, nous distinguerons deux principaux types de concentration mentale : la concentration intense et la concentration calme. Chacun d'eux peut être volontaire ou involontaire. La concentration est volontaire, lorsqu'il existe un désir délibéré de fixer son attention sur une chose et d'exclure tout le reste, et involontaire, lorsque l'esprit est captivé par un stimulus. Nous ne considérerons que la concentration arbitraire.
La concentration volontaire est intense lorsqu'elle s'accompagne d'un effort musculaire visant à fixer et à rendre plus vivante une image mentale, abstraite ou concrète. Souvent, lorsqu'ils essaient de se concentrer sur quelque chose, les gens contractent les muscles de leur visage, par exemple en fronçant les sourcils, en serrant les mâchoires, ce qui en soi provoque un état. tension nerveuse.
Concentrons-nous sur un seul fait intéressant, ce qui est directement lié au sujet abordé ici. Nous parlons de certaines conséquences de l'état de tension, que nous n'avons pas encore évoquées.
Auparavant, nous considérions la tension comme une pathologie, c'est-à-dire comme une « tension excessive », et analysions les dommages qu'elle peut causer au corps humain. Néanmoins, comme déjà mentionné dans le premier chapitre, un état de tension est naturel et nécessaire à une vie active. La tension ne devient nocive que lorsqu’elle est excessive. Si nous parlons d'intelligence, alors le principal problème des gens est exactement le contraire du phénomène de tension nerveuse. Dans ce cas, une « atonie pathologique » se produit. Définissons la concentration mentale comme une tension de l'imagination, et la distraction comme une atonie de l'imagination. La tension « pure » de l’imagination ne doit pas être confondue avec un état d’agitation émotionnelle, qui provoque des pensées anxieuses conduisant à une tension excessive. Dans ce cas, une concentration involontaire se produit, sans la participation du « je ». La concentration consciente est toujours une action délibérée du Soi.
L'atonie intellectuelle, ou atonie du « je », est un manque de pensée consciente et une prédominance de l'activité subconsciente.
L’objectif principal de l’hypoconscience, comme nous l’avons déjà dit et comme en témoigne le nom lui-même, est d’atteindre un niveau de conscience plus élevé. Vous pouvez augmenter la conscience en renforçant et en atteignant la pleine maturité du « je ». La concentration augmente considérablement le tonus mental d'une personne et lui permet d'utiliser pleinement sa volonté et sa pensée créative.
Dans son livre « Mental Tone », Jean-Claude Fillou écrit ce qui suit : « La volonté, le courage, la persévérance, la maîtrise de soi et la capacité de rester calme dans les moments difficiles désignent des états dans lesquels la totalité de l'énergie d'une personne a un ton particulièrement élevé. . À l’inverse, les personnes passives, inertes et facilement excitables ont un tonus très bas, car elles gaspillent leurs forces en vain. Cela inclut également les asthéniques de tous types, les personnes impatientes, indécises et impuissantes - en un mot, ceux qui semblent destinés à être le jouet de forces extérieures, au lieu de s'établir par une adaptation active et consciente au monde extérieur et de laisser leur marque. dessus. » « Une personne persistante, par exemple, a une grande vitalité parce qu'elle sait utiliser sa force. Une personne instable et impulsive a un tonus insuffisant, car elle utilise mal ses pouvoirs et les gère mal.
Nous pourrions dire que le manque de tonus mental signifie une « faiblesse de conscience » due à de faibles niveaux d'« éveil » et, bien sûr, à un mauvais entraînement qui accompagne de faibles niveaux de conscience.
Concernant la relation entre concentration et dépense énergétique, on affirme généralement que, puisque la concentration nécessite beaucoup d’efforts, son niveau élevé ne peut pas contribuer à réduire la dépense énergétique. En fait, une concentration tranquille ne nécessite pas beaucoup d’efforts et constitue la capacité de conserver calmement une image mentale. Au contraire, la concentration, qui s'accompagne d'un effort nerveux considérable, entraîne sans doute une grande dépense d'énergie, surtout lorsqu'elle est involontaire et provoquée par une impulsion émotionnelle soudaine et forte.
En parlant de concentration, nous devrions également considérer le problème de l’incapacité d’une personne à libérer son esprit de certaines pensées, émotions, expériences ou sensations d’un passé lointain ou proche. Par exemple, tout complexe est une incapacité à se libérer du choc émotionnel du passé, qu'une personne considère comme faisant partie du présent.
On peut dire que la concentration ne provoque pas de fatigue, elle représente le tonus mental qui devrait être normal pour une personne. L’errance mentale est une hypotonie des pensées, elle ne favorise pas le repos ni ne réduit la dépense énergétique, mais provoque une baisse d’énergie. L'errance de l'imagination ne contribue pas au repos de l'esprit, mais augmente au contraire le nombre de stimuli dans l'esprit humain, dont chacun crée un autre problème qui nécessite sa propre solution.
Le seul repos véritablement efficace pour l’esprit vient d’un état qui peut être atteint en apprenant à libérer complètement son esprit des pensées, c’est-à-dire un état de « vide mental » dans lequel le flux des pensées s’arrête temporairement. Cet état peut être défini comme une « déconcentration » complète. La technique permettant d'atteindre la concentration mentale dépend invariablement de la question de savoir si une position émotionnelle et volontaire particulière a été atteinte dans laquelle une personne attache une signification exclusive et exclusive à l'activité, à l'objet ou à l'idée sur laquelle elle souhaite se concentrer. Il s'agit d'un état d'indifférence totale d'une personne envers tout ce qui ne fait pas l'objet de son intérêt. Le facteur clé de la technique de concentration est l'indifférence à l'égard des autres stimuli et idées, basée sur un effort volontaire. Il faut également mentionner un autre facteur très important : lorsqu'une personne se concentre correctement, elle vit dans le présent (voir chapitre « Existence vraie et imaginaire »).
Pour bien évaluer le mécanisme de concentration, donnons un exemple : il est beaucoup plus facile pour une personne de se concentrer si elle doit le faire, lorsqu'il existe une forte contrainte externe l'obligeant à terminer le travail ou à résoudre un problème dans un certain temps. cadre. Le processus de concentration sera encore plus facile s’il est puni pour ne pas avoir terminé une tâche à temps.
Lorsqu’une personne veut se concentrer sur quelque chose, elle doit accorder la plus grande importance à ce sur quoi elle va concentrer son attention. Il doit penser qu’il est très important pour lui d’accorder une attention exclusive au sujet qui l’intéresse et que c’est une « question de vie ou de mort ». La prochaine chose à retenir est l’utilisation correcte de la respiration. Il est nécessaire d'inspirer profondément pour parvenir, par la volonté, à la concentration de toute votre structure psychophysique. Pour maintenir votre concentration, vous devez concentrer votre attention, ce qui peut être obtenu grâce à un degré d’éveil plus élevé. L’état de concentration représente en réalité un degré plus élevé de vigilance de l’esprit. À l’inverse, l’incapacité à se concentrer est toujours causée par le sommeil mental, c’est-à-dire un faible niveau de conscience. Pour vous concentrer efficacement, vous devez éviter l’ennui et le sommeil mental et percevoir chaque idée, tâche ou objet comme si vous le rencontriez pour la première fois de votre vie.
Quantité équivalents de cette substance dans 1 litre de solution. La concentration normale est exprimée en mol-eq/l ou g-eq/l (c'est-à-dire en équivalents molaires). Pour enregistrer la concentration de telles solutions, les abréviations « n" ou " N" Par exemple, une solution contenant 0,1 équivalent molaire/l est appelée décinormale et s’écrit sous la forme 0,1 n.
La concentration normale peut varier en fonction de la réaction dans laquelle la substance est impliquée. Par exemple, une solution unmolaire de H 2 SO 4 sera une normale si elle est destinée à réagir avec un alcali pour former sulfate acide de potassium KHSO 4, et binormal dans la réaction pour former K 2 SO 4.
La molalité (concentration pondérale molaire, concentration molaire) est la quantité de soluté (nombre de moles) dans 1 000 g de solvant. Mesurée en moles par kg, l'expression « molalité » est également courante. Ainsi, une solution avec une concentration de 0,5 mol/kg est appelée 0,5-mol.
ν - quantité de soluté, taupe;
m 2 - masse de solvant, kg.
Une attention particulière doit être portée au fait que malgré la similitude des noms, la concentration molaire et la molalité sont des quantités différentes. Tout d'abord, contrairement à la concentration molaire, lors de l'expression de la concentration en molalité, le calcul est basé sur la masse solvant, et non par le volume de solution. La molalité, contrairement à la concentration molaire, ne dépend pas de la température.
Fraction molaire- le rapport du nombre de moles d'un composant donné au nombre total de moles de tous les composants. La fraction molaire est exprimée en fractions d'unité.
![]() ,
,
ν je - quantité jeème composant, mol;
n - nombre de composants ;
La pression de vapeur du solvant au-dessus de la solution. La loi de Raoult. Il existe un équilibre dynamique entre un liquide et sa vapeur saturée
liquide ↔ vapeur saturée,
ceux. le nombre de molécules liquides s'évaporant de la surface est égal au nombre de molécules qui se condensent. Cet équilibre correspond à la pression de vapeur saturée du solvant au-dessus du solvant pur. L'indice (1) indique que la propriété est relative au solvant ; (2) – au soluté et à l'exposant
(o) indique qu'il s'agit d'une propriété d'une substance à l'état pur ; dans ce cas, c'est une propriété d'un solvant pur. En 1882, le scientifique français Raoult formule la loi qui porte son nom : la pression de vapeur saturée d'un solvant au-dessus d'une solution est proportionnelle à la fraction molaire du solvant :
Expression de la masse molaire du soluté
![]() (7.5)
(7.5)
Par conséquent, en mesurant expérimentalement la pression de vapeur saturée du solvant au-dessus de la solution, la masse molaire du soluté peut être déterminée.
Points de congélation et d'ébullition des solutions. Ébullioscopie. Cryoscopie. Une diminution de la pression de vapeur saturée du solvant au dessus de la solution entraîne une augmentation du point d'ébullition et une diminution du point de congélation de la solution par rapport à un solvant pur.
Selon le premier corollaire de la loi de Raoult, l'augmentation du point d'ébullition et la diminution du point de congélation des solutions non électrolytiques sont directement proportionnelles à la concentration molaire du soluté :
ΔTébullition=ECm(2) (7,6)
ΔTzam..=KСm(2) (7,7),
où Сm(2)Сm(2) est la concentration molaire de la solution ; E - constantes ébullioscopiques et K - cryoscopiques, correspondant à une augmentation du point d'ébullition et une diminution du point de congélation d'une solution avec Cm(2) = 1 mol/1000 g de solvant. Les valeurs de E et K dépendent uniquement de la nature du solvant (tableau 7.1).
|
|
Selon le deuxième corollaire de la loi de Raoult : des quantités équimoléculaires de différents nonélectrolytes, dissoutes en quantités égales en masse d'un même solvant, augmentent le point d'ébullition ou abaissent le point de congélation du même nombre de degrés.
Osmose. La loi de Van't Hoff. Processus de transfert spontané de solvant
(diffusion) à travers une membrane semi-perméable, appelée osmose.
La pression qui doit être appliquée à une solution pour que l’osmose s’arrête est appelée pression osmotique. Si la pression appliquée à une solution plus concentrée est supérieure à la pression osmotique, alors le solvant se déplacera de solution en solvant. Le procédé s'appelle osmose inverse et est utilisé pour purifier les eaux naturelles et usées ; il peut notamment être utilisé pour le traitement de l'eau dans le domaine de l'énergie thermique.
La dépendance de la pression osmotique sur la température et la concentration est décrite par l'équation :
π = с(В)RT, (7.11)
où π – pression osmotique ; с(В) – concentration molaire de la substance dissoute, mol/l ; R – constante universelle des gaz ; T – température, K.
Loi de Van't Hoff : pression osmotique est égale à la pression qu'exercerait la substance dissoute si elle, étant à l'état gazeux à la même température, occupait le même volume qu'occupe la solution.
De la loi de Van't Hoff, il résulte que les solutions de divers non-électrolytes de même concentration, situées à la même température, sont isotoniques, c'est-à-dire ayant la même pression osmotique.
Principes de base de la théorie de la dissociation électrolytique
1. Les électrolytes, lorsqu'ils sont dissous dans l'eau, se décomposent (se dissocient) en ions - positifs et négatifs.
2. Sous influence courant électrique les ions acquièrent un mouvement directionnel : les particules chargées positivement se déplacent vers la cathode, les particules chargées négativement se déplacent vers l'anode. Par conséquent, les particules chargées positivement sont appelées cations et les particules chargées négativement sont appelées anions.
3. Le mouvement dirigé se produit à la suite de l'attraction de leurs électrodes chargées de manière opposée (la cathode est chargée négativement et l'anode est chargée positivement).
4. L'ionisation est un processus réversible : parallèlement à la désintégration des molécules en ions (dissociation), se produit le processus de combinaison des ions en molécules (association).
Sur la base de la théorie de la dissociation électrolytique, les définitions suivantes peuvent être données pour les principales classes de composés :
Les acides sont des électrolytes dont la dissociation ne produit que des ions hydrogène sous forme de cations. Par exemple,
HCl → H + + Cl - ;
La basicité d'un acide est déterminée par le nombre de cations hydrogène formés lors de la dissociation. Ainsi, HCl, HNO 3 sont des acides monobasiques, H 2 SO 4, H 2 CO 3 sont dibasiques, H 3 PO 4, H 3 AsO 4 sont tribasiques.
Les bases sont des électrolytes dont la dissociation ne produit que des ions hydroxyde sous forme d'anions. Par exemple,
KOH → K + + OH - ,
Les bases solubles dans l'eau sont appelées alcalis.
L'acidité d'une base est déterminée par le nombre de ses groupes hydroxyles. Par exemple, KOH, NaOH sont des bases à un acide, Ca(OH) 2 est à deux acides, Sn(OH) 4 est à quatre acides, etc.
Les sels sont des électrolytes dont la dissociation produit des cations métalliques (ainsi que l'ion NH 4 +) et des anions de résidus acides. Par exemple,
CaCl 2 → Ca 2+ + 2Cl - ,
Les électrolytes, dont la dissociation, selon les conditions, peuvent former simultanément à la fois des cations hydrogène et des anions - les ions hydroxyde sont appelés amphotères. Par exemple,
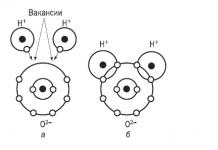
H 2 O H + + OH - ,
Mécanisme de dissociation
Les substances possédant des liaisons ioniques se dissocient le plus facilement. Comme vous le savez, ces substances sont constituées d'ions. Lorsqu’ils se dissolvent, les dipôles d’eau s’orientent autour des ions positifs et négatifs. Des forces d'attraction mutuelle apparaissent entre les ions et les dipôles de l'eau, ce qui affaiblit la liaison entre les ions et les ions se déplacent du cristal vers la solution. Dans ce cas, des ions hydratés se forment, c'est-à-dire ions chimiquement liés aux molécules d’eau.
Les électrolytes, dont les molécules sont formées selon le type polaire, se dissocient de la même manière. une liaison covalente(molécules polaires). Autour de chaque molécule polaire d'une substance, sont également orientés des dipôles d'eau qui, avec leurs pôles négatifs, sont attirés vers le pôle positif de la molécule et avec leurs pôles positifs - vers le pôle négatif. À la suite de cette interaction, le nuage électronique de connexion (paire d'électrons) est complètement déplacé vers l'atome ayant une électronégativité plus élevée, la molécule polaire se transforme en une molécule ionique, puis des ions hydratés se forment facilement. ![]() .La dissociation des molécules polaires peut être complète ou partielle.
.La dissociation des molécules polaires peut être complète ou partielle.
Ainsi, les électrolytes sont des composés comportant des liaisons ioniques ou polaires - sels, acides et bases. Et ils peuvent se dissocier en ions dans les solvants polaires.
Constante de dissociation- voir constantes d'équilibre, qui montre la tendance d'un gros objet dissocier(diviser) de manière réversible en petits objets, comme lorsque complexe se décompose en composants molécules, ou lorsque sel se sépare en solution aqueuse en ions. La constante de dissociation est généralement désignée par et inverse constante d'association. Dans le cas des sels, la constante de dissociation est parfois appelée constante d'ionisation.
En réaction générale
où le complexe est divisé en X unités A et oui unités de B, la constante de dissociation est déterminée comme suit :
![]()
où [A], [B] et - concentration A, B et complexe A x B y respectivement.
Degré de dissociation- grandeur caractérisant l'état équilibre V réactions dissociation V systèmes homogènes (homogènes).
« Le degré de dissociation est le rapport du nombre de molécules dissociées sur le nombre total de molécules multiplié par 100 % » :
![]()
le nombre de ceux qui ont rompu ions molécules au nombre total de molécules dissoutes.
Le degré de dissociation est égal au rapport du nombre de molécules dissociées à la somme, où est le nombre de molécules non dissociées. Souvent exprimé en pourcentage. Le degré de dissociation dépend à la fois de la nature de l'électrolyte dissous et de la concentration de la solution.
Électrolyte- une substance dont la masse fondue ou la solution conduit le courant électrique en raison de la dissociation en ions, mais la substance elle-même ne conduit pas le courant électrique. Des exemples d'électrolytes comprennent des solutions d'acides, de sels et de bases. Les électrolytes sont des conducteurs du deuxième type, des substances qui, dans une solution (ou une fonte), sont entièrement ou partiellement constituées d'ions et, par conséquent, ont une conductivité ionique.
Électrolytes forts- les électrolytes dont le degré de dissociation dans les solutions est égal à l'unité (c'est-à-dire qu'ils se dissocient complètement) et ne dépend pas de la concentration de la solution. Cela comprend la grande majorité des sels, des alcalis, ainsi que certains acides (acides forts, tels que : HCl, HBr, HI, HNO 3).
Électrolytes faibles- le degré de dissociation est inférieur à l'unité (c'est-à-dire qu'ils ne se dissocient pas complètement) et diminue avec l'augmentation de la concentration. Ceux-ci inclus eau, une série d'acides (acides faibles), de bases p-, d- et f- éléments.
Loi de dilution d'Ostwald- une relation exprimant la dépendance de l'équivalent conductivité électrique solution diluée de binaire électrolyte faible sur la concentration de la solution :
![]()
Ici K - constante de dissociation électrolyte, с - concentration, λ et λ ∞ - valeurs de conductivité électrique équivalente, respectivement, à la concentration c et à la dilution infinie. Le rapport est une conséquence loi de l'action de masse et l'égalité
où α est le degré de dissociation.
La loi de dilution d'Ostwald est dérivée V. Ostwald V 1888 et il l'a également confirmé expérimentalement. L'établissement expérimental de l'exactitude de la loi de dilution d'Ostwald avait grande importance pour étayer la théorie dissociation électrolytique.
Produit ionique de l'eau- produit des concentrations des ions hydrogène H+ et des ions hydroxyles OH - dans l'eau ou dans les solutions aqueuses, constante d'autoprotolyse de l'eau
Affichage de la valeur du produit ionique de l'eau
L'eau, bien que faible électrolyte, dans une faible mesure se dissocie:
L'équilibre de cette réaction est fortement déplacé vers la gauche. Constante de dissociation l'eau peut être calculée à l'aide de la formule :
![]()
Concentration ionique hydronium(protons);
Concentration en ions hydroxyde ;
Concentration d'eau (sous forme moléculaire) dans l'eau ;
La concentration d'eau dans l'eau, compte tenu de son faible degré de dissociation, est pratiquement constante et s'élève à (1000 g/l)/(18 g/ taupe) = 55,56 moles/l.
À 25 °C, la constante de dissociation de l'eau est de 1,8 · 10 −16 mol/l. L'équation (1) peut être réécrite comme suit :
Notons le produit K· = K in = 1,8·10−16 mol/l·55,56 mol/l = 10−14 mol²/l² = · (à 25 °C).
Constante K V , égal au produit les concentrations de protons et d’ions hydroxyde sont appeléesproduit ionique de l'eau . Elle est constante non seulement pour l'eau pure, mais également pour les solutions aqueuses diluées de substances. Avec l'augmentation de la température, la dissociation de l'eau augmente, par conséquent, Kv augmente également, avec la diminution de la température - vice versa.
Hydrolyse(du grec ancien ὕδωρ - eau et λύσις - décomposition) - l'un des types de réactions chimiques de solvolyse, où lorsque des substances interagissent avec l'eau, la substance d'origine se décompose avec la formation de nouveaux composés. Le mécanisme d'hydrolyse de composés de différentes classes : sels, glucides, protéines, esters, graisses, etc. présente des différences significatives.
1. Hydrolyse d'un sel d'un acide faible et d'une base forte (hydrolyse par anion) :
(la solution a un environnement légèrement alcalin, la réaction se déroule réversible
2. Hydrolyse d'un sel d'un acide fort et d'une base faible (hydrolyse par cation) :
(la solution a un environnement légèrement acide, la réaction se déroule réversible, l'hydrolyse dans la deuxième étape se produit dans une mesure insignifiante)
Hydrolyse par anion et cations (hydrolyse complète)- hydrolyse d'un sel formé d'une base faible et d'un acide faible. Suite à une hydrolyse complète, le milieu reste neutre (selon la force de l'acide et de la base formés, une légère alcalinisation ou acidification du milieu est possible) (pH ~ 7). Le tournesol et la phénolphtaléine ne changent pas de couleur.
Exemples d'hydrolyse complète :
1. Hydrolyse de CuS : CuS + 2H2O => Cu(OH)2 + H2S
Facteurs affectant l'hydrolyse. 1) Une augmentation de la température entraîne un déplacement de l'équilibre vers les produits de réaction. 2) Une augmentation de la concentration vers les substances de départ entraîne un déplacement de l'équilibre vers les produits de réaction. 3) Une augmentation de la concentration des produits de réaction entraîne la suppression de l'hydrolyse et un déplacement de l'équilibre vers les substances de départ.
7) Réactions redox . État d'oxydation. Oxydation et réduction. Les agents oxydants et réducteurs les plus importants.Dualité rédox. Types d'OVR. Méthode de balance électronique. Potentiels redox standards. Direction du flux OVR. Une gamme de contraintes métalliques. Cellule galvanique, EMF d'une cellule galvanique. Utilisation pratique des OVR (piles, accumulateurs).
Électrolyse. Processus cathodiques et anodiques pendant l'électrolyse. Les lois de Faraday. Application pratique de l'électrolyse. Corrosion des métaux. Corrosion chimique et électrochimique. Méthodes de protection contre la corrosion
Réactions redox, OVR, rédox(de l'anglais rédox ← rouge vente aux enchères-bœuf idation- oxydo-réduction) sont des réactions chimiques consécutives qui se produisent avec un changement des états d'oxydation des atomes qui composent les substances réactives, réalisé par la redistribution des électrons entre l'atome oxydant et l'atome réducteur.
Oxydation, réduction
Dans les réactions redox, les électrons sont transférés d’un atome, d’une molécule ou d’un ion à un autre. Le processus de perte d’électrons est l’oxydation. Lors de l'oxydation, l'état d'oxydation augmente :
Le processus d’ajout d’électrons est une réduction. Lors de la réduction, l'état d'oxydation diminue :
Les atomes ou les ions qui gagnent des électrons dans une réaction donnée sont des agents oxydants, et ceux qui donnent des électrons sont des agents réducteurs.
État d'oxydation(indice d'oxydation, charge formelle) - une valeur conventionnelle auxiliaire pour enregistrer les processus d'oxydation, de réduction et de réactions redox, la valeur numérique de la charge électrique attribuée à un atome dans une molécule en supposant que les paires d'électrons qui réalisent la liaison sont complètement décalés vers des atomes plus électronégatifs.
Dualité rédox est la capacité d'un atome dans un état d'oxydation intermédiaire à être à la fois un agent réducteur et un agent oxydant, selon la substance avec laquelle il réagit.
(Plus d'informations sur les agents oxydants, les agents réducteurs et les états d'oxydation intermédiaires peuvent être trouvées dans la section précédente).
Par exemple, tous les non-métaux (à l'exception du fluor et de l'oxygène), les nitrites, les sulfites et certaines substances complexes présentent une dualité rédox :
4 +3 SO2, HNO2
Les réactions redox peuvent être divisées en trois groupes selon l'endroit où se trouvent les atomes des éléments oxydants et réducteurs.
Les réactions d'oxydo-réduction interatomiques et intermoléculaires sont des réactions dans lesquelles l'agent oxydant et l'agent réducteur sont des substances différentes. Cela inclut, par exemple, les réactions de composé et de substitution les plus simples :
Les réactions de dismutation (auto-oxydation-auto-réduction) sont des réactions dans lesquelles les agents réducteurs sont des atomes d'éléments ayant un état d'oxydation intermédiaire de la même substance. Dans ce cas, ils réagissent entre eux en tant qu'agent réducteur et agent oxydant et sont capables de donner et d'accepter des électrons, déplaçant l'un vers un état d'oxydation inférieur et l'autre vers un état d'oxydation supérieur.
Par exemple:
Réactions d'oxydo-réduction intramoléculaires dans lesquelles l'état d'oxydation de différents atomes change au sein d'une même molécule. Le plus souvent, cela se produit en raison de la décomposition thermique de la substance. Par exemple:
|
2Hg +2 O –2 = 2Hg 0 + O 2 0 |
N –3 H 4 N +5 O 3 = N 2 +1 O + 2H 2 O. |
Méthode de balance électronique- une des méthodes d'égalisation Réactions redox(ORR). Il s'agit de définir les coefficients en ORR en fonction des états d'oxydation. Pour une égalisation correcte, une certaine séquence d'actions doit être suivie :
Trouvez l’agent oxydant et l’agent réducteur.
Établissez pour eux des diagrammes (demi-réactions) de transitions électroniques qui correspondent à ce processus redox.
Égalisez le nombre d'électrons donnés et reçus dans des demi-réactions.
Résumez séparément les parties gauche et droite des demi-réactions.
Disposez les coefficients dans l’équation de la réaction redox.
Potentiel redox (potentiel redox depuis Anglais rédox - rouge vente aux enchères-bœuf réaction d'idation, E h ou Eh) - une mesure de la capacité d'une substance chimique à attacher des électrons ( restaurer ). Le potentiel redox est exprimé en millivolts(mV). Un exemple d'électrode redox : Pt/Fe3+,Fe2+ Le potentiel redox est défini comme potentiel électrique monté par immersion platine ou or (électrode inerte)V environnement redox, C'est dedans solution, contenant les deux connexion rétablie(Un rouge) et composé oxydé(Un bœuf). Si la demi-réaction de réduction est représentée équation:
A bœuf + n e − → A rouge ,
Que dépendance quantitative potentiel redox de concentration(plus précisément activités) réagir les substances sont exprimées équation de Nernst.
Le potentiel d’oxydo-réduction est déterminé méthodes électrochimiques en utilisant électrode de verre avec fonction red-ox et exprimé en millivolts(mV) relatif standard électrode à hydrogène V conditions standards.
Série d'activité électrochimique (série de tension, série de potentiel d'électrode standard) des métaux- une séquence dans laquelle les métaux sont disposés par ordre croissant potentiels électrochimiques standardsφ 0 correspondant à la demi-réaction de réduction du cation métallique Me n+ : Me n+ + nē → Me
|
Li→Rb→K→Ba→Sr→Californie→N / A→Mg→Al→Mn→Zn→Cr→Fe→CD→Co→Ni→Sn→Pb→H →Sb→Bi→Cu→Hg→Ag→PD→Pt→Au |
Un certain nombre de tensions caractérisent l'activité comparative des métaux dans Réactions redox dans des solutions aqueuses.
Pile galvanique- une source chimique de courant électrique, basée sur l'interaction de deux métaux et (ou) de leurs oxydes dans un électrolyte, conduisant à l'apparition d'un courant électrique en circuit fermé. Nommé d'après Luigi Galvani
Électrolyse- un processus physique et chimique consistant en la libération de électrodes constituants de solutés ou d'autres substances résultant de réactions secondaires à électrodes, qui se produit lors du passage courant électriqueà travers une solution ou fondre électrolyte .
Mouvement ordonné ions dans les liquides conducteurs se produit dans le champ électrique créé électrodes- conducteurs reliés aux pôles de la source énergie électrique. Anode en électrolyse, on l'appelle électrode positive, cathode - négatif . Positif ions - cations - (ions les métaux, hydrogène ions, ions ammonium etc.) - se déplacer vers la cathode, négatif ions - anions - (ions de résidus acides et groupe hydroxyle) - se déplacent vers l'anode.
Le phénomène d’électrolyse est largement utilisé dans l’industrie moderne. En particulier, l'électrolyse est l'une des méthodes de production industrielle aluminium, hydrogène, et hydroxyde de sodium, chlore, composés organochlorés [ source non précisée 1318 jours ] , dioxyde de manganèse , peroxyde d'hydrogène. Un grand nombre de métaux sont extraits des minerais et traités par électrolyse ( électroextraction, électroraffinage). De plus, l’électrolyse est le principal processus par lequel il fonctionne source de courant chimique.
L'électrolyse est utilisée dans le traitement des eaux usées (procédés d'électrocoagulation, d'électroextraction, d'électroflottation)
La première loi de Faraday
DANS 1832 Faradayétabli que la masse m de la substance libérée sur l'électrode est directement proportionnelle à la charge électrique q traversant l'électrolyte : si un courant continu d'intensité I traverse l'électrolyte pendant un temps t. Le coefficient de proportionnalité est appelé équivalent électrochimique de la substance. Elle est numériquement égale à la masse de la substance libérée lorsqu'une seule charge électrique traverse l'électrolyte et dépend de la nature chimique de la substance.
La deuxième loi de Faraday
Les équivalents électrochimiques de diverses substances sont appelés leurs équivalents chimiques.
Équivalent chimique et elle appelé rapport de masse molaire A et elleà son valence z. Donc l’équivalent électrochimique
![]()
Où - constante de Faraday.
La deuxième loi de Faraday s'écrit comme suit :
![]()
Où - masse molaire une substance donnée formée (mais pas nécessairement libérée - elle aurait pu entrer dans une réaction immédiatement après sa formation) à la suite d'une électrolyse, g/taupe; -force actuelle passé à travers une substance ou un mélange de substances (solution, matière fondue), UN; - temps pendant lequel l'électrolyse a été réalisée, Avec; -constante de Faraday, Cl· taupe−1 ; - le nombre d'électrons participant au processus, qui, à des valeurs de courant suffisamment élevées, est égal à la valeur absolue de la charge de l'ion (et de son contre-ion) qui a directement participé à l'électrolyse (oxydée ou réduite). Cependant, ce n'est pas toujours le cas; par exemple, lors de l'électrolyse d'une solution de sel de cuivre(II), non seulement du cuivre libre peut se former, mais également des ions cuivre(I) (à faible courant).
corrosion(du latin corrosio - corrosion) est la destruction spontanée des métaux suite à une interaction chimique ou physico-chimique avec l'environnement. En général, il s'agit de la destruction de tout matériau, qu'il s'agisse de métal ou de céramique, de bois ou de polymère. La cause de la corrosion est l'instabilité thermodynamique des matériaux de structure aux effets des substances présentes dans l'environnement en contact avec eux. Un exemple est la corrosion par l'oxygène du fer dans l'eau : 4Fe + 6H2O + 3O2 = 4Fe(OH)3. L'oxyde de fer hydraté Fe(OH)3 est ce qu'on appelle la rouille.
Corrosion électrochimique et chimique.
La destruction du métal sous l'influence de l'environnement est appelée corrosion.
En plus de détruire le métal, la corrosion affecte négativement les performances des pièces, contribuant à tous types de destruction.
La corrosion, selon la nature de l'environnement, peut être chimique ou électrochimique.
La corrosion électrochimique se produit dans les solutions aqueuses, ainsi que dans une atmosphère ordinaire où règne de l'humidité.
L'essence de cette corrosion est que les ions métalliques à la surface de la pièce, peu liés aux ions profonds, sont facilement séparés du métal par les molécules d'eau.
Le métal, ayant perdu certaines de ses particules chargées positivement, les ions, devient chargé négativement en raison de la quantité excessive d'électrons restants. Dans le même temps, la couche d'eau adjacente au métal acquiert une charge positive due aux ions métalliques. La différence de charge à l'interface métal-eau provoque un saut de potentiel, qui change au cours du processus de corrosion, augmentant à cause de la dissolution du métal et diminuant à cause du dépôt d'ions de la solution sur le métal.
Dans la vie quotidienne, le terme « rouille » est plus souvent utilisé pour les alliages de fer (acier). Les cas de corrosion des polymères sont moins connus. Par rapport à eux, il existe la notion de « vieillissement », semblable au terme « corrosion » pour les métaux. Par exemple, le vieillissement du caoutchouc dû à l'interaction avec l'oxygène de l'air ou la destruction de certains plastiques sous l'influence des précipitations, ainsi que la corrosion biologique. La vitesse de corrosion, comme toute réaction chimique, dépend fortement de la température. Une augmentation de la température de 100 degrés peut augmenter le taux de corrosion de plusieurs ordres de grandeur.
Méthodes de protection contre la corrosion
augmenter la résistance chimique des matériaux de structure,
isolation de la surface métallique d'un environnement agressif,
réduire l'agressivité de l'environnement de production, réduire la corrosion par application d'un courant extérieur (protection électrochimique).
8) Connexions complexes . Structure des composés complexes (agent complexant, ligands, numéro de coordination, sphère interne et externe du complexe). La nature des liaisons chimiques dans les composés complexes. Complexes cationiques anioniques et neutres. Nomenclature des composés complexes. Types de composés complexes. Dissociation de composés complexes. Instabilité complexe constante. Propriétés chimiques des composés complexes (réactions des sphères interne et externe).
Connexion complexe - Substance chimique, qui comprend des particules complexes. Actuellement, il n’existe pas de définition stricte de la notion de « particule complexe ». La définition suivante est généralement utilisée.
Une particule complexe est une particule complexe capable d'exister indépendamment dans un cristal ou une solution, formée à partir d'autres particules plus simples également capables d'exister indépendamment. Parfois, les particules chimiques complexes sont appelées particules complexes, dont tout ou partie des liaisons se forment selon le mécanisme donneur-accepteur.
Un agent complexant est l'atome central d'une particule complexe. Généralement, l'agent complexant est un atome de l'élément qui forme le métal, mais il peut également s'agir d'un atome d'oxygène, d'azote, de soufre, d'iode et d'autres éléments qui forment des non-métaux. L'agent complexant est généralement chargé positivement et est dans ce cas appelé centre métallique dans la littérature scientifique moderne ; la charge de l'agent complexant peut également être négative ou égale à zéro.
Les ligands sont des atomes ou des groupes isolés d'atomes situés autour d'un agent complexant. Les ligands peuvent être des particules qui, avant la formation d'un composé complexe, étaient des molécules (H2O, CO, NH3, etc.), des anions (OH−, Cl−, PO43−, etc.), ainsi que le cation hydrogène H+.
La sphère interne d’un composé complexe est l’atome central auquel sont associés les ligands, c’est-à-dire en fait une particule complexe.
La sphère externe d'un composé complexe est constituée des particules restantes associées à la particule complexe par des liaisons ioniques ou intermoléculaires, y compris celles hydrogène.
La dentité d'un ligand est déterminée par le nombre de sites de coordination occupés par le ligand dans la sphère de coordination de l'agent complexant. Il existe des ligands monodentés (non identifiés) reliés à l'atome central par l'un de leurs atomes, c'est-à-dire par une liaison covalente, bidentés (reliés à l'atome central par deux de leurs atomes, c'est-à-dire par deux liaisons), tri-, tétradenté, etc.
Un polyèdre de coordination est un polyèdre moléculaire imaginaire, au centre duquel se trouve un atome complexant, et aux sommets se trouvent des particules de ligand directement associées à l'atome central.
Le numéro de coordination (CN) est le nombre de liaisons formées par l'atome central avec des ligands. Pour les composés complexes avec des ligands monodentés, le CN est égal au nombre de ligands, et dans le cas de ligands polydentés, au nombre de ces ligands multiplié par la dentation.
Il existe plusieurs classifications de composés complexes basées sur différents principes.
Selon la charge du complexe
1) Les complexes cationiques se forment suite à la coordination autour de l'ion positif de molécules neutres (H2O, NH3, etc.).
[(Zn(NH3)4)]Cl2 - chlorure de tétraammine zinc(II)
Cl2 - chlorure d'hexaammine-cobalt(II)
2) Complexes anioniques : l'agent complexant est un atome à état d'oxydation positif, et les ligands sont des anions simples ou complexes.
K2 - tétrafluorobéryllate de potassium (II)
Li - tétrahydridealuminate de lithium (III)
3) Les complexes neutres sont formés par la coordination de molécules autour d'un atome neutre, ainsi que par une coordination simultanée autour d'un ion positif - un agent complexant d'ions et de molécules négatifs.
Tétracarbonylnickel
Dichlorodiammineplatine (II)
[modifier]Par le nombre de places occupées par les ligands dans la sphère de coordination
Structure d'un ion complexe formé d'un cation métallique et d'un anion EDTA
1) Ligands monodentés. De tels ligands sont neutres (molécules H2O, NH3, CO, NO, etc.) et chargés (ions CN−, F−, Cl−, OH−, SCN−, S2O32−, etc.).
2) Ligands bidentés. Des exemples sont les ligands : ion acide aminoacétique H2N - CH2 - COO−, ion oxalate −O - CO - CO - O−, ion carbonate CO32−, ion sulfate SO42−.
3) Ligands polydentés. Par exemple, les complexons sont des ligands organiques contenant plusieurs groupes −С≡N ou −COOH (acide éthylènediaminetétraacétique - EDTA). Les complexes cycliques formés par certains ligands polydentés sont classés comme complexes chélatés (hémoglobine, etc.).
Par nature du ligand
1) Ammoniac - complexes dans lesquels des molécules d'ammoniac servent de ligands, par exemple : SO4, Cl3, Cl4, etc.
2) Complexes aquatiques - dans lesquels l'eau est le ligand : Cl2, Cl3, etc.
3) Les carbonyles sont des composés complexes dont les ligands sont des molécules de monoxyde de carbone (II) : , .
4) Complexes acides - complexes dans lesquels les ligands sont des résidus acides. Il s'agit notamment des sels complexes : K2, des acides complexes : H2, H2.
5) Complexes hydroxo - composés complexes dans lesquels les ions hydroxydes agissent comme ligands : Na2, Na2, etc.
Nomenclature
1) Au nom d'un composé complexe, la partie chargée négativement - l'anion - est indiquée en premier, puis la partie positive - le cation.
2) Le nom de la partie complexe commence par une indication de la composition de la sphère interne. Dans la sphère interne, les ligands sont d’abord appelés anions, en ajoutant la terminaison « o » à leur nom latin. Par exemple : Cl− - chloro, CN− - cyano, SCN− - thiocyanato, NO3− - nitrato, SO32− - sulfito, OH− - hydroxo, etc. Les termes suivants sont utilisés : pour ammoniac coordonné - ammine, pour eau - aqua, pour monoxyde de carbone (II) - carbonyle.
3) Le nombre de ligands monodentés est indiqué par des chiffres grecs : 1 - mono (souvent non indiqué), 2 - di, 3 - trois, 4 - tétra, 5 - penta, 6 - hexa. Pour les ligands polydentés (par exemple éthylènediamine, oxalate), des bis-, tris-, tétrakis-, etc. sont utilisés.
4) Ensuite, l'agent complexant est nommé à l'aide de la racine de son nom latin et de la terminaison -at, après quoi l'état d'oxydation de l'agent complexant est indiqué en chiffres romains (entre parenthèses).
5) Après avoir désigné la composition de la sphère intérieure, on appelle la sphère extérieure.
6) Au nom des particules complexes neutres, l'agent complexant est indiqué au nominatif, mais son degré n'est pas indiqué, puisqu'il est clairement déterminé en fonction de la neutralité électrique du complexe.
K3 - hexacyanoferrate de potassium (III)
(NH4)2 - dihydroxotétrachloroplatinate d'ammonium (IV)
[Cr(H2O)3F3] - trifluorotriaquachrome
[Co(NH3)3Cl(NO2)2] - dinitrichlorotriammine cobalt
Cl2 - chlorure de dichlorotétraammineplatine (IV)
NO3 - nitrate de tétraaqualithium
Pour les mêmes raisons, la constante d'instabilité d'un composé complexe est plus souvent utilisée :
La constante d'instabilité est une valeur négative, donc plus le complexe est petit et plus stable.
9) Fondamentaux de la chimie analytique . Sujet de chimie analytique. Analyse qualitative et quantitative. Exigences pour l'analyse chimique. Réactions qualitatives. Méthodes d'analyse chimiques, physico-chimiques, biologiques. Objets d'analyse. Fondamentaux de la méthode d'analyse titrimétrique (matériel, technique, calculs).
La chimie analytique est la science des méthodes permettant de déterminer la composition chimique d'une substance et sa structure. Le sujet de la chimie analytique est le développement de méthodes et la mise en œuvre pratique des analyses, l'étude des fondements théoriques des méthodes analytiques, qui comprennent : l'étude des formes d'existence des éléments et de leurs composés dans divers environnements et états d'agrégation, la détermination de la composition et de la stabilité des composés de coordination, des caractéristiques optiques, électrochimiques et autres d'une substance, recherche des vitesses de réactions chimiques, détermination des caractéristiques métrologiques des méthodes.
La base théorique de la chimie analytique réside dans les lois fondamentales des sciences naturelles : la loi périodique de D.I. Mendeleev, lois de conservation de l'énergie et de la masse de matière, lois de constance de composition, masses effectives, etc. La chimie analytique est étroitement liée à la physique, à la chimie inorganique, physique, colloïdale, à l'électrochimie, à la thermodynamique, à la théorie des solutions et à la métrologie. La chimie analytique moderne utilise la doctrine des composés de coordination, les méthodes de chimie quantique, la théorie de la structure de la matière et la cinétique des réactions.
L'analyse qualitative résout la question : quels composants sont inclus dans la composition d'un composé ou d'un minéral. L'analyse qualitative montre quels éléments chimiques se compose de l’analyte et des ions, groupes d’atomes ou de molécules qui entrent dans sa composition. Lors de l'étude de la composition d'une substance inconnue, l'analyse qualitative précède toujours l'analyse quantitative.
^ L'analyse quantitative permet d'établir des relations quantitatives entre les éléments constitutifs de la substance, du minéral ou du mélange de substances étudiées. Contrairement à l'analyse qualitative, l'analyse quantitative détermine la teneur en composants individuels de l'analyte ou la teneur totale de la substance dans le produit testé.
Les exigences suivantes s'appliquent aux réactions chimiques dans l'analyse qualitative.
1. La réaction devrait se produire presque instantanément.
2. La réaction doit être irréversible.
3. La réaction doit s'accompagner d'un effet externe (AS) :
a) changement de couleur de la solution ;
b) formation ou dissolution d'un précipité ;
c) rejet de substances gazeuses ;
d) coloration des flammes, etc.
4. La réaction doit être aussi sensible et spécifique que possible.
Les exigences suivantes s'appliquent aux réactions chimiques utilisées dans cette analyse :
1) la réaction doit se dérouler assez rapidement et être pratiquement irréversible ;
2) les substances qui entrent dans la réaction doivent réagir dans des rapports quantitatifs strictement définis, c'est-à-dire la réaction doit être stoechiométrique et non accompagnée de réactions secondaires ;
3) à la suite de la réaction, des composés avec une certaine composition moléculaire doivent être obtenus ;
4) le déroulement de la réaction ne doit pas être influencé par les impuretés présentes dans l'analyte ;
5) la réaction doit permettre de déterminer facilement le moment de son achèvement, ainsi que la masse du produit de réaction ou le volume de la solution réactive dépensé pour sa mise en œuvre.
L'analyse qualitative est un ensemble de méthodes chimiques, physico-chimiques et physiques utilisées pour détecter les éléments, radicaux et composés faisant partie de la substance ou du mélange de substances analysé. Dans l'analyse qualitative, on utilise des réactions chimiques caractéristiques, facilement exécutables, dans lesquelles on observe l'apparition ou la disparition d'une couleur, la libération ou la dissolution d'un précipité, la formation de gaz, etc.. Les réactions doivent être aussi sélectives et très sensibles que possible. L'analyse qualitative des solutions aqueuses est basée sur des réactions ioniques et permet la détection de cations ou d'anions. Le fondateur de l'analyse qualitative est considéré comme R. Boyle, qui a introduit le concept d'éléments chimiques en tant que parties principales non décomposables de substances complexes et a systématisé toutes les réactions qualitatives connues à son époque.
La méthode d'analyse titrimétrique a été proposée par J. L. Gay-Lussac au siècle dernier et, en raison de sa facilité de mise en œuvre, de sa rapidité, de sa grande précision et de sa capacité à utiliser des réactions de divers types, est devenue très répandue pour la détermination de substances inorganiques et organiques. dans des solutions aqueuses et non aqueuses. En cours de développement, cette méthode a servi de base à de nombreuses méthodes d'analyse titrimétriques physico-chimiques modernes. Le nom précédemment utilisé pour la méthode «analyse volumétrique», en raison du fait que dans la plupart des cas, la quantité de réactif ajouté (titrant) est déterminée par le volume de sa solution, a maintenant été remplacé par le nom plus correct «analyse titrimétrique». , car parfois, avec les déterminations les plus précises, ce n'est pas le volume qui est mesuré, mais la masse de la solution réactive.
Bases de l'analyse titrimétrique
Objectif : initier les étudiants aux opérations et calculs de base en analyse titrimétrique.
Équipement : pipettes pour différents volumes de solutions, burette, 2 flacons de titrage coniques de 250 ml, entonnoir, support de laboratoire avec pied.
La méthode d'analyse titrimétrique est basée sur la détermination de la quantité d'une substance dans l'objet analysé par la quantité (volume) du titrant qui a interagi.
Le processus d’ajout progressif d’une solution titrante à une solution de l’analyte est appelé titrage. Le moment où le titrant a été ajouté à la solution d'essai en quantité chimiquement équivalente à la substance à déterminer est appelé point d'équivalence. Pour déterminer ce point, un indicateur est ajouté à la solution test. La couleur de l'indicateur change lorsque la réaction entre l'analyte et le titrant est terminée. En pratique, le changement de couleur ne coïncide pas exactement avec le point d’équivalence. Dans ce cas, ils parlent du point final du titrage (e.t.t.).
Selon le type de réactions utilisées, les méthodes titrimétriques sont divisées en quatre groupes :
1) méthodes de titrage acido-basique basées sur l'utilisation de réactions de neutralisation ;
2) méthodes de titrage redox ;
3) méthodes de précipitation ;
4) méthodes de complexation.
Selon le mode de mise en œuvre, les méthodes titrimétriques se répartissent en :
1) pour le titrage direct ;
2) titrage en retour ;
3) titrage du substituant.
Quel que soit le type de réaction utilisé, pour tout dosage titrimétrique il est nécessaire de disposer :
1) titrant – solution titrée de travail ;
2) indicateur (parfois la solution titrée est aussi un indicateur) ;
3) ustensiles de mesure pour déterminer avec précision les volumes de substances réactives.
Le calcul de la concentration à partir des résultats de l'analyse titrimétrique est effectué selon la loi des équivalents : .
10)Bases de la chimie organique . Possibilités de valence du carbone dans les composés organiques. Séries homologues, homologues. Isomérie, isomères. Classification des composés organiques selon la structure du squelette carboné. Classification des composés organiques par groupes fonctionnels. Bases de la nomenclature des hydrocarbures, dérivés halogénés, alcools, phénols, aldéhydes, cétones, acides carboxyliques, amines. Principaux types de réactions organiques (substitution, addition, décomposition, isomérisation, décomposition, oxydo-réduction)
Les isomères sont des substances qui ont la même composition qualitative et quantitative de molécules, mais des structures différentes, et donc des propriétés physiques et chimiques différentes.
Il existe plusieurs types d'isomérie :
1) isomérie de la chaîne carbonée. Par exemple, le butane normal CH3-CH2-CH2-CH3 a une structure non ramifiée et son isomère 2-méthylpropane a une structure ramifiée.
2) isomérie d'une liaison multiple (double ou triple). Par exemple, 1-butène CH3 = CH-CH2-CH3 et 2-butène CH3-CH = CH-CH3 ;
3) isomérie du groupe fonctionnel. Par exemple, 1-propanol CH3-CH2-CH2-OH et 2-propanol CH3-CH-CH3 ;
4) isomérie interclasse. Par exemple, l'alcool éthanol C2H5OH et l'éther diméthylique CH3-O-CH3 ont la même formule moléculaire C2H6O.
Les alcènes sont également caractérisés par une stéréoisomérie spatiale. Les stéréoisomères ont le même ordre de liaisons chimiques, mais des dispositions différentes d'atomes ou de groupes d'atomes dans l'espace. Dans ce cas, des isomères cis et trans se forment.
Cis-2-butène trans-2-butène
Les homologues sont des composés de structure et de structure similaires. propriétés chimiques, mais diffèrent dans leur composition moléculaire par un ou plusieurs groupes CH2, appelés différences homologues.
Les homologues forment des séries homologues. Une série homologue est une série de composés similaires par leur structure et leurs propriétés chimiques qui diffèrent les uns des autres par leur composition moléculaire par une ou plusieurs différences de CH2 homologues.
Vous connaissez déjà la série homologue des alcanes, alcènes, alcynes et arènes.
La première nomenclature apparue au début du développement de la chimie organique, alors qu'il n'existait ni classification ni théorie de la structure des composés organiques. Les composés organiques ont reçu des noms aléatoires en fonction de leur source (acide oxalique, acide malique, vanilline), de leur couleur ou de leur odeur (composés aromatiques) et, moins souvent, en fonction de leurs propriétés chimiques (paraffines). Beaucoup de ces noms sont encore souvent utilisés aujourd’hui. Par exemple : urée, toluène, xylène, indigo, acide acétique, acide butyrique, acide valérique, glycol, alanine et bien d'autres. Il s’agit d’une nomenclature triviale (historique).
Nomenclature rationnelle - selon cette nomenclature, le nom du membre le plus simple (généralement le premier) d'une série homologue donnée est généralement pris comme base pour le nom d'un composé organique. Tous les autres composés sont considérés comme des dérivés de ce composé, formés en remplaçant les atomes d'hydrogène par des hydrocarbures ou d'autres radicaux (par exemple : aldéhyde triméthylacétique, méthylamine, acide chloroacétique, alcool méthylique). Actuellement, une telle nomenclature n'est utilisée que dans les cas où elle donne une idée particulièrement claire du lien.
Nomenclature systématique - Nomenclature IUPAC - Nomenclature chimique internationale unifiée. La nomenclature systématique est basée sur la théorie moderne de la structure et de la classification des composés organiques et tente de résoudre le problème principal de la nomenclature : le nom de chaque composé organique doit contenir les noms corrects des fonctions (substituants) et le squelette principal de l'hydrocarbure. et doit être tel que le nom puisse être utilisé pour écrire la seule formule développée correcte.
Le processus de création d'une nomenclature internationale a débuté en 1892 (nomenclature de Genève), s'est poursuivi en 1930 (nomenclature de Liège) et depuis 1947, de nouveaux développements ont été associés aux activités de la commission IUPAC sur la nomenclature des composés organiques. Publié dans années différentes Les règles de l'IUPAC ont été compilées en 1979 dans le « livre bleu ». La Commission IUPAC considère que sa tâche n'est pas de créer un nouveau système de nomenclature unifié, mais de rationaliser et de « codifier » les pratiques existantes. Il en résulte la coexistence dans les règles de l'IUPAC de plusieurs systèmes de nomenclature, et, par conséquent, de plusieurs noms acceptables pour une même substance. Les règles de l'IUPAC sont basées sur les systèmes suivants : nomenclature substitutive, radicale-fonctionnelle, additive (connective), de remplacement, etc.
Actuellement, une nomenclature rationnelle et systématique est utilisée pour désigner avec précision la composition et la structure des composés organiques.
Les réactions des substances organiques peuvent être formellement divisées en quatre types principaux : substitution, addition, élimination (élimination) et réarrangement (isomérisation). Il est évident que toute la variété des réactions des composés organiques ne peut être réduite au cadre de la classification proposée (par exemple, les réactions de combustion). Cependant, une telle classification aidera à établir des analogies avec les classifications des réactions se produisant entre substances inorganiques qui vous sont déjà familières au cours de la chimie inorganique.
Généralement, le principal composé organique impliqué dans une réaction est appelé substrat, et l’autre composant de la réaction est classiquement considéré comme le réactif.
Réactions de substitution
Les réactions qui entraînent le remplacement d'un atome ou d'un groupe d'atomes dans la molécule d'origine (substrat) par d'autres atomes ou groupes d'atomes sont appelées réactions de substitution.
Les réactions de substitution mettent en jeu des composés saturés et aromatiques, comme par exemple les alcanes, les cycloalcanes ou les arènes.
Donnons des exemples de telles réactions.
Sous l'influence de la lumière, les atomes d'hydrogène d'une molécule de méthane peuvent être remplacés par des atomes d'halogène, par exemple des atomes de chlore :
CH4 + Cl2 -> CH3Cl + HCl
Un autre exemple de remplacement de l'hydrogène par un halogène est la conversion du benzène en bromobenzène :
Avec cette forme d'écriture, les réactifs, le catalyseur et les conditions de réaction sont écrits au-dessus de la flèche, et les produits de réaction inorganiques sont écrits en dessous.
Réactions d'addition
Les réactions dans lesquelles deux ou plusieurs molécules de substances réactives se combinent en une seule sont appelées réactions d'addition.
Les composés insaturés, tels que les alcènes ou les alcynes, subissent des réactions d'addition. Selon la molécule qui agit comme réactif, on distingue l'hydrogénation (ou réduction), l'halogénation, l'hydrohalogénation, l'hydratation et d'autres réactions d'addition. Chacun d'eux nécessite certaines conditions.
1. L'hydrogénation est la réaction d'ajout d'une molécule d'hydrogène à une liaison multiple :
CH3-CH = CH2 + H2 -> CH3-CH2-CH3
propène propane
2. Hydrohalogénation - la réaction d'addition d'halogénure d'hydrogène (par exemple, l'hydrochloration) :
CH2=CH2 + HCl -> CH3-CH2-Cl
éthylène chloroéthane
3. Halogénation - la réaction d'ajout d'un halogène (par exemple, chloration) :
CH2=CH2 + Cl2 -> CH2Cl-CH2Cl
éthène 1,2-dichloroéthane
4. La polymérisation est un type particulier de réaction d'addition dans laquelle des molécules d'une substance de faible poids moléculaire se combinent entre elles pour former des molécules d'une substance de très haut poids moléculaire - des macromolécules.
Les réactions de polymérisation sont des processus consistant à combiner de nombreuses molécules d'une substance de faible poids moléculaire (monomère) en grosses molécules (macromolécules) d'un polymère.
Un exemple de réaction de polymérisation est la production de polyéthylène à partir d'éthylène (éthène) sous l'action d'un rayonnement ultraviolet et d'un initiateur de polymérisation radicalaire R.
Réactions d'élimination
Les réactions qui aboutissent à la formation de molécules de plusieurs nouvelles substances à partir d'une molécule du composé d'origine sont appelées réactions d'élimination ou d'élimination.
Des exemples de telles réactions incluent la production d’éthylène à partir de diverses substances organiques.
Parmi les réactions d'élimination, la réaction de division thermique des hydrocarbures, sur laquelle repose le craquage des alcanes, est particulièrement importante - le processus technologique le plus important :
Dans la plupart des cas, le clivage d'une petite molécule d'une molécule de la substance mère conduit à la formation d'une liaison N supplémentaire entre les atomes. Les réactions d'élimination se produisent dans certaines conditions et avec certains réactifs. Les équations données reflètent uniquement le résultat final de ces transformations.
Réactions d'isomérisation
Les réactions à la suite desquelles des molécules d'une substance sont formées à partir de molécules d'autres substances de même composition qualitative et quantitative, c'est-à-dire avec la même formule moléculaire, sont appelées réactions.
Classification des composés organiques.
Les composés organiques sont classés selon deux caractéristiques principales : la structure du squelette carboné et les groupes fonctionnels.
Sur la base de la structure du squelette carboné, on distingue les composés acycliques, carbocycliques et hétérocycliques.
Composés acycliques - contiennent une chaîne ouverte d'atomes de carbone.
Les composés carbocycliques contiennent une chaîne fermée d'atomes de carbone et sont divisés en alicycliques et aromatiques. Les composés alicycliques comprennent tous les composés carbocycliques, à l'exception des composés aromatiques. Les composés aromatiques contiennent un fragment cyclohexatriène (cycle benzène).
Les composés hétérocycliques contiennent des cycles contenant, outre les atomes de carbone, un ou plusieurs hétéroatomes.
Selon la nature de leurs groupes fonctionnels, les composés organiques sont divisés en classes.
Tableau 1. Principales classes de composés organiques.

Tableau 2. Noms des alcanes et des radicaux alkyle adoptés par la nomenclature systématique de l'IUPAC.

Tableau 3. Noms des groupes caractéristiques (classés par ordre décroissant de priorité).

Développer la concentration est un effort conscient menant à la capacité de reconnaître et, par conséquent, d’expérimenter les processus internes. Ce niveau (qualité) caractérise l’attitude consciente d’une personne envers sa vie. Il faut comprendre que sans effort conscient, une personne ne peut pas s'impliquer à la fois dans le processus de connaissance de soi et dans le processus de compréhension du sujet, d'acceptation des connaissances et des informations.
Souvent, une personne sous-estime l'importance de la capacité de concentration, ou confond la concentration avec l'attention portée à quelque chose, ou avec l'accord interne (lorsque l'associativité remplace l'effort interne). La concentration nécessite un calme interne constant. Pas de tension, mais de concentration, lorsqu'une personne ne perd pas le contrôle d'elle-même et de la situation.
La concentration d'une personne dépend du nombre d'actions mal développées au moment de l'entraînement, c'est-à-dire de la façon dont une personne a développé sa conscience tout au long de sa vie. Même chez les personnes atteintes haut niveau le niveau de concentration de l'intelligence est rarement suffisant pour la préservation interne (quand processus de réflexionéconomise l'énergie dépensée pour son activité).
Je voudrais attirer votre attention sur le fait que Développement intellectuel ne crée pas de conditions suffisantes pour le développement de la capacité d'être dans un état concentré. Le développement de la concentration doit être considéré comme un art qui contient une ressource supplémentaire pour la conscience. La concentration ne détruit pas l'énergie existante - elle la préserve et l'améliore avant tout, aidant une personne à faire le plein.
Chaque action dans la vie d’une personne est déterminée par son contenu, en d’autres termes, par l’expérience sensorielle qui accompagne une personne dans le processus d’exécution de toute action. Si cette plénitude n'est pas présente, alors la personne recherche des sources émotionnelles supplémentaires qui se rendent compte de l'insuffisance de l'expérience du processus (consommer des nouvelles, rechercher un interlocuteur, essayer de comprendre ce qu'elle fera dans un avenir proche, etc.).
Une personne ne peut s’empêcher de chercher une source d’épanouissement si elle ne sait pas la produire intérieurement. Et ici la question, en fait, est de savoir ce qui le remplit et quelle est la source de ses désirs. Comment plus de gens agit sans concentration, plus ses intérêts sont grossiers et plus il est facile de les trouver. Mais une personne intellectuellement en développement ne peut pas réaliser diverses expériences sensorielles si elle ne sait pas utiliser son corps et son énergie dans un seul mécanisme d'action fermé.
Il est impossible de ne pas prendre en compte la dépendance de la concentration à l'égard de l'énergie qu'une personne possède depuis sa naissance et qu'elle a déjà gaspillée à la suite d'une vie déséquilibrée. Chacun de nous possède une énergie initiale différente et, au début, tout le monde ne peut pas utiliser suffisamment d’énergie pour progresser rapidement dans le développement de la concentration. Il est important de comprendre cela et de mesurer vos actions par rapport à vos capacités. Dans un premier temps, vous ne devez pas essayer de couvrir un trop grand nombre d'actions à la fois, sinon vous perdrez la responsabilité de ce qui est fait.
L'art d'enseigner
Pour maîtriser l’art d’apprendre à se concentrer, il faut trouver du soutien. Cela vous permet de construire des cours, puis de pratiquer, en établissant une progression dans le développement et en s'appuyant sur la capacité d'une personne à augmenter son niveau de concentration. Pour ce faire, vous devez connaître deux arts :
- l'art de trouver le début;
- l'art de rester concentré sur sa tâche.
Conditions d'éducation
Les conditions d'apprentissage de la concentration nécessitent un rythme constant de travail concentré et la capacité de concentration. C'est-à-dire qu'il s'agit de comprendre les quatre étapes qui nous conduisent à l'effort énergétique de concentration :
- remplissage;
- attention;
- se concentrer;
- concentration.
État d'irrévocabilité
La condition pour parvenir à l’état d’irrévocabilité dans ce cas est deux efforts constants :
- concentration;
- conscience.
Ces deux efforts doivent être interconnectés. Si la capacité de concentration n’est pas développée, elle ne peut pas être développée en peu de temps. Par conséquent, si la concentration n’est pas développée, les actions conscientes ne peuvent pas être suffisamment efficaces.
Chacune de nos actions doit devenir pour nous une expérience consciente, et plus nous y sommes réels, plus l'expérience elle-même est réelle pour nous. Souvent, l’expérience vécue par les gens n’est pas adaptée au concept même de développement personnel. Mais c'est précisément cette expérience qui détermine si une personne peut travailler avec un niveau de concentration suffisant, ou si elle est déjà habituée à travailler sans concentration.
Les méthodes de développement de la concentration sont associées aux principes élémentaires de l'existence : elles reposent sur la discipline, la régularité et la capacité d'être dans un effort volontaire d'existence contrôlé. Et si nous ajoutons ici des pratiques et des techniques plus spéciales, nous obtiendrons alors le minimum nécessaire pour commencer à travailler avec concentration.
Une personne peut-elle atteindre un degré élevé de concentration sans tout cela ? Certainement pas, mais si dès la naissance il dispose d'une quantité suffisante d'énergie pour alimenter le cerveau, alors, bien sûr, une telle personne sera en partie capable de réaliser les tâches de construction de la conscience sans travail particulier. Cependant, avec l'incapacité de conserver l'énergie, un jour arrive un moment d'affaiblissement des capacités mentales.
Outils d'apprentissage
Toutes pratiques statiques et motrices réalisées dans une perspective de développement de la concentration.
6600