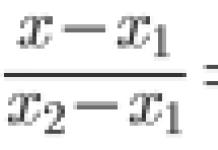XX amžiaus pradžioje. Eksperimentais apšvitinant ploną foliją alfa dalelėmis, E. Rutherfordas nustatė atomo struktūrą. Jis parodė, kad atomas turi planetinį modelį (3 pav.), tai yra, jis susideda iš tankaus teigiamai įkrauto branduolio, aplink kurį sukasi laisvas elektronų apvalkalas.
Ryžiai. 3. E. Rutherfordo atomo sandaros planetinis modelis
Apskritai atomas yra elektriškai neutrali cheminio elemento elementų struktūra. Fizinė Z elemento serijos numerio reikšmė Periodinė elementų lentelė elementai buvo nustatyti Rutherfordo planetiniame atomo modelyje. Z sutampa su teigiamų elementariųjų krūvių skaičiumi branduolyje, kurie natūraliai padidėja vienu, pereinant iš ankstesnio elemento į kitą. Cheminės elementų savybės ir daugelis jų fizinių savybių paaiškinamos jų atomų išorinių, vadinamųjų valentinių elektronų, elgesiu.
Todėl cheminių elementų savybių periodiškumas turi būti siejamas su tam tikru elektronų išsidėstymo įvairių elementų atomuose periodiškumu. Periodinės lentelės teorija grindžiama šiais principais:
a) cheminio elemento eilės numeris yra iš viso elektronai tam tikro elemento atome;
b) elektronų būseną atome lemia jų kvantinių skaičių aibė P,l, m Ir m s . Elektronų pasiskirstymas atome tarp energetinių būsenų turi atitikti minimalios potencinės energijos principą: didėjant elektronų skaičiui, kiekvienas paskesnis elektronas turi užimti galimą energijos būseną su mažiausia energija;
c) atomo energetinių būsenų užpildymas elektronais turėtų vykti pagal Pauli principą.
Elektronai atome, užimančiame būsenų rinkinį, turintį tą pačią pagrindinio kvantinio skaičiaus reikšmę P, sudaro elektroninį apvalkalą arba elektroninį sluoksnį. Priklausomai nuo vertybių n Išskiriami šie apvalkalai: KAM adresu n = 1,L adresu n = 2,M adresu n= 3,N adresu n = 4,APIE adresu P= 5 ir tt Maksimalus elektronų skaičius, kuris gali būti apvalkaluose pagal Pauli principą: in KAM-apvalkalas – 2 elektronai, apvalkaluose L,M,N Ir APIE 8, 18, 32 ir 50 elektronų atitinkamai. Kiekviename apvalkale elektronai yra paskirstyti į pogrupius arba posluoksnius, kurių kiekvienas atitinka tam tikrą orbitinio kvantinio skaičiaus reikšmę. Atominėje fizikoje elektroninę būseną atome įprasta žymėti simboliu Pl, nurodantis dviejų kvantinių skaičių reikšmę. Elektronai, esantys būsenose, pasižyminčiose tais pačiais kvantiniais skaičiais n Ir l, vadinami lygiaverčiais. Skaičius Z-ekvivalentiški elektronai žymimi simboliu eksponentu nl z. Jei elektronai yra tam tikrose būsenose su tam tikromis kvantinių skaičių reikšmėmis P Ir l, tada vadinamoji elektroninė konfigūracija laikoma duota. Pavyzdžiui, pagrindinę deguonies atomo būseną galima išreikšti tokia simboline formule: 1s 2, 2s 2, 2p 4. Tai rodo, kad du elektronai yra būsenose su n= 1 ir l= 0, du elektronai turi kvantinius skaičius n= 2 ir l= 0 ir keturi elektronai užima būsenasc n = 2 ir l= 1.
Elektroninių būsenų užpildymo tvarka atominiuose apvalkaluose, o viename apvalkale - pogrupiuose (poapvaliuose) turi atitikti energijos lygių išdėstymo su duomenimis seką. P Ir l. Pirmiausia užpildomos mažiausią įmanomą energiją turinčios būsenos, o po to – vis didesnės energijos būsenos. Lengvųjų atomų atveju ši tvarka atitinka tai, kad pirmiausia užpildomas mažesnio dydžio apvalkalas. P ir tik tada kitas apvalkalas turėtų būti užpildytas elektronais. Per vieną apvalkalą, valstybės su l= 0, o tada būsenos su dideliais l, iki l=P– 1. Elektronų sąveika lemia tai, kad esant pakankamai dideliems pagrindiniams kvantiniams skaičiams n teigia su puikiais n ir mažas l gali turėti mažesnę energiją, tai yra būti energetiškai palankesnė nei būsenos su žemesne P, bet su daugiau l. Iš to, kas pasakyta, išplaukia, kad elementų cheminių savybių periodiškumas paaiškinamas elektroninių konfigūracijų pakartojamumu susijusių elementų atomų išoriniuose elektroniniuose pogrupiuose.
Šviesos savybių bangų-dalelių dvilypumas.
Apibendrinkime skyriaus „Optika“ rezultatus.
Viduje geometrinė optikaį šviesos prigimtį neatsižvelgiama. Naudojama šviesos pluošto sąvoka, kuriai suformuluoti geometrinės optikos dėsniai. Šie dėsniai leidžia apskaičiuoti šviesos spindulių trajektoriją tuo atveju, kai įvairių kliūčių spindulio kelyje dydžiai yra pakankamai dideli. Šių dėsnių panaudojimas leido sukurti įvairias optines sistemas ir instrumentus (lęšį, mikroskopą, teleskopą, kamerą, skaidrių projektorių).
Šviesą vertinant kaip elektromagnetinę bangą, buvo galima suprasti tokius reiškinius kaip šviesos trukdžiai, difrakcija ir poliarizacija. Šviesos banginis pobūdis pasireiškia tada, kai kliūties dydis šviesos bangos kelyje yra panašus į bangos ilgį. Interferencijos, difrakcijos, šviesos poliarizacijos reiškiniai yra įvairūs praktinis naudojimas(spektrometrija, defektų aptikimas, holografija) Projektuojant įvairias optines sistemas reikia atsižvelgti į šviesos bangines savybes.
Kvantinėje optikoje šviesa pasireiškia kaip dalelių srautas arba šviesos kvantai – fotonai. Kvantinių sąvokų rėmuose randami paaiškinimai tokiems reiškiniams kaip kūnų šiluminė spinduliuotė, išoriniai ir vidiniai fotoelektriniai efektai, Komptono efektas ir kt.
Tai, kad kai kuriuose eksperimentuose šviesa pasižymi banginėmis savybėmis, o kituose – korpuskulinėmis savybėmis, reiškia, kad ji turi sudėtingą dvejopą prigimtį, kuri paprastai apibūdinama terminu bangos-dalelės dvilypumas . Vėliau buvo nustatytas materijos dalelių bangų ir dalelių dvilypumas.
G.Ya.Myakishev, B.B.Bukhovcevas, V.M.Charugin. Fizika. 11 klasė. Vadovėlis bendrojo ugdymo įstaigoms - M.: „Prosveshchenie“, 2009 ir kt. 11 skyrius.
18 tema. (2 val.)
Atominė fizika. Rutherfordo eksperimentai. Atomo planetinis modelis. Bohro kvantiniai postulatai. Lazeriai.
Sudėtingos atomo struktūros atradimas yra svarbiausias vystymosi etapas šiuolaikinė fizika, kuris paliko pėdsaką visame tolimesniame jos vystyme. Kuriant kiekybinę atomo sandaros teoriją, atsirado atomų fizika, kuri leido paaiškinti atomų spektrus, fizikinius ir Cheminės savybėsįvairių medžiagų, dėl kurių atsirado kitos fizikos šakos. Buvo atrasti mikrodalelių judėjimo dėsniai – kvantinės mechanikos dėsniai.
Vienas pirmųjų atomo struktūros modelių buvo pasiūlytas 1903 m. J. J. Tomsonas . Jis manė, kad atomas buvo sferinis; teigiamas krūvis pasiskirsto tolygiai visame šio rutulio tūryje, o jo viduje išsidėstę neigiamo krūvio elektronai. Atomo spindulys yra maždaug 10–10 m. Tačiau eksperimentiniai rezultatai įrodė, kad šis modelis yra klaidingas.
Rutherfordo eksperimentai. Naują atomo modelį pasiūlė Rutherfordas, atlikęs eksperimentus tirdamas greito sklaidą. α - dalelės ant materijos atomų. Šių eksperimentų metu radioaktyvus vaistas 2 (radis, 18.1 pav.) buvo patalpintas į švino indą 1. Siauras pluoštas 3 α - dalelės (visiškai jonizuoti radžio skleidžiami helio atomai) buvo nukreiptos ant plonos metalinės folijos 4 . Už jo buvo pastatytas ekranas 5, padengtas cinko sulfido kristalų sluoksniu, galinčiu švytėti veikiant greitai įkraunamų dalelių. Stebimi blyksniai ekrane 18.1 pav
naudojant mikroskopą 6 .
Buvo nustatyta, kad α -dalelės prasiskverbia pro plonas metalines plokštes beveik nenukrypdamos nuo tiesaus kelio. Tuo pačiu metu nedidelė alfa dalelių dalis buvo nukreipta žymiai didesniais (iki 180 ○) kampais.
Rutherfordas pasiūlė, kad alfa dalelių išsibarstymas dideliais kampais paaiškinamas tuo, kad teigiamas krūvis atome nepasiskirsto tolygiai 10–10 m spindulio rutulyje, o yra sutelktas centrinėje atomo dalyje. daug mažesnių matmenų regionas.
Beveik visa atomo masė yra sutelkta šioje centrinėje teigiamai įkrautoje atomo dalyje – atomo branduolyje. Rutherfordo skaičiavimai parodė, kad norint paaiškinti alfa dalelių sklaidos eksperimentus, reikia paimti, kad branduolio spindulys būtų maždaug 10–15 m, esant tokiam mažam spinduliui elektrinis laukasšalia jo paviršiaus esantis branduolys yra labai didelis. Šioje srityje juda α -dalelę veikia didelė jėga, kuri nukreipia dalelę dideliais kampais, taip pat ir priešinga kryptimi.
Po to, kai Rutherfordo eksperimentuose buvo atrastas teigiamai įkrautas branduolys, reikėjo atsakyti į klausimus, kur atome yra elektronai ir kas jame užima likusią erdvę. Rutherfordas teigė, kad atomo struktūra yra panaši į planetų sistemą. Kaip planetos sukasi aplink Saulę dideliais atstumais nuo jos, taip ir elektronai sukasi aplink atomo branduolį. Tolimiausio nuo branduolio elektrono orbitos spindulys yra atomo spindulys. Šis atominės struktūros modelis buvo vadinamas planetinis arba branduolinis modelis.
Tačiau atominės sistemos skiriasi nuo planetų sistemų fizine jėgų, laikančių planetas ir elektronus savo orbitose, prigimtimi: planetas žvaigždes traukia visuotinės gravitacijos jėgos, o pagrindinis vaidmuo tenka elektronų sąveikai su atomo branduoliu. vaidina priešingų elektros krūvių Kulono traukos jėgos. Gravitacinės traukos jėgos tarp elektrono ir atomo branduolio yra nereikšmingos, palyginti su elektromagnetinėmis.
Branduolinis atomo modelis gerai paaiškina pagrindinius įkrautų dalelių sklaidos dėsnius. Kadangi didžioji erdvės tarp atomo branduolio ir aplink jį skriejančių elektronų yra tuščia, greitai įkrautos dalelės gali beveik laisvai prasiskverbti pro medžiagos sluoksnius, kuriuose yra keli tūkstančiai atomų sluoksnių.
Susidūrusi su elektronu, alfa dalelė praktiškai nėra išsibarsčiusi, nes jos masė yra maždaug 8000 kartų daugiau masės elektronas. Tačiau tuo atveju, kai alfa dalelė skrenda šalia vieno iš atomo branduolių, veikiama atomo branduolio elektrinio lauko, ji gali būti išsklaidyta bet kokiu kampu iki 180°. Tačiau dėl mažo branduolio dydžio, palyginti su atomo dydžiu, tokie įvykiai įvyksta labai retai.
Branduolinis atomo modelis leido paaiškinti alfa dalelių sklaidos medžiagoje eksperimentų rezultatus, tačiau susidūrė su dar vienu esminiu sunkumu: Rutherfordo elektronų judėjimo atome dėsniai prieštaravo elektrodinamikos dėsniams.
Kaip žinoma, bet kokį pagreitintą elektros krūvių judėjimą lydi elektromagnetinių bangų spinduliavimas. Žiedinis judėjimas – pagreitintas judėjimas, todėl atome esantis elektronas turi skleisti elektromagnetines bangas, kurių dažnis lygus apsisukimo aplink branduolį dažniui. Tai turėtų lemti elektrono energijos sumažėjimą, jo laipsnišką artėjimą prie atomo branduolio ir nukristi į branduolį.
Taigi atomas, susidedantis iš atomo branduolio ir aplink jį besisukančių elektronų, pagal klasikinės fizikos dėsnius, yra nestabilus. Tačiau iš tikrųjų atomai yra stabilūs ir neskleidžia šviesos nesužadintoje būsenoje.
Iki XIX amžiaus pabaigos buvo manoma, kad atomas yra nedalomas. Tačiau po to, kai anglų fizikas Josephas Johnas Thomsonas 1897 m. atrado elektroną, tapo aišku, kad mokslininkai klydo.
Taigi, atradęs elektroną, Tomsonas padarė išvadą, kad jis turi masę ir turi neigiamą krūvį. Buvo manoma, kad elektronas yra neatskiriama atomo dalis. Bet kadangi jis turi neigiamą krūvį, todėl atome turi būti dalelių, turinčių teigiamą krūvį, nes apskritai atomas yra neutralus.
Tomsono atominis modelis
Tomsonas pasiūlė savo atomo modelį. Jis tikėjo, kad atomas turi rutulio formą. Šio rutulio viduje yra teigiamai įkrauta medžiaga, kurioje yra neigiamo krūvio elektronų. Thomsonas juokaudamas pavadino savo modelį „razinų bandele“. Tai yra, jo modelyje elektronai yra tarsi įsiterpę į kažkokią teigiamai įkrautą masę, kaip razinos bandelėje.
Rutherfordo patirtis

Rutherfordo patirtis
Tolesni mokslininkų atlikti atomo tyrimai parodė, kad Thomsono pasiūlytas modelis buvo neteisingas.
1909 metais anglų fizikas Ernestas Rutherfordas atliko eksperimentą su alfa dalelių, kurios susidaro irstant cheminiam elementui radžiui, sklaida. Alfa dalelių masė yra 8000 kartų didesnė už elektrono masę.
Rutherfordo eksperimento metu alfa dalelių spindulys buvo praleistas per ploną aukso foliją. Reikia pasakyti, kad folija buvo tokia plona, kad jos storis buvo beveik vienas molekulių sluoksnis. Jei Thomsonas buvo teisus, o atomą sudarė kažkoks elektronų debesis, tada alfa dalelės, turinčios didelę masę, turėtų lengvai pereiti per foliją. Tačiau iš tikrųjų paaiškėjo, kad kai kurios alfa dalelės iš tikrųjų praėjo pro šalį, nukrypdamos tik nedideliu kampu, o kai kurios susidūrė su kokia nors kliūtimi ir atšoko atgal. Tai buvo neįtikėtina. Vėliau Rutherfordas palygino savo patirtį su 15 colių apvalkalo šaudymu į minkštą popierių. Jo eksperimento rezultatas buvo toks, tarsi sviedinys ne tik neprasiskverbė į minkštą popierių, bet ir atšoko nuo jo. Tai yra, atomo viduje buvo kažkas, kas neleido alfa dalelėms praeiti pro atomą. Kadangi alfa dalelės turėjo teigiamą krūvį, greičiausiai jos praeidavo pro kitas daleles, turinčias teigiamą krūvį. Ir šių dalelių dydžiai buvo daug mažesni nei paties atomo dydžiai. Aukso atomą turėjo sudaryti teigiamą krūvį turintis branduolys ir jį supantys neigiamai įkrauti elektronai.
Galima sakyti, kad tai buvo branduolinės fizikos gimimas.
Atomo planetinis modelis

Rutherfordo atomo modelis
Rutherfordas pasiūlė savo atomo modelį, kuris paaiškino atomo struktūrą. Jis tikėjo, kad visa atomo dalis buvo sutelkta teigiamai įkrautame branduolyje. Ir neigiamo krūvio elektronai sukasi aplink šį branduolį, kaip planetos sukasi aplink Saulę. O elektronai sukasi veikiami Kulono jėgos, veikiančios juos iš branduolio. Rutherfordo modelis buvo vadinamas planetiniu.
Elektronai atome sukasi tokiu milžinišku greičiu, kad virš branduolio paviršiaus susidaro tam tikras debesis. Visi atomai yra tam tikru atstumu vienas nuo kito. Ir jie „nesilipdo“, nes aplink kiekvieno atomo branduolį yra savo elektronų „debesis“, neigiamai įkrautas. Ir šis „debesis“ yra atstumtas nuo kito atomo neigiamai įkrauto elektronų „debesio“.
Tačiau Rutherfordo atomo modelis turėjo trūkumų. Tai buvo nesuderinama su klasikinės fizikos dėsniais. Kodėl elektronas nepatenka į branduolį? Nes tai sukasi aplink jį. Tačiau sukdamasis jis turi skleisti elektromagnetines bangas ir prarasti energiją. Ir, palaipsniui išeikvojęs visą energiją, elektronas turi kristi į branduolį. Tačiau realybėje tai neįvyksta. Tai reiškia, kad atome vykstantys procesai nepaklūsta klasikiniams dėsniams.
Vėliau danų fizikas Nielsas Bohras pateikė šio reiškinio paaiškinimą. Jis pasiūlė, kad elektronai atome judėtų tik stacionariomis orbitomis, kuriose jie neišskiria energijos. Ir Bohr buvo teisus.
Atominė struktūra
Krūvio, masės ir energijos vienetai atomų fizikoje.
Taigi, bet kurios dalelės krūvis visada turi sveiką skaičių elementariųjų krūvių. Atominio dydžio dalelėms šis sveikasis skaičius taip pat bus mažas. Atsižvelgiant į tai, atomų fizikoje elektros krūvio vienetu patogu imti elementarųjį krūvį e = 1,60 10-19 C. Atominėje fizikoje masės vienetas laikomas 1/12 anglies izotopo 12C atomo masės. Šio izotopo atominė masė yra 12, o molinė masė M = 12 10-3 kg/mol. Todėl atominės masės vienetas (a.m.u.) yra lygus
Atominės masės vienetas taip pat gali būti apibrėžtas kaip elemento, kurio atominė masė yra 1, atomo masė. Todėl atomo masė (tiksliau jo vidutinė vertė), išreikšta atominės masės vienetais, yra lygi atomo masei. elemento.
Atkreipkite dėmesį, kad elementas, turintis atominę masę lygus vienam, gamtoje neegzistuoja. Vandenilio atominė masė yra artima vienetui, bet šiek tiek didesnė: ji lygi 1,008. Taigi, lengviausio atomo masė yra 1,008 a. valgyti.
Atominėje fizikoje naudojamas energijos vienetas yra energija, kurią įgyja dalelė, kurios krūvis yra e (pavyzdžiui, elektronas), praeinant per 1 V potencialų skirtumą. Šis vienetas vadinamas elektronvoltu ir žymimas eV. Energija, kurią įgyja krūvis judant elektriniame lauke, yra lygi krūvio ir potencialų skirtumo sandaugai tarp kelio pradžios ir pabaigos taškų, todėl
1 eV=1,6 10-19 C 1V=1,6 10-19J.
Iš elektronvolto apibrėžimo išplaukia, kad potencialų skirtumu U [V] pagreitinto elektrono energija skaitiniu požiūriu lygi U [eV]. Jonas, kurio krūvis yra 2e, praėjęs per tą patį potencialų skirtumą, įgyja 2U [eV] energiją ir kt.
Ne tik įkrautų, bet ir neutralių dalelių energija gali būti matuojama elektronvoltais. Pavyzdžiui, išreikškime elektronvoltais deguonies atomo (m=16 amu), judančio greičiu v=103 m/s, energiją:
Taip pat naudojami vienetai, kurie yra elektronvolto kartotiniai:
1 keV=103 eV, 1 MeV=106 eV, 1 GeV=109 eV, 1 TeV=1012 eV.
Rutherfordo-Boro atomo modelis.
Visa materija susideda iš elementariosios dalelės. Bet materija tiesiogiai nesusideda iš elementariųjų dalelių. Statybiniai blokai arba elementai, iš kurių sudaryta visa medžiaga, yra atomai. Iki 1912 m. mokslininkai vaizdavo atomą kaip teigiamai įkrautą rutulį, kuriame yra neigiamo krūvio elektronų. Dizainą, panašų į keksiuką su elektroninėmis razinomis, pasiūlė Thomsonų bendravardžiai Josephas Johnas ir Williamas Lordas Kelvinas.

Apskritai teigiamas ir neigiamas krūviai tokiame atome yra kompensuojami ir atomas yra elektriškai neutralus. Buvo manoma, kad visa atomo masė buvo sutelkta elektronuose. Kadangi elektronas yra daug lengvesnis už atomą, net ir paprasčiausiuose atomuose turi būti tūkstančiai elektronų.
1909 m. Rutherfordas pavedė tuometiniam jaunam fizikui Marsdenui ištirti alfa spindulių sklaidą, kai jie sklinda per plonas metalines plokštes. Dauguma elementariųjų dalelių patyrė nedidelį deformaciją po to, kai praėjo pro plokštes. Tačiau Marsdenas sugebėjo aptikti labai stipriai nukrypusias daleles. Tiesa, jų buvo labai mažai, bet nustebino tai, kad jie apskritai egzistavo. Žinoma, Marsdenas galėjo tai įsivaizduoti. Alfa dalelėms registruoti buvo naudojamas spintariskopas – mažas permatomas ekranas, padengtas specialia fluorescencine medžiaga. Kai elementari dalelė atsitrenkia į tokį ekraną, atsiranda silpnas arimas. Blykstė labai maža ir silpna. Jis stebimas mikroskopu. Kad akis tai pastebėtų, žmogus turi priprasti prie tamsos. Norėdami tai padaryti, prieš pradėdamas dirbti, tai yra registruoti ir skaičiuoti blyksnius, jis turi sėdėti pusvalandį visiškoje tamsoje. Todėl natūralu manyti, kad Marsdenas galėjo klysti.
Rutherfordas prašo Marsdeno pakartoti eksperimentus, tačiau šį kartą specialiai stebėkite daleles, kurios gavo didelį nuokrypį iki 90°.
Kai po kelių dienų Marsdenas įėjo į Rutherfordo biurą ir pasakė: „Yra tokių dalelių“, Rutherfordas nustebęs numetė ragelį. Rutherfordas, nors ir siūlė Marsdenui atlikti šiuos eksperimentus, pats nesitikėjo tokio rezultato.
Vėliau Rutherfordas prisiminė: tai buvo pats neįtikėtiniausias įvykis mano gyvenime. Tai buvo beveik taip pat neįtikėtina, kaip šaudyti 15 colių apvalkalu į minkštojo popieriaus gabalą, o apvalkalas sugrįžo ir pataikė į tave.".
Eksperimentai buvo dar kartą patikrinti, tačiau šį kartą prie eksperimentų prisijungė Geigeris. Šis reiškinys buvo eksperimentiškai ištirtas, o eksperimentinė medžiaga buvo paskelbta tais pačiais metais. Tačiau rezultatų prasmė buvo paslaptinga. Tomsono atomas negalėjo sustabdyti dideliu greičiu skriejančios alfa dalelės.
1911 m. Rutherfordas paskelbė savo straipsnį „Alfa ir beta dalelių išsklaidymo medžiaga ir atomo struktūra“, kuriame pasiūlė savo garsųjį planetinį atomo modelį.

Rezerfordo atomo centre yra mažas, labai masyvus teigiamai įkrautas branduolys, nuo kurio alfa dalelė atšoko aprašytuose eksperimentuose. Aplink branduolį sukasi lengvi, neigiamo krūvio elektronai. Didžioji dalis erdvės atomo viduje yra užpildyta tuštuma. Apskritai modelis yra labai panašus į mūsų saulės sistemą.
Rutherfordo apgailestavimui, straipsnis buvo sutiktas tyliai. Rutherfordas, žinoma, suprato kodėl. Jo atomas buvo trumpalaikis. Aplink branduolį besisukantis elektronas turi skleisti elektromagnetines bangas ir dėl to prarasti energiją. Tuo pačiu metu jo greitis turėtų sulėtėti ir nukristi ant šerdies. Tačiau patirtis rodo, kad beveik visi gamtoje esantys atomai yra stabilūs.
Nielsas Bohras ištaisė situaciją.
Bohro teorija
Bohro postulatai savo prigimtimi panašūs į Keplerio dėsnius, kurių taip pat yra trys. Abu yra atspėti modeliai, gauti remiantis eksperimentiniais faktais. Kepleriui galbūt buvo dar sunkiau. Kaip, pavyzdžiui, galima pasiekti rezultatą, kuris (formulė)? Tik po to, kai Niutonas suformulavo mechanikos dėsnius, Keplerio dėsnius tapo įmanoma paaiškinti.
Pagrindinis Rutherfordo modelio trūkumas buvo tas, kad elektronas, judantis žiedine orbita aplink branduolį, turėtų skleisti elektromagnetines bangas, tačiau įrodymai rodo, kad taip nėra. Mokslininkai, įskaitant Rutherfordą, negalėjo paaiškinti šio prieštaravimo. Boras taip pat negalėjo to padaryti. Jis tiesiog stojo į faktus: kadangi elektronai neišspinduliuoja, vadinasi, taip ir turi būti. Taip atsirado pirmasis postulatas. Iš viso, kaip jau minėjome, jų yra trys.
Boro postulatai
1. Elektronai juda atome nejudančiomis orbitomis, o energijos neišskiria ir nesugeria.
2. Stacionarios orbitos bus tos, kurioms elektrono kampinis impulsas mvr yra lygus sveikajam kartotiniam.
![]() , kur k = 1, 2, 3, 4...
, kur k = 1, 2, 3, 4...
3. Judėdamas iš vienos orbitos į kitą, elektronas skleidžia arba sugeria energiją fotono pavidalu.
Būdamas tolimesnėse orbitose, elektronas turi daugiau energijos, todėl, judėdamas į orbitą arčiau branduolio, išspinduliuoja vieną fotoną su energija

Kai atomas sugeria fotoną, elektronas gali pakilti į aukštesnį lygį.
Vandenilio atomo matmenys
Elektronas, besisukantis aplink branduolį, patiria Kulono traukos jėgą link jo:

kur yra atomo branduolio, kurio atominis skaičius Z, krūvis.
Ši jėga pagal antrąjį Niutono dėsnį turi būti lygi, todėl:  arba
arba  .
.
Antrasis Bohro postulatas mums sako, kad orbitos spindulys negali būti savavališkas, bet turi paklusti lygčiai:
kur žymėsime k-ąją stacionarią orbitą. Iš čia gauname

 .
.
Gavome atomo, kurio eilės numeris Z, k-osios stacionarios orbitos spindulį. Vandeniliui Z=1. Raskime pirmosios (k = 1) vidinės orbitos, kurioje elektronas turi mažiausią energijos kiekį, spindulį.
Vadinasi, vandenilio atomo skersmuo yra maždaug , o tai gerai sutampa su eksperimentiniais duomenimis.
Raskime k-osios orbitos elektrono energiją.
Jo energija kyla iš kinetinė energija orbitos judėjimas ir potenciali elektrostatinė sąveikos su branduoliu energija.
Jie tapo svarbiu žingsniu fizikos raidoje. Rutherfordo modelis buvo labai svarbus. Atomas kaip sistema ir jį sudarančios dalelės buvo ištirtos tiksliau ir išsamiau. Tai paskatino sėkmingą tokio mokslo kaip branduolinės fizikos plėtrą.
Senovės idėjos apie materijos sandarą
Dar antikos laikais buvo daroma prielaida, kad aplinkiniai kūnai susideda iš mažyčių dalelių. To meto mąstytojai įsivaizdavo, kad atomas yra mažiausia ir nedaloma bet kokios medžiagos dalelė. Jie teigė, kad Visatoje nėra nieko mažesnio už atomą. Tokių pažiūrų laikėsi didieji senovės graikų mokslininkai ir filosofai – Demokritas, Lukrecijus, Epikūras. Šių mąstytojų hipotezės šiandien yra sujungtos pavadinimu „senovės atomizmas“.
Viduramžių spektakliai
Senovės laikai praėjo, o viduramžiais buvo ir mokslininkų, kurie darė įvairias prielaidas apie medžiagų sandarą. Tačiau vyraujant religinėms filosofines pažiūras o bažnyčios galia tuo istorijos laikotarpiu nuslopino bet kokius žmogaus proto bandymus ir siekius prie materialistinių mokslo išvadų ir atradimų. Kaip žinia, viduramžių inkvizicija su to meto mokslo pasaulio atstovais elgėsi labai nedraugiškai. Belieka pasakyti, kad šviesūs to meto protai turėjo atomo nedalumo idėją, kilusią iš senovės.
XVIII–XIX amžių tyrinėjimai
XVIII amžius buvo pažymėtas rimtais atradimais elementarios materijos sandaros srityje. Daugiausia mokslininkų, tokių kaip Antoine'as Lavoisier, Michailas Lomonosovas ir Nepriklausomai vienas nuo kito, pastangų dėka jie sugebėjo įrodyti, kad atomai tikrai egzistuoja. Bet klausimas apie juos vidinė struktūra liko atvira. XVIII amžiaus pabaiga buvo pažymėta tokiu reikšmingu įvykiu m mokslo pasaulis, kaip periodinės lentelės atradimas D. I. Mendelejevo cheminiai elementai. Tai buvo tikrai galingas to meto proveržis ir pakėlė uždangą nuo supratimo, kad visi atomai turi vieną prigimtį, kad jie yra susiję vienas su kitu. Vėliau, XIX amžiuje, dar vienas svarbus žingsnis siekiant išnarplioti atomo struktūrą buvo įrodymas, kad bet kuriame iš jų yra elektronas. Šiuo laikotarpiu mokslininkų darbai paruošė palankią dirvą XX amžiaus atradimams.

Tomsono eksperimentai
Anglų fizikas Johnas Thomsonas 1897 metais įrodė, kad atomuose yra elektronų su neigiamu krūviu. Šiame etape klaidingos idėjos, kad atomas yra bet kurios medžiagos dalijimosi riba, buvo visiškai sunaikintos. Kaip Thomsonui pavyko įrodyti elektronų egzistavimą? Savo eksperimentuose mokslininkas įdėjo elektrodus į labai išretintas dujas ir praėjo elektros. Dėl to atsirado katodiniai spinduliai. Thomsonas atidžiai ištyrė jų ypatybes ir išsiaiškino, kad tai įkrautų dalelių srautas, judantis milžinišku greičiu. Mokslininkui pavyko apskaičiuoti šių dalelių masę ir jų krūvį. Jis taip pat išsiaiškino, kad jų negalima paversti neutraliomis dalelėmis, nes elektros krūvis yra jų prigimties pagrindas. Taigi Thomsonas taip pat buvo pirmojo pasaulyje atomo struktūros modelio kūrėjas. Pagal jį atomas – tai krūva teigiamai įkrautos medžiagos, kurioje tolygiai pasiskirstę neigiamo krūvio elektronai. Ši struktūra paaiškina bendrą atomų neutralumą, nes priešingi krūviai balansuoja vienas kitą. Johno Thomsono eksperimentai tapo neįkainojami tolesniam atomo sandaros tyrimui. Tačiau daugelis klausimų liko neatsakyti.

Rutherfordo tyrimai
Tomsonas atrado elektronų egzistavimą, tačiau jam nepavyko rasti teigiamai įkrautų dalelių atome. ištaisė šį nesusipratimą 1911 m. Eksperimentų metu, tirdamas alfa dalelių aktyvumą dujose, jis atrado, kad atome yra dalelių, kurios buvo teigiamai įkrautos. Rutherfordas pastebėjo, kad kai spinduliai praeina per dujas arba per ploną metalinę plokštę, nedidelis dalelių skaičius smarkiai nukrypo nuo judėjimo trajektorijos. Jie tiesiogine prasme buvo išmesti atgal. Mokslininkas spėjo, kad toks elgesys paaiškinamas susidūrimais su teigiamai įkrautomis dalelėmis. Tokie eksperimentai leido fizikui sukurti Rutherfordo atomo sandaros modelį.

Planetinis modelis
Dabar mokslininko idėjos šiek tiek skyrėsi nuo Johno Thomsono prielaidų. Jų atominiai modeliai taip pat skiriasi. leido jam sukurti visiškai naują šios srities teoriją. Mokslininko atradimai buvo labai svarbūs tolimesnis vystymas fizika. Rutherfordo modelis apibūdina atomą kaip turintį centre esantį branduolį ir aplink jį judančius elektronus. Branduolys turi teigiamą krūvį, o elektronai – neigiamą. Rutherfordo atomo modelis padarė prielaidą apie elektronų sukimąsi aplink branduolį tam tikromis trajektorijomis – orbitomis. Mokslininko atradimas padėjo paaiškinti alfa dalelių nukrypimo priežastį ir tapo postūmiu plėtoti atomo branduolinę teoriją. Rutherfordo atomo modelis rodo analogiją su planetų judėjimu saulės sistema aplink Saulę. Tai labai tikslus ir ryškus palyginimas. Todėl Rutherfordo modelis, kuriame atomas juda aplink branduolį orbita, buvo vadinamas planetiniu.

Nielso Bohro darbai
Po dvejų metų danų fizikas Nielsas Bohras bandė sujungti idėjas apie atomo struktūrą su kvantinėmis savybėmis. šviesos srautas. Mokslininkas naudojo Rutherfordo branduolinį atomo modelį kaip savo naujos teorijos pagrindą. Pasak Bohro, atomai sukasi aplink branduolį apskritimo orbitomis. Ši judėjimo trajektorija lemia elektronų pagreitį. Be to, šių dalelių Kulono sąveika su atomo centru yra susijusi su energijos kūrimu ir išleidimu erdviniam elektromagnetiniam laukui, atsirandančiam dėl elektronų judėjimo, palaikyti. Tokiomis sąlygomis neigiamo krūvio dalelės kada nors turi nukristi ant branduolio. Bet tai neįvyksta, o tai rodo didesnį atomų, kaip sistemų, stabilumą. Nielsas Bohras suprato, kad klasikinės termodinamikos dėsniai, aprašyti Maksvelo lygtimis, neveikia intraatominėmis sąlygomis. Todėl mokslininkas iškėlė sau uždavinį išvesti naujus dėsnius, kurie galiotų elementariųjų dalelių pasaulyje.

Boro postulatai
Daugiausia dėl to, kad Rutherfordo modelis egzistavo, atomas ir jo komponentai buvo gerai ištirti, Nielsas Bohras galėjo priartėti prie savo postulatų kūrimo. Pirmoji iš jų teigia, kad atomas turi, kuriame jis nekeičia savo energijos, o elektronai juda orbitomis nekeisdami savo trajektorijos. Pagal antrąjį postulatą, kai elektronas juda iš vienos orbitos į kitą, energija išsiskiria arba absorbuojama. Jis lygus ankstesnės ir vėlesnės atomo būsenų energijų skirtumui. Be to, jei elektronas šokinėja į orbitą arčiau branduolio, atsiranda spinduliuotė ir atvirkščiai. Nepaisant to, kad elektronų judėjimas mažai panašus į orbitos trajektoriją, esančią griežtai apskritime, Bohro atradimas leido gauti puikų linijos spektro egzistavimo paaiškinimą Maždaug tuo pačiu metu fizikai Hertzas ir Frankas gyveno Vokietijoje, patvirtino Nielso Bohro mokymą apie stacionarių, stabilių atomo būsenų egzistavimą ir galimybę keisti atominės energijos vertes.

Dviejų mokslininkų bendradarbiavimas
Beje, Rutherfordas ilgai negalėjo nustatyti, kad mokslininkai Marsdenas ir Geigeris bandė dar kartą patikrinti Ernesto Rutherfordo teiginius ir, atlikę išsamius ir nuodugnius eksperimentus bei skaičiavimus, padarė išvadą, kad tai yra esmė. yra svarbiausia savybė atomas, o visas jo krūvis sutelktas jame. Vėliau buvo įrodyta, kad branduolinio krūvio reikšmė yra skaitinė lygi elemento eilės skaičiui D. I. Mendelejevo periodinėje elementų sistemoje. Įdomu tai, kad Nielsas Bohras netrukus susitiko su Rutherfordu ir visiškai sutiko su jo nuomone. Vėliau mokslininkai ilgą laiką dirbo kartu toje pačioje laboratorijoje. Rutherfordo modelis, atomas kaip sistema, susidedanti iš elementarių įkrautų dalelių – visa tai Nielsas Bohras laikė teisingu ir amžiams atidėjo savo elektroninį modelį į šalį. Bendras moksline veikla mokslininkai buvo labai sėkmingi ir davė vaisių. Kiekvienas iš jų gilinosi į elementariųjų dalelių savybių tyrimą ir padarė mokslui reikšmingų atradimų. Vėliau Rutherfordas atrado ir įrodė branduolio skilimo galimybę, tačiau tai yra kito straipsnio tema.