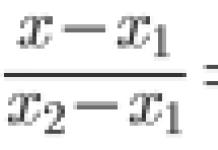|
Didumas ir jo matmenys |
Santykis |
|
X elemento atominė masė (santykinė) |
|
|
Elemento serijos numeris |
Z= N(e –) = N(R +) |
|
E elemento masės dalis X medžiagoje, vieneto dalimis, procentais |
|
|
X medžiagos kiekis, mol | |
|
Dujų medžiagos kiekis, mol |
Na. R– = 101 325 Pa, T |
|
= 273 tūkst |
|
|
X medžiagos molinė masė, g/mol, kg/mol |
m X medžiagos masė, g, kg (X) = n (X) M |
|
(X) |
V m Molinis dujų tūris, l/mol, m 3 /mol |
|
= 22,4 l/mol N.S. |
V = V m × (X) = |
|
Dujų tūris, m 3 |
|
|
Produkto išeiga |
|
|
X medžiagos tankis, g/l, g/ml, kg/m3 Tankis dujinė medžiaga |
|
|
X ant vandenilio |
Dujinės medžiagos X tankis ore M |
|
(oras) = 29 g/mol Kombinuotas |
|
|
dujų įstatymas |
Mendelejevo-Klapeirono lygtis = PV, nRT R |
|
= 8,314 J/mol × K |
|
|
Dujinės medžiagos tūrinė dalis dujų mišinyje, vieneto dalimis arba % |
|
|
Dujų mišinio molinė masė |
|
|
Medžiagos (X) molinė dalis mišinyje |
Šilumos kiekis, J, kJ = (X) = n Šilumos kiekis, J, kJ M |
|
K |
Reakcijos terminis poveikisQ =– |
|
H |
|
|
Medžiagos X susidarymo šiluma, J/mol, kJ/mol Greitis cheminė reakcija |
|
|
(mol/lsek.) Masinių veiksmų dėsnis |
(dėl paprastos reakcijos) a A+ V B= Su C + d D = u B= (dėl paprastos reakcijos) k B= (A) V |
|
(B) |
|
|
Van't Hoffo taisyklė |
|
|
Medžiagos tirpumas (X) (g/100 g tirpiklio) |
|
|
X medžiagos masės dalis A + X mišinyje, vieneto dalimis, % |
m Tirpalo svoris, g, kg m(rr) = m(X)+ m Tirpalo svoris, g, kg V(H2O) (rr) |
|
(rr) |
|
|
Ištirpusios medžiagos masės dalis tirpale, vieneto dalimis, % |
|
|
Tirpalo tankis |
|
|
Tirpalo tūris, cm 3, l, m 3 |
|
|
Molinė koncentracija, mol/l |
|
|
Elektrolitų disociacijos laipsnis (X), vieneto dalimis arba % |
Joninis vandens produktas K |
|
(H2O) = |
pH vertė |
pH = -lg
Pagrindinis: Kuznecova N.E. ir kt
. Chemija. 8 klasė-10 klasė – M.: Ventana-Graf, 2005-2007. Kuznecova N.E., Litvinova T.N., Levkin A.N.
Chemija.11 klasė 2 dalimis, 2005-2007 m. Egorovas A.S.
Chemija. Naujas pasirengimo universitetams vadovėlis. Rostovas n/d: Feniksas, 2004.– 640 p.
Chemija.11 klasė 2 dalimis, 2005-2007 m. Egorovas A.S. Chemija: modernus pasirengimo vieningam valstybiniam egzaminui kursas. Rostovas n/a: Feniksas, 2011. (2012) – 699 p.
Savarankiškas cheminių problemų sprendimo vadovas. – Rostovas prie Dono: Feniksas, 2000. – 352 p.
Chemijos / dėstytojo vadovas stojantiesiems į universitetus. Rostovas n/D, Finiksas, 2005– 536 p. Khomchenko G.P., Khomchenko I.G. . Chemijos problemos stojantiesiems į universitetus. M.: baigti mokyklą
. 2007.–302p.
Papildomas:. Mokomoji medžiaga, skirta pasirengti centralizuotam chemijos testavimui / A.I. Vrublevskis –Mn.: Unipress LLC, 2004. – 368 p.
Papildomas:. 1000 chemijos uždavinių su transformacijų grandinėmis ir kontroliniais testais moksleiviams ir pretendentams – Mn.: Unipress LLC, 2003. – 400 p.
Egorovas A.S.. Visų tipų chemijos skaičiavimo uždaviniai ruošiantis vieningam valstybiniam egzaminui – Rostovas n/D: Phoenix, 2003. – 320 p.
Egorovas A.S., Aminova G.Kh.. Tipinės užduotys ir pratimai ruošiantis chemijos egzaminui. – Rostovas n/d: Feniksas, 2005. – 448 p.
Vieningas valstybinis egzaminas 2007. Chemija. Mokomoji medžiaga studentams rengti / FIPI - M.: Intelektų centras, 2007. – 272 p.
Vieningas valstybinis egzaminas 2011 m. Chemija. Švietimo ir mokymo rinkinys ed. A.A. Kaverina – M.: Tautinis ugdymas, 2011 m.
Vienintelės realios užduočių galimybės pasiruošti vieningam valstybiniam egzaminui. Vieningas valstybinis egzaminas 2007 m. Chemija / V.Yu. Mišina, E.N. Strelnikova. M.: Federalinis testavimo centras, 2007.–151 p.
Kaverina A.A. Optimalus užduočių bankas ruošiant mokinius. Vieningas valstybinis egzaminas 2012. Chemija. Pamoka./ A.A. Kaverina, D.Yu. Dobrotinas, Yu.N. Medvedevas, M.G. Snastina – M.: Intelekto centras, 2012. – 256 p.
Litvinova T.N., Vyskubova N.K., Azhipa L.T., Solovjova M.V.. Testinės užduotys be testų 10 mėnesių neakivaizdinių parengiamųjų kursų studentams (metodiniai nurodymai). Krasnodaras, 2004. – P. 18 – 70.
Litvinova T.N.. Chemija. Vieningas valstybinis egzaminas 2011 m. Treniruočių testai. Rostovas n/d: Feniksas, 2011.– 349 p.
Litvinova T.N.. Chemija. Vieningo valstybinio egzamino testai. Rostovas n/d.: Feniksas, 2012. - 284 p.
Litvinova T.N.. Chemija. Dėsniai, elementų ir jų junginių savybės. Rostovas n/d.: Feniksas, 2012. - 156 p.
Litvinova T.N., Melnikova E.D., Solovjova M.V.., Azhipa L.T., Vyskubova N.K. Chemija užduotyse stojantiesiems į universitetus – M.: Onyx Publishing House LLC: Mir and Education Publishing House LLC, 2009. – 832 p.
Mokomasis ir metodinis chemijos kompleksas medicinos ir biologijos klasių mokiniams, red. T.N. Litvinova – Krasnodaras.: KSMU, – 2008 m.
Chemija. Vieningas valstybinis egzaminas 2008 m. Stojamieji testai, mokymo priemonė / red. V.N. Doronkina. – Rostovas n/d: Legionas, 2008.– 271 p.
Chemijos svetainių sąrašas:
1. Alhimik. http:// www. alhimik. ru
2. Chemija visiems. Elektroninis žinynas skirtas pilnas kursas chemija.
http:// www. informika. ru/ tekstą/ duomenų bazėje/ chemija/ PRADĖTI. html
3. Mokyklinė chemija – žinynas. http:// www. mokyklinė chemija. pateikė. ru
4. Chemijos dėstytojas. http://www. chemija.nm.ru
Interneto ištekliai
Alhimik. http:// www. alhimik. ru
Chemija visiems. Elektroninis žinynas visam chemijos kursui.
http:// www. informika. ru/ tekstą/ duomenų bazėje/ chemija/ PRADĖTI. html
Mokyklinė chemija – žinynas. http:// www. mokyklinė chemija. pateikė. ru
http://www.classchem.narod.ru
Chemijos dėstytojas. http://www. chemija.nm.ru
http://www.alleng.ru/edu/chem.htm- mokomieji interneto šaltiniai apie chemiją
http://schoolchemistry.by.ru/- mokyklinė chemija. Šioje svetainėje yra galimybė atlikti internetinį testavimą įvairiomis temomis, taip pat demonstracinės parinktys Vieningas valstybinis egzaminas
Chemija ir gyvenimas – XXI amžius: mokslo populiarinimo žurnalas. http:// www. hij. ru
Patikrinkite informaciją. Būtina patikrinti faktų tikslumą ir šiame straipsnyje pateiktos informacijos patikimumą. Pokalbių puslapyje yra diskusija tema: Abejonės dėl terminijos. Cheminė formulė ... Vikipedija
Cheminė formulė atspindi informaciją apie medžiagų sudėtį ir struktūrą, naudojant cheminius simbolius, skaičius ir skliausteliuose esančius skyrimo simbolius. Šiuo metu išskiriami šie cheminių formulių tipai: Paprasčiausia formulė. Galima gauti patyrusioje... ... Vikipedijoje
Cheminė formulė atspindi informaciją apie medžiagų sudėtį ir struktūrą, naudojant cheminius simbolius, skaičius ir skliausteliuose esančius skyrimo simbolius. Šiuo metu išskiriami šie cheminių formulių tipai: Paprasčiausia formulė. Galima gauti patyrusioje... ... Vikipedijoje
Cheminė formulė atspindi informaciją apie medžiagų sudėtį ir struktūrą, naudojant cheminius simbolius, skaičius ir skliausteliuose esančius skyrimo simbolius. Šiuo metu išskiriami šie cheminių formulių tipai: Paprasčiausia formulė. Galima gauti patyrusioje... ... Vikipedijoje
Cheminė formulė atspindi informaciją apie medžiagų sudėtį ir struktūrą, naudojant cheminius simbolius, skaičius ir skliausteliuose esančius skyrimo simbolius. Šiuo metu išskiriami šie cheminių formulių tipai: Paprasčiausia formulė. Galima gauti patyrusioje... ... Vikipedijoje
Pagrindinis straipsnis: Neorganiniai junginiai Neorganinių junginių sąrašas pagal elementus Informacinis neorganinių junginių sąrašas, pateiktas abėcėlės tvarka (pagal formulę) kiekvienai medžiagai, elementų vandenilio rūgštys (jei ... ... Vikipedija
Šį straipsnį ar skyrių reikia peržiūrėti. Prašau patobulinti straipsnį pagal straipsnių rašymo taisykles... Vikipedija
Cheminė lygtis (cheminės reakcijos lygtis) yra sąlyginis cheminės reakcijos įrašymas naudojant chemines formules, skaitinius koeficientus ir matematiniai simboliai. Cheminės reakcijos lygtis suteikia kokybinę ir kiekybinę... ... Vikipediją
Cheminis programinė įranga kompiuterines programas, naudojamas chemijos srityje. Turinys 1 Chemijos redaktoriai 2 Platformos 3 Literatūra ... Vikipedija
Knygos
- Pramoninės įrangos montavimo japonų-anglų-rusų žodynas. Apie 8000 terminų, Popova I.S.. Žodynas skirtas plačiam vartotojų ratui ir pirmiausia vertėjams bei techniniams specialistams, užsiimantiems pramoninės įrangos tiekimu ir diegimu iš Japonijos ar...
- Trumpas biocheminių terminų žodynas Kunizhevas S.M.. Žodynas skirtas universitetų chemijos ir biologijos specialybių studentams, studijuojantiems bendrosios biochemijos, ekologijos ir biotechnologijos pagrindų kursą, taip pat gali būti naudojamas ...
Pagrindinių formulių rinkinys mokyklos kursas chemija
Mokyklinio chemijos kurso pagrindinių formulių rinkinys
G. P. Loginova
Elena Savinkina
E. V. Savinkina G. P. Loginova
Pagrindinių chemijos formulių rinkinys
Mokinio kišeninis vadovas
bendroji chemija
Svarbiausios cheminės sąvokos ir dėsniai
Cheminis elementas- tai tam tikros rūšies atomas, turintis tą patį branduolinį krūvį.
Santykinė atominė masė(A r) rodo, kiek kartų tam tikro cheminio elemento atomo masė yra didesnė už anglies-12 atomo masę (12 C).
Cheminė medžiaga– bet kokių cheminių dalelių rinkinys.
Cheminės dalelės
Formulės vienetas – įprastinė dalelė, kurios sudėtis atitinka nurodytą cheminę formulę, pavyzdžiui:Ar – medžiaga argonas (susideda iš Ar atomų),
H 2 O – medžiaga vanduo (susideda iš H 2 O molekulių),
KNO 3 – kalio nitratas (sudarytas iš K + katijonų ir NO 3 ¯ anijonų).
Santykiai tarp fiziniai dydžiai
Elemento atominė masė (santykinė). B, A r (B):Kur *T(atomas B) – elemento B atomo masė;
*t ir– atominės masės vienetas;
*t ir = 1/12 T(12 C atomas) = 1,6610 24 g.
Medžiagos kiekis B, n(B), mol:
Kur N(B)– dalelių skaičius B;
N A– Avogadro konstanta (NA = 6,0210 23 mol -1).
Medžiagos molinė masė V, M(V), g/mol:
Kur t(V)– masė B.
Molinis dujų tūris IN, V M l/mol:
Kur V M = 22,4 l/mol (Avogadro dėsnio pasekmė), normaliomis sąlygomis (nr. – atmosferos slėgis p = 101 325 Pa (1 atm); termodinaminė temperatūra T = 273,15 K arba Celsijaus temperatūra t = 0 °C).
B vandeniliui, D(dujos B iš H 2):
*Dujinės medžiagos tankis IN oru, D(dujos B virš oro): Elemento masės dalis E materijoje V, w(E):Kur x yra E atomų skaičius medžiagos B formulėje
Atomo sandara ir periodinis dėsnis D.I. Mendelejevas
Masės skaičius (A) – iš viso protonai ir neutronai atomo branduolyje:
A = N(p 0) + N(p +).
Atominis branduolinis krūvis (Z)lygus skaičiui protonai branduolyje ir elektronų skaičius atome:Z = N(p+) = N(e¯).
Izotopai– to paties elemento atomai, besiskiriantys neutronų skaičiumi branduolyje, pvz.: kalis-39: 39 K (19 p + , 20n 0, 19e¯); kalio-40: 40 K (19 p+, 21n 0, 19e¯).*Energijos lygiai ir polygiai
*Atominė orbita(AO) apibūdina erdvės sritį, kurioje yra didžiausia tikimybė, kad tam tikrą energiją turintis elektronas atsidurs.*S- ir p-orbitalių formos
Periodinis įstatymas ir periodinė lentelė D.I. Mendelejevas
Elementų ir jų junginių savybės periodiškai kartojasi didėjant atominiam skaičiui, kuris yra lygus elemento atomo branduolio krūviui.Laikotarpio numeris atitinka energijos lygių, užpildytų elektronais, skaičius, ir reiškia paskutinis energijos lygis, kurį reikia užpildyti(ES).
Grupės numeris A rodo Ir ir tt
Grupės numeris B rodo valentinių elektronų skaičius ns Ir (n – 1)d.
S-elementų skyrius– energijos polygis (ESL) užpildytas elektronais ns-EPU– IA ir IIA grupės, H ir He.
P-elementų skyrius– užpildytas elektronais np-EPU– IIIA-VIIIA-grupės.
D elementų skyrius– užpildytas elektronais (P- 1) d-EPU – IB-VIIIB2 grupės.
f elementų skyrius– užpildytas elektronais (P-2) f-EPU – lantanidai ir aktinidai.
III periodo elementų vandenilio junginių sudėties ir savybių pokyčiai Periodinė elementų lentelė
Nelakus, suyra su vandeniu: NaH, MgH 2, AlH 3.Lakiosios medžiagos: SiH 4, PH 3, H 2 S, HCl.
Sudėties ir savybių pasikeitimas didesni oksidai ir periodinės lentelės 3 periodo elementų hidroksidai
Pagrindiniai: Na 2 O – NaOH, MgO – Mg(OH) 2.Amfoterinis: Al 2 O 3 – Al(OH) 3.
Rūgšti: SiO 2 – H 4 SiO 4, P 2 O 5 – H 3 PO 4, SO 3 – H 2 SO 4, Cl 2 O 7 – HClO 4.
Cheminis ryšys
Elektronegatyvumas(χ) – dydis, apibūdinantis molekulėje esančio atomo gebėjimą įgyti neigiamą krūvį.Ugdymo mechanizmai kovalentinis ryšys
Keitimo mechanizmas- dviejų gretimų atomų orbitalių, kurių kiekvienas turėjo po vieną elektroną, sutapimas.Donoro-akceptoriaus mechanizmas– vieno atomo laisvosios orbitalės sutapimas su kito atomo, kuriame yra elektronų pora, orbitale.
Orbitalių persidengimas jungties formavimosi metu
*Hibridizacijos tipas – geometrinė dalelės forma – kampas tarp ryšių
Centrinių atomų orbitų hibridizacija– jų energijos ir formos derinimas.sp– linijinis – 180°
sp 2– trikampis – 120°
sp 3– tetraedrinis – 109,5°
sp 3 d– trigonalinis-bipiramidinis – 90°; 120°
sp 3 d 2– oktaedrinė – 90°
Mišiniai ir tirpalai
Sprendimas- vienalytė sistema, susidedanti iš dviejų ar daugiau medžiagų, kurių kiekis gali būti keičiamas tam tikrose ribose.
Sprendimas: tirpiklis (pvz., vanduo) + tirpiklis.
Tikri sprendimai yra dalelių, mažesnių nei 1 nanometras.
Koloidiniai tirpalai yra dalelių, kurių dydis svyruoja nuo 1 iki 100 nanometrų.
Mechaniniai mišiniai(suspensijos) turi didesnių nei 100 nanometrų dalelių.
Sustabdymas=> kieta + skysta
Emulsija=> skystis + skystis
Putos, rūkas=> dujos + skystis
Atskiriami heterogeniniai mišiniai nusodinimas ir filtravimas.
Atskiriami vienarūšiai mišiniai garinimas, distiliavimas, chromatografija.
Sotus tirpalas yra arba gali būti pusiausvyroje su ištirpusia medžiaga (jei ištirpusi medžiaga yra kieta, tai jos perteklius yra nuosėdose).
Tirpumas– ištirpusios medžiagos kiekis sočiame tirpale tam tikroje temperatūroje.
Nesotus tirpalas mažiau,
Persotintas tirpalas yra tirpios medžiagos daugiau, nei jo tirpumas tam tikroje temperatūroje.
Fizikinių ir cheminių dydžių ryšiai tirpale
Tirpintos medžiagos masės dalis IN, w(B); vieneto dalis arba %:Kur t(V)– B masė,
t(r)– tirpalo masė.
tirpalo svoris, m(p), g:
m(p) = m(B) + m(H2O) = V(p) ρ(p),
čia F(p) yra tirpalo tūris;ρ(p) – tirpalo tankis.
Tirpalo tūris, V(p), l:
Molinė koncentracija, s(V), mol/l:kur n(B) yra medžiagos B kiekis;
M(B) – medžiagos B molinė masė.
Tirpalo sudėties keitimas
Tirpalo praskiedimas vandeniu:> t"(V)= t(B);
> tirpalo masė didėja pridėto vandens mase: m"(p) = m(p) + m(H2O).
Vandens išgarinimas iš tirpalo:
> tirpios medžiagos masė nekinta: t"(B) = t(B).
> tirpalo masė mažėja išgaravusio vandens mase: m"(p) = m(p) – m(H 2 O).
Sujungti du sprendimus: Tirpalų masės, taip pat ištirpusios medžiagos masės, susumuojamos:
t"(B) = t(B) + t"(B);
t"(p) = t(p) + t"(p).
Krištolo lašas: ištirpusios medžiagos masė ir tirpalo masė sumažinamos nusodintų kristalų mase:
m"(B) = m(B) – m(nuosėdos); m"(p) = m(p) – m(nuosėdos).
Vandens masė nesikeičia.
Cheminės reakcijos terminis poveikis
*Medžiagos susidarymo entalpija ΔH°(B), kJ/mol, yra reakcijos entalpija, kai susidaro 1 molis medžiagos iš paprastų medžiagų jų standartinėse būsenose, ty esant pastoviam slėgiui (1 atm kiekvienai sistemos dujoms arba bendrai slėgis 1 atm, kai nėra dujinės reakcijos dalyvių) ir pastovi temperatūra (paprastai 298 K , arba 25 °C).*Šiluminis cheminės reakcijos poveikis (Heso dėsnis)
Q = ΣQ(Produktai) - ΣQ(reagentai).
ΔН° = ΣΔН°(produktai) – Σ ΔН°(reagentai).
Dėl reakcijos aA + bB +… = dD + eE +…ΔH° = (dΔH°(D) + eΔH°(E) +…) – (aΔH°(A) + bΔH°(B) +…),
Kur a, b, d, e– stechiometriniai medžiagų kiekiai, atitinkantys reakcijos lygties koeficientus.Cheminės reakcijos greitis
Jei per laiką τ tūryje V reagento arba produkto kiekis, pakeistas Δ n, greita reakcija:
Monomolekulinei reakcijai A →…:
v = k c(A).
Dėl bimolekulinės reakcijos A + B → ...:v = k c(A) c(B).
Trimolekulinei reakcijai A + B + C → ...:v = k c(A) c(B) c(C).
Cheminės reakcijos greičio keitimas
Greitoji reakcija padidinti:1) chemiškai aktyvus reagentai;
2) skatinimas reagentų koncentracijos;
3) padidinti
4) skatinimas temperatūra;
5) katalizatoriai. Greitoji reakcija sumažinti:
1) chemiškai neaktyvus reagentai;
2) pažeminimas reagentų koncentracijos;
3) mažinti kietų ir skystų reagentų paviršiai;
4) pažeminimas temperatūra;
5) inhibitoriai.
*Temperatūros greičio koeficientas(γ) yra lygus skaičiui, rodančiam, kiek kartų padidėja reakcijos greitis, kai temperatūra pakyla dešimčia laipsnių:
Cheminė pusiausvyra
* Masės veikimo dėsnis cheminei pusiausvyrai: pusiausvyros būsenoje sandaugų molinių koncentracijų laipsniais sandauga lygus
Jų stechiometriniai koeficientai, gaunami iš reagentų molinių koncentracijų sandaugoje, lygiomis jų stechiometriniams koeficientams, esant pastoviai temperatūrai, yra pastovi vertė (koncentracijos pusiausvyros konstanta).
Esant cheminės pusiausvyros būsenai grįžtamai reakcijai:
aA + bB + … ↔ dD + fF + …
K c = [D] d [F] f .../ [A] a [B] b ...
*Cheminės pusiausvyros poslinkis link produktų susidarymo
1) Reagentų koncentracijos didinimas;2) produktų koncentracijos mažinimas;
3) temperatūros padidėjimas (endoterminei reakcijai);
4) temperatūros sumažėjimas (egzoterminei reakcijai);
5) slėgio padidėjimas (reakcijai, kuri vyksta sumažėjus tūriui);
6) slėgio sumažėjimas (reakcijai, kuri vyksta padidėjus tūriui).
Keitimosi reakcijos tirpale
Elektrolitinė disociacija– jonų (katijonų ir anijonų) susidarymo procesas, kai tam tikros medžiagos ištirpsta vandenyje.
rūgštys susidaro vandenilio katijonai Ir rūgščių anijonai, Pavyzdžiui:
HNO 3 = H + + NO 3 ¯
At elektrolitinė disociacija priežastys susidaro metalo katijonai ir hidroksido jonai, pavyzdžiui:NaOH = Na + + OH¯
Elektrolitinės disociacijos metu druskos(vidutinis, dvigubas, mišrus) susidaro metalo katijonai ir rūgščių anijonai, pavyzdžiui:NaNO 3 = Na + + NO 3 ¯
KAl(SO 4) 2 = K + + Al 3+ + 2SO 4 2-
Elektrolitinės disociacijos metu rūgščių druskos susidaro metalo katijonai ir rūgščių hidroanijonai, pavyzdžiui:NaHCO 3 = Na + + HCO 3 ‾
Kai kurios stiprios rūgštys
HBr, HCl, HClO 4, H 2 Cr 2 O 7, HI, HMnO 4, H 2 SO 4, H 2 SeO 4, HNO 3, H 2 CrO 4Keletas rimtų priežasčių
RbOH, CsOH, KOH, NaOH, LiOH, Ba(OH) 2, Sr(OH) 2, Ca(OH) 2Disociacijos laipsnis α– disocijuotų dalelių skaičiaus ir pradinių dalelių skaičiaus santykis.
Esant pastoviam garsui:
Medžiagų klasifikavimas pagal disociacijos laipsnį
Berthollet taisyklė
Keitimosi reakcijos tirpale vyksta negrįžtamai, jei susidaro nuosėdos, dujos arba silpnas elektrolitas.Molekulinių ir joninių reakcijų lygčių pavyzdžiai
1. Molekulinė lygtis: CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaCl"Užbaigta" joninė lygtis: Сu 2+ + 2Сl¯ + 2Na + + 2OH¯ = Cu(OH) 2 ↓ + 2Na + + 2Сl¯
„Trumpoji“ joninė lygtis: Cu 2+ + 2OH¯ = Cu(OH) 2 ↓
2. Molekulinė lygtis: FeS (T) + 2HCl = FeCl 2 + H 2 S
„Visa“ joninė lygtis: FeS + 2H + + 2Сl¯ = Fe 2+ + 2Сl¯ + H 2 S
„Trumpoji“ joninė lygtis: FeS (T) + 2H + = Fe 2+ + H 2 S
3. Molekulinė lygtis: 3HNO 3 + K 3 PO 4 = H 3 PO 4 + 3KNO 3
„Visa“ joninė lygtis: 3H + + 3NO 3 ¯ + 3K + + PO 4 3- = H 3 PO 4 + 3K + + 3NO 3 ¯
„Trumpoji“ joninė lygtis: 3H + + PO 4 3- = H 3 PO 4
*Vandenilio vertė
(pH) pH = – log = 14 + log*pH intervalas skiestiems vandeniniams tirpalams
pH 7 (neutrali aplinka)Mainų reakcijų pavyzdžiai
Neutralizacijos reakcija – mainų reakcija vykstančios rūgšties ir bazės sąveikos metu.1. Šarmas + stipri rūgštis: Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Ba 2+ + 2ON¯ + 2H + + 2Сl¯ = Ba 2+ + 2Сl¯ + 2Н 2 O
H + + OH¯ = H2O
2. Mažai tirpi bazė + stipri rūgštis: Cu(OH) 2(t) + 2HCl = CuCl 2 + 2H 2 O
Cu(OH)2 + 2H + + 2Cl¯ = Cu 2+ + 2Cl¯ + 2H2O
Cu(OH)2 + 2H+ = Cu 2+ + 2H2O
*Hidrolizė– mainų reakcija tarp medžiagos ir vandens, nekeičiant atomų oksidacijos būsenų.
1. Negrįžtama dvejetainių junginių hidrolizė:
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
2. Grįžtamoji druskų hidrolizė:
A) susidaro druska stiprus bazinis katijonas ir stiprus rūgšties anijonas:
NaCl = Na + + Сl¯
Na + + H 2 O ≠ ;
Cl¯ + H 2 O ≠
Nėra hidrolizės; neutrali aplinka, pH = 7.
B) Susidaro druska stiprus bazinis katijonas ir silpnas rūgšties anijonas:
Na 2S = 2Na + + S 2-
Na + + H 2 O ≠
S 2- + H 2 O ↔ HS¯ + OH¯
Hidrolizė anijonu; šarminė aplinka, pH >7.
B) Susidaro druska silpnos arba mažai tirpios bazės katijonas ir stiprios rūgšties anijonas:
Įvadinio fragmento pabaiga.
Tekstą pateikė liters LLC.
Galite saugiai sumokėti už knygą banko kortele Visa, MasterCard, Maestro, iš mobiliojo telefono sąskaitos, iš mokėjimo terminalo, MTS ar Svyaznoy salone, per PayPal, WebMoney, Yandex.Money, QIWI Piniginę, premijų korteles ar bet kuriuo kitu jums patogiu būdu.
Šiuolaikinius cheminių elementų simbolius į mokslą 1813 metais pristatė J. Berzelius. Pagal jo pasiūlymą elementai žymimi lotyniškų pavadinimų pradinėmis raidėmis. Pavyzdžiui, deguonis (Oxygenium) žymimas raide O, siera (Sulfur) – S, vandenilis (Hydrogenium) – raide H. Tais atvejais, kai elementų pavadinimai prasideda ta pačia raide, įvedama dar viena raidė. pridėta prie pirmosios raidės. Taigi anglis (Carboneum) turi simbolį C, kalcis (kalcis) – Ca, varis (Cuprum) – Cu.
Cheminiai simboliai – tai ne tik sutrumpinti elementų pavadinimai: jie išreiškia ir tam tikrus kiekius (arba mases), t.y. Kiekvienas simbolis žymi arba vieną elemento atomą, arba vieną jo atomų molį, arba elemento masę, lygią (arba proporcingą) to elemento molinei masei. Pavyzdžiui, C reiškia arba vieną anglies atomą, arba vieną molį anglies atomų, arba 12 masės vienetų (dažniausiai 12 g) anglies.
Cheminės formulės
Medžiagų formulės taip pat nurodo ne tik medžiagos sudėtį, bet ir kiekį bei masę. Kiekviena formulė reiškia arba vieną medžiagos molekulę, arba vieną medžiagos molį, arba medžiagos masę, lygią (arba proporcingą) jos molinei masei. Pavyzdžiui, H2O reiškia arba vieną vandens molekulę, arba vieną molį vandens, arba 18 masės vienetų (paprastai (18 g) vandens).
Paprastos medžiagos taip pat žymimos formulėmis, rodančiomis, kiek atomų sudaro paprastos medžiagos molekulė: pavyzdžiui, vandenilio H 2 formulė. Jei paprastos medžiagos molekulės atominė sudėtis nėra tiksliai žinoma arba medžiaga susideda iš molekulių, turinčių skirtingą atomų skaičių, taip pat jei ji turi atominę ar metalinę struktūrą, o ne molekulinę, paprasta medžiaga žymima elemento simbolis. Pavyzdžiui, paprasta medžiaga fosforas žymima formule P, nes, priklausomai nuo sąlygų, fosforas gali būti sudarytas iš molekulių su skirtingu atomų skaičiumi arba turėti polimero struktūrą.
Chemijos formulės uždaviniams spręsti
Medžiagos formulė nustatoma remiantis analizės rezultatais. Pavyzdžiui, pagal analizę gliukozė turi 40 % (masės) anglies, 6,72 % (masės) vandenilio ir 53,28 % (masės) deguonies. Todėl anglies, vandenilio ir deguonies masės yra santykiu 40:6,72:53,28. Pažymime norimą gliukozės formulę C x H y O z, kur x, y ir z yra anglies, vandenilio ir deguonies atomų skaičiai molekulėje. Šių elementų atomų masės atitinkamai lygios 12,01; 1.01 ir 16.00 val Todėl gliukozės molekulėje yra 12,01x amu. anglies, 1,01 u amu vandenilis ir 16.00zа.u.m. deguonies. Šių masių santykis yra 12,01x: 1,01y: 16,00z. Tačiau mes jau nustatėme šį ryšį remdamiesi gliukozės analizės duomenimis. Taigi:
12,01x: 1,01y: 16,00z = 40:6,72:53,28.
Pagal proporcijų savybes:
x: y: z = 40/12.01:6.72/1.01:53.28/16.00
arba x:y:z = 3,33:6,65:3,33 = 1:2:1.
Todėl gliukozės molekulėje yra du vandenilio atomai ir vienas deguonies atomas viename anglies atome. Šią sąlygą tenkina formulės CH 2 O, C 2 H 4 O 2, C 3 H 6 O 3 ir kt. Pirmoji iš šių formulių – CH 2 O – vadinama paprasčiausia arba empirine formule; jo molekulinė masė yra 30,02. Norint išsiaiškinti tikrąjį ar molekulinė formulė, turite žinoti tam tikros medžiagos molekulinę masę. Kaitinant, gliukozė sunaikinama nevirsdama dujomis. Bet jo molekulinę masę galima nustatyti kitais metodais: ji lygi 180. Palyginus šią molekulinę masę su molekuline mase, atitinkančia paprasčiausią formulę, aišku, kad formulė C 6 H 12 O 6 atitinka gliukozę.
Taigi cheminė formulė yra medžiagos sudėties vaizdas, naudojant cheminių elementų simbolius, skaitinius indeksus ir kai kuriuos kitus ženklus. Išskiriami šie formulių tipai:
— paprasčiausias , kuris gaunamas eksperimentiniu būdu nustatant cheminių elementų santykį molekulėje ir naudojant jų santykinių atominių masių reikšmes (žr. aukščiau pateiktą pavyzdį);
— molekulinės , kurią galima gauti žinant paprasčiausią medžiagos formulę ir jos molekulinę masę (žr. aukščiau esantį pavyzdį);
— racionalus , rodančios atomų grupes, būdingas cheminių elementų klasėms (R-OH - alkoholiai, R - COOH - karboksirūgštys, R - NH2 - pirminiai aminai ir kt.);
— struktūrinis (grafinis) , rodomas tarpusavio susitarimas atomai molekulėje (gali būti dvimačiai (plokštumoje) arba trimačiai (erdvėje));
— elektroninis, rodantis elektronų pasiskirstymą per orbitas (parašyta tik cheminiams elementams, o ne molekulėms).
Pažvelkime atidžiau į etilo alkoholio molekulės pavyzdį:
- paprasčiausia etanolio formulė yra C 2 H 6 O;
- etanolio molekulinė formulė yra C 2 H 6 O;
- racionali etanolio formulė yra C 2 H 5 OH;
Problemų sprendimo pavyzdžiai
1 PAVYZDYS
| Pratimas | Visiškai sudegus deguonies turinčiam organinės medžiagos sveriantis 13,8 g gavo 26,4 g anglies dioksidas ir 16,2 g vandens. Raskite medžiagos molekulinę formulę, jei jos garų santykinis tankis vandenilio atžvilgiu yra 23. |
| Sprendimas | Sudarykite organinio junginio degimo reakcijos schemą, nurodydami anglies, vandenilio ir deguonies atomų skaičių atitinkamai „x“, „y“ ir „z“: C x H y Oz + O z → CO 2 + H 2 O. Nustatykime elementų, sudarančių šią medžiagą, masę. Santykinių atominių masių vertės paimtos iš periodinės D.I. Mendelejevas, apvalina iki sveikųjų skaičių: Ar(C) = 12 amu, Ar(H) = 1 amu, Ar(O) = 16 amu. m(C) = n(C) × M(C) = n(CO2) × M(C) = × M(C); m (H) = n (H) × M (H) = 2 × n (H2O) × M (H) = × M (H); Apskaičiuokime anglies dvideginio ir vandens molines mases. Kaip žinoma, molekulės molinė masė yra lygi molekulę sudarančių atomų santykinių atominių masių sumai (M = Mr): M(CO2) = Ar(C) + 2 × Ar(O) = 12+ 2 × 16 = 12 + 32 = 44 g/mol; M(H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g/mol. m(C) = x 12 = 7,2 g; m(H) = 2 × 16,2 / 18 × 1 = 1,8 g. m(O) = m(C x H y Oz) - m(C) - m(H) = 13,8 - 7,2 - 1,8 = 4,8 g. Apibrėžkime cheminė formulė jungtys: x:y:z = m(C)/Ar(C): m(H)/Ar(H): m(O)/Ar(O); x:y:z = 7,2/12:1,8/1:4,8/16; x:y:z = 0,6: 1,8: 0,3 = 2: 6: 1. Tai reiškia, kad paprasčiausia junginio formulė yra C 2 H 6 O, o molinė masė yra 46 g/mol. Organinės medžiagos molinę masę galima nustatyti naudojant jos vandenilio tankį: M medžiaga = M(H2) × D(H2) ; M medžiaga = 2 × 23 = 46 g/mol. M medžiaga / M (C 2 H 6 O) = 46 / 46 = 1. Tai reiškia, kad organinio junginio formulė bus C 2 H 6 O. |
| Atsakymas | C2H6O |
2 PAVYZDYS
| Pratimas | Fosforo masės dalis viename iš jo oksidų yra 56,4%. Oksido garų tankis ore yra 7,59. Nustatykite oksido molekulinę formulę. |
| Sprendimas | Elemento X masės dalis NX kompozicijos molekulėje apskaičiuojama pagal šią formulę: ω (X) = n × Ar (X) / M (HX) × 100%. Paskaičiuokime masės dalis deguonis junginyje: ω(O) = 100 % – ω(P) = 100 % – 56,4 % = 43,6 %. Į junginį įtrauktų elementų molių skaičių pažymėkime „x“ (fosforas), „y“ (deguonis). Tada molinis santykis atrodys taip (santykinių atominių masių reikšmės, paimtos iš D.I. Mendelejevo periodinės lentelės, suapvalinamos iki sveikųjų skaičių): x:y = ω(P)/Ar(P): ω(O)/Ar(O); x:y = 56,4/31: 43,6/16; x:y = 1,82:2,725 = 1:1,5 = 2:3. Tai reiškia, kad paprasčiausia fosforo ir deguonies sujungimo formulė bus P 2 O 3, o molinė masė 94 g/mol. Organinės medžiagos molinę masę galima nustatyti pagal jos oro tankį: M medžiaga = M oro × D oro; M medžiaga = 29 × 7,59 = 220 g/mol. Norėdami rasti tikrąją organinio junginio formulę, randame gautų molinių masių santykį: M medžiaga / M (P 2 O 3) = 220 / 94 = 2. Tai reiškia, kad fosforo ir deguonies atomų indeksai turėtų būti 2 kartus didesni, t.y. medžiagos formulė bus P 4 O 6. |
| Atsakymas | P4O6 |




 V m= 22,4 l/mol (n.s.)
V m= 22,4 l/mol (n.s.)