Ruošiamės vieningam valstybiniam egzaminui.
ALKANAS (sotieji angliavandeniliai, parafinai)
Alkanai yra alifatiniai (acikliniai) sotieji angliavandeniliai, kuriuose anglies atomai yra sujungti paprastais (viengubais) ryšiais tiesiomis arba šakotomis grandinėmis, pagal bendrą formulę C n H 2n+2, kur n ≥1.
Alkanai – sočiųjų angliavandenilių pavadinimas pagal tarptautinę nomenklatūrą.
Parafinai – istoriškai nusistovėjęs pavadinimas, atspindintis šių junginių savybes (iš lot. parrum affinis – mažas giminingumas, mažas aktyvumas).
Ekstremalus arba prisotintas , šie angliavandeniliai pavadinti dėl visiško anglies grandinės prisotinimo vandenilio atomais.
Homologinė alkanų serija
Alkanai, turintys bendrą formulę C n H 2n+2 , yra tos pačios struktūros susijusių junginių serija, kurioje kiekvienas paskesnis narys nuo ankstesnio skiriasi pastovia atomų grupe (-CH 2 -). Ši jungčių seka vadinamahomologinės serijos(iš graikų homolog - panašus), atskiri šios serijos nariai - homologai , o atomų grupė, į kurią skiriasi kaimyniniai homologaihomologinis skirtumas.
- CH 4 – pirmasis homologinės serijos narys – metano (yra 1 C atomas);
- CH3 -CH3 arba CH3 -CH3 – etanas (2 C atomai);
- CH3-CH2-CH3 arba CH3-CH2-CH3 – propanas (3 C atomai);
- CH3-CH2-CH2-CH3 arba CH3-CH2-CH2-CH3 – butanas (4 C atomai).
Priesaga -an būdinga visų alkanų pavadinimams. Pradedant nuo penktojo homologo, alkano pavadinimas susidaro iš graikiško skaitmens, nurodančio anglies atomų skaičių molekulėje, ir priesagos-anas: pentanas C5H12, heksanas C6H14, heptanas C7H16, oktanas C8H18, nonanas C9H20, dekanas C10H22 ir kt.
Homologai skiriasi molekuline mase, taigi ir fizinėmis savybėmis. Didėjant anglies atomų skaičiui alkano molekulėje homologinėje serijoje, stebimas natūralus homologų fizikinių savybių pokytis: didėja virimo ir lydymosi temperatūra, didėja tankis. Visi alkanai yra lengvesni už vandenį ir jame netirpūs, tačiau tirpsta nepoliniuose tirpikliuose (pavyzdžiui, benzene) ir patys yra geri tirpikliai. Alkanai iš CH 4 iki C 4 H 10 – dujos, nuo C 5 H 12 iki C 17 H 36 – skysčiai, paskui – kietos medžiagos. Turėdami tą pačią kokybinę sudėtį ir to paties tipo cheminius ryšius, homologai turi panašias chemines savybes. Todėl žinant vieno iš homologinės serijos narių chemines savybes, galima numatyti kitų šios serijos narių cheminę elgseną.
Alkanų sandara
Alkanai turi dviejų tipų cheminius ryšius:
C–C ir C–H.
C-C ryšys yra kovalentinis nepolinis. C–H ryšys yra kovalentinis, silpnai polinis, nes anglis ir vandenilis yra artimi elektronegatyvumu).
Visi alkanuose esantys anglies atomai yra sp būsenos 3-hibridizacija.
Keturios anglies σ jungtys yra nukreiptos į erdvę 109 kampu O 28", kas atitinka mažiausią elektronų atstūmimą. Todėl paprasčiausio alkanų atstovo – metano CH molekulė. 4 – turi tetraedro formą, kurio centre yra anglies atomas, o viršūnėse – vandenilio atomai.
Alkanų izomerizmas
Izomerizmas yra reiškinys, kai egzistuoja junginiai, kurių sudėtis yra tokia pati (ta pati molekulinė formulė), bet skirtingos struktūros. Tokios jungtys vadinamos izomerai.
Dėl atomų susijungimo molekulėse tvarkos (t. y. cheminės struktūros) skirtumaistruktūrinė izomerija (anglies skeleto izomerija). Alkanų eilėje struktūrinė izomerija pasireiškia tada, kai grandinėje yra 4 ar daugiau anglies atomų, t.y. pradedant butanu C 4 N 10 . Pavyzdžiui, C sudėties alkanas 4 H 10 gali egzistuoti formoje du struktūriniai izomerai:
CH 3 –CH 2 –CH 2 –CH 3 (butanas) ir CH 3 –CH(CH 3 ) –CH3 (2-metilpropanas).
Struktūriniai izomerai skiriasi fizinėmis savybėmis. Šakotos struktūros alkanai dėl mažesnio tankio molekulių pakavimo ir atitinkamai mažesnės tarpmolekulinės sąveikos verda žemesnėje temperatūroje nei jų neišsišakoję izomerai.
Alkanų cheminės savybės
Trivialus (istorinis) alkanų pavadinimas – „parafinai“ – reiškia „neturintis giminystės“. Alkanai normaliomis sąlygomis yra chemiškai neaktyvūs. Mažą alkanų reaktyvumą lemia labai mažas C-C ir CH jungčių poliškumas jų molekulėse dėl beveik identiško anglies ir vandenilio atomų elektronegatyvumo. Sotieji angliavandeniliai normaliomis sąlygomis nesąveikauja su koncentruotomis rūgštimis, šarmais ar net tokiu aktyviu reagentu kaip kalio permanganatas. Alkanai paprastai nesugeba adityvinių reakcijų dėl didelio visų anglies atomų ryšių prisotinimo.
I. Pakeitimo reakcijos
Tam tikromis sąlygomis (kaitinant, šviesoje arba naudojant katalizatorius) CH jungtys nutrūksta ir vandenilio atomai pakeičiami kitais atomais arba atomų grupėmis. Šiose reakcijose vyksta homolitinis kovalentinių ryšių skilimas, t.y. jas vykdo laisvųjų radikalų (grandinės) mechanizmas.
1) Halogeninimas
Alkanų halogeninimas yra reakcija, kai vienas ar daugiau vandenilio atomų alkano molekulėje pakeičiami halogenu. Reakcijos produktai vadinami halogenalkanais arba alkanų halogeno dariniais R-Cl arba C n H 2n+1 – Cl.
Alkanų reakcija su chloru ir bromu vyksta šviesoje arba kaitinant.
Metano chloravimas:
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 etapas)
(hν – šviesos kvantas; CH 3 Cl – chlormetanas)
Jei yra pakankamai chloro, reakcija tęsiasi toliau:
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 etapas)
(CH 2 Cl 2 – dichlormetanas)
СH 2 Cl 2 + Cl 2 hν → CHCl 3 + HCl (3 etapas)
(CHCl3 – trichlormetanas arba chloroformas)
CHCl 3 + Cl 2 hν → CCl 4 + HCl (4 etapas)
(CCl 4 - anglies tetrachloridas)
Alkanų halogeninimo reakcija vyksta per radikalų grandinės mechanizmą. Akademiko ir Nobelio premijos laureato N. N. Semenovo darbai vaidino svarbų vaidmenį plėtojant grandininių reakcijų teoriją.
Vandenilio pakeitimo halogeno atomu greitis halogenalkanuose yra didesnis nei atitinkamo alkano, tai yra dėl abipusės molekulėje esančių atomų įtakos. Didėjant angliavandenilio radikalui, judriausi vandenilio atomai lieka anglies atome, esančiame arčiausiai pakaito:
CH 3 –CH 2 –Cl + Cl 2 hν → CH 3 – CHCl 2 + HCl
(CH3 – CHCl2 – 1,1-dichloretanas)
Chloruojant ar brominant alkaną antriniais arba tretiniais anglies atomais, vandenilį lengviausia pakeisti tretiniame atome, sunkiau antriniame, o dar sunkiau – pirminiame. Tai paaiškinama didesniu tretinių ir antrinių angliavandenilių radikalų stabilumu, palyginti su pirminiais, dėl nesuporuoto elektrono delokalizacijos. Todėl, pavyzdžiui, bromuojant propaną, pagrindinis reakcijos produktas yra 2-brompropanas:
Su fluoru reakcija vyksta sprogstamai.
2) Nitravimas (Konovalov reakcija)
Nepaisant to, kad normaliomis sąlygomis alkanai nereaguoja su koncentruota azoto rūgštimi, kaitinant iki 140°C su atskiesta (10%) azoto rūgštimi, esant slėgiui, vyksta nitrinimo reakcija – vandenilio atomo pakeitimas nitro grupe. NO2. Reakcijos produktai – nitroalkanai R-NO 2 arba C n H 2n+1 – NO 2.
Reakcijos schema:
CH 4 + HNO 3 t˚С,Р → CH 3 NO 2 + H 2 O (nitrinant metaną susidaro nitrometanas).
Reakcijų metu vandenilio atomai lengviausiai pakeičiami tretiniais anglies atomais, po to antriniais ir, galiausiai, pirminiais.
3) Sulfonavimas
Sieros rūgštis įprastoje temperatūroje neturi įtakos alkanams, tačiau žemoje temperatūroje ji yra koncentruotasieros rūgštisgali veikti iki ribosangliavandeniliaivedantis prie vandenilio atomo pakeitimo sulfogrupe SO 3 H
II. Alkanų oksidacijos reakcijos
Įprastoje temperatūroje alkanai nereaguoja net su stipriais oksidatoriais (H 2 Cr 2 O 7, KMnO 4 ir kt.).
1) Įvedus į atvirą ugnį, alkanai dega. Tokiu atveju, esant deguonies pertekliui, jie visiškai oksiduojasi iki CO 2 ir vandens. Angliavandenilių degimą lydi didelis šilumos kiekis (egzoterminė reakcija).
CH 4 + 2O 2 → CO 2 + 2H 2 O+ Q
C 5 H 12 + 8O 2 → 5CO 2 + 6H 2 O + Q
Bendrosios formos alkanų degimo reakcijos lygtis:
Iš šios lygties išplaukia, kad padidėjus anglies atomų skaičiui ( n ) alkane padidėja deguonies kiekis, reikalingas jo pilnai oksidacijai. Deginant aukštesnius alkanus ( n >>1) ore esančio deguonies gali nepakakti, kad jie visiškai oksiduotųsi iki CO 2
. Tada susidaro dalinės oksidacijos produktai: anglies monoksidas CO,
suodžiai (smulki anglis, nulinė oksidacijos būsena). Todėl aukštesni alkanai dega ore dūmine liepsna, o pakeliui išsiskiriantis nuodingas anglies monoksidas (bekvapis ir bespalvis) kelia pavojų žmogui.
Metano degimas, kai trūksta deguonies, vyksta pagal lygtis:
2CH4 + 3O2 →2CO +4H2O
CH4 + O2 →C +2H2O
2) Katalizinis oksidavimas atmosferos deguonimi.
Dalinai oksiduojant alkanus santykinai žemoje temperatūroje ir naudojant katalizatorius, nutrūksta tik dalis C-C ir C-H jungčių ir gaunami vertingi produktai: karboksirūgštys, ketonai, aldehidai ir alkoholiai.
2CH 4 + O 2 → 2CH 3 OH (CH 3 OH – metanolis)
CH 4 + O 2 → HCOH + H 2 O (HCOH – metanalis)
2CH4 + 3O2 →2HCOOH +2H2 O (HCOOH – metano rūgštis)
Kai butanas nevisiškai oksiduojamas, gaunama acto rūgštis:
2C 4 H 10 + 5O 2 → 4СH 3 COOH + 2H 2 O
III Alkanų šiluminės transformacijos
1) Alkanų krekingas– angliavandenilių terminio skilimo procesas, pagrįstas didelių molekulių anglies grandinės suskaidymo reakcijomis susidarant alkanų ir alkenų molekulėms su trumpesne grandine.
Alkanų krekingas yra naftos perdirbimo pagrindas, siekiant gauti mažesnės molekulinės masės produktus, kurie naudojami kaip variklių kuras, tepalinės alyvos ir kt., taip pat žaliavos chemijos ir naftos chemijos pramonei.
Yra du būdai, kaip atlikti šį procesą:terminis įtrūkimas(kai šildomas be oro prieigos) irkatalizinis krekingas(saikesnis kaitinimas esant katalizatoriui).
C 10 H 22 t°С → C 5 H 12 + C 5 H 10
2) Alkanų dehidrinimas
Kaitinant alkanus esant katalizatoriams (Pt, Pd, Ni, Cr 2 O 3, Al 2 O 3 ) jų katalizatorius dehidrogenacija – vandenilio atomų abstrakcija nutrūkus CH-H ryšiams.
3) Alkanų izomerizacija.
Normalios struktūros alkanai veikiami katalizatorių ir kaitinant gali virsti šakotaisiais alkanais, nekeičiant molekulių sudėties, t.y. įsitraukia į izomerizacijos reakcijas. Šiose reakcijose dalyvauja alkanai, kurių molekulėse yra mažiausiai 4 anglies atomai.
Pavyzdžiui, n-pentano izomerizacija į izopentaną (2-metilbutaną) vyksta 100 °C temperatūroje, esant aliuminio chlorido katalizatoriui:
4) Dehidrociklinimo arba aromatinimo reakcija
Alkanai, kurių pagrindinė grandinė yra 6 ar daugiau anglies atomų, patenka į dehidrociklizacijos reakciją, bet visada sudaro 6-narį žiedą (cikloheksanas ir jo dariniai). Reakcijos sąlygomis šis ciklas toliau dehidrogenuojamas ir virsta energetiškai stabilesniu aromatinio angliavandenilio (areno) benzeno žiedu. Pavyzdžiui:
Šiomis reakcijomis grindžiamas riformingo procesas – naftos produktų perdirbimas, kad susidarytų arenos (sočiųjų angliavandenilių aromatizavimas) ir vandenilis. N-alkanų pavertimas arenais pagerina benzino atsparumą smūgiams.
5) Terminis skilimas iki paprastų medžiagų
CH 4 t → C + 2H 2
6) Metano pirolizė.
Prie 1500 °C atsirandatarpmolekulinis dehidrogenavimas metano
su acetileno susidarymu:
2CH 4 1500°С → C 2 H2 + 3H 2
Ši reakcija naudojama pramoninei acetileno gamybai.
IV Metano konversija
Svarbi metano ir vandens garų reakcija, dėl kurios susidaro anglies monoksido (II) ir vandenilio mišinys – „sintezės dujos“:
Ši reakcija naudojama vandenilio gamybai. Sintetinės dujos yra žaliava įvairių angliavandenilių gamybai.
Alkanų paruošimas
Alkanai yra izoliuojami iš natūralių šaltinių (gamtinių ir susijusių dujų, naftos). Gamtinės dujos sudaro iki 95% metano. Pelkės dujos, susidarančios dėl angliavandenių bakterinio apdorojimo (puvimo), yra tokios pačios sudėties. Susijusias naftos dujas daugiausia sudaro etanas, propanas, butanas ir iš dalies pentanas. Jie atskiriami nuo naftos specialiuose naftos apdorojimo įrenginiuose. Nesant dujų kondensato stočių, susijusios naftos dujos deginamos raketose, o tai yra labai neprotinga ir švaistoma praktika naftos gavybos srityje. Kartu su dujomis alyva išvaloma nuo vandens, nešvarumų ir smėlio, po to patenka į vamzdį transportavimui. Jis gaunamas iš aliejaus distiliuojant
daugiau nei 100 atskirų junginių, linijinių ir šakotųjų alkanų, cikloalkanų ir aromatinių angliavandenilių.
Taip pat naudojami sintetiniai metodai.
- Alkanų krekingas (pramoninis metodas)
- Nesočiųjų angliavandenilių hidrinimas:
C n H 2n + H 2 t˚С, Ni arba Pd → C n H 2n+2
Sudėtingesnių alkanų sintezė veikiant metaliniam natriui monohalogeniniams alkanams, turintiems mažiau anglies atomų:
2CH3–CH2Br+2Na→CH3–CH2–CH2–CH3+2NaBr
Wurtz reakcija prasminga tik gaminant iš vieno alkilo halogenido, nes kitu atveju alkanų mišinį sunku atskirti laboratorinėmis sąlygomis.
Pavyzdžiui:
Be propano C 3 H 8 susidaro butanas C 4 H 10 (iš 2 molekulių C 2 H 5 Br) ir etano C 2 H 6 (iš 2 molekulių CH 3 Br).
- Terminis dekarboksilinimas. Karboksilo rūgščių druskų susiliejimas su šarmu (Dumas reakcija):
arba apskritai
R-COONa + NaOH R-H + Na2CO3
- Karboksilo rūgščių druskų elektrolizė (Kolbės reakcija):
- Izomerizacija. Veikiant katalizatoriams, kaitinant normalios struktūros alkanai vyksta izomerizacija - anglies skeleto pertvarkymas, susidaro šakotos struktūros alkanai.
- Skystieji angliavandeniliai sudaro didelę variklių ir raketų kuro dalį ir yra naudojami kaip tirpikliai.
- Vazelino aliejus (skystų angliavandenilių mišinys, turintis iki 15 anglies atomų) – skaidrus, bekvapis ir beskonis skystis, naudojamas medicinoje, parfumerijoje ir kosmetikoje.
- Vazelinas (skystų ir kietų sočiųjų angliavandenilių mišinys su anglies atomų skaičiumi iki 25) naudojamas medicinoje naudojamų tepalų gamybai.
- Parafinas (kietų alkanų mišinys C 19-С 35 ) - balta kieta masė be kvapo ir skonio (mp 50-70 ° C) - naudojama žvakėms gaminti, degtukų impregnavimui ir vyniojamajam popieriui, terminėms procedūroms medicinoje. Naudojamas kaip žaliava organinių rūgščių ir alkoholių, ploviklių ir paviršiaus aktyviųjų medžiagų gamybai.
- Normalūs vidutinės molekulinės masės sotieji angliavandeniliai naudojami kaip maistinių medžiagų substratas mikrobiologinėje baltymų sintezėje iš naftos.
- Didelę reikšmę turi alkanų halogeniniai dariniai, kurie naudojami kaip tirpikliai, aušinimo skysčiai ir žaliavos tolesnei sintezei.
- Šiuolaikinėje naftos chemijos pramonėje sotieji angliavandeniliai yra įvairių organinių junginių gamybos pagrindas, svarbi žaliava tarpinių produktų gavimo procesuose plastikų, gumos, sintetinių pluoštų, ploviklių ir daugelio kitų medžiagų gamybai.
Šaltiniai
- G.I. Deryabina, G.V. Organinė chemija.Elektroninis šaltinis.
- I.I.Novošinskis, N.S.Novošinskaja. Organinė chemija: vadovas aukštųjų mokyklų studentams ir stojantiesiems. – M.: OOO „Leidykla ONICS XXI amžius“, 2004 m
- Kuzmenko N.E., Ereminas V.V., Popkovas V.A. Chemijos pradžia. Šiuolaikiniai kursai stojantiesiems į universitetus. M.: Egzaminas, 2002 m.
– tai yra sotieji (arba sotieji) necikliniai angliavandeniliai, kuriuose yra visos jungtysviengungis.
Bendra formulė:
C n H 2 n +2
Visi alkanuose esantys anglies atomai turi sp 3 - hibridizacija.
Pirmieji keturi homologinės alkanų serijos nariai yra dujos, C5–C17 yra skysčiai, o nuo C18 – kietosios medžiagos. Visi alkanai yra lengvesni už vandenį, netirpsta vandenyje ir su juo nesimaišo.
Cheminės savybės.
1) Anglies ryšys su vandeniliu alkanuose yra žemo poliškumo.
2) Todėl jo plyšimas reakcijose įmanomas tik homolitiniu mechanizmu:
Tai įmanoma tik atšiauriomis sąlygomis.
3) Sotieji (sotieji) angliavandeniliai neturi galimybės įsitraukti į adityvines reakcijas. Jiems būdingas pakeitimo reakcijos vandenilio atomai ir skilimas. Šios reakcijos vyksta arba šiluma, arba šviesoje, arba naudojant katalizatorius.
Alkanai nereaguok su koncentruotomis rūgštimis, šarmais, kalio permanganatu, bromo vandeniu.
I. Pakeitimo reakcijos.
1) Halogeninimas: radikalus pakeitimas.
Chloras ir bromas šviesoje arba karštyje.
A) chlorinimas: procesas greitas, todėl vyksta be atskyrimo, susidaro pakaitinių produktų mišinys:
CH 3 - CH 2 - CH 3 + Cl 2 – (lengvas) CH3-CH2-CH2Cl + CH3-CHCl-CH3 + HCl
B) brominimas:
CH 3 CH 3
CH3-CH2-CH-CH3 +Br2 – (šviesus) CH3-CH2-C-CH3 + HBr
Brominimas yra lėtesnis ir selektyvesnis procesas.
Bromo selektyvumas:
tretinis > antrinis > pirminis anglies atomas.
Radikalaus pakeitimo mechanizmas: Grandinės laisvasis radikalas.
Laisvasis radikalas R ∙ yra LABAI AKTYVI dalelė, kuri neša vienas nesuporuotas elektronas ir linkę sudaryti ryšį su kokiu nors kitu atomu.
1) Grandinės inicijavimas (paleidimas): chloro molekulė, veikiama šviesos kvanto, suskaidoma į du radikalus Cl · :
2) Grandinės plėtra: Chloro radikalas abstrahuoja vandenilio atomą iš alkano. Tokiu atveju susidaro tarpinė dalelė – alkilo radikalas, kuris savo ruožtu abstrahuoja chloro atomą iš Cl 2 molekulės. Tokiu atveju vėl gaunamas chloro radikalas ir procesas kartojamas - grandinė tęsiasi:
3) Atvira grandinė: dviejų radikalų susijungimas į molekulę.
2) Nitravimas
(M.I. Konovalovo reakcija):
Reakcijos mechanizmas taip pat radikalus.
Kaitinimas iki 140°C atskiesta (10%) azoto rūgštimi:
CH 3 CH 3
CH3-CH2-CH-CH3 + HNO3 CH3-CH2-C-CH3 + H2O
Nitrinimo selektyvumas: NE 2
tretinis > antrinis > pirminis anglies atomas.
3) Krekingas – alkanų transformacija veikiant šilumai.
a) Ilgos grandinės alkanams krekingo metu susidaro alkanas ir alkenas. Be to, kai ilgis didesnis nei 5 C atomai, gaunamas skirtingo ilgio angliavandenilių mišinys.
CH 3 –CH 2 –CH 2 –CH 3 - 400°C CH3-CH3 + CH2 =CH2
b) Metano įtrūkimai vyksta dviem galimais būdais:
1. ilgalaikis metano kaitinimas: CH 4 - 1500° C C+2H2
2. momentinis pašildymas iki 1500 laipsnių ir greitas aušinimas:
2CH 4 – 1500°C H–C ≡ C–H + 3H 2
Acetilenas
4) Izomerizacija - anglies skeleto pertvarkymas, susidarant kitiems izomerams: kaitinant AlCl 3 katalizatoriumi.
CH3-CH2-CH2-CH3-(100o, AlCl3) CH3-CH-CH3
5) Oksidacija:
1) Degimas:
CH 4 + 2O 2 ⇆ CO 2 + 2H 2 O
C 5 H 12 + 8O 2 ⇆ 5CO 2 + 6H 2 O
2) Katalizinė oksidacija:
Metanas: CH 4 + O 2 – (katalizatorius) CH 3 OH, HSON ir HCOOH mišinys
Butanas: C 4 H 10 + O 2 – (katalizatorius) 2 CH 3 COOH (acto rūgštis)
6) Dehidrinimas ir ciklizacija.
1) Trumpieji alkanai dehidrogenuojami į alkenus arba dienus:
C 2 H 6 – (kat., t) C 2 H 4 + H 2
CH 3 -CH 2 -CH 2 -CH 3 – (kat. Cr 2 O 3, t) butadienas + H2
2) Esant katalizatoriui, heksanas ir heptanas atitinkamai paverčiami benzenu ir toluenu.
CH3-CH2-CH2-CH2-CH2-CH3 – (kat. Pt, t) + 4 H 2
Kvitas:
1) Wurtz reakcija: metalinio natrio poveikis angliavandenilių monohalogeniniams dariniams:
2CH 3 – CH 2 Br + 2Na CH 3 – CH 2 – CH 2 – CH 3 +2 NaBr
Anglies skeletas padvigubėja. Reakcija tinka simetriniams alkanams gaminti.
2) Karboksirūgšties druskų dekarboksilinimas(Dumas reakcija): karboksirūgščių druskų susiliejimas su šarmais.
Taip metanas susidaro kaitinant natrio acetatą su natrio hidroksidu.
CH 3 COONa + NaOH ( susiliejimas) CH 4 +Na 2 CO 3
3) Karboksirūgšties druskų tirpalų elektrolizė(Kolbės reakcija):
2CH 3 COONa + 2H 2 O – (elektros srovė) 2CO 2 + H 2 + C 2 H 6 + 2NaOH
katodas:
išleidžiamas vanduo: 2H 2 O + 2e N 2 + 2OH -
anodas:
Rūgščių anijonų išleidimas: 2CH 3 SOO - -2e 2CO 2 + CH 3 -SN 3
4) Aliuminio karbido hidrolizė– metano gamyba.
Al 4 C 3 +12H 2 O 3CH 4 + 4Al(OH) 3
5) Nesočiųjų arba ciklinių angliavandenilių hidrinimas esant katalizatoriams (platina, paladis, nikelis).
R–CH=CH–R’ + H 2 – kat R–CH 2 – CH 2 -R'
(ciklopropanas) + H 2 – Pd CH 3 – CH 2 – CH 3 (propanas)
6) Alkanus galima gauti iš naftos krekingo arba frakcinio distiliavimo būdu.
Būdingos angliavandenilių cheminės savybės: alkanai, alkenai, dienai, alkinai, aromatiniai angliavandeniliai
Alkanai
Alkanai yra angliavandeniliai, kurių molekulėse atomai yra sujungti viengubomis jungtimis ir kurie atitinka bendrą formulę $C_(n)H_(2n+2)$.
Homologinė metano serija
Kaip jau žinote, homologai- tai medžiagos, kurių struktūra ir savybės yra panašios ir skiriasi viena ar keliomis $CH_2$ grupėmis.
Sotieji angliavandeniliai sudaro homologinę metano seriją.
Izomerizmas ir nomenklatūra
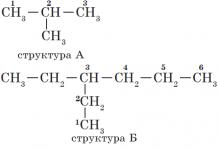
Alkanams būdinga vadinamoji struktūrinė izomerija. Struktūriniai izomerai skiriasi vienas nuo kito anglies skeleto struktūra. Kaip jau žinote, paprasčiausias alkanas, kuriam būdingi struktūriniai izomerai, yra butanas:
Pažvelkime atidžiau į IUPAC alkanų nomenklatūros pagrindus:
1. Pagrindinės grandinės pasirinkimas.
Angliavandenilio pavadinimo formavimas prasideda nuo pagrindinės grandinės apibrėžimo - ilgiausios anglies atomų grandinės molekulėje, kuri yra tarsi jos pagrindas.
2.
Pagrindinės grandinės atomams priskiriami numeriai. Pagrindinės grandinės atomų numeracija prasideda nuo to galo, kuriam pakaitalas yra arčiausiai (struktūros A, B). Jei pakaitai yra vienodu atstumu nuo grandinės galo, tai numeracija pradedama nuo to galo, kuriame jų yra daugiau (B struktūra). Jei skirtingi pakaitai yra vienodais atstumais nuo grandinės galų, tada numeracija pradedama nuo galo, prie kurio arčiausiai yra vyresnysis (struktūra D). Angliavandenilių pakaitalų eiliškumas nustatomas pagal raidės, kuria prasideda jų pavadinimas, abėcėlėje: metilas (—$СН_3$), tada propilas ($—СН_2—СН_2—СН_3$), etilas ($—СН_2). —СН_3$ ) ir kt.
Atkreipkite dėmesį, kad pakaitalo pavadinimas formuojamas pakeičiant galūnę -an priesagai -il atitinkamo alkano vardu.
3. Vardo formavimas.
Pavadinimo pradžioje nurodomi skaičiai - anglies atomų, prie kurių yra pakaitai, skaičiai. Jei tam tikrame atome yra keli pakaitalai, atitinkamas skaičius pavadinime kartojamas du kartus, atskiriant kableliu ($2,2-$). Po skaičiaus pakaitų skaičius nurodomas brūkšneliu ( di- du, trys- trys, tetra- keturi, penta- penki) ir pavaduotojo pavardė ( metilas, etilas, propilas). Tada be tarpų ar brūkšnelių – pagrindinės grandinės pavadinimas. Pagrindinė grandinė vadinama angliavandeniliu - homologinės metano serijos nariu ( metanas, etanas, propanas ir kt.).

Medžiagų, kurių struktūrinės formulės pateiktos aukščiau, pavadinimai yra tokie:
- struktūra A: 2 USD -metilpropanas;
— B struktūra: 3 USD -etilheksanas;
— struktūra B: $2,2,4$ -trimetilpentanas;
- struktūra G: $ 2 $ -metilas$4$-etilheksanas.
Alkanų fizinės ir cheminės savybės
Fizinės savybės. Pirmieji keturi homologinės metano serijos atstovai yra dujos. Paprasčiausias iš jų yra metanas, bespalvės, beskonės ir bekvapės dujos (dujų kvapą pajutus reikia skambinti 104$, lemia merkaptanų kvapas – sieros turintys junginiai, specialiai dedami į metaną, naudojamą buitinius ir pramoninius dujų prietaisus, kad šalia jų esantys žmonės galėtų aptikti nuotėkį pagal kvapą).
Angliavandeniliai, kurių sudėtis nuo $С_5Н_(12)$ iki $С_(15)Н_(32)$, yra skysčiai; sunkesni angliavandeniliai yra kietos medžiagos.
Alkanų virimo ir lydymosi temperatūra palaipsniui didėja didėjant anglies grandinės ilgiui. Visi angliavandeniliai blogai tirpsta vandenyje. Skystieji angliavandeniliai yra įprasti organiniai tirpikliai.
Cheminės savybės.
1. Pakeitimo reakcijos. Alkanams būdingiausios reakcijos yra laisvųjų radikalų pakeitimo reakcijos, kurių metu vandenilio atomas pakeičiamas halogeno atomu arba kokia nors grupe.
Pateiksime būdingiausių reakcijų lygtis.
Halogeninimas:
$CH_4+Cl_2→CH_3Cl+HCl$.
Esant halogeno pertekliui, chloravimas gali vykti toliau, iki visiško vandenilio atomų pakeitimo chloru:
$CH_3Cl+Cl_2→HCl+(CH_2Cl_2)↙(\tekstas"dichlormetanas (metileno chloridas)")$,
$CH_2Cl_2+Cl_2→HCl+(CHСl_3)↙(\tekstas"trichlormetanas(chloroformas)")$,
$CHCl_3+Cl_2→HCl+(CCl_4)↙(\tekstas"anglies tetrachloridas(anglies tetrachloridas)")$.
Gautos medžiagos plačiai naudojamos kaip organinės sintezės tirpikliai ir pradinės medžiagos.
2. Dehidrogenavimas (vandenilio pašalinimas). Kai alkanai perduodami per katalizatorių ($Pt, Ni, Al_2O_3, Cr_2O_3$) aukštoje temperatūroje ($400-600°C$), pašalinama vandenilio molekulė ir susidaro alkenas:
$CH_3—CH_3→CH_2=CH_2+H_2$
3. Reakcijos, kurias lydi anglies grandinės sunaikinimas. Visi sotieji angliavandeniliai dega susidarant anglies dioksidui ir vandeniui. Dujiniai angliavandeniliai, tam tikromis proporcijomis susimaišę su oru, gali sprogti. Sočiųjų angliavandenilių degimas yra laisvųjų radikalų egzoterminė reakcija, kuri yra labai svarbi naudojant alkanus kaip kurą:
$СН_4+2О_2→СО_2+2Н_2O+880 kJ.$
Apskritai alkanų degimo reakciją galima parašyti taip:
$C_(n)H_(2n+2)+((3n+1)/(2))O_2→nCO_2+(n+1)H_2O$
Terminis angliavandenilių skaidymas:
$C_(n)H_(2n+2)(→)↖(400-500°C)C_(n-k)H_(2(n-k)+2)+C_(k)H_(2k)$
Procesas vyksta per laisvųjų radikalų mechanizmą. Temperatūros padidėjimas sukelia homolizinį anglies-anglies jungties skilimą ir laisvųjų radikalų susidarymą:
$R—CH_2CH_2:CH_2—R—R—CH_2CH_2·+·CH_2—R$.
Šie radikalai sąveikauja vienas su kitu, keisdami vandenilio atomą, sudarydami alkano molekulę ir alkeno molekulę:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Terminio skilimo reakcijos yra pramoninio angliavandenilių krekingo proceso pagrindas. Šis procesas yra svarbiausias naftos perdirbimo etapas.
Kai metanas pašildomas iki $1000°C$ temperatūros, prasideda metano pirolizė – skilimas į paprastas medžiagas:
$CH_4(→)↖(1000°C)C+2H_2$
Kaitinant iki $1500°C$ temperatūros, galimas acetileno susidarymas:
$2CH_4(→)↖(1500°C)CH=CH+3H_2$
4. Izomerizacija. Kai linijiniai angliavandeniliai kaitinami izomerizacijos katalizatoriumi (aliuminio chloridu), susidaro medžiagos su šakotu anglies karkasu:
5. Aromatizavimas. Alkanai, kurių grandinėje yra šeši ar daugiau anglies atomų, ciklizuojasi dalyvaujant katalizatoriui, sudarydami benzeną ir jo darinius:

Kokia yra alkanų laisvųjų radikalų reakcijos priežastis? Visi alkano molekulėse esantys anglies atomai yra $sp^3$ hibridizacijos būsenoje. Šių medžiagų molekulės yra sudarytos naudojant kovalentinius nepolinius $C-C$ (anglies-anglies) ryšius ir silpnai polinius $C-H$ (anglies-vandenilio) ryšius. Juose nėra padidinto ar sumažėjusio elektronų tankio plotų arba lengvai poliarizuojamų ryšių, t.y. tokie ryšiai, kurių elektronų tankis gali pasislinkti veikiant išoriniams veiksniams (jonų elektrostatiniams laukams). Vadinasi, alkanai nereaguos su įkrautomis dalelėmis, nes ryšiai alkano molekulėse nenutrūksta dėl heterolitinio mechanizmo.
Alkenai
Nesotieji apima angliavandenilius, kurių molekulėse yra daug jungčių tarp anglies atomų. Yra neribotas alkenai, alkadienai (polienai), alkinai. Cikliniai angliavandeniliai, kurių žiede yra dviguba jungtis (cikloalkenai), taip pat cikloalkanai, kurių žiede yra nedidelis anglies atomų skaičius (tris ar keturis atomus), taip pat yra nesotieji. Nesočiųjų savybė siejama su šių medžiagų, visų pirma vandenilio, sudėjimo reakcijas, kai susidaro sočiųjų arba sočiųjų angliavandenilių - alkanų.
Alkenai yra acikliniai angliavandeniliai, kurių molekulėje, be pavienių jungčių, yra viena dviguba jungtis tarp anglies atomų ir atitinkanti bendrą formulę $C_(n)H_(2n)$.
Antrasis jo pavadinimas yra olefinai- alkenai buvo gauti pagal analogiją su nesočiosiomis riebalų rūgštimis (oleino, linolo), kurių likučiai yra skystų riebalų dalis - aliejai (iš lat. oleumas- aliejus).
Homologinė eteno serija
Neišsišakoję alkenai sudaro homologinę eteno (etileno) seriją:
$С_2Н_4$ - etenas, $С_3Н_6$ - propenas, $С_4Н_8$ - butenas, $С_5Н_(10)$ - pentenas, $С_6Н_(12)$ - heksenas ir kt.
Izomerizmas ir nomenklatūra
Alkenams, kaip ir alkanams, būdinga struktūrinė izomerija. Struktūriniai izomerai skiriasi vienas nuo kito anglies skeleto struktūra. Paprasčiausias alkenas, kuriam būdingi struktūriniai izomerai, yra butenas:

Ypatingas struktūrinės izomerijos tipas yra dvigubos jungties padėties izomerija:
$CH_3—(CH_2)↙(butenas-1)—CH=CH_2$ $CH_3—(CH=CH)↙(butenas-2)—CH_3$
Beveik laisvas anglies atomų sukimasis aplink vieną anglies-anglies ryšį, todėl alkano molekulės gali įgauti įvairiausių formų. Sukimasis aplink dvigubą jungtį neįmanomas, todėl alkenuose atsiranda kitokio tipo izomerija - geometrinė arba cis-trans izomerija.

Cis- izomerai skiriasi nuo transas - izomerai pagal erdvinį molekulinių fragmentų (šiuo atveju metilo grupių) išsidėstymą $π$ ryšio plokštumos atžvilgiu, taigi ir pagal jų savybes.
Alkenai yra izomeriniai cikloalkanams (tarpklasių izomerija), pavyzdžiui:

IUPAC alkenų nomenklatūra yra panaši į alkanų nomenklatūrą.
1. Pagrindinės grandinės pasirinkimas.
Angliavandenilio pavadinimo suteikimas prasideda identifikuojant pagrindinę grandinę – ilgiausią anglies atomų grandinę molekulėje. Alkenų atveju pagrindinėje grandinėje turi būti dviguba jungtis.
2. Pagrindinės grandinės atomų numeracija.
Pagrindinės grandinės atomų numeracija prasideda nuo galo, prie kurio yra arčiausiai dviguba jungtis. Pavyzdžiui, teisingas ryšio pavadinimas yra:

$5$-metilheksenas-$2$, o ne $2$-metilheksenas-$4$, kaip galima tikėtis.
Jei dvigubos jungties padėtis negali nustatyti grandinės atomų numeracijos pradžios, tai ji nustatoma pagal pakaitų padėtį, kaip ir sočiųjų angliavandenilių atveju.

3. Vardo formavimas.
Alkenų pavadinimai susidaro taip pat, kaip ir alkanų pavadinimai. Pavadinimo pabaigoje nurodykite anglies atomo, nuo kurio prasideda dviguba jungtis, skaičių ir priesagą, nurodantį, kad junginys priklauso alkenų klasei - -lt.
Pavyzdžiui:

Alkenų fizinės ir cheminės savybės
Fizinės savybės. Pirmieji trys homologinės alkenų serijos atstovai yra dujos; sudėties $С_5Н_(10)$ - $С_(16)Н_(32)$ medžiagos - skysčiai; Aukštesni alkenai yra kietos medžiagos.
Virimo ir lydymosi temperatūra natūraliai didėja didėjant junginių molekulinei masei.
Cheminės savybės.
Papildymo reakcijos. Prisiminkime, kad išskirtinis nesočiųjų angliavandenilių - alkenų - atstovų bruožas yra galimybė įsitraukti į sudėjimo reakcijas. Dauguma šių reakcijų vyksta pagal mechanizmą
1. Alkenų hidrinimas. Alkenai gali pridėti vandenilio esant hidrinimo katalizatoriams, metalai - platina, paladis, nikelis:
$CH_3—CH_2—CH=CH_2+H_2(→)↖(Pt)CH_3—CH_2—CH_2—CH_3$.
Ši reakcija vyksta esant atmosferos ir padidintam slėgiui ir nereikalauja aukštos temperatūros, nes yra egzoterminis. Kai temperatūra pakyla, tie patys katalizatoriai gali sukelti atvirkštinę reakciją – dehidrogenaciją.
2. Halogeninimas (halogenų pridėjimas). Alkeno sąveika su bromo vandeniu arba bromo tirpalu organiniame tirpiklyje ($CCl_4$) lemia greitą šių tirpalų spalvos pasikeitimą dėl to, kad į alkeną pridedama halogeno molekulė ir susidaro dihalogeniniai alkanai:
$CH_2=CH_2+Br_2→CH_2Br—CH_2Br$.
3.
$CH_3-(CH)↙(propenas)=CH_2+HBr→CH_3-(CHBr)↙(2-brompropenas)-CH_3$
Ši reakcija paklūsta Markovnikovo taisyklė:
Kai į alkeną pridedamas vandenilio halogenidas, vandenilis pridedamas prie labiau hidrinto anglies atomo, t.y. atomas, kuriame yra daugiau vandenilio atomų, o halogenas - mažiau hidrintas.
Dėl alkenų hidratacijos susidaro alkoholiai. Pavyzdžiui, vandens įdėjimas į eteną yra vienas iš pramoninių etilo alkoholio gamybos būdų:
$(CH_2)↙(etenas)=CH_2+H_2O(→)↖(t,H_3PO_4)CH_3-(CH_2OH)↙(etanolis)$
Atkreipkite dėmesį, kad pirminis alkoholis (su hidrokso grupe ant pirminės anglies) susidaro tik tada, kai etenas yra hidratuotas. Kai propenas ar kiti alkenai hidratuojami, susidaro antriniai alkoholiai.

Ši reakcija taip pat vyksta pagal Markovnikovo taisyklę - vandenilio katijonas prisijungia prie labiau hidrinto anglies atomo, o hidrokso grupė - prie mažiau hidrinto.
5. Polimerizacija. Ypatingas pridėjimo atvejis yra alkenų polimerizacijos reakcija:
$nCH_2(=)↙(etenas)CH_2(→)↖(UV šviesa, R)(...(-CH_2-CH_2-)↙(polietilenas)...)_n$
Ši prisijungimo reakcija vyksta per laisvųjų radikalų mechanizmą.
6. Oksidacijos reakcija.
Kaip ir bet kurie organiniai junginiai, alkenai dega deguonyje, sudarydami $СО_2$ ir $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2+2Н_2О$.
Apskritai:
$C_(n)H_(2n)+(3n)/(2)O_2→nCO_2+nH_2O$
Skirtingai nuo alkanų, kurie yra atsparūs oksidacijai tirpaluose, alkenai lengvai oksiduojami kalio permanganato tirpalais. Neutraliuose arba šarminiuose tirpaluose alkenai oksiduojami į diolius (dihidroksilius alkoholius), o prie tų atomų, tarp kurių prieš oksidaciją buvo dviguba jungtis, pridedamos hidroksilo grupės:

Alkadienai (dieno angliavandeniliai)
Alkadienai yra acikliniai angliavandeniliai, kurių molekulėje, be pavienių jungčių, yra dvi dvigubos jungtys tarp anglies atomų ir atitinkančios bendrą formulę $C_(n)H_(2n-2)$.
Priklausomai nuo santykinio dvigubų jungčių išsidėstymo, išskiriami trys dienų tipai:
- alkadienai su sukaupta dvigubų ryšių išdėstymas:
- alkadienai su konjuguotas dvigubos jungtys;
$CH_2=CH—CH=CH_2$;
- alkadienai su izoliuotas dvigubi ryšiai
$CH_2=CH—CH_2—CH=CH_2$.
Šios trys alkadienų rūšys labai skiriasi viena nuo kitos struktūra ir savybėmis. Centrinis anglies atomas (atomas, kuris sudaro dvi dvigubas jungtis) alkadienuose su kumuliuotais ryšiais yra $sp$-hibridizacijos būsenoje. Jis sudaro dvi $σ$ jungtis, esančias toje pačioje linijoje ir nukreiptas priešingomis kryptimis, ir dvi $ π$ jungtis, esančias statmenose plokštumose. $π$-Ryšiai susidaro dėl nehibridizuotų kiekvieno anglies atomo p-orbitalių. Alkadienų su izoliuotomis dvigubomis jungtimis savybės yra labai specifinės, nes konjuguotos $π$ jungtys reikšmingai veikia viena kitą.
p-orbitalės, sudarančios konjuguotas $π$-jungtis, sudaro praktiškai vieną sistemą (ji vadinama $π$-sistema), nes gretimų $π$ obligacijų p-orbitalės iš dalies sutampa.
Izomerizmas ir nomenklatūra
Alkadienams būdinga ir struktūrinė izomerija, ir cis-, trans-izomerija.
Struktūrinė izomerija.
— anglies skeleto izomerija:

— kelių jungčių padėties izomerija:
$(CH_2=CH—CH=CH_2)↙(butadienas-1,3)$ $(CH_2=C=CH—CH_3)↙(butadienas-1,2)$
cis-, trans- izomerija (erdvinė ir geometrinė)
Pavyzdžiui:
Alkadienai yra alkinų ir cikloalkenų klasių izomeriniai junginiai.
Formuojant alkadieno pavadinimą, nurodomi dvigubų jungčių skaičiai. Pagrindinėje grandinėje būtinai turi būti dvi daugybinės jungtys.
Pavyzdžiui:

Alkadienų fizinės ir cheminės savybės
Fizinės savybės.
Normaliomis sąlygomis propandienas-1,2, butadienas-1,3 yra dujos, o 2-metilbutadienas-1,3 yra lakus skystis. Alkadienai su izoliuotomis dvigubomis jungtimis (paprasčiausias iš jų yra pentadienas-1,4) yra skysčiai. Didesni dienai yra kietosios medžiagos.
Cheminės savybės.
Alkadienų su izoliuotomis dvigubomis jungtimis cheminės savybės mažai skiriasi nuo alkenų savybių. Alkadienai su konjuguotomis jungtimis turi keletą ypatingų savybių.
1. Papildymo reakcijos. Alkadienai gali pridėti vandenilio, halogenų ir vandenilio halogenidų.
Ypatinga pridėjimo prie alkadienų su konjuguotomis jungtimis ypatybė yra galimybė pridėti molekules tiek 1 ir 2, tiek 1 ir 4 padėtyse.

Produktų santykis priklauso nuo atitinkamų reakcijų sąlygų ir būdo.
2.Polimerizacijos reakcija. Svarbiausia dienų savybė yra gebėjimas polimerizuotis veikiant katijonams arba laisviesiems radikalams. Šių junginių polimerizacija yra sintetinių kaučiukų pagrindas:
$nCH_2=(CH—CH=CH_2)↙(butadienas-1,3)→((... —CH_2—CH=CH—CH_2— ...)_n)↙(\tekstas"sintetinis butadieno kaučiukas")$ .
Konjuguotų dienų polimerizacija vyksta kaip 1,4-addicija.
Šiuo atveju dviguba jungtis pasirodo esanti vienete centrinė, o elementarioji jungtis, savo ruožtu, gali perimti abu cis-, taip transas - konfigūracija

Alkinai
Alkinai yra acikliniai angliavandeniliai, kurių molekulėje, be pavienių jungčių, yra viena triguba jungtis tarp anglies atomų ir atitinkanti bendrą formulę $C_(n)H_(2n-2)$.
Homologinė etino serija
Tiesios grandinės alkinai sudaro homologinę etino (acetileno) seriją:
$С_2Н_2$ – etinas, $С_3Н_4$ – propinas, $С_4Н_6$ – butinas, $С_5Н_8$ – pentinas, $С_6Н_(10)$ – heksinas ir kt.
Izomerizmas ir nomenklatūra
Alkinams, kaip ir alkenams, būdinga struktūrinė izomerija: anglies karkaso izomerija ir daugybinio ryšio padėties izomerija. Paprasčiausias alkinas, kuriam būdingi alkinų klasės daugialypės jungties padėties struktūriniai izomerai, yra butinas:
$СН_3—(СН_2)↙(butinas-1)—С≡СН$ $СН_3—(С≡С)↙(butinas-2)—СН_3$
Galimas anglies skeleto izomerizmas alkinuose, pradedant pentinu:

Kadangi triguba jungtis turi tiesinę anglies grandinės struktūrą, geometrinė ( cis-, trans-) izomerija alkinams neįmanoma.
Trigubos jungties buvimą šios klasės angliavandenilių molekulėse atspindi priesaga -į, o jo padėtis grandinėje yra anglies atomo skaičius.
Pavyzdžiui:

Kai kurių kitų klasių junginiai yra izomeriniai alkinams. Taigi cheminė formulė $C_6H_(10)$ turi heksiną (alkiną), heksadieną (alkadieną) ir ciklohekseną (cikloalkeną):

Alkinų fizinės ir cheminės savybės
Fizinės savybės. Alkinų, taip pat alkenų, virimo ir lydymosi temperatūra natūraliai didėja didėjant junginių molekulinei masei.
Alkinai turi specifinį kvapą. Jie geriau tirpsta vandenyje nei alkanai ir alkenai.
Cheminės savybės.
Papildymo reakcijos. Alkinai yra nesotieji junginiai ir juose vyksta adityvinės reakcijos. Dažniausiai reakcijos elektrofilinis papildymas.
1. Halogeninimas (halogeno molekulės pridėjimas). Alkinas gali prijungti dvi halogeno molekules (chlorą, bromą):
$CH≡CH+Br_2→(CHBr=CHBr)↙(1,2-dibrometanas),$
$CHBr=CHBr+Br_2→(CHBr_2-CHBr_2)↙(1,1,2,2-tetrabrometanas)$
2. Hidrohalogeninimas (vandenilio halogenido pridėjimas). Vandenilio halogenido pridėjimo reakcija, kuri vyksta per elektrofilinį mechanizmą, taip pat vyksta dviem etapais ir abiejose stadijose tenkinama Markovnikovo taisyklė:
$CH_3-C≡CH+Br→(CH_3-CBr=CH_2)↙(2-brompropenas),$
$CH_3-CBr=CH_2+HBr→(CH_3-CHBr_2-CH_3)↙(2,2-dibrompropanas)$
3. Hidratacija (vandens papildymas). Didelę reikšmę pramoninei ketonų ir aldehidų sintezei turi vandens pridėjimo reakcija (hidratacija), kuri vadinama Kučerovo reakcija:
4. Alkinų hidrinimas. Alkinai prideda vandenilio esant metaliniams katalizatoriams ($Pt, Pd, Ni$):
$R-C≡C-R+H_2(→)↖(Pt)R-CH=CH-R,$
$R-CH=CH-R+H_2(→)↖(Pt)R-CH_2-CH_2-R$
Kadangi triguboje jungtyje yra dvi reaktyvios $π$ jungtys, alkanai laipsniškai prideda vandenilį:
1) trimerizacija.
Kai etinas praleidžiamas per aktyvuotą anglį, susidaro produktų mišinys, vienas iš kurių yra benzenas:

2) dimerizacija.
Be acetileno trimerizacijos, galima ir jo dimerizacija. Vienvalenčių vario druskų įtakoje susidaro vinilo acetilenas:
$2HC≡CH→(HC≡C-CH=CH_2)↙(\tekstas"butenas-1-3(vinilacetilenas)")$
Ši medžiaga naudojama chloropreno gamybai:
$HC≡C-CH=CH_2+HCl(→)↖(CaCl)H_2C=(CCl-CH)↙(chloroprenas)=CH_2$
polimerizacijos būdu gaunamas chloropreno kaučiukas:
$nH_2C=CCl-CH=CH_2→(...-H_2C-CCl=CH-CH_2-...)_n$
Alkinų oksidacija.
Etinas (acetilenas) dega deguonyje, išskirdamas labai daug šilumos:
$2C_2H_2+5O_2→4CO_2+2H_2O+2600kJ$ Deguonies-acetileno degiklio veikimas pagrįstas šia reakcija, kurios liepsnos temperatūra yra labai aukšta (daugiau nei $3000°C$), todėl ją galima naudoti metalų pjovimas ir suvirinimas.
Ore acetilenas dega dūmine liepsna, nes anglies kiekis jo molekulėje yra didesnis nei etano ir eteno molekulėse.
Alkinai, kaip ir alkenai, keičia parūgštintų kalio permanganato tirpalų spalvą; Tokiu atveju daugialypė jungtis sunaikinama.
Reakcijos, apibūdinančios pagrindinius deguonies turinčių junginių gamybos būdus
1. Halogenalkanų hidrolizė. Jau žinote, kad halokenalkanų susidarymas alkoholiams reaguojant su vandenilio halogenidais yra grįžtama reakcija. Todėl aišku, kad alkoholius galima gauti halogenalkanų hidrolizė- šių junginių reakcijos su vandeniu:
$R-Cl+NaOH(→)↖(H_2O)R-OH+NaCl+H_2O$
Daugiahidroksilius alkoholius galima gauti hidrolizuojant halogenalkanus, kurių molekulėje yra daugiau nei vienas halogeno atomas. Pavyzdžiui:
2. Alkenų hidratacija- vandens pridėjimas per alkeno molekulės $π$ ryšį - jums jau pažįstamas, pavyzdžiui:
$(CH_2=CH_2)↙(etenas)+H_2O(→)↖(H^(+))(C_2H_5OH)↙(etanolis)$
Dėl propeno hidratacijos, vadovaujantis Markovnikovo taisykle, susidaro antrinis alkoholis - propanolis-2:

3. Aldehidų ir ketonų hidrinimas. Jau žinote, kad alkoholių oksidacija švelniomis sąlygomis sukelia aldehidų arba ketonų susidarymą. Akivaizdu, kad alkoholius galima gauti hidrinant (redukuojant vandeniliu, pridedant vandenilio) aldehidus ir ketonus:

4. Alkenų oksidacija. Glikolius, kaip jau minėta, galima gauti oksiduojant alkenus vandeniniu kalio permanganato tirpalu. Pavyzdžiui, etilenglikolis (etandiolis-1,2) susidaro oksiduojant etileną (eteną):
$CH_2=CH_2+[O]+H_2O(→)↖(KMnO_4)HO-CH_2-CH_2-OH$
5. Specifiniai alkoholio gamybos metodai. Kai kurie alkoholiai gaunami naudojant jiems būdingus metodus. Taigi metanolis gaminamas pramoniniu būdu, kai vandenilis sąveikauja su anglies monoksidu (II) (anglies monoksidu), esant padidintam slėgiui ir aukštai temperatūrai ant katalizatoriaus (cinko oksido) paviršiaus:
$CO+2H_2(→)↖(t,p,ZnO)CH_3-OH$
Šiai reakcijai reikalingas anglies monoksido ir vandenilio mišinys, dar vadinamas sintezės dujomis ($CO + nH_2O$), gaunamas leidžiant vandens garus per karštą anglį:
$C+H_2O(→)↖(t)CO+H_2-Q$
6. Gliukozės fermentacija.Šis etilo (vyno) alkoholio gamybos būdas žmonėms buvo žinomas nuo senų senovės:
$(C_6H_(12)O_6)↙(gliukozė)(→)↖(mielės)2C_2H_5OH+2CO_2$
Aldehidų ir ketonų gamybos metodai
Gali susidaryti aldehidai ir ketonai oksidacija arba alkoholių dehidrogenacija. Dar kartą atkreipkime dėmesį, kad oksiduojant arba dehidrogenuojant pirminiams alkoholiams gali susidaryti aldehidai, o antrinių – ketonų:

Kučerovo reakcija. Dėl hidratacijos reakcijos acetilenas gamina acetaldehidą, o ketonai gaunami iš acetileno homologų:

Kai šildomas kalcio arba bario druskos karboksirūgštys sudaro ketoną ir metalo karbonatą:

Karboksilo rūgščių gamybos metodai
Karboksirūgštys gali būti gaunamos oksiduojant pirminius aldehido alkoholius:

Aromatinės karboksirūgštys susidaro oksiduojantis benzeno homologams:

Hidrolizuojant įvairius karboksirūgšties darinius taip pat susidaro rūgštys. Taigi, esterio hidrolizės metu susidaro alkoholis ir karboksirūgštis. Kaip minėta aukščiau, rūgštimi katalizuojamos esterinimo ir hidrolizės reakcijos yra grįžtamos:
Esterio hidrolizė, veikiant vandeniniam šarmo tirpalui, vyksta negrįžtamai, iš esterio susidaro ne rūgštis, o jos druska.
Alkenai– tai angliavandeniliai, kurių molekulės turi VIENĄ dvigubą C=C ryšį.
Bendra alkenų formulė:
CnH2n
Dvigubos jungties anglies atomo hibridizacijos tipas – sp 2 . Likusieji alkeno molekulėje esantys anglies atomai turi sp 3 - hibridizacija.
Molekulė turi plokščią struktūrą, kampas tarp σ jungčių yra 120 0
Dvigubos jungties ilgis yra trumpesnis nei viengubos jungties ilgis.
Alkenų nomenklatūra: pavadinime atsiranda priesaga -LT.
Pirmasis homologinės serijos narys yra C 2 H 4 (etenas).
Paprasčiausiiems alkenams taip pat naudojami istoriniai pavadinimai:
etilenas (etenas),
propilenas (propenas),
Nomenklatūroje dažnai naudojami šie monovalentiniai alkeno radikalai:
CH2-CH=CH2
Alkenų izomerijos tipai:
1. Anglies skeleto izomerija:(pradedant nuo C 4 H 8 – buteno ir 2-metilpropeno)
2. Daugialypės jungties padėties izomerizmas:(pradedant nuo C 4 H 8): butenas-1 ir butenas-2.
3. Tarpklasių izomerizmas: Su cikloalkanai(pradedant propenu):
C 4 H 8 - butenas ir ciklobutanas.
4. Erdvinė alkenų izomerija:
Dėl to, kad laisvas sukimasis aplink dvigubą jungtį yra neįmanomas, tai tampa įmanoma cis-trans- izomerija .
Alkenai, kurių kiekvienas iš dviejų anglies atomų yra dviguboje jungtyje įvairūs pakaitalai, gali egzistuoti dviejų izomerų pavidalu, besiskiriančių pakaitų išsidėstymu π-jungties plokštumos atžvilgiu:
Cheminės alkenų savybės.
Alkenai pasižymi:
prisijungimo prie dvigubos jungties reakcijos,
oksidacijos reakcijos,
pakeitimo reakcijos „šoninėje grandinėje“.
1. Dvigubos jungties pridėjimo reakcijos: silpnesnis π ryšys nutrūksta ir susidaro sotusis junginys.
Tai elektrofilinės prisijungimo reakcijos – A E.
1) Hidrinimas:
CH3-CH = CH2 + H2 CH3-CH2-CH3
2) Halogeninimas:
CH 3 -CH = CH 2 + Br 2 (tirpalas) CH3-CHBr-CH2Br
Bromo vandens spalvos pasikeitimas yra kokybinė reakcija į dvigubą jungtį.
3) Hidrohalogeninimas:
CH3-CH = CH2 + HBr CH3-CHBr-CH3
(MARKOVNIKOVO TAISYKLĖ: vandenilis jungiasi prie labiausiai hidrinto anglies atomo).
4) Hidratacija – vandens pridėjimas:
CH3-CH = CH2 + HOH CH3-CH-CH3
(aneksija taip pat vyksta pagal Markovnikovo taisyklę)
2. Vandenilio bromido įpylimas į peroksidų buvimas (Aršaus efektas) - tai radikalus papildymas - A R
CH 3 -CH = CH 2 + HBr - (H 2 O 2) CH3-CH2-CH2Br
(vyksta reakcija su vandenilio bromidu, esant peroksiduiprieš Markovnikovo valdžią )
3. Degimas– visiškas alkenų oksidavimas deguonimi iki anglies dioksido ir vandens.
C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O
4. Lengva alkenų oksidacija – Wagnerio reakcija : reakcija su šaltu vandeniniu kalio permanganato tirpalu.
3CH 3 - CH=CH 2 + 2KMnO4 + 4H2O 2MnO2 + 2KOH + 3 CH 3 - CH - CH 2
ô ô
oi oi
( susidaro diolis)
Vandeninio kalio permanganato tirpalo spalvos pakitimas alkenais yra kokybinė reakcija į alkenus.
5. Stipri alkenų oksidacija– karštas neutralus arba rūgštus kalio permanganato tirpalas. Ateina su C=C dvigubos jungties skilimu.
1. Kalio permanganatui veikiant rūgščioje aplinkoje, priklausomai nuo alkeno skeleto struktūros, susidaro:
Anglies grandinės fragmentas ties dviguba jungtimi
Kuo tai virsta?
=CH2
C O 2
= CH – R
R– C OOH karboksirūgštis
= C–R
ô
R
ketonas R – C – R
║
O
CH 3 - SU -1 N=SU -2 H2 +2 KMn +7 O4 + 3H2SO4
CH 3 -C +3 OOH+ C +4 O 2 + 2Mn +2 SO 4 + K 2 SO 4 + 4H 2 O
2. Jei kaitinant reakcija vyksta neutralioje aplinkoje, gaunami tokie rezultatai: kalio druskos:
Grandinės fragmentas ties dviguba jungtimi
Kuo tai virsta?
=CH2
K 2 C O 3
= CH – R
R– C OO K - karboksirūgšties druska
= C–R
ô
R
ketonas R – C – R
║
O
3CH 3 SU -1 N=SU-2 N 2 +10 K MnO 4 -t 3CH 3 C +3 OO K + + 3K 2 C +4 O 3 + 10MnO 2 +4H 2 O+ K Oi
6. Oksidacija etileno deguonis, esant paladžio druskoms.
CH 2 = CH 2 + O 2 – (kat) C H 3 CHO
(acto aldehidas)
7. Chloravimas ir brominimasprie šoninės grandinės: jei reakcija su chloru vykdoma šviesoje arba aukštoje temperatūroje, šoninėje grandinėje pakeičiamas vandenilis.
CH 3 -CH = CH 2 + Cl 2 – (šviesus) CH2-CH = CH2+HCl
8. Polimerizacija:
n CH3 – CH = CH2 (-CH-CH2-) n
propileno polipropileno
CH 3
ALKENU GAVIMAS
aš . Įtrūkimai alkanai:
C 7 H 16 – (t) CH3 - CH =CH2 + C4H10
Alkeno alkanas
II. Halogenalkanų dehidrohalogeninimas veikiant alkoholio šarmo tirpalui - reakcija PAŠALINIMAS.
Zaicevo taisyklė: Vandenilio atomo abstrakcija šalinimo reakcijose vyksta daugiausia iš mažiausiai hidrinto anglies atomo.
III . Alkoholių dehidratacija esant aukštesnei temperatūrai (virš 140°C) esant vandenį šalinantiems reagentams – aliuminio oksidui arba koncentruotai sieros rūgščiai – pašalinimo reakcija.
CH 3 - CH-CH 2 -CH3 – (H 2 SO 4,t>140 o) H 2 O+CH 3 - CH=CH-CH3
Oi
(taip pat paklūsta Zaicevo taisyklei)
IV . Dihalogeninių alkanų dehalogeninimas turintys halogeno atomus prie gretimų anglies atomų, veikiant aktyviems metalams.
CH 2 Br-CH Br-CH3+ Mg CH 2 =CH-CH 3 + Mg Br 2
Galima naudoti ir cinką.
V . Alkanų dehidrogenavimas 500°C temperatūroje:
VI. Nevisiškas dienų ir alkinų hidrinimas
C 2 H 2 + H 2 (trūkumas) – (kat) C 2 H 4
Angliavandeniliai, kurių molekulėse atomai yra sujungti pavieniais ryšiais ir kurie atitinka bendrąją formulę C n H 2 n +2.
Alkano molekulėse visi anglies atomai yra sp 3 hibridizacijos būsenoje. Tai reiškia, kad visos keturios hibridinės anglies atomo orbitos yra identiškos savo forma, energija ir yra nukreiptos į lygiakraščio trikampės piramidės – tetraedro – kampus. Kampai tarp orbitų yra 109° 28′.
Aplink vieną anglies-anglies ryšį galimas beveik laisvas sukimasis, o alkano molekulės gali įgauti įvairiausių formų, kurių kampai ties anglies atomais yra arti tetraedro (109° 28′), pavyzdžiui, molekulėje. n-pentanas.

Ypač verta prisiminti ryšius alkano molekulėse. Visi ryšiai sočiųjų angliavandenilių molekulėse yra pavieniai. Sutapimas vyksta išilgai ašies,
jungiantys atomų branduolius, tai yra σ ryšiai. Anglies ir anglies jungtys yra nepolinės ir prastai poliarizuojamos. C-C jungties ilgis alkanuose yra 0,154 nm (1,54 10 - 10 m). C-H jungtys yra šiek tiek trumpesnės. Elektronų tankis šiek tiek pasislenka link labiau elektronegatyvaus anglies atomo, ty CH jungtis yra silpnai polinė.
Polinių ryšių nebuvimas sočiųjų angliavandenilių molekulėse lemia tai, kad jie blogai tirpsta vandenyje ir nesąveikauja su įkrautomis dalelėmis (jonais). Alkanams būdingiausios reakcijos yra tos, kuriose dalyvauja laisvieji radikalai.
Homologinė metano serija
Homologai- medžiagos, kurios yra panašios savo struktūra ir savybėmis ir skiriasi viena ar keliomis CH 2 grupėmis.

Izomerizmas ir nomenklatūra
Alkanams būdinga vadinamoji struktūrinė izomerija. Struktūriniai izomerai skiriasi vienas nuo kito anglies skeleto struktūra. Paprasčiausias alkanas, kuriam būdingi struktūriniai izomerai, yra butanas. 
Nomenklatūros pagrindai
1. Pagrindinės grandinės parinkimas. Angliavandenilio pavadinimo formavimas prasideda nuo pagrindinės grandinės apibrėžimo - ilgiausios anglies atomų grandinės molekulėje, kuri yra tarsi jos pagrindas.
2. Pagrindinės grandinės atomų numeracija. Pagrindinės grandinės atomams priskiriami numeriai. Pagrindinės grandinės atomų numeracija prasideda nuo to galo, kuriam pakaitalas yra arčiausiai (struktūros A, B). Jei pakaitai yra vienodu atstumu nuo grandinės galo, tai numeracija pradedama nuo to galo, kuriame jų yra daugiau (B struktūra). Jei skirtingi pakaitai yra vienodais atstumais nuo grandinės galų, tada numeracija pradedama nuo galo, prie kurio arčiausiai yra vyresnysis (struktūra D). Angliavandenilių pakaitalų eiliškumas nustatomas pagal raidės, kuria prasideda jų pavadinimas, atsiradimo abėcėlėje eilės tvarka: metilas (-CH 3), tada etilas (-CH 2 -CH 3), propilas (-CH 2 -CH 2 -CH3) ir kt.
Atkreipkite dėmesį, kad pakaitalo pavadinimas susidaro pakeičiant galūnę -an priesaga - dumblas atitinkamo alkano vardu.
3. Vardo formavimas. Pavadinimo pradžioje nurodomi skaičiai - anglies atomų, prie kurių yra pakaitai, skaičiai. Jei tam tikrame atome yra keli pakaitai, atitinkamas skaičius pavadinime kartojamas du kartus, atskiriant kableliu (2,2-). Po skaičiaus pakaitų skaičius nurodomas brūkšneliu ( di- du, trys- trys, tetra- keturi, penta- penki) ir pakaito pavadinimas (metilas, etilas, propilas). Tada be tarpų ar brūkšnelių – pagrindinės grandinės pavadinimas. Pagrindinė grandinė vadinama angliavandeniliu - homologinės metano serijos nariu ( metano CH 4, etanas C 2 H 6, propanas C 3 H 8, C 4 H 10, pentanas C 5 H 12, heksanas C 6 H 14, heptanas C 7 H 16, oktaninis skaičius C 8 H 18, nonan S 9 H 20, dekanas C10H22).

Alkanų fizinės savybės
Pirmieji keturi homologinės metano serijos atstovai yra dujos. Paprasčiausias iš jų yra metanas - bespalvės, beskonės ir bekvapės dujos ("dujų" kvapą, kurį pajutus reikia skambinti 04, lemia merkaptanų - sieros turinčių junginių, specialiai dedama į buityje naudojamą metaną, kvapas. ir pramoniniai dujų prietaisai, kad šalia jų esantys žmonės galėtų aptikti nuotėkį pagal kvapą).
Angliavandeniliai, kurių sudėtis yra nuo C 4 H 12 iki C 15 H 32, yra skysčiai; sunkesni angliavandeniliai yra kietos medžiagos. Alkanų virimo ir lydymosi temperatūra palaipsniui didėja didėjant anglies grandinės ilgiui. Visi angliavandeniliai blogai tirpsta vandenyje. Skystieji angliavandeniliai yra įprasti organiniai tirpikliai.
Alkanų cheminės savybės
Pakeitimo reakcijos.
Alkanams būdingiausios reakcijos yra laisvųjų radikalų pakeitimo reakcijos, kurių metu vandenilio atomas pakeičiamas halogeno atomu arba kokia nors grupe. Pateiksime charakteringų reakcijų lygtis halogeninimas: 
Esant halogeno pertekliui, chloravimas gali vykti toliau, iki visiško vandenilio atomų pakeitimo chloru: 
Gautos medžiagos plačiai naudojamos kaip organinės sintezės tirpikliai ir pradinės medžiagos.
Dehidrogenavimo reakcija(vandenilio gavyba).
Kai alkanai per katalizatorių (Pt, Ni, Al 2 0 3, Cr 2 0 3) perleidžiami aukštoje temperatūroje (400-600 ° C), pašalinama vandenilio molekulė ir susidaro alkenas:
Reakcijos, kurias lydi anglies grandinės sunaikinimas.
Visi sotieji angliavandeniliai dega, sudarydami anglies dioksidą ir vandenį. Dujiniai angliavandeniliai, tam tikromis proporcijomis susimaišę su oru, gali sprogti.
1. Sočiųjų angliavandenilių deginimas yra laisvųjų radikalų egzoterminė reakcija, kuri yra labai svarbi naudojant alkanus kaip kurą:
Apskritai alkanų degimo reakciją galima parašyti taip:
2. Terminis angliavandenilių skaidymas.
Procesas vyksta per laisvųjų radikalų mechanizmą. Temperatūros padidėjimas veda prie homolitinio anglies-anglies ryšio skilimo ir laisvųjų radikalų susidarymo.
Šie radikalai sąveikauja vienas su kitu, keisdami vandenilio atomą, sudarydami alkano molekulę ir alkeno molekulę:
Terminio skilimo reakcijos yra pramoninio angliavandenilių krekingo proceso pagrindas. Šis procesas yra svarbiausias naftos perdirbimo etapas.
3. Pirolizė. Kai metanas pašildomas iki 1000 °C temperatūros, prasideda metano pirolizė – skilimas į paprastas medžiagas: ![]()
Kaitinant iki 1500 °C temperatūros, galimas acetileno susidarymas:
4. Izomerizacija. Kai linijiniai angliavandeniliai kaitinami izomerizacijos katalizatoriumi (aliuminio chloridu), susidaro medžiagos su šakotu anglies karkasu: 
5. Aromatizavimas. Alkanai, kurių grandinėje yra šeši ar daugiau anglies atomų, ciklizuojasi dalyvaujant katalizatoriui, sudarydami benzeną ir jo darinius: 
Alkanai patenka į reakcijas, kurios vyksta pagal laisvųjų radikalų mechanizmą, nes visi alkano molekulėse esantys anglies atomai yra sp 3 hibridizacijos būsenoje. Šių medžiagų molekulės yra sudarytos naudojant kovalentinius nepolinius C-C (anglies-anglies) ryšius ir silpnai polinius C-H (anglies-vandenilio) ryšius. Juose nėra zonų su padidintu ar sumažėjusiu elektronų tankiu arba lengvai poliarizuojamų ryšių, t.y. tokių ryšių, kuriuose elektronų tankis gali pasislinkti veikiant išoriniams veiksniams (jonų elektrostatiniams laukams). Vadinasi, alkanai nereaguos su įkrautomis dalelėmis, nes ryšiai alkano molekulėse nenutrūksta dėl heterolitinio mechanizmo.