Tęsinys. Žiūrėkite pradžią № 15, 16/2004
5 pamoka. Hibridizacija
anglies atomų orbitalės
Kovalentinis cheminis ryšys susidaro naudojant bendras jungiamąsias elektronų poras, tokias kaip:

Suformuoti cheminį ryšį, t.y. Tik nesuporuoti elektronai gali sukurti bendrą elektronų porą su „svetimu“ elektronu iš kito atomo. Rašant elektronines formules, nesuporuoti elektronai yra po vieną orbitinėje ląstelėje.
Atominė orbita yra funkcija, apibūdinanti elektronų debesies tankį kiekviename erdvės taške aplink atomo branduolį.
Elektronų debesis yra erdvės sritis, kurioje elektroną galima aptikti su didele tikimybe. Dėl patvirtinimo elektroninė struktūra anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 r 2 elektronai. Sužadintoje būsenoje (kai energija absorbuojama) vienas iš 2 anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 s
2 elektronai gali išeiti į laisvą 2 elektronai. 2 22 elektronai. 2 2-orbitinė. Tada anglies atome atsiranda keturi nesuporuoti elektronai: Prisiminkime, kad elektroninėje atomo formulėje (pavyzdžiui, anglies 6 C – 1 2 elektronai. p anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 2) dideli skaičiai prieš raides – 1, 2 – rodo energijos lygio skaičių. Laiškai 2 elektronai. Ir

nurodo elektronų debesies (orbitalės) formą, o skaičiai dešinėje virš raidžių nurodo elektronų skaičių tam tikroje orbitoje. Visi 2 elektronai.- sferinės orbitos: anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 Antrame energijos lygyje, išskyrus 2 anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2-Yra trys orbitos 2 anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2- orbitos. Šios 2 -orbitalės yra elipsoidinės formos, panašios į hantelius, ir yra orientuotos erdvėje 90° kampu viena kitos atžvilgiu. 2, 2- Orbitos žymi 2 p x p y ir 2
p z 2 elektronai. pagal ašis, išilgai kurių yra šios orbitos. anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 Susidarius cheminiams ryšiams elektronų orbitalės įgauna tokią pačią formą. Taigi, sočiųjų angliavandenilių vienas -orbitinė ir trys- anglies atomo orbitalės sudaro keturias identiškas (hibridines)
![]()
sp -orbitinė ir trys 3 orbitos:
tai - 3 -hibridizacija. 2 elektronai. p anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 Hibridizacija – atominių orbitalių derinimas (maišymas).
) formuojantis naujoms atominėms orbitoms, vadinamoms -orbitinė ir trys 3-hibridinės orbitos pasirodo, kad yra nukreipti į tetraedro viršūnes (taisyklinga trikampė piramidė).
Atitinkamai, kampai tarp šių orbitalių yra tetraedriniai, lygūs 109°28".
Elektronų orbitalių viršūnės gali sutapti su kitų atomų orbitomis. Jei elektronų debesys persidengia išilgai linijos, jungiančios atomų centrus, tada toks kovalentinis ryšys vadinamas sigma() ryšys. Pavyzdžiui, etano molekulėje C 2 H 6 cheminis ryšys susidaro tarp dviejų anglies atomų perdengiant dvi hibridines orbitales. Tai yra ryšys. Be to, kiekvienas anglies atomas su savo trimis -orbitinė ir trys 3-orbitalės sutampa su 2 elektronai.-trijų vandenilio atomų orbitalės, sudarančios tris -ryšius.
Iš viso anglies atomui galimos trys valentinės būsenos su skirtingais hibridizacijos tipais. Išskyrus -orbitinė ir trys 3-hibridizacija egzistuoja -orbitinė ir trys 2 - ir -orbitinė ir trys- hibridizacija.
-orbitinė ir trys 2 -tai -- maišyti vieną 2 elektronai.- ir du anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2- orbitalės. Dėl to susidaro trys hibridai -orbitinė ir trys 2 -orbitalės. -orbitinė ir trysŠios 2 orbitalės yra toje pačioje plokštumoje (su ašimis, X adresu
anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2) ir yra nukreipti į trikampio viršūnes, kurių kampas tarp orbitalių yra 120°. Nehibridizuotas -orbitinė ir trys-orbita yra statmena trijų hibridų plokštumai 2-orbitalės (orientuotos išilgai ašies z anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2). Viršutinė pusė
-orbitalės yra virš plokštumos, apatinė pusė yra žemiau plokštumos. -orbitinė ir trys Tipas anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 2-anglies hibridizacija vyksta junginiuose su dviguba jungtimi: C=C, C=O, C=N. Be to, tik viena iš ryšių tarp dviejų atomų (pavyzdžiui, C=C) gali būti - jungtis. (Kitos atomo jungiamosios orbitalės nukreiptos priešingomis kryptimis.) Antroji jungtis susidaro dėl persidengiančio nehibridinio
-orbitalės abiejose linijos, jungiančios atomo branduolius, pusėse. anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 Kovalentinis ryšys, suformuotas šoniniu persidengimu -vadinamos gretimų anglies atomų orbitalės.
pi()-ryšis
|
- komunikacijos
-orbitinė ir trys-tai - Dėl mažesnio orbitos persidengimo ryšys -ryšis yra silpnesnis nei -jungtis. – tai vieno maišymas (formos ir energijos išlyginimas). s-
anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2 ir vienas -orbitinė ir trys-orbitalės sudarytų du hibridus -orbitinė ir trys- orbitos.
anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2-Orbitos yra toje pačioje linijoje (180° kampu) ir nukreiptos priešingomis kryptimis nuo anglies atomo branduolio. Du
-orbitos lieka nehibridizuotos. Jie dedami vienas kitą statmenai -orbitinė ir trys jungčių kryptys. Nuotraukoje -orbitalės rodomos išilgai ašies y
anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2, ir nehibridizuoti du 2 orbitalės yra toje pačioje plokštumoje (su ašimis p 2-orbitalės (orientuotos išilgai ašies.
-orbitalės – išilgai ašių
Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant sp
Ryšys tarp tokių anglies atomo parametrų kaip prisijungusių grupių skaičius, hibridizacijos tipas ir susidariusių cheminių jungčių tipai parodytas 4 lentelėje.
4 lentelė
Kovalentiniai anglies ryšiai
| Grupių skaičius, susiję su anglimi |
Tipas hibridizacija |
Tipai dalyvaujantys cheminiai ryšiai |
Sudėtinių formulių pavyzdžiai |
|---|---|---|---|
| 4 | Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant 3 | Keturi – jungtys | |
| 3 | Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant 2 | Trys - jungtys ir vienas - ryšys |
|
| 2 | Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant | Du - jungtys ir du – jungtys |
H–CC–H |
Pratimai.
1. Kurie atomų elektronai (pavyzdžiui, anglies ar azoto) vadinami nesuporuotais?
2. Ką reiškia sąvoka „bendrosios elektronų poros“ junginiuose su kovalentiniu ryšiu (pavyzdžiui, CH 4 arba H2S )?
3. Kokios elektroninės atomų būsenos (pavyzdžiui, C arba N ) vadinami pagrindiniais, o kurie sužadinami?
4. Ką reiškia skaičiai ir raidės elektroninėje atomo formulėje (pavyzdžiui, C arba N )?
5. Kas yra atominė orbita? Kiek orbitų yra antrajame C atomo energijos lygyje? ir kuo jie skiriasi?
6. Kuo hibridinės orbitos skiriasi nuo pradinių orbitų, iš kurių jos buvo suformuotos?
7. Kokie anglies atomo hibridizacijos tipai žinomi ir iš ko jie susideda?
8. Nubraižykite vienos iš anglies atomo elektroninių būsenų orbitų erdvinio išsidėstymo paveikslą.
9. Kaip vadinami cheminiai ryšiai ir ką?-Nurodykite-Ir
10. jungtys jungtyse:

Toliau nurodytų junginių anglies atomų atveju nurodykite: a) hibridizacijos tipą; b) jo cheminių ryšių tipai; c) ryšio kampai.
Atsakymai į 1 temos pratimus
1. 5 pamoka Elektronai, kurie orbitoje yra po vieną, vadinami nesuporuoti elektronai
2. . Pavyzdžiui, sužadinto anglies atomo elektronų difrakcijos formulėje yra keturi nesuporuoti elektronai, o azoto atomas turi tris: Du elektronai dalyvauja formuojant vieną cheminis ryšys , paskambino bendra elektronų pora

3. . Paprastai prieš susidarant cheminei jungtiei vienas iš šios poros elektronų priklausė vienam atomui, o kitas elektronas priklausė kitam atomui: 2 elektronai. 2 , 22 elektronai. 2 , 2-orbitinė. Tada anglies atome atsiranda keturi nesuporuoti elektronai: 2 , 32 elektronai. 2 , 3-orbitinė. Tada anglies atome atsiranda keturi nesuporuoti elektronai: 2 , 42 elektronai. 2 , 3Atomo elektroninė būsena, kurioje stebima elektronų orbitalių užpildymo tvarka: 1 2 , 4-orbitinė. Tada anglies atome atsiranda keturi nesuporuoti elektronai: d 2 ir kt., vadinami pagrindinė sąlyga . IN
susijaudinusi būsena
5.
Atominė orbita yra funkcija, apibūdinanti elektronų debesies tankį kiekviename erdvės taške aplink tam tikro atomo branduolį. Antrajame anglies atomo energijos lygyje yra keturios orbitos - 2 2 elektronai., 2p x, 2- Orbitos žymi 2,
2p y. Šios orbitos skiriasi:
a) elektronų debesies forma ( 2 elektronai.- kamuolys, anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2– hantelis);
b) anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2-orbitalės turi skirtingą orientaciją erdvėje – išilgai viena kitai statmenų ašių x, -orbitalės rodomos išilgai ašies p 2-orbitalės (orientuotos išilgai ašies, jie yra pažymėti p x, - Orbitos žymi 2,
p y.
6.
Hibridinės orbitalės skiriasi nuo originalių (ne hibridinių) orbitalių forma ir energija. Pavyzdžiui, 2 elektronai.-orbital - sferos forma, anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2– simetriška aštunta figūra, Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant-hibridinė orbita – asimetrinė aštunta figūra.
Energijos skirtumai: E(2 elektronai.) < E(-orbitinė ir trys) < E(anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2). Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant Taigi, 2 elektronai.-
-orbita – orbita, suvidurkinta pagal formą ir energiją, gaunama sumaišius originalą -orbitinė. Tada anglies atome atsiranda keturi nesuporuoti elektronai: Ir
7. - orbitalės. Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant 3 , Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant Anglies atomui žinomi trys hibridizacijos tipai: Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant (2 ir).
9.
žiūrėkite 5 pamokos tekstą
-ryšis - kovalentinis ryšys, susidarantis orbitalių persidengiant išilgai linijos, jungiančios atomų centrus. anglies atomas ir šio elemento valentingumas vartoja anglies atomo sužadinimo sąvoką. Įprastoje (nesužadintoje) būsenoje anglies atomas turi du nesuporuotus 2-ryšis – kovalentinis ryšys, susidarantis šoniniu persidengimu
-orbitalės abiejose linijos, jungiančios atomų centrus, pusėse.
-Ryšiai rodomi antroje ir trečioje eilutėmis tarp sujungtų atomų.
1 puslapis Valencijos teorija suvaidino lemiamą vaidmenį kuriant chemijos teoriją apskritai ir organinė chemija
ypač. Remdamasis valentingumo teorija, Kekule padarė prielaidą, kad anglies atomas yra keturiavalentis, ir 1858 m., remdamasis šia prielaida, bandė įsivaizduoti paprasčiausių organinių molekulių ir radikalų struktūrą. Tais pačiais 1858 m. škotų chemikas Archibaldas Scottas Cooperis (1831–1892) pasiūlė atomus (arba ryšius, kaip jie paprastai vadinami) jungiančias jėgas pavaizduoti brūkšneliais. Po to, kai buvo "sukurta" pirmoji organinė molekulė, tapo visiškai aišku, kodėl organinės molekulės yra daug didesnės ir sudėtingesnės nei neorganinės molekulės.
Pagal Kekule idėjas, anglies atomai gali jungtis vienas prie kito naudodami vieną ar daugiau iš keturių valentinių ryšių, sudarydami ilgas grandines – tiesias arba šakotas. Matyt, jokie kiti atomai neturi tokio nuostabaus gebėjimo, kokį turi anglis.
Padidinus anglies atomų skaičių, šią seką galima tęsti beveik neribotą laiką. Į angliavandenilių grandinę pridėjus deguonies (dvi valentiniai ryšiai) arba azoto (trys valentiniai ryšiai), galime įsivaizduoti etilo alkoholio (C2H6O) ir metilamino (CH5N) molekulių struktūrines formules: 
Darant prielaidą, kad tarp gretimų atomų gali būti du ryšiai (dviguba jungtis) arba trys ryšiai (triguba jungtis), galima pavaizduoti tokių junginių kaip etilenas (C2H4), acetilenas (C2H2), metilcianidas (C2H3N) struktūrines formules. ), acetonas (C3H6O) ir acto rūgštis(C2H4O2): 
Naudingumas struktūrines formules buvo toks akivaizdus, kad daugelis organinių chemikų juos iškart priėmė. Jie paskelbė, kad visi bandymai pavaizduoti organines molekules kaip struktūras, sukurtas iš radikalų, yra visiškai pasenę. Dėl to buvo nustatyta, kad rašant junginio formulę būtina parodyti jo atominę struktūrą.
Tai naudojo rusų chemikas Aleksandras Michailovičius Butlerovas (1823-1886). nauja sistema struktūrines formules jo sukurtoje organinių junginių sandaros teorijoje. Praėjusio amžiaus 60-aisiais jis parodė, kaip naudojant struktūrines formules galima aiškiai paaiškinti izomerų egzistavimo priežastis (žr. 5 skyrių). Pavyzdžiui, etilo alkoholis ir dimetilo eteris turi tą pačią empirinę formulę C2H6O, tačiau šių junginių struktūrinės formulės labai skiriasi: 
todėl nenuostabu, kad pasikeitus atomų išsidėstymui atsiranda du labai skirtingų savybių rinkiniai. Etilo alkoholyje vienas iš šešių vandenilio atomų yra prijungtas prie deguonies atomo, o dimetilo eteryje visi šeši vandenilio atomai yra prijungti prie anglies atomų. Deguonies atomas sulaiko vandenilio atomą silpniau nei anglies atomas, todėl pridedamas natrio metalas etilo alkoholis, pakeičia vandenilį (šeštadalį viso). Natris, pridėtas į dimetilo eterį, visiškai neišstumia vandenilio. Taigi, rengiant struktūrines formules, galima vadovautis cheminės reakcijos, o struktūrinės formulės savo ruožtu gali padėti suprasti reakcijų esmę.
Butlerovas ypač daug dėmesio skyrė vienai izomerizmo rūšiai, vadinamai tautomerija (dinamine izomerija), kurioje kai kurios medžiagos visada veikia kaip dviejų junginių mišiniai. Jei vienas iš šių junginių yra išskirtas gryna forma, jis iš karto iš dalies virsta kitu junginiu. Butlerovas parodė, kad tautomeriją sukelia spontaniškas vandenilio atomo perėjimas iš deguonies atomo į gretimą anglies atomą (ir atvirkščiai).
Norint visiškai įrodyti struktūrinių formulių sistemos pagrįstumą, reikėjo nustatyti benzeno, angliavandenilio, turinčio šešis anglies atomus ir šešis vandenilio atomus, struktūrinę formulę. Iš karto to padaryti nebuvo įmanoma. Atrodė, kad nėra tokios struktūrinės formulės, kuri, nors ir atitiktų valentingumo reikalavimus, tuo pačiu paaiškintų didesnį junginio stabilumą. Pirmosios benzeno struktūrinių formulių versijos buvo labai panašios į kai kurių angliavandenilių formules – labai nestabilūs junginiai ir cheminėmis savybėmis nepanašūs į benzeną.
Amoniako molekulėje elektronai aplink azoto atomą taip pat yra sp 3 hibridizuotose orbitose. Panašus vaizdas stebimas ir vandens molekulės atveju.
NH3H2O 
Su sp 3 orbitine hibridizacija anglies atomas gali sudaryti tik paprastus s ryšius. Kai dvigubą ryšį sudaro anglis, naudojama sp 2 hibridizacija (7 pav.). Šiuo atveju hibridizacijoje dalyvauja viena 2s ir dvi 2p orbitalės, o viena 2p orbita lieka nehibridinė. Sp 2 orbitalės yra lygiavertės, jų ašys yra viena plokštumos ir sudaro 120° kampą viena su kita; nehibridinė 2p orbitalė yra statmena hibridinių orbitų plokštumai.
Ryžiai. 7 2 elektronai. Ir
du2 -orbitinė. Tada anglies atome atsiranda keturi nesuporuoti elektronai: orbitalės suformuoti tris sp 2- hibridinės orbitos.

Kai anglis sudaro trigubą jungtį, naudojama sp hibridizacija. Šiuo atveju hibridizacijoje dalyvauja viena 2s ir viena p orbitalė, o dvi 2p orbitalės lieka nehibridinės (8 pav.).

Ryžiai. 8 Vieno hibridizavimo matematinės procedūros vaizdas 2 2 elektronai. ir od
nojus2 -orbitinė. Tada anglies atome atsiranda keturi nesuporuoti elektronai: orbitalės sudarytų dvi sp- hibridinės orbitos.

acetilenas
13 pratimas. Apibūdinkite ryšius tarp atomų (a) etano rūgšties, (b) etanalio, etanamido molekulėse pagal atomų orbitales ir numatykite visus ryšio kampus.
Atsakymas(A) 

Ryšio ilgis ir energija
Bendros elektronų poros laiko du surištus atomus tam tikru atstumu, vadinamu ryšio ilgis. Ryšio ilgis tarp atomų yra maždaug lygus jų kovalentinių spindulių (r) sumai (2 lentelė), todėl galima apskaičiuoti bet kokių ryšių ilgį. l A - B = r A + r B
2 lentelė
Kai kurių elementų kovalentiniai spinduliai (r), Å
Pvz. 14.V Apskaičiuokite (a) C-H, (b) C-C, (c) C=C ir (d) CºС jungties ilgį,
(e.) C-O, (e) C=O, (g) C-Cl, ... Kovalentinių spindulių reikšmės pateiktos lentelėje. 1.2.
Atsakymas(a) 0,77 + 0,37 = 1,14 Å, (b) 2 x 0,77 = 1,54 Å, (c) 2 x 0,67 = 1,34 Å, (d) ...
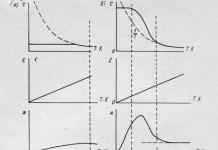
Apskritai, didėjant ryšių tarp dviejų atomų skaičiui, jų ilgis mažėja. Atrodo, kad kai kuriose molekulėse anglies ir anglies jungties ilgis yra tarpinis tarp viengubo (1,54Å) ir dvigubo (1,33Å) jungčių ilgio. Šiuo atveju kalbame apie bendravimo tvarką. Apytikslę tokio ryšio eilės reikšmę galima rasti grafiškai.
Energija – tai gebėjimas dirbti. Judantis objektas turi kinetinė energija. Jei objektai vienas kitą traukia arba atstumia, jie turi potencialią energiją. Du rutuliai, sujungti spyruokle, gali turėti potencialią energiją, jei spyruoklė yra įtempta arba suspausta. Jei spyruoklė yra ištempta, tada tarp rutuliukų yra patraukli energija, o jei ji suspausta, tada yra atstūmimo energija. Jei duosi pavasarį
atsipalaiduokite, tada abiem atvejais potenciali kamuoliukų energija pavirs kinetine energija.
Cheminė energija yra potencialios energijos forma. Jis egzistuoja, nes skirtingos molekulių dalys traukia arba atstumia viena kitą. Kuo daugiau potencialios energijos turi objektas, tuo jis mažiau stabilus. . Reakcijų metu cheminė energija gali išsiskirti kaip šilumos energija.
Beveik neįmanoma nustatyti absoliučios molekulės energijos kiekio. Ir taip mes kalbame apie tik apie santykinė potenciali energija molekulės Molekulių santykinę potencialią energiją patogu pavaizduoti santykinės entalpijos pavidalu Reagentų ir produktų santykinių entalpijų skirtumas žymimas DH°. Už egzoterminės reakcijos DH° turi neigiamą reikšmę, o endoterminė – teigiamą. Kai iš atomų susidaro vandenilio molekulė, išsiskiria šiluma, o kai vandenilio molekulė skyla į atomus, turi būti tiekiama šiluma:
H· + H· ¾® H¾H DH° = –104 kcal/mol (–435 kJ/mol)
Н-Н ¾® H· + H· DH° = +104 kcal/mol (+435 kJ/mol)
1 kcal = 4,184 kJ
Kai susidaro chloro molekulė, iš atomų išsiskiria mažiau energijos nei susidarius vandenilio molekulei:
Сl· + Cl· ¾® Сl¾Cl DH° = –58 kcal/mol
Cl-Cl ¾® Cl· + Cl· DH° = +58 kcal/mol
3 lentelė
Ryšių energijos, kcal/mol.
Jei palygintume viengubo, dvigubo ir trigubo anglies-anglies jungčių energijas, pamatytume, kad dvigubos jungties energija yra mažesnė nei du kartus, o trigubo jungties energija yra mažesnė nei tris kartus didesnė už viengubos jungties energiją. S-S jungtys. Todėl daugybinių ryšių pavertimas paprastomis, pavyzdžiui, polimerizacijos metu, lydimas energijos išsiskyrimo.

Ryšio energija (E), kcal/mol 88 146 200
Kalbant apie kitus elementus, dažniausiai pastebimas priešingas vaizdas. Pavyzdžiui, pereinant nuo viengubų prie dvigubų ir trigubų azoto-azoto ryšių, jų energija padvigubėja ir patrigubėja.

Ryšio energija (E), kcal/mol 38 100 226
Taigi anglies grandinių susidarymas naudingas anglims, o dviatominių molekulių susidarymas – azotui. Azoto-azoto grandines gali sudaryti ne daugiau kaip keturi atomai.
Organinė chemija yra anglies atomo chemija. Organinių junginių skaičius yra dešimtis kartų didesnis nei neorganinių, o tai galima tik paaiškinti anglies atomo ypatybės :
a) jis yra elektronegatyvumo skalės vidurys ir antrasis periodas, todėl jam nenaudinga atiduoti savuosius ir priimti svetimus elektronus bei įgyti teigiamą ar neigiamą krūvį;
b) ypatinga elektronų apvalkalo struktūra – nėra elektronų porų ir laisvųjų orbitalių (yra tik dar vienas panašios sandaros atomas - vandenilis, tikriausiai todėl anglis ir vandenilis sudaro tiek daug junginių - angliavandenilių).
Anglies atomo elektroninė struktūra
C – 1s 2 2s 2 2p 2 arba 1s 2 2s 2 2p x 1 2p y 1 2p z 0
Grafine forma:
Anglies atomas sužadintoje būsenoje turi tokią elektroninę formulę:
*C – 1s 2 2s 1 2p 3 arba 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Ląstelių pavidalu: 
S- ir p-orbitalių forma


Atominė orbita - erdvės sritis, kurioje greičiausiai bus aptiktas elektronas, su atitinkamais kvantiniais skaičiais.
Tai trimatis elektronų „kontūrinis žemėlapis“, kuriame bangų funkcija nustato santykinę tikimybę rasti elektroną tame konkrečiame orbitos taške.
Santykiniai atominių orbitų dydžiai didėja didėjant jų energijai ( pagrindinis kvantinis skaičius- n), o jų formą ir orientaciją erdvėje lemia kvantiniai skaičiai l ir m. Orbitose esantys elektronai apibūdinami sukimosi kvantiniu skaičiumi. Kiekvienoje orbitoje gali būti ne daugiau kaip 2 elektronai su priešingais sukiniais.
Formuodamas ryšius su kitais atomais, anglies atomas transformuoja savo elektroninį apvalkalą taip, kad susiformuotų stipriausi ryšiai ir dėl to išsiskiria kuo daugiau energijos, o sistema įgauna didžiausią stabilumą.
Norint pakeisti atomo elektroninį apvalkalą, reikia energijos, kuri vėliau kompensuojama susidarant stipresniems ryšiams.
Elektronų apvalkalo transformacija (hibridizacija) gali būti daugiausia 3 tipų, priklausomai nuo atomų, su kuriais anglies atomas sudaro ryšius, skaičiaus.
Hibridizacijos tipai:
Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant 3 – atomas sudaro ryšius su 4 gretimais atomais (tetraedrinė hibridizacija):
Elektroninė sp 3 formulė – hibridinis anglies atomas:
*С –1s 2 2(sp 3) 4 ląstelių pavidalu 

Ryšio kampas tarp hibridinių orbitų yra ~109°.
Stereocheminė anglies atomo formulė:

Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant 2 – Hibridizacija (valentinė būsena)– atomas sudaro ryšius su 3 gretimais atomais (trigonalinė hibridizacija):
Elektroninė sp 2 formulė – hibridinis anglies atomas:
*С –1s 2 2(sp 2) 3 2p 1 ląstelių pavidalu 
Ryšio kampas tarp hibridinių orbitų yra ~120°.
Stereocheminė sp 2 formulė – hibridinis anglies atomas:

Anglies-anglies triguba jungtis CC susideda iš -ryšio, susidariusio persidengiant– Hibridizacija (valentinė būsena) – atomas sudaro ryšius su 2 gretimais atomais (tiesinė hibridizacija):
Elektroninė sp – hibridinio anglies atomo formulė:
*С –1s 2 2(sp) 2 2p 2 ląstelių pavidalu 
Ryšio kampas tarp hibridinių orbitų yra ~180°.
Stereocheminė formulė:

S-orbitalė dalyvauja visų tipų hibridizacijoje, nes jis turi minimalią energiją.
Elektronų debesies restruktūrizavimas leidžia susidaryti kuo stipresniems ryšiams ir minimaliai atomų sąveikai susidariusioje molekulėje. Tuo pačiu metu hibridinės orbitalės gali būti netapačios, bet jungties kampai gali skirtis, pavyzdžiui, CH2Cl2 ir CCl4
2. Kovalentiniai ryšiai anglies junginiuose
Kovalentiniai ryšiai, savybės, formavimo būdai ir priežastys – mokyklinė programa.
Leisk man tik priminti:
1. Švietimo komunikacijos Tarp atomų galima laikyti jų atominių orbitalių persidengimo rezultatą, ir kuo jis efektyvesnis (kuo didesnis persidengimo integralas), tuo stipresnis ryšys.
Apskaičiuotais duomenimis, santykinis atominių orbitų Srel sutapimo efektyvumas didėja taip:

Todėl naudojant hibridines orbitales, tokias kaip sp 3 anglies orbitalės, ryšiams su keturiais vandenilio atomais sudaryti, ryšiai yra stipresni.
2. Kovalentiniai ryšiai anglies junginiuose susidaro dviem būdais:
A)Jei dvi atominės orbitos persidengia išilgai savo pagrindinių ašių, gaunama jungtis vadinama - σ ryšys.
Geometrija. Taigi, kai metane susidaro ryšiai su vandenilio atomais, keturios hibridinės anglies atomo sp 3 ~ orbitalės persidengia su keturių vandenilio atomų s-orbitalės, sudarydamos keturias vienodas stiprias σ jungtis, esančias 109°28" kampu kiekvienai. kita (standartinis tetraedrinis kampas) Panaši griežtai simetriška tetraedrinė struktūra taip pat atsiranda, pavyzdžiui, susidarant CCl 4, jei atomai, sudarantys ryšius su anglimi, nėra vienodi, pvz., CH 2 C1 2 atveju, erdvinė; struktūra šiek tiek skirsis nuo visiškai simetriškos, nors iš esmės išlieka tetraedrinė.
σ jungties ilgis tarp anglies atomų priklauso nuo atomų hibridizacijos ir mažėja pereinant nuo sp 3 - hibridizacijos į sp. Tai paaiškinama tuo, kad s orbitalė yra arčiau branduolio nei p orbitalė, todėl kuo didesnė jos dalis hibridinėje orbitoje, tuo ji trumpesnė, taigi ir susiformuoja trumpesnis ryšys.
B) Jei dvi atominės -orbitinė. Tada anglies atome atsiranda keturi nesuporuoti elektronai: -orbitos, esančios lygiagrečiai viena kitai, atlieka šoninį persidengimą virš ir žemiau plokštumos, kurioje yra atomai, tada susidariusi jungtis vadinama - π (pi) - bendravimas


Šoninis sutapimas atominės orbitalės yra mažiau efektyvios nei persidengimas išilgai pagrindinės ašies, taigi π - ryšiai yra ne tokie stiprūs σ - jungtys. Tai visų pirma pasireiškia tuo, kad dvigubos anglies-anglies jungties energija yra mažesnė nei dvigubai didesnė už vienos jungties energiją. Taigi, C-C jungties energija etane yra 347 kJ/mol, o C = C jungties energija etene yra tik 598 kJ/mol, o ne ~ 700 kJ/mol.
Dviejų atominių 2p orbitalių šoninio persidengimo laipsnis , taigi ir jėgos π -ryšiai yra didžiausi, jei yra du anglies atomai ir keturi su jais susiję atomai išsidėstę griežtai vienoje plokštumoje, t.y. jei jie koplanarinis , nes tik šiuo atveju atominės 2p orbitalės yra tiksliai lygiagrečios viena kitai ir todėl gali maksimaliai sutapti. Bet koks nukrypimas nuo koplaninės būsenos dėl sukimosi aplinkui σ - ryšys, jungiantis du anglies atomus, sumažins persidengimo laipsnį ir atitinkamai sumažės stiprumas π -ryšis, kuris taip padeda išlaikyti molekulės lygumą.
Rotacija aplink anglies-anglies dviguba jungtis neįmanoma.
Paskirstymas π -elektronai virš ir žemiau molekulės plokštumos reiškia egzistavimą neigiamo krūvio sritis, paruoštas sąveikauti su bet kokiais elektronų trūkumo reagentais.
Deguonies, azoto ir kt. atomai taip pat turi skirtingas valentines būsenas (hibridizaciją), o jų elektronų poros gali išsidėstyti tiek hibridinėje, tiek p-orbitalėje.
Anglis (C) yra šeštasis periodinės lentelės elementas, kurio atominė masė yra 12. Elementas yra nemetalas, jo izotopas yra 14 C. Anglies atomo struktūra yra visos organinės chemijos pagrindas, nes visos organinės medžiagos apima anglies molekules. .
anglies atomas
Anglies padėtis periodinėje Mendelejevo lentelėje:
- šeštasis serijos numeris;
- ketvirta grupė;
- antrasis periodas.

Ryžiai. 1. Anglies padėtis periodinėje lentelėje.
Remiantis lentelės duomenimis, galime daryti išvadą, kad elemento anglies atomo struktūra apima du apvalkalus, ant kurių yra šeši elektronai. Sudėtyje esančios anglies valentingumas organinės medžiagos, yra pastovus ir lygus IV. Tai reiškia, kad išoriniame elektroniniame lygyje yra keturi elektronai, o vidiniame – du.
Iš keturių elektronų du užima sferinę 2s orbitą, o likę du – 2p hantelių orbitą. Sužadintoje būsenoje vienas elektronas iš 2s orbitos juda į vieną iš 2p orbitų. Kai elektronas juda iš vienos orbitos į kitą, energija išeikvojama.
Taigi, sužadintas anglies atomas turi keturis nesuporuotus elektronus. Jo konfigūraciją galima išreikšti formule 2s 1 2p 3. Tai leidžia suformuoti keturis kovalentiniai ryšiai su kitais elementais. Pavyzdžiui, metano molekulėje (CH4) anglis sudaro ryšius su keturiais vandenilio atomais – vienas ryšys tarp vandenilio ir anglies orbitalių ir trys ryšiai tarp anglies p orbitalių ir vandenilio s orbitalių.
Anglies atomo struktūra gali būti pavaizduota kaip +6C) 2) 4 arba 1s 2 2s 2 2p 2.

Ryžiai. 2. Anglies atomo sandara.
Fizinės savybės
Anglis gamtoje randama kaip akmenys. Yra žinomi keli alotropinės modifikacijos anglis:
- grafitas;
- deimantas;
- karabinas;
- anglis;
- suodžiai.
Visos šios medžiagos skiriasi savo kristalinės gardelės struktūra. Dauguma kietas- deimantas - turi kubinę anglies formą. Aukštoje temperatūroje deimantas virsta šešiakampės struktūros grafitu.

Ryžiai. 3. Kristalinės grotelės grafitas ir deimantas.
Cheminės savybės
Anglies atominę struktūrą ir gebėjimą prijungti keturis kitos medžiagos atomus lemia cheminės savybės elementas. Anglis reaguoja su metalais, sudarydama karbidus:
- Ca + 2C → CaC 2;
- Cr + C → CrC;
- 3Fe + C → Fe 3 C.
Taip pat reaguoja su metalų oksidais:
- 2ZnO + C → 2Zn + CO 2;
- PbO + C → Pb + CO;
- SnO 2 + 2C → Sn + 2CO.
Esant aukštai temperatūrai, anglis reaguoja su nemetalais, ypač vandeniliu, sudarydama angliavandenilius:
C + 2H 2 → CH 4.
Su deguonimi susidaro anglis anglies dvideginio ir anglies monoksidas:
- C + O2 → CO 2;
- 2C + O 2 → 2СО.
Sąveikaujant su vandeniu susidaro ir anglies monoksidas.