Тодорхой үйл явцын талаар ярилцаж буй олон хүмүүсээс "Энэ бол физик!" эсвэл "Энэ бол хими!" Үнэн хэрэгтээ хүн амьдралынхаа туршид тохиолддог байгаль, өдөр тутмын амьдрал, сансар огторгуйд тохиолддог бараг бүх үзэгдлийг эдгээр шинжлэх ухааны аль нэгэнд хамааруулж болно. Физик үзэгдэл нь химийн үзэгдлээс хэрхэн ялгаатай болохыг ойлгох нь сонирхолтой юм.
Шинжлэх ухааны физик
Физик үзэгдлүүд нь химийн үзэгдлүүдээс юугаараа ялгаатай вэ гэсэн асуултад хариулахын өмнө эдгээр шинжлэх ухаан тус бүрээр ямар объект, процессыг судалж байгааг ойлгох шаардлагатай. Физикээс эхэлье.
Та сонирхож магадгүй:
Эртний Грек хэлнээс "фисис" гэдэг үгийг "байгаль" гэж орчуулдаг. Өөрөөр хэлбэл, физик бол объектын шинж чанар, янз бүрийн нөхцөлд тэдний зан байдал, төлөв хоорондын өөрчлөлтийг судалдаг байгалийн шинжлэх ухаан юм. Физикийн зорилго нь байгалийн үйл явцыг зохицуулдаг хуулиудыг тодорхойлох явдал юм. Энэ шинжлэх ухааны хувьд судалж буй объект нь юунаас бүрдэх, химийн найрлага нь ямар байх нь хамаагүй, түүний хувьд зөвхөн дулаан, механик хүч, даралт гэх мэт зүйлд өртөх тохиолдолд тухайн объект хэрхэн ажиллах нь чухал юм. .
Физик нь оптик, механик, термодинамик, атомын физик гэх мэт үзэгдлийн тодорхой хүрээг судалдаг хэд хэдэн хэсэгт хуваагддаг. Үүнээс гадна олон бие даасан шинжлэх ухаан нь физик, жишээлбэл, одон орон, геологи гэх мэт бүхэлдээ хамааралтай байдаг.
Шинжлэх ухааны хими

Физикээс ялгаатай нь хими бол бодисын бүтэц, найрлага, шинж чанар, түүний үр дүнд үүссэн өөрчлөлтийг судалдаг шинжлэх ухаан юм. химийн урвал. Өөрөөр хэлбэл, химийн судлах объект нь химийн найрлага, тодорхой үйл явцын явцад түүний өөрчлөлт юм.
Хими нь физикийн нэгэн адил олон хэсэгтэй бөгөөд тус бүр нь тодорхой анги судалдаг химийн бодисууджишээлбэл, органик ба органик бус, био болон цахилгаан химийн. Анагаах ухаан, биологи, геологи, тэр ч байтугай одон орон судлалын судалгаа нь энэ шинжлэх ухааны ололтод тулгуурладаг.
Эртний Грекийн гүн ухаантнууд химийн шинжлэх ухааныг шинжлэх ухаан гэж хүлээн зөвшөөрдөггүй байсан нь туршилтын төвлөрөл, түүнчлэн түүнийг хүрээлсэн псевдо-шинжлэх ухааны мэдлэгийн улмаас (орчин үеийн хими нь алхимиас "төрсөн" гэдгийг санаарай). Сэргэн мандалтын үеэс л Английн химич, физикч, гүн ухаантан Роберт Бойлийн ажлын ачаар хими нь бүрэн хэмжээний шинжлэх ухаан гэж ойлгогдож эхэлсэн.
Физик үзэгдлийн жишээ

Та физик хуулийг дагаж мөрддөг асар олон тооны жишээг өгч болно. Жишээлбэл, сургуулийн сурагч бүр 5-р ангидаа физик үзэгдэл болох зам дээрх машины хөдөлгөөнийг мэддэг. Энэ тохиолдолд энэ машин юунаас бүрдэх, хөдлөхийн тулд хаанаас эрчим хүч авах нь хамаагүй, цорын ганц чухал зүйл бол сансар огторгуйд (замын дагуу) тодорхой траекторийн дагуу тодорхой хурдтайгаар хөдөлдөг. Түүнээс гадна машиныг хурдасгах, тоормослох үйл явц нь бас физик юм. Машин болон бусад хатуу биетүүдийн хөдөлгөөнийг физикийн "Механик" хэсэгт авч үздэг.
I. ...БӨЛӨӨ ЕРӨНХИЙДӨӨ II. ШИНЖЛЭХ УХААНЫ ТУХАЙ III. ХИМИЙН ТУХАЙ Хими муу юу? Анагаах ухаан бол химийн эх мөн үү? Аналитик химигүй ертөнц. Апокалипсис? Шүүхийн химийн шинжилгээгүйгээр хэр олон гэмт хэрэг шийдэгдэхгүй вэ? Агрохимийн бодисгүйгээр бид хаана хүрэх вэ? Астрохими нь амьдралын нууцыг илчлэх болов уу? Биохими яагаад хэрэгтэй вэ? Химийн хичээлээс галургид юу байдаг вэ? Геохими үнэхээр түүхий эдийн “донтолтын” үндэс мөн үү? Гидрохими бидэнд шинэ "алт" өгөх үү? Хүний эд эс яагаад будагдсан байдаг вэ? Гистохими ба цитохими. Хорт хавдар, ДОХ, ханиад... Аль шинжлэх ухаан үнэхээр эсрэг байдаг вэ? Дархлаа хими Химийн тооцоолол хийх боломжтой юу? Квантын хими. Цэлцэгнүүлсэн мах нь хүнтэй юугаараа төстэй вэ? Коллоид хими. Католик шашин хэзээ салахыг хүлээн зөвшөөрдөг вэ? Гоо сайхны химийн талаар. Дэлхий хүмүүст яагаад сансрын химийн бодис хэрэгтэй вэ? Кристал химигүйгээр орчин үеийн мэдээллийн талбар байж болох уу? Санта Клаус химич, эмч нарт хэрхэн тусалдаг вэ? Криохими ба крио эмчилгээ. Лазер хими - үүнийг юугаар иддэг вэ? Ой модгүйгээр тэмцэх боломжтой юу? Модны хими. Соронзон дотор амьдрал байж болох уу? Магнетохими. Эмийн хими ба эмгэг судлалын хооронд ямар хамааралтай вэ? Металлургийн химийн хичээлээс юугаараа ялгаатай вэ? Бидэнд механик хими яагаад хэрэгтэй байна вэ? Бид богино долгионы химийн бодистой хаана тааралддаг вэ? Нанохими – Химийн хэмжээ хязгаар? Хэн биднийг удирдаж байна вэ? Нейрохими. Органик бус хими: хуучин эсвэл шинэ шинжлэх ухаан уу? Газрын тос эсвэл түүний боловсруулсан бүтээгдэхүүнийг зарах уу? Нефтийн хими. Чи, би, тэр, тэр хамтдаа... органик хими? Магадгүй бид хэзээ нэгэн цагт сүнсийг нэгтгэх болов уу? Органик синтез. Боломжтой юу урт удаан амьдралчөлөөт бус бодис дахь чөлөөт бөөмс? Физик органик хими. "Пегниохими" гэж юу вэ? Христийн шавь нь нефтийн химийн чиглэлээр юугаараа ижил төстэй вэ? Бид чулуун зэвсгийн үе рүү буцах уу? Петурги. Бид чулуун зэвсгийн үе рүү буцах уу? Петурги. Бид гал тогооны өрөөнд химийн бодис хэр их хэрэглэдэг вэ? Хүнсний хими. Плазмын хими нь хүмүүст эсвэл Бурханд зориулагдсан уу? Дайны эсвэл энх тайвны төлөөх химийн хэрэглээ юу? Электрон ямар өнгөтэй вэ? Цацрагийн хими. Цацраг идэвхит үзэгдлийг хэн нээсэн бэ? Цацраг идэвхжил хэр аюултай вэ? Уйтгартай энерги байдаг уу? Радиохими. Стереохими гэж юу вэ? Аль нь илүү дээр вэ: үер эсвэл метаны сүйрэл? Супрамолекулын хими. D.I юу ярьсан бэ? Менделеев докторын ажилдаа? Термохими. Техникийн хими - салгах үндэслэлтэй юу? Топохими нь гадаргуугийн хими мөн үү? Магадгүй бид нүүрс түлж болохгүй гэж үү? Нүүрсний хими. Бидний эмчилгээ юу вэ? Фармакохими. Фемтохими нь шинэ зүйл мөн үү? Толгойг нь цохих нь гэмт хэрэг үү, эсвэл... физик хими? Анхны фитохимичид хэн бэ? Дэлхий дээр хүчилтөрөгч хаанаас ирдэг вэ, алсын хараа нь юу вэ? Фотохими. Өндөр энергийн хими нь ердийн химийн хичээлээс юугаараа ялгаатай вэ? Хурдлалгүйгээр амьдрах боломжтой юу? Химийн кинетик ба катализ. Химийн физик нь физик химигээс юугаараа ялгаатай вэ? Энгийн хүний өгөгч гэж юу вэ? Химийн технологи. Дайнд химийн ямар үүрэг гүйцэтгэдэг вэ? Химийн зэвсэг. Худалдааны уут, дугуй, удамшлын агентууд юунаас бүтдэг вэ? Макромолекулын нэгдлүүдийн хими. Цайг нэгтгэх боломжтой юу? Байгалийн нэгдлүүдийн хими. Яагаад бидэнд силикат хими хэрэгтэй байна вэ? Хатуу төлөвт хими нь гетеро хэвийн үү гэсэн асуултад хэрхэн хариулдаг вэ? Органик элементийн нэгдлүүдийн хими юу вэ? Цахилгаан хими, яагаад бидэнд хэрэгтэй байна вэ? Үелэх системийн хил хязгаарыг юу шахдаг вэ? Цөмийн хими. Их сургуульгүйгээр химийн чиглэлээр яаж орох вэ? Аль нь химийн элементОросын нэрээр нэрлэсэн үү? Химийн элементүүдийн нэрсийн талаар.
Фонтын хэмжээ: - +
Химийн физик нь физик химигээс юугаараа ялгаатай вэ?
Химийн физикмолекул ба хатуу биетийн электрон бүтэц, молекулын спектр, химийн урвалын энгийн үйлдэл, шаталт ба тэсрэлт, өөрөөр хэлбэл химийн үзэгдлийн физик талыг судалдаг. Энэ нэр томъёог 1930 онд Германы химич А.Эйкен нэвтрүүлсэн.
1920-иод онд байгуулагдсан. хөгжилтэй холбоотой квант механикмөн түүний үзэл баримтлалыг химийн салбарт ашиглах. Химийн физик ба физик химийн хоёрын зааг дур зоргоороо байдаг. Зүйл физик химиэсрэгээр: физик нөлөөллийн химийн үр дүн (жишээлбэл, толгойг нь тоосгоор цохисны улмаас хүний үхэл). Химийн физикийн ололтуудын нэг бол онол гэж үзэх ёстой салаалсан гинжин урвалууд.
ОХУ-ын ШУА-ийн Химийн физикийн хүрээлэнгийн үүсгэн байгуулагч Н.Н. Семёнов гүн гүнзгий судалгаа хийсэн гинжин урвалууд. Эдгээр нь химийн урвалын өөрөө эхлүүлдэг хэд хэдэн шат дамжлага бөгөөд нэгэнт эхэлсэн бөгөөд эцсийн шат дуусах хүртэл үргэлжилнэ. Германы химич М.Боденштейн 1913 онд ийм урвал явагдах боломжтойг анх санал болгосон хэдий ч үе шатыг тайлбарласан онол. гинжин урвалмөн түүний хурдыг харуулах нь байхгүй байсан. Гинжин урвалын гол түлхүүр нь үүсэх эхний үе шат юм чөлөөт радикал- хосгүй электронтой, тиймээс химийн хувьд маш идэвхтэй атом буюу атомын бүлэг. Үүссэний дараа молекултай харилцан үйлчилж, урвалын бүтээгдэхүүний нэг болох шинэ чөлөөт радикал үүсдэг. Шинээр үүссэн чөлөөт радикал дараа нь өөр молекултай урвалд орж болох бөгөөд ямар нэгэн зүйл чөлөөт радикалууд ижил төстэй молекул үүсгэхээс урьдчилан сэргийлэх хүртэл урвал үргэлжилнэ. хэлхээ тасрах хүртэл.
Ялангуяа чухал гинжин урвал бол урвал юм салаалсан гинж, 1923 онд физикч Г.А. Крамерс ба И.А. Кристиансен. Энэ урвалын үед чөлөөт радикалууд нь зөвхөн идэвхтэй сайтуудыг үүсгээд зогсохгүй үржиж, шинэ хэлхээ үүсгэж, урвалыг хурдасгадаг. Урвалын бодит явц нь түүний үүсэх савны хэмжээ гэх мэт олон тооны гадны хязгаарлалтаас хамаарна. Хэрэв чөлөөт радикалуудын тоо хурдацтай нэмэгдвэл урвал нь тэсрэлт үүсгэдэг. 1926 онд хоёр оюутанН.Н. Фосфорын уурын исэлдэлтийг усны уураар судалж байхдаа Семенов анх энэ үзэгдлийг ажигласан. Энэ урвал тухайн үеийн химийн кинетикийн хуулиудын дагуу байх ёстой шигээ явагдсангүй. Семенов энэ зөрүүний шалтгааныг тэд салаалсан гинжин урвалын үр дагавартай харьцаж байгаагаас харав. Гэвч ийм тайлбарыг тухайн үед хүлээн зөвшөөрөгдсөн эрх мэдэлтэн М.Боденштейн няцаасан юм химийн кинетик. Н.Н. энэ үзэгдлийг дахин хоёр жилийн турш эрчимтэй судалжээ. Семенов ба С.Н. Хиншелвуд Англид бие даан судалгаа хийж байсан бөгөөд энэ хугацааны дараа Семеновын зөв байсан нь тодорхой болсон.
Н.Н. Семенов нэг сэдэвт зохиол (Гинжин урвал. Ленинград, ОНТИ., 1934) хэвлүүлсэн бөгөөд үүнд тэрээр олон химийн урвалууд, түүний дотор полимержих урвал нь гинжин хэлхээний эсвэл салаалсан гинжин урвалын механизмыг ашиглан явагддаг болохыг нотолсон. Дараа нь тэр нь тогтоогдсон уран-235 цөмийг нейтроноор задлах урвал нь салаалсан гинжин урвалын шинж чанартай байдаг.
1956 онд Семенов Хиншелвудтай хамт шагнагджээ Нобелийн шагналхимийн чиглэлээр "химийн урвалын механизмын чиглэлээр судалгаа хийсэн". Семенов Нобелийн лекцдээ: "Гинжин урвалын онол нь онолын химийн гол асуудал болох урвалд орж буй бөөмсийн реактив ба бүтцийн хоорондын уялдаа холбоог шийдвэрлэхэд ойртох боломжийг нээж өгдөг. .. Энэ мэдлэггүйгээр химийн технологийг ямар ч хэмжээгээр баяжуулах, тэр байтугай биологийн салбарт шийдвэрлэх амжилтанд хүрэх боломжгүй юм...”
ОХУ-ын ШУА-ийн Химийн физикийн хүрээлэн (Москва), Оросын ШУА-ийн Химийн физикийн асуудлын хүрээлэн (Черноголовка) ажиллаж байна. “Химийн физик” сэтгүүл байдаг. Та уншиж болно: Buchachenko A.L. Орчин үеийн химийн физик: хөгжил дэвшлийн зорилго ба замууд // Химийн дэвшил. - 1987. - Т. 56. - No 11.
Физик хими
"Жинхэнэ физик химийн талаархи танилцуулга". М.В.Ломоносовын гар бичмэл. 1752
Физик хими(уран зохиолд ихэвчлэн товчилдог физик хими) - химийн нэг салбар, химийн бодисын бүтэц, бүтэц, хувирлын ерөнхий хуулиудын шинжлэх ухаан. Химийн үзэгдлийг онолын болон туршилтын аргуудфизик.
· 1Физик химийн түүх
· 2 Физик химийн судлах зүйл
· 3Физик хими ба химийн физикийн ялгаа
· Физик химийн 4 хэсэг
o 4.1 Коллоид хими
o 4.2 Кристалын хими
o 4.3 Радиохими
o 4.4 Термохими
o 4.5 Атомын бүтцийн тухай сургаал
o 4.6 Металлын зэврэлтийн тухай сургаал
o 4.7 Шийдлийн тухай сургаал
o 4.8 Химийн кинетик
o 4.9 Фотохими
o 4.10 Химийн термодинамик
o 4.11 Физик-химийн шинжилгээ
o 4.12 Химийн нэгдлүүдийн урвалын онол
o 4.13 Өндөр энергийн хими
o 4.14 Лазерын хими
o 4.15 Цацрагийн хими
o 4.16 Цөмийн хими
o 4.17 Цахилгаан хими
o 4.18 Дууны хими
o 4.19 Бүтцийн хими
· 5 Потенциометр
Физик химийн түүх[
Физик хими 18-р зууны дунд үеэс эхэлсэн. Шинжлэх ухааны арга зүй, мэдлэгийн онолын асуудлын талаархи орчин үеийн ойлголтод "Физик хими" гэсэн нэр томъёо нь М. Ломоносов 1752 онд анх Петербургийн их сургуулийн оюутнуудад “Жинхэнэ физик химийн курс”-ыг зааж байсан В. Эдгээр лекцүүдийн оршил хэсэгт тэрээр дараах тодорхойлолтыг өгсөн: "Физик хими бол физикийн зарчим, туршилтын үндсэн дээр нарийн төвөгтэй биет дэх химийн үйлдлээр юу болж байгааг тайлбарлах ёстой шинжлэх ухаан юм." Эрдэмтэн дулааны корпускул-кинетик онолын бүтээлүүддээ дээрх даалгавар, арга барилд бүрэн нийцэх асуудлыг авч үздэг. Энэ нь хувь хүний таамаглал, энэхүү үзэл баримтлалын заалтуудыг батлахад үйлчилдэг туршилтын үйл ажиллагааны мөн чанар юм. М.В.Ломоносов судалгааныхаа олон салбарт ийм зарчмуудыг баримталсан: өөрийн үүсгэн байгуулсан "шилний шинжлэх ухаан"-ыг хөгжүүлэх, практикт хэрэгжүүлэх, матери ба хүч (хөдөлгөөн) хадгалагдах хуулийг батлахад зориулагдсан янз бүрийн туршилтуудад; - уусмалыг судлахтай холбоотой ажил, туршилтуудад тэрээр өнөөг хүртэл хөгжиж буй физик, химийн үзэгдлийг судлах өргөн хүрээний хөтөлбөр боловсруулсан.
Дараа нь 100 гаруй жилийн завсарлага гарч, Д.И.Менделеев 1850-иад оны сүүлээр Орост анхны физик, химийн судалгаа хийж эхэлсэн.
Физик химийн дараагийн хичээлийг 1865 онд Харьковын их сургуульд Н.Н.Бекетов заажээ.
ОХУ-д физик химийн анхны тэнхим 1914 онд Санкт-Петербургийн их сургуулийн Физик-математикийн факультетэд нээгдэж, намар нь заавал хичээл зааж эхэлжээ. практик хичээлүүдфизик химийн чиглэлээр, Д.П.Коновалов, М.С.Вревский нарын шавь.
Физик химийн тухай өгүүлэл нийтлэх зорилготой анхны шинжлэх ухааны сэтгүүлийг 1887 онд В.Оствальд, Ж.Вант Хофф нар үүсгэн байгуулжээ.
Физик химийн судалгааны сэдэв[
Физик хими нь орчин үеийн химийн үндсэн онолын үндэс суурь юм онолын аргуудквант механик, статистик физик ба термодинамик, шугаман бус динамик, талбайн онол гэх мэт физикийн чухал салбарууд. Үүнд материйн бүтцийг судлах, үүнд: молекулын бүтэц, химийн термодинамик, химийн кинетик ба катализ орно. Цахилгаан хими, фотохими, гадаргуугийн үзэгдлийн физик хими (адсорбцийг оруулаад), цацрагийн хими, металлын зэврэлтийг судлах, өндөр молекулт нэгдлүүдийн физик хими (полимер физикийг үзнэ үү) гэх мэтийг физик химийн хувьд тусдаа хэсэг болгон ялгадаг. заримдаа коллоид хими, физик-химийн шинжилгээ, квант химийн бие даасан хэсэг гэж үздэг. Физик химийн ихэнх салбарууд судалгааны объект, арга, арга зүйн онцлог, ашигласан аппарат хэрэгслийн хувьд нэлээд тодорхой хил хязгаартай байдаг.
Физик хими ба химийн физикийн ялгаа
Эдгээр шинжлэх ухаан хоёулаа хими ба физикийн огтлолцол дээр байдаг; заримдаа химийн физикийг физик химийн хичээлд оруулдаг. Эдгээр шинжлэх ухааны хооронд тодорхой хил хязгаарыг тогтоох нь үргэлж боломжгүй байдаг. Гэсэн хэдий ч боломжийн нарийвчлалтайгаар энэ ялгааг дараах байдлаар тодорхойлж болно.
Физик хими нь нэгэн зэрэг оролцож байгаа үйл явцыг бүхэлд нь авч үздэг багцтоосонцор;
· химийн физикийн тойм тусдаабөөмс ба тэдгээрийн хоорондын харилцан үйлчлэл, өөрөөр хэлбэл тодорхой атом ба молекулууд (тиймээс физик химид өргөн хэрэглэгддэг "хамгийн тохиромжтой хий" гэсэн ойлголт түүнд байхгүй болно).
Физик, хими бол 21-р зуунд технологийн дэвшилд шууд хувь нэмэр оруулдаг шинжлэх ухаан юм. Энэ хоёр салбар нь хүрээлэн буй ертөнцийн үйл ажиллагааны хууль тогтоомж, түүний бүрдсэн хамгийн жижиг хэсгүүдийн өөрчлөлтийг судалдаг. Байгалийн бүх үзэгдлүүд нь химийн болон физикийн үндэстэй байдаг бөгөөд энэ нь бүх зүйлд хамаатай: гэрэлтэх, шатах, буцалгах, хайлах, ямар нэгэн зүйлтэй ямар нэгэн харилцан үйлчлэл.
Сургуулийн бүх хүмүүс хими-физик, биологи, байгалийн шинжлэх ухааны үндсийг судалдаг байсан ч хүн бүр эдгээр шинжлэх ухаантай амьдралаа холбодоггүй, одоо хүн бүр тэдгээрийн хоорондын шугамыг тодорхойлж чадахгүй.
Физикийн шинжлэх ухаан ба химийн шинжлэх ухааны гол ялгаа нь юу болохыг ойлгохын тулд эхлээд тэдгээрийг сайтар судалж, эдгээр салбаруудын үндсэн зарчмуудтай танилцах хэрэгтэй.
Физикийн тухай: хөдөлгөөн ба түүний хуулиуд
Физикийн хэлцлүүд шууд судалгаа ерөнхий шинж чанаруудхүрээлэн буй ертөнц, материйн хөдөлгөөний энгийн бөгөөд нарийн төвөгтэй хэлбэрүүд, байгалийн үзэгдлүүд, эдгээр бүх үйл явцын үндэс суурь болдог. Шинжлэх ухаан нь янз бүрийн материаллаг объектуудын чанар, тэдгээрийн хоорондын харилцан үйлчлэлийн илрэлийг судалдаг. Физикчид мөн ерөнхий хэв маягийг судалж байна янз бүрийн төрөласуудал; Эдгээр нэгтгэх зарчмуудыг физикийн хууль гэж нэрлэдэг.

Физик нь материаллаг системийг янз бүрийн хэмжүүрээр хамгийн өргөн хүрээнд авч үздэг тул олон талаараа суурь шинжлэх ухаан юм. Энэ нь байгалийн бүх шинжлэх ухаантай маш нягт холбоотой бөгөөд физикийн хуулиуд биологийн болон геологийн үзэгдлийг ижил хэмжээгээр тодорхойлдог. Бүх зүйл шиг математиктай нягт холбоотой байдаг физикийн онолуудтоо болон математикийн илэрхийлэл хэлбэрээр томьёолсон. Товчхондоо, энэ сахилга бат нь хүрээлэн буй ертөнцийн бүх үзэгдэл, тэдгээрийн үүсэх зүй тогтлыг физикийн хуулиудад үндэслэн өргөнөөр судалдаг.

Хими: бүх зүйл юунаас бүрддэг вэ?
Хими нь үндсэндээ шинж чанар, бодисыг янз бүрийн өөрчлөлттэй хослуулан судалдаг. Химийн урвал нь цэвэр бодисыг хольж, шинэ элементүүдийг бий болгосны үр дүн юм.
Шинжлэх ухаан нь биологи, одон орон зэрэг байгалийн бусад салбаруудтай нягт холбоотой байдаг. Хими нь янз бүрийн төрлийн бодисын дотоод бүтэц, бодисын бүрэлдэхүүн хэсгүүдийн харилцан үйлчлэл, хувирлын талуудыг судалдаг. Хими нь мөн өөрийн хууль, онол, зүй тогтол, шинжлэх ухааны таамаглалыг ашигладаг.

Физик, химийн хоёрын гол ялгаа нь юу вэ?
Байгалийн шинжлэх ухаанд хамаарах нь эдгээр шинжлэх ухааныг олон талаар нэгтгэдэг боловч тэдгээрийн хооронд нийтлэг зүйлээс хамаагүй олон ялгаа байдаг.
- Байгалийн хоёр шинжлэх ухааны гол ялгаа нь физик нь энгийн бөөмс (бичил ертөнц, үүнд атомын болон нуклонуудын түвшин орно) болон тодорхой нэг орчинд байрлах бодисын янз бүрийн шинж чанарыг судалдагт оршино. нэгтгэх байдал. Хими нь атомуудаас молекулуудыг "угсрах" үйл явц, тухайн бодис өөр төрлийн бодистой тодорхой урвалд орох чадварыг судлах чиглэлээр ажилладаг.
- Биологи, одон орон судлалын нэгэн адил орчин үеийн физик нь арга зүйн хэрэгслээр олон оновчтой бус ойлголтуудыг ашиглах боломжийг олгодог бөгөөд энэ нь дэлхий дээрх амьдралын гарал үүсэл, орчлон ертөнцийн гарал үүсэл, философитой холбоотой онолуудад голчлон хамаатай. "хамгийн тохиромжтой" ба "материал". Хими нь оновчтой зарчимд илүү ойр байсан нарийн шинжлэх ухаан, ерөнхийдөө эртний алхими болон гүн ухааны аль алинаас нь холдож байна.
- Физик үзэгдлийн биетүүдийн химийн найрлага нь шинж чанар нь өөрчлөгдөөгүй хэвээр байна. Химийн үзэгдлүүд нь шинэ шинж чанар нь илэрч буй бодисыг нөгөөд шилжүүлэх явдал юм; Энэ нь эдгээр мэргэжлээр судалж буй хичээлүүдийн ялгаа юм.
- Физикийн тайлбарласан үзэгдлийн өргөн хүрээний ангилал. Хими бол илүү их зүйл юм өндөр мэргэшсэн сахилга бат, энэ нь физикээс (макро ертөнц ба бичил ертөнц) ялгаатай нь зөвхөн бичил ертөнцийг (молекулын түвшин) судлахад чиглэгддэг.
- Физик нь материаллаг биетүүдийг чанар, шинж чанараар нь судлах, хими нь эдгээр биетүүдийн найрлага, тэдгээрийн бүрэлдэх хамгийн жижиг хэсгүүд, хоорондоо харилцан үйлчлэлцдэг.

Физик химийн түүх
М.В. Ломоносов, аль нь 1752
Н.Н. Бекетов 1865
БА Нернст.
М.С.Вревский.
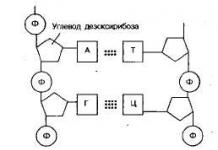
Молекулууд, ионууд, чөлөөт радикалууд.
Элементүүдийн атомууд нь химийн процесст оролцдог гурван төрлийн бөөмсийг үүсгэдэг - молекул, ион, чөлөөт радикалууд.
Молекулхимийн шинж чанартай, бие даасан оршин тогтнох чадвартай бодисын хамгийн жижиг төвийг сахисан бөөмс юм. Монатомик ба байдаг олон атомт молекулууд(хоёр атом, гурвалсан атом гэх мэт). Ердийн нөхцөлд язгуур хий нь нэг атомын молекулуудаас бүрддэг; өндөр молекулын нэгдлүүдийн молекулууд нь эсрэгээрээ олон мянган атом агуулдаг.
Тэгээд тэр- илүүдэл электрон (анион) эсвэл тэдгээрийн дутагдал (катион) бүхий атом эсвэл химийн холбоо бүхий атомуудын бүлэг болох цэнэгтэй бөөмс. Бодис дотор эерэг ионууд үргэлж сөрөг ионуудтай хамт байдаг. Ионуудын хооронд ажилладаг цахилгаан статик хүч их байдаг тул бодист ижил тэмдэгтэй ионуудын мэдэгдэхүйц илүүдэл үүсэх боломжгүй юм.
Чөлөөт радикалханаагүй валенттай бөөмс, өөрөөр хэлбэл хосгүй электронтой бөөм гэж нэрлэдэг. Ийм бөөмс нь жишээлбэл, ·CH 3 ба ·NH 2 юм. Хэвийн нөхцөлд чөлөөт радикалууд нь дүрмээр бол удаан хугацаанд оршин тогтнох боломжгүй, учир нь тэдгээр нь маш идэвхтэй бөгөөд идэвхгүй тоосонцор үүсгэхэд амархан хариу үйлдэл үзүүлдэг. Ийнхүү хоёр метилийн радикал CH3 нийлж C 2 H 6 (этан) молекул үүсгэдэг. Чөлөөт радикалуудын оролцоогүйгээр олон хариу үйлдэл хийх боломжгүй юм. Маш өндөр температурт (жишээлбэл, нарны агаар мандалд) цорын ганц хоёр атомт тоосонцор нь чөлөөт радикалууд (CN, ·OH, ·CH болон бусад) байж болно. Галын дөлөнд олон тооны чөлөөт радикалууд байдаг.
Илүү нарийн төвөгтэй бүтэцтэй чөлөөт радикалууд нь мэдэгдэж байгаа бөгөөд тэдгээр нь харьцангуй тогтвортой бөгөөд хэвийн нөхцөлд оршин тогтнох боломжтой, жишээлбэл, трифенилметил радикал (C 6 H 5) 3 C (түүний нээлтээр чөлөөт радикалуудыг судалж эхэлсэн). Түүний тогтвортой байдлын нэг шалтгаан нь орон зайн хүчин зүйлүүд юм - фенил бүлгүүдийн том хэмжээ нь радикалуудыг гексафенилетан молекул болгон нэгтгэхээс сэргийлдэг.
Ковалент холбоо.
Бүтцийн томъёонд химийн холбоо бүрийг дүрсэлсэн болно валентын шугам , Жишээлбэл:
H−H (хоёр устөрөгчийн атомын хоорондох холбоо)
H 3 N−H + (аммиакийн молекулын азотын атом ба устөрөгчийн катион хоорондын холбоо)
(K +)−(I−) (калийн катион ба иодид ионы хоорондох холбоо).
Үүний улмаас химийн холбоо үүсдэг атомын цөмийг хос электронд татах(цэгээр тэмдэглэсэн ··), энэ нь нарийн төвөгтэй хэсгүүдийн (молекулууд, нийлмэл ионууд) электрон томъёонд илэрхийлэгддэг. валентын шугам- өөрсдийнхөөс ялгаатай нь ганц хос электронуудатом бүр, жишээ нь:
| :::F−F::: | (F 2); | H−Cl::: | (HCl); | .. H−N−H | Х | (NH 3) |
Химийн холбоо гэж нэрлэдэг ковалент, -ээр үүсгэгдсэн бол хос электроныг хуваалцахатом хоёулаа.
Молекулын туйлшрал
Нэг элементийн атомуудаас үүссэн молекулууд ерөнхийдөө байх болно туйлшралгүй , бонд нь өөрөө хэр туйлшралгүй байдаг. Тиймээс H 2, F 2, N 2 молекулууд нь туйлшралгүй байдаг.
Янз бүрийн элементийн атомуудаас үүссэн молекулууд байж болно туйл
Тэгээд туйлшралгүй
. -аас хамаарна геометрийн хэлбэр.
Хэрэв хэлбэр нь тэгш хэмтэй бол молекул туйлшралгүй(BF 3, CH 4, CO 2, SO 3), хэрэв тэгш бус (ганц хос эсвэл хосгүй электрон байгаа тул) молекул туйл(NH 3, H 2 O, SO 2, NO 2).
Тэгш хэмтэй молекулын хажуугийн атомын аль нэгийг өөр элементийн атомаар солих үед геометрийн хэлбэр мөн гажиж, туйлшрал гарч ирдэг, жишээлбэл, хлоржуулсан метан CH 3 Cl, CH 2 Cl 2 ба CHCl 3 (CH) -д. 4 метан молекул нь туйлшралгүй).
Туйлшрал-аас молекулын тэгш бус хэлбэр үүсдэг туйлшрал ковалент холбоо
элементүүдийн атомуудын хооронд өөр өөр цахилгаан сөрөг нөлөөтэй
.
Дээр дурдсанчлан, бондын тэнхлэгийн дагуу электрон нягтын хэсэгчилсэн шилжилт илүү электрон сөрөг элементийн атом руу явагддаг, жишээлбэл:
| H δ+ → Cl δ− | B δ+ → F δ− |
| C δ− ← H δ+ | N δ− ← H δ+ |
(энд δ нь атомуудын хэсэгчилсэн цахилгаан цэнэг юм).
Илүү их цахилгаан сөрөг байдлын ялгаа элементүүд байх тусам δ цэнэгийн үнэмлэхүй утга өндөр байх тусам илүү их байх болно туйл ковалент холбоо байх болно.
Тэгш хэмтэй молекулуудад (жишээлбэл, BF 3) сөрөг (δ−) ба эерэг (δ+) цэнэгийн "хүндийн төвүүд" давхцдаг боловч тэгш хэмт бус молекулуудад (жишээлбэл, NH 3) таарахгүй. давхцах.
Үүний үр дүнд тэгш бус молекулуудад цахилгаан диполь
- орон зайд, жишээлбэл, усны молекулд тодорхой зайд тусгаарлагдсан цэнэгүүдээс ялгаатай.
Устөрөгчийн холбоо.
Олон бодисыг судлахдаа гэж нэрлэгддэг устөрөгчийн холбоо . Жишээлбэл, шингэн дэх HF молекулууд устөрөгчийн фторустөрөгчийн холбоогоор бие биетэйгээ холбогддог, үүнтэй адил шингэн ус эсвэл мөсөн талст дахь H 2 O молекулууд, түүнчлэн NH 3 ба H 2 O молекулууд хоорондоо молекул хоорондын холболтоор холбогддог - аммиакийн гидрат NH 3 H 2 O.
Устөрөгчийн холбоо тогтворгүй маш амархан устдаг (жишээлбэл, мөс хайлах, ус буцалгах үед). Гэсэн хэдий ч эдгээр холбоог таслахад зарим нэмэлт энерги зарцуулагддаг тул молекулуудын хооронд устөрөгчийн холбоо бүхий бодисын хайлах болон буцлах цэг нь ижил төстэй бодисуудаас хамаагүй өндөр боловч устөрөгчийн холбоогүй байдаг.
Валент. Донор хүлээн авагчийн холбоо.Молекулын бүтцийн онолын дагуу атомууд нь орбиталууд нь нэг электрон эзэлдэг шиг олон ковалент холбоо үүсгэж чаддаг боловч энэ нь үргэлж тийм байдаггүй. [AO-г бөглөх хүлээн зөвшөөрөгдсөн схемд эхлээд бүрхүүлийн дугаарыг, дараа нь тойрог замын төрлийг, дараа нь тойрог замд нэгээс олон электрон байгаа бол тэдгээрийн тоог (дээд бичээс) зааж өгнө. Тиймээс, бичлэг хийх (2 с) 2 нь асаалттай гэсэн үг с-хоёр дахь бүрхүүлийн орбиталууд нь хоёр электрон агуулдаг.] Үндсэн төлөвт байгаа нүүрстөрөгчийн атом (3 Р) цахим тохиргоотой (1 с) 2 (2с) 2 (2х x)(2 х y), хоёр тойрог зам дүүрээгүй байхад, i.e. тус бүр нэг электрон агуулдаг. Гэсэн хэдий ч хоёр валент нүүрстөрөгчийн нэгдлүүд нь маш ховор бөгөөд өндөр урвалд ордог. Ихэвчлэн нүүрстөрөгч нь дөрвөн валент бөгөөд энэ нь өдөөлтөд шилжсэнтэй холбоотой юм. С-төлөв (1 с) 2 (2с) (2х x)(2 ху)(2 х z) Дөрвөн дүүргэгдээгүй тойрог замд маш бага энерги шаардагдана. Шилжилттэй холбоотой эрчим хүчний зардал 2 с- электроныг чөлөөтэй болгох 2 Р-орбитал нь хоёр нэмэлт холбоо үүсэх үед ялгарсан энергиэр нөхөгддөг. Бөглөөгүй AO үүсэхийн тулд энэ үйл явц нь эрч хүчтэй байх ёстой. Электрон тохиргоотой азотын атом (1 с) 2 (2с) 2 (2х x)(2 ху)(2 х z) 2-ыг шилжүүлэхэд шаардагдах энергийн учир таван валентын нэгдлүүдийг үүсгэдэггүй с-3-т зориулсан электрон г-орбитал нь таван валентын тохиргоог үүсгэдэг (1 с) 2 (2с)(2х x)(2 ху)(2 х z)(3 г), хэтэрхий том байна. Үүний нэгэн адил ердийн тохиргоотой борын атомууд (1 с) 2 (2с) 2 (2х) өдөөгдсөн нөхцөлд гурвалсан нэгдлүүдийг үүсгэж чаддаг (1 с) 2 (2с)(2х x)(2 х y) шилжилтийн үед тохиолддог 2 с- электрон 2 Р-AO, гэхдээ өдөөгдсөн төлөвт шилжсэнээс хойш таван валентын нэгдлүүдийг үүсгэдэггүй (1 с)(2с)(2х x)(2 ху)(2 х z), 1-ийн аль нэгийг шилжүүлсэнтэй холбоотой с- электронууд илүү их өндөр түвшин, хэт их эрчим хүч шаарддаг. Атомуудын харилцан үйлчлэл нь тэдгээрийн хооронд холбоо үүсэх нь зөвхөн ойр энергитэй тойрог замууд байгаа тохиолдолд л явагддаг. ижил үндсэн квант тоотой орбиталууд. Эхний 10 элементийн холбогдох өгөгдөл тогтмол хүснэгтдоор тоймлон харуулав. Атомын валентийн төлөв нь түүний химийн холбоо үүсгэх төлөв юм, жишээлбэл төлөв 5 Сдөрвөн валент нүүрстөрөгчийн хувьд.
| ҮЕИЙН ХҮТНЭГТИЙН ЭХНИЙ АРВАН ЭЛЕМЕНТИЙН ВАЛЕНЦИЙН ТӨЛӨВ, ВАЛЕНЦ | |||
| Бүрэлдэхүүн | Газрын төлөв | Хэвийн валентын төлөв | Тогтмол валент |
| Х | (1с) | (1с) | |
| Тэр | (1с) 2 | (1с) 2 | |
| Ли | (1с) 2 (2с) | (1с) 2 (2с) | |
| Бай | (1с) 2 (2с) 2 | (1с) 2 (2с)(2х) | |
| Б | (1с) 2 (2с) 2 (2х) | (1с) 2 (2с)(2х x)(2 ху) | |
| C | (1с) 2 (2с) 2 (2х x)(2 ху) | (1с) 2 (2с)(2х x)(2 ху)(2 х z) | |
| Н | (1с) 2 (2с) 2 (2х x)(2 ху)(2 х z) | (1с) 2 (2с) 2 (2х x)(2 ху)(2 х z) | |
| О | (1с) 2 (2с) 2 (2х x) 2 (2 ху)(2 х z) | (1с) 2 (2с) 2 (2х x) 2 (2 ху)(2 х z) | |
| Ф | (1с) 2 (2с) 2 (2х x) 2 (2 ху) 2 (2 х z) | (1с) 2 (2с) 2 (2х x) 2 (2 ху) 2 (2 х z) | |
| Үгүй | (1с) 2 (2с) 2 (2х x) 2 (2 ху) 2 (2 х z) 2 | (1с) 2 (2с) 2 (2х x) 2 (2 ху) 2 (2 х z) 2 |
Эдгээр хэв маягийг дараах жишээнүүдэд харуулав.

Физик химийн түүх
Физик хими 18-р зууны дунд үеэс эхэлсэн. "Физик хими" гэсэн нэр томъёо нь хамаарна М.В. Ломоносов, аль нь 1752 жил би анх удаа Санкт-Петербургийн их сургуулийн оюутнуудад “Жинхэнэ физикийн химийн курс”-ыг уншиж өгсөн. Энэ хичээлээр тэрээр өөрөө энэ шинжлэх ухааны дараах тодорхойлолтыг өгсөн. "Физик хими бол нарийн төвөгтэй биет дэх химийн үйлдлээр юу болж байгааг физик зарчим, туршилтын үндсэн дээр тайлбарлах ёстой шинжлэх ухаан юм."
Дараа нь зуу гаруй жилийн завсарлага аваад физик химийн дараагийн хичээлийг академич заажээ Н.Н. БекетовХарьковын их сургуульд 1865 жил. Н.Н. Бекетов Оросын бусад их дээд сургуульд физик химийн хичээл зааж эхэлсэн. Флавицкий (Казань 1874), В.Оствальд (Тарту дахь их сургууль 18807), И.А. Каблюков (Москвагийн их сургууль 1886).
1887 онд Лейпцигийн их сургуульд (Герман) физик химийн шинжлэх ухааныг бие даасан шинжлэх ухаан, эрдэм шинжилгээний салбар гэж хүлээн зөвшөөрсөн. В.Оствальд тэргүүтэй физик химийн анхны тэнхим, тэнд физик химийн шинжлэх ухааны анхны сэтгүүлийг үүсгэн байгуулжээ. 19-р зууны төгсгөлд Лейпцигийн их сургууль нь физик химийн хөгжлийн төв байсан бөгөөд тэргүүлэх физик химичүүд нь: В.Оствальд, Ж.вант Хофф, АррениусТэгээд Нернст.
ОХУ-д физик химийн анхны тэнхим 1914 онд Санкт-Петербургийн их сургуулийн Физик-математикийн факультетэд нээгдэж, намар нь физик химийн хичээлийг заавал, практик хичээл зааж эхэлжээ. М.С.Вревский.
Физик хими ба химийн физикийн ялгаа
Эдгээр шинжлэх ухаан хоёулаа хими ба физикийн огтлолцол дээр байдаг; заримдаа химийн физикийг физик химийн хичээлд оруулдаг. Эдгээр шинжлэх ухааны хооронд тодорхой хил хязгаарыг тогтоох нь үргэлж боломжгүй байдаг. Гэсэн хэдий ч боломжийн нарийвчлалтайгаар энэ ялгааг дараах байдлаар тодорхойлж болно.
Физик хими нь нэгэн зэрэг оролцож байгаа үйл явцыг бүхэлд нь авч үздэг багцтоосонцор;
· химийн физикийн тойм тусдаабөөмс ба тэдгээрийн хоорондын харилцан үйлчлэл, тухайлбал тодорхой атом ба молекулууд (тиймээс физик химид өргөн хэрэглэгддэг "хамгийн тохиромжтой хий" гэсэн ойлголт түүнд байхгүй болно).
Лекц 2 Молекулуудын бүтэц, химийн бондын шинж чанар. Химийн бондын төрлүүд. Элементийн цахилгаан сөрөг байдлын тухай ойлголт. Туйлшрал. Диполь момент. Молекул үүсэх атомын энерги. Молекулын бүтцийг туршилтаар судлах арга.
Молекулын бүтэц(молекулын бүтэц), харилцан зохицуулалтмолекул дахь атомууд. Химийн урвалын үед урвалд орох бодисын молекул дахь атомууд өөрчлөгддөг ба шинэ нэгдлүүд үүсдэг. Иймээс химийн үндсэн асуудлын нэг бол анхны нэгдлүүдийн атомуудын зохион байгуулалт, тэдгээрээс бусад нэгдлүүд үүсэх явцад гарсан өөрчлөлтийн шинж чанарыг тодруулах явдал юм.
Молекулын бүтцийн талаархи анхны санаанууд нь бодисын химийн шинж чанарын шинжилгээнд үндэслэсэн байв. Эдгээр санаанууд нь мэдлэгийн хувьд илүү төвөгтэй болсон химийн шинж чанарбодисууд. Химийн үндсэн хуулиудыг хэрэглэснээр тухайн нэгдлийн молекулыг бүрдүүлдэг атомын тоо, төрлийг тодорхойлох боломжтой болсон; Энэ мэдээлэл нь химийн томъёонд агуулагддаг. Цаг хугацаа өнгөрөхөд химичүүд нэг химийн томъёо нь молекулыг нарийн тодорхойлоход хангалтгүй гэдгийг ойлгосон, учир нь ижил химийн томъёотой боловч өөр өөр шинж чанартай изомер молекулууд байдаг. Энэ баримт нь эрдэмтэд молекул дахь атомууд нь тэдгээрийн хоорондын холбоогоор тогтворжсон тодорхой топологитой байх ёстой гэж үзэхэд хүргэсэн. Энэ санааг анх 1858 онд Германы химич Ф.Кекуле илэрхийлжээ. Түүний санаа бодлын дагуу молекулыг ашиглан дүрсэлж болно бүтцийн томъёо, энэ нь зөвхөн атомуудыг төдийгүй тэдгээрийн хоорондын холбоог илтгэнэ. Атом хоорондын холбоо нь атомуудын орон зайн зохион байгуулалттай тохирч байх ёстой. Метан молекулын бүтцийн талаархи санаа бодлыг хөгжүүлэх үе шатуудыг Зураг дээр үзүүлэв. 1. Бүтэц нь орчин үеийн өгөгдөлтэй тохирч байна Г : молекул нь ердийн тетраэдр хэлбэртэй, төвд нүүрстөрөгчийн атом, оройн хэсэгт устөрөгчийн атомууд байдаг.
Гэсэн хэдий ч ийм судалгаанд молекулуудын хэмжээний талаар юу ч хэлээгүй байна. Энэ мэдээлэл нь зөвхөн зохих физик аргуудыг боловсруулснаар л боломжтой болсон. Эдгээрээс хамгийн чухал нь рентген туяаны дифракц байв. Кристалууд дээрх рентген туяаны тархалтын загвараас болор дахь атомуудын яг байрлалыг тодорхойлох, молекулын талстуудын хувьд бие даасан молекул дахь атомуудыг нутагшуулах боломжтой болсон. Бусад аргууд нь хий, уураар дамжин өнгөрөх электронуудын дифракц, молекулуудын эргэлтийн спектрийн шинжилгээ зэрэг орно.
Энэ бүх мэдээллийг зөвхөн өгдөг ерөнхий санаамолекулын бүтцийн тухай. Химийн бондын мөн чанар нь орчин үеийн квант онолыг судлах боломжийг бидэнд олгодог. Хэдийгээр молекулын бүтцийг хангалттай өндөр нарийвчлалтайгаар тооцоолох боломжгүй байгаа ч мэдэгдэж байгаа бүх мэдээлэл байна химийн холбоотайлбарлаж болно. Шинэ төрлийн химийн холбоо бий болно гэж таамаглаж байсан.