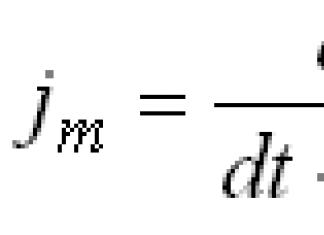1. Химийн хичээлийн сэдэв, даалгавар Химийн үндсэн ойлголт, хууль тогтоомж.
2. Үелэх хууль ба химийн элементүүдийн үелэх систем Д.И. Менделеев атомын бүтцийн талаархи санаан дээр үндэслэсэн. Шинжлэх ухааны хөгжилд үечилсэн хуулийн ач холбогдол.
3. Химийн элементийн атомын бүтэц, тэдгээрийн шинж чанарын өөрчлөлтийн загвар: а) ижил үеийн элементүүд; б) нэг үндсэн дэд бүлгийн элементүүд.
4. Химийн бондын төрөл: ион, металл, ковалент (туйлт, туйл биш); органик нэгдлүүдийн энгийн ба олон тооны холбоо.Болор торны төрөл.
5. Ангилал химийн урвалорганик бус химийн чиглэлээр.
6. Органик химийн химийн урвалын ангилал
7. Химийн урвалын хурд. Хурдны шинж чанар, урвалд орох бодисын концентраци, температур, катализатороос хамаарал.
8. Химийн тэнцвэр ба түүнийг нүүлгэн шилжүүлэх нөхцөл: урвалд орох бодисын концентрацийн өөрчлөлт, температур, даралт.
9. Аллотропийн тухай ойлголт. Аллотропи тийм биш органик бодиснүүрстөрөгч ба хүчилтөрөгчийн жишээг ашиглан.
10. Дисперс систем Ангилал, жишээ Коллоид уусмал Суспенз, эмульс, аэрозоль, гелийг анагаах ухаанд хэрэглэх.
11. Уусмал.Үнэн уусмал.Бодисын уусах чадвар физик-химийн үзэгдэл.. Уусмалын ангилал.Баяжуулалтын төрөл.
12.Электролитийн диссоциаци. Электролит ба электролит бус Ион солилцооны урвал Диссоциацийн зэрэг.
13. Органик бус нэгдлүүдийн хамгийн чухал ангиуд.
14. Оксид. Илүү өндөр оксидуудГурав дахь үеийн химийн элементүүд. Үелэх систем дэх химийн элементүүдийн байрлалтай холбоотойгоор тэдгээрийн шинж чанарын өөрчлөлтийн зүй тогтол.
15. Электролитийн диссоциацийн талаархи санаан дээр үндэслэсэн хүчил, тэдгээрийн ангилал, шинж чанар.
16. Электролитийн диссоциацийн талаархи санаан дээр үндэслэсэн суурь, тэдгээрийн ангилал, шинж чанар.
17. Исэлдэлтийн шинж чанарыг харгалзан металл, хүчил, шүлт, бие биетэйгээ харилцан үйлчлэх давс, тэдгээрийн найрлага, нэрс - ион солилцооны урвал.
18. Давсны гидролиз Гидролизийн төрлүүд.
19. Редокс урвал (хөнгөн цагааны зарим металлын исэл, баяжмал хүхрийн хүчлийг зэстэй харьцах жишээг ашиглан).
20.Хайлмал болон давсны уусмалын электролиз.
21. Металл бус, химийн элементүүдийн үелэх систем дэх байрлал D.I. Менделеев, тэдгээрийн атомын бүтэц. Хүчилтөрөгчийн дэд бүлгийн элементүүдийн жишээг ашиглан металл бус бодисын исэлдэлтийн шинж чанарууд. . Металл бус устөрөгчийн нэгдлүүд. Үелэх систем дэх химийн элементүүдийн байрлалтай холбоотойгоор тэдгээрийн шинж чанарын өөрчлөлтийн зүй тогтол D.I. Менделеев
22. Галоген Галогенийн ерөнхий шинж чанар Хлор Физик-химийн шинж чанар Давсны хүчил, түүний шинж чанар Хлорид.
23. Хүчилтөрөгчийн дэд бүлэг.VIA дэд бүлгийн ерөнхий шинж чанар.Хүхэр, ee. физик-химийн шинж чанар. Хүхрийн нэгдлүүд: хүхэрт устөрөгч, хүхрийн исэл, хүхрийн хүчил, түүний давс.
24. Азотын дэд бүлэг.. Азотын нэгдлүүд: аммиак, аммонийн давс, азотын хүчил, түүний давс.
25. Нүүрстөрөгчийн дэд бүлэг Ерөнхий шинж чанар Нүүрстөрөгч Атомын бүтэц Нүүрстөрөгчийн аллотропийн өөрчлөлт Химийн шинж чанар Нүүрстөрөгчийн нэгдлүүд: исэл, нүүрстөрөгчийн хүчил, түүний давс.
26. Металл, тэдгээрийн химийн элементүүдийн үечилсэн систем дэх байр суурь D.I. Менделеев, тэдгээрийн атомын бүтэц, металлын холбоо. Металлын ерөнхий химийн шинж чанар. . Металлын цахилгаан химийн хүчдэлийн цуваа. Давсны уусмалаас металыг бусад металлаар нүүлгэн шилжүүлэх
27. Металлын химийн болон цахилгаан химийн зэврэлт. Металлын зэврэлт үүсэх нөхцөл. Зэврэлт үүсэх нөхцөл, металл ба хайлшийг зэврэлтээс хамгаалах арга хэмжээ
28. Ерөнхий аргуудметалл авах. Хүчилтөрөгчгүй хүчлүүдийн давсны жишээг ашиглан электролизийн практик ач холбогдол.
29. Шүлтлэг металл.Д.И.Менделеевийн PSHE-ийн байрлалд үндэслэсэн ерөнхий шинж чанар.Натри ба түүний нэгдлүүдийн шинж чанар. Биологийн үүрэгнатри ба калийн ионууд.
30. шүлтлэг шороон металл.Кальци, түүний шинж чанар.Кальцийн хамгийн чухал нэгдлүүд.Кальцийн ионуудын биологийн үүрэг.
31. Төмөр: химийн элементүүдийн үечилсэн систем дэх байрлал D.I. Менделеев, атомын бүтэц, боломжит исэлдэлтийн төлөв, физик шинж чанар, хүчилтөрөгч, галоген, хүчил, давсны уусмалуудтай харилцан үйлчлэл. Төмрийн хайлш.
32. Органик бус болон органик бодисын олон янз байдлын шалтгаан; бодисын хамаарал.
33 Органик бодисын химийн бүтцийн онолын үндсэн зарчим А.М. Бутлеров. Химийн бүтэц нь молекул дахь атомуудын холболт ба харилцан нөлөөллийн дараалал юм.
34. Органик нэгдлүүдийн изомеризм ба түүний төрлүүд.
35. Ханасан нүүрсустөрөгчид, ерөнхий томъёомөн энэ цувралын гомологуудын химийн бүтэц. Метан хийн шинж чанар ба хэрэглээ.
36. Этилен цувралын ханаагүй нүүрсустөрөгчид, ерөнхий томъёо, химийн бүтэц. Этиленийн шинж чанар ба хэрэглээ Этилен нүүрсустөрөгчийг гарган авах арга
37. Ацетилен нь молекул дахь гурвалсан холбоо бүхий нүүрсустөрөгчийн төлөөлөгч юм. Ацетиленийн шинж чанар, үйлдвэрлэл, хэрэглээ.
38. Үнэрт нүүрсустөрөгч. бензол, бүтцийн томъёо, шинж чанар, олж авах. Бензол ба түүний гомологийн хэрэглээ.
39. Нүүрс устөрөгчийн байгалийн эх үүсвэр: хий, газрын тос, нүүрсба тэдгээрийн практик хэрэглээ.
40. Хязгаарлалт нэг атомт спирт, тэдгээрийн бүтэц, шинж чанар. Этилийн спирт бэлтгэх, хэрэглэх. Ханасан ба ханаагүй нүүрсустөрөгчөөс спирт бэлтгэх.
41. Фенол, түүний химийн бүтэц, шинж чанар, бэлтгэл, хэрэглээ.
42. Альдегид, тэдгээрийн химийн бүтэц, шинж чанар. Шоргоолж ба ацетальдегидийг бэлтгэх, хэрэглэх.
43. Монобаазыг хязгаарлах карбоксилын хүчил, тэдгээрийн бүтэц, шинж чанарыг цууны хүчлээр жишээ болгон авч үзэх.
44. Өөх тос, тэдгээрийн найрлага, шинж чанар. Байгаль дахь өөх тос, биеийн өөхний хувирал. Өөх тосыг техникийн аргаар боловсруулах бүтээгдэхүүн. Синтетик угаалгын бодисын тухай ойлголт.
45. Глюкоз нь моносахаридын төлөөлөгч, химийн бүтэц, физик, химийн шинж чанар, хэрэглээ
46. Цардуул, байгальд тохиолдох, практик ач холбогдол, цардуулын гидролиз
47. Целлюлоз, молекулын найрлага, физик, химийн шинж чанар, хэрэглээ. Ацетат эслэгийн жишээг ашиглан хиймэл утаснуудын тухай ойлголт.
48. Амин хүчил, тэдгээрийн найрлага, химийн шинж чанар: давсны хүчил, шүлт, бие биетэйгээ харилцан үйлчлэл. Амин хүчлийн биологийн үүрэг, тэдгээрийн хэрэглээ.
49. Анилин нь амины төлөөлөгч юм; химийн бүтэц, шинж чанар; үйлдвэрлэл, практик хэрэглээ.
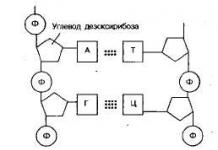
50. Органик нэгдлүүдийн хамгийн чухал ангиудын хоорондын хамаарал.Генетик холбоо.
51. Уургууд нь биополимер. Уургийн шинж чанар, биологийн үүрэг.
52. Өндөр молекулын нэгдлүүдийн ерөнхий шинж чанар: найрлага, бүтэц, тэдгээрийн үйлдвэрлэлийн үндсэн урвал (жишээлбэл, полиэтилен эсвэл синтетик резин).
53. Синтетик каучукийн төрөл, тэдгээрийн шинж чанар, хэрэглээ.
54. Витамин Витаминуудын ангилал Витаминуудын биологийн үүрэг.
55. Ферментүүд Ангилал Биологийн үүрэг.
56. Гормонууд. Ангилал Биологийн үүрэг.
Холбогдох мэдээлэл.
= ОЮУТАН ХОТ = Нэгдүгээр курсын дэвтэр
1 СЕМЕСТРИЙН ШАЛГАЛТ
"Органик бус ба туршилтын химийн үндэс" хичээлийн шалгалтын хөтөлбөр
1-р семестр, JNF, 2011/2012 оны хичээлийн жил
Химийн тэнцвэр.Жинхэнэ тэнцвэрийн шинж тэмдэг. Нэг төрлийн ба дахь тэнцвэрийн тогтмолууд гетероген системүүд. Урвалж ба бүтээгдэхүүний тэнцвэрт концентраци, тэдгээрийн тооцооны тухай ойлголт.
Температур, даралт, урвалж, бүтээгдэхүүний концентрацийн өөрчлөлттэй холбоотойгоор Ле Шательегийн зарчим ба химийн тэнцвэрт өөрчлөлт.
Редокс урвалууд(OVR). Атомын исэлдэлтийн зэрэг ба түүний ORR-ийн өөрчлөлт.Ердийн исэлдүүлэгч бодис ба ангижруулагч бодисууд. Исэлдүүлэх, багасгах үйлчилгээтэй бодисууд. OVR дахь хүрээлэн буй орчны үүрэг. Электрон-ион хагас урвалын аргыг ашиглан ORR тэгшитгэлийг зурах.
Стандарт электрохимийн потенциал нь усан уусмал дахь бодисын исэлдэлтийн шинж чанарын шинж чанар юм. Стандарт нөхцөлд OVR-ийн чиглэлийн шалгуур. Тооцооллын асуудлыг шийдвэрлэх.
Ерөнхий шинж чанаруудшийдлүүд.Уусгагч ба ууссан бодис. Төвлөрсөн ба шингэрүүлсэн уусмал. Ханасан, ханаагүй, хэт ханасан уусмал, тэдгээрийг бэлтгэх арга. Уусах чадвар. Уусалтын дулааны нөлөө. Уусах чадварын диаграммууд (политермүүд). Шингэн уусгагч дахь хий ба талст бодисын уусах чадварын температураас хамаарах байдал.
Электролит ба электролит бус уусмал.Оствальд шингэрүүлэх хууль.
Бага уусдаг хүчтэй электролит ба уусах бүтээгдэхүүн (SP). PR утгыг ашиглан тооцоо хийх. Хур тунадас, тунадасыг уусгах нөхцөл. Шилжилт фазын тэнцвэрт байдалбага уусдаг хүчтэй электролитийн ханасан уусмалд.
Протоны онолын үндсэн ойлголтуудхүчил ба суурь. Протик уусгагч ба тэдгээрийн ионы бүтээгдэхүүн. Протоны онол дахь хүчил ба суурь. Хүчиллэг ба суурийн тогтмолууд ба тэдгээрийн хоорондын хамаарал. Амфолитууд.
Температурын нөлөөн дор протолитийн тэнцвэрт байдал, протолитийн концентраци (шингэрэлт) болон протолизын бүтээгдэхүүний ижил ионуудыг нэвтрүүлэх үед шилжих. Хязгааргүй шингэрүүлэлтийн ойролцоо уусмал дахь протолизын зэрэг ба рН.
Усны ионы бүтээгдэхүүн. Дунд зэргийн хүчиллэг байдлын устөрөгч ба гидроксидын үзүүлэлтүүд. Усан уусмалын рН хэмжүүр.
Солволиз ба гидролиз.Хоёртын нэгдлүүдийн эргэлт буцалтгүй гидролиз. Давсны урвуу гидролиз. Гидролизийн тэнцвэрт өөрчлөлт.
Хүчтэй ба сул хүчил, суурь, түүнчлэн амфолитийн үед рН-ийн утга ба протолизийн зэрэглэлийн тооцоо.
Атомын бүтэц ба үечилсэн хууль. Устөрөгчийн атом. Олон электрон атомууд. Хамгийн гол нь тойрог зам, соронзон, спин квант тоо юм. Атомын тойрог зам, электрон түвшин ба дэд түвшин.
Хамгийн бага энергийн зарчим, Хундын дүрэм, Паулигийн зарчим. Электронууд атомын тойрог замд байрлах дараалал. Клечковскийн дүрэм. Элементүүдийн атомын электрон томъёо, энергийн диаграм.
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем. Үе ба бүлгүүд. Хэсэгүүд s-, p-, d-Тэгээд f-элементүүд.
Химийн холбоо.Ион ба ковалент холбоо. Валентийн холбооны аргын үндсэн ойлголтууд. Электрон орбиталуудын давхцал; сигма, пи, дельта холболт. Олон холболт. Гибридизаци ба молекулын геометрийн санаа.
Бондын туйлшрал ба молекулуудын туйлшрал. Химийн бондын диполь момент ба молекулын диполь момент.
Молекулын тойрог замын аргын тухай ойлголт. Устөрөгчийн холбоо ба молекул хоорондын харилцан үйлчлэл.
Оюутнууд 1-р улирлын шалгалтанд эерэг дүн авахад шаардагдах мэдлэг
1. Тэмдгүүдхимийн элементүүд ба тэдгээрийн нэр. Хэсэгүүд s-, p-, d-Тэгээд f-Үелэх систем дэх элементүүд.2. Нэршилорганик бус бодис (лекцийн хичээл, лабораторийн дадлага, гэрийн даалгаварт агуулагдах томъёо, нэрс).
3. Цахим тохиргооҮелэх систем дэх атомуудыг координатаар нь (бүлгийн дугаар, хугацааны дугаар).
4. Үндсэн, тойрог зам, соронзон квант тоо, тэдгээрийн хоорондын холбоо ба энергийн түвшин, дэд түвшин, атомын орбиталуудын тоо.
5. Тодорхойлолт эрлийзжүүлэлтийн төрөлатомын орбитал ба AB төрлийн бөөмсийн геометрийн хэлбэрийг таамаглах X(молекулууд эсвэл ионууд), A, B нь атомууд юм с-Тэгээд p-элементүүд.
6. Тэнцвэрийн тогтмол.Хүчиллэг ба суурийн тогтмолууд. Ле Шательегийн зарчимхимийн тэнцвэрт байдлыг өөрчлөх.
7. Уусах чадварорганик бус бодисууд. Уусах чадварын бүтээгдэхүүн. Хур тунадас орох нөхцөл ба түүний уусах байдал.
8. Урвалын тэгшитгэл зохиохдараах төрлүүд:
* усан уусмал дахь солилцооны урвал (молекул ба ионы тэгшитгэл)
* усан уусмал дахь исэлдэлтийн урвал (молекул ба ионы тэгшитгэл, электрон-ионы хагас урвалын аргаар коэффициентийг сонгох)
* уусгагч болгон усыг оролцуулсан протолит урвал
* давсны гидролизийн урвал, хоёртын нэгдлүүдийн гидролиз.
9. Уусмалын найрлага:
* массын хэсэг
* молярт (ууссан бодисын молийн концентраци)
10. Хүчиллэг, шүлтлэг, төвийг сахисан орчинусан уусмал. Устөрөгчийн индекс (рН). Усан уусмалын рН хэмжүүр.
Органик бус химийн бичгийн шалгалтын талаар оюутнууд юу мэдэх ёстой вэ
# Шалгалт К-2 өрөөнд 9.00 цагаас эхэлнэ. Ерөнхий химийн хичээлээр 1 улирлын 15-24 оноо авсан оюутнуудын хувьд шалгалт 9.30 цагт эхэлнэ. Тодорхой ангиллын оюутнууд шалгалт өгөх тасалбарын төрлийг сонгох эрхтэй: үндсэн түвшин (хамгийн их оноо 50 оноо) эсвэл тасалбар нөхөн үржихүйн түвшин (хамгийн их оноо 24 оноо).
# Үнийн дэвтэргүй оюутнууд шалгалт өгөхгүй.Оюутан кредит дутуу болон бусад шалтгааны улмаас шалгалтад ороогүй тохиолдолд тэнхим нь зөвхөн деканаас бичгээр зөвшөөрөл авсан тохиолдолд түүнээс шалгалт авч болно.
# Боловсруулах хугацаа бичсэн ажилшалгалт дээр 9.00-12.00 цаг хүртэл(9.30-аас 12.30 хүртэл). Шалгалтын үеэр та органик бус химийн лавлах хүснэгт (жижүүр багшийн гаргасан) болон бичил тооцоолуур ашиглахыг зөвшөөрнө. Оюутнууд бичгийн ажлын цаасыг шалгалтын картын хамт жижүүр багшаас авдаг.
# Шалгалтын үеэр зөвшөөрөгдөөгүйгар утас, цахим дэвтэр, зөөврийн компьютер ашиглах. Оюутан үзэгчдийг орхиж байнашалгалтын үеэр зөвхөн жижүүрийн багшийн зөвшөөрлөөр боломжтой бөгөөд бүх тохиолдолд шалгалтын картыг өөрчлөх шаардлагатай.
# Үр дүнгийн зарлалшалгалт - шалгалт өгөх өдөр, 15.00 цагт Органик бус химийн тэнхим дээр. Туршилтын дэвтэр олгох - 15.00 цагт, зөвхөн оюутан бүрт биечлэн олгоно.
# Шалгалтын тасалбарДараах сэдвээр 6 асуултыг багтаасан болно.
1. Химийн тэнцвэрт байдал;
2. Уусмалын ерөнхий шинж чанар, уусах чадварын бүтээгдэхүүн;
3. Редокс урвал;
4. Протолитийн тэнцвэрт байдал, гидролиз;
5. Атомын бүтэц, үечилсэн хууль;
6. Химийн холбоо ба молекулын бүтэц.
## 2, 3 эсвэл 4 тасалбарын асуултыг илэрхийлнэ тооцооны асуудал 1-р улиралд судалсан төрлүүдийн нэг.
## тооцооны асуудал дагалддаг нэмэлт асуултууд, хангалттай буюу сайн үнэлгээ өгөх шаардлагагүй (налуу үсгээр, хайрцгаар хүрээлэгдсэн).
## Эерэг үнэлгээ (“хангалттай”) авахын тулд та өгөх ёстой бүх зургаан асуултын зөв хариулт("Эерэг үнэлгээ авахын тулд оюутнуудад шаардагдах мэдлэг" -ийг үзнэ үү). Асуултуудын хариултууд нь тодорхой, ойлгомжтой, үндэслэлтэй, химийн мэдлэгтэй байх ёстой (томьёо, химийн урвалын тэгшитгэл, физик, химийн хэмжигдэхүүний орчин үеийн тэмдэглэгээг ашиглах, асуудлыг шийдвэрлэхдээ тооцооны томьёог гаргаж авах гэх мэт).
Нэмэлт асуултад зөв, бүрэн, үндэслэлтэй хариулт өгөх нь ажлыг маш сайн үнэлэх үндэс суурь болдог.
Бичсэн шалгалтын хуудасүнэлэгддэг оноогоордараах байдлаар:
41-50 оноо - "маш сайн"
31-40 оноо - "сайн"
21-30 оноо - "хангалттай"
0-20 оноо - "хангалтгүй"
Тасалбар №1
Д.И.Менделеевийн үечилсэн хууль ба химийн элементүүдийн үечилсэн систем нь атомын бүтцийн талаархи санаан дээр үндэслэсэн. Утга үечилсэн хуульшинжлэх ухааныг хөгжүүлэхийн төлөө.1869 онд Д.И.Менделеев энгийн бодис, нэгдлүүдийн шинж чанарын шинжилгээнд үндэслэн Үелэх хуулийг томъёолжээ.
Энгийн биеийн шинж чанарууд ... ба элементийн нэгдлүүд нь элементүүдийн атомын массын хэмжээнээс үе үе хамааралтай байдаг.
Тогтмол хуулинд үндэслэн элементүүдийн үечилсэн системийг эмхэтгэсэн. Үүнд ижил төстэй шинж чанартай элементүүдийг босоо багана - бүлгүүдэд нэгтгэсэн. Зарим тохиолдолд элементүүдийг үечилсэн системд байрлуулахдаа шинж чанаруудын давталтын давтамжийг хадгалахын тулд атомын массын өсөлтийн дарааллыг зөрчих шаардлагатай байв. Жишээлбэл, теллур, иод, түүнчлэн аргон, кали зэргийг "солих" шаардлагатай байв.
Учир нь атомын бүтцийн талаар юу ч мэдэгдээгүй үед Менделеев үелэх хуулийг санаачилсан.
20-р зуунд атомын гаригийн загварыг санал болгосны дараа үечилсэн хуулийг дараах байдлаар томъёолсон.
^
Химийн элемент ба нэгдлүүдийн шинж чанар нь атомын цөмийн цэнэгээс үе үе хамааралтай байдаг.
Цөмийн цэнэг нь үелэх систем дэх элементийн тоо болон атомын электрон бүрхүүл дэх электронуудын тоотой тэнцүү байна.
Энэхүү томъёолол нь Тогтмол хуулийн "зөрчил"-ийг тайлбарлав.
Үелэх системд хугацааны дугаар тоотой тэнцүү байнаатом дахь электрон түвшин, үндсэн дэд бүлгийн элементүүдийн бүлгийн дугаар нь гаднах түвшний электронуудын тоотой тэнцүү байна.
Химийн элементүүдийн шинж чанарыг үе үе өөрчлөх шалтгаан нь электрон бүрхүүлийг үе үе дүүргэх явдал юм. Дараагийн бүрхүүлийг дүүргэсний дараа шинэ үе эхэлнэ. Элементүүдийн үе үе өөрчлөгдөх нь ислийн найрлага, шинж чанарын өөрчлөлтөөс тодорхой харагдаж байна.

Тогтмол хуулийн шинжлэх ухааны ач холбогдол. Тогтмол хууль нь химийн элементүүд болон тэдгээрийн нэгдлүүдийн шинж чанарыг системчлэх боломжийг олгосон. Эмхэтгэх үед тогтмол хүснэгтМенделеев нээгдээгүй олон элемент байдгийг урьдчилан таамаглаж, тэдэнд хоосон эс үлдээж, нээгдээгүй элементүүдийн олон шинж чанарыг урьдчилан таамагласан нь тэднийг нээхэд дөхөм болсон.
Тасалбар №2
Д.И.Менделеевийн химийн элементийн үечилсэн системийн IV-А бүлгийн хоёрдугаар үеийн элементүүдийн жишээг ашиглан химийн элементийн атомын бүтэц. Эдгээр химийн элементүүд болон тэдгээрийн атомын бүтцээс хамааран тэдгээрийн үүсгэсэн энгийн ба нарийн төвөгтэй бодисуудын (оксид, гидроксид) шинж чанарын өөрчлөлтийн зүй тогтол.Хугацааны дагуу зүүнээс баруун тийш шилжих тусам элементүүдийн металл шинж чанар улам бүр багасдаг. Нэг бүлгийн дотор дээрээс доошоо шилжих үед элементүүд нь эсрэгээрээ улам бүр тодрох металл шинж чанарыг харуулдаг. Богино хугацааны (2, 3-р үе) дунд хэсэгт байрлах элементүүд нь ихэвчлэн араг ясны ковалент бүтэцтэй байдаг бөгөөд эдгээр үеийн баруун хэсгийн элементүүд нь энгийн ковалент молекулууд хэлбэрээр оршдог.

Атомын радиус дараах байдлаар өөрчлөгддөг: тодорхой хугацааны дагуу зүүнээс баруун тийш шилжих үед буурах; бүлгийн дагуу дээрээс доошоо шилжих үед нэмэгдэнэ. Хугацааны туршид зүүнээс баруун тийш шилжих үед цахилгаан сөрөг чанар, иончлолын энерги, электроны хамаарал нэмэгдэж, галогенүүдийн хувьд хамгийн дээд хэмжээнд хүрдэг. Эрхэм хийн хувьд цахилгаан сөрөг чанар нь 0. Бүлгийн дагуу дээрээс доошоо шилжих үед элементүүдийн электрон хамаарлын өөрчлөлт нь тийм ч онцлог шинж чанартай биш боловч үүнтэй зэрэгцэн элементүүдийн электрон сөрөг чанар буурдаг.

Хоёр дахь үеийн элементүүдэд 2s, дараа нь 2p орбиталууд дүүрдэг.


Д.М.Менделеевийн химийн элементүүдийн үечилсэн системийн IV бүлгийн үндсэн дэд бүлэгт нүүрстөрөгч С, цахиур Si, германий Ge, цагаан тугалга Sn, хар тугалга Pb орно. Эдгээр элементүүдийн гаднах электрон давхарга нь 4 электрон агуулдаг (s 2 p 2 тохиргоо). Тиймээс нүүрстөрөгчийн дэд бүлгийн элементүүд нь зарим ижил төстэй шинж чанартай байх ёстой. Ялангуяа тэдгээрийн исэлдэлтийн хамгийн дээд түвшин ижил бөгөөд +4 байна.

Дэд бүлгийн элементүүдийн шинж чанарын ялгаа юунд хүргэдэг вэ? Ионжуулалтын энерги ба тэдгээрийн атомын радиусын ялгаа. Атомын тоо нэмэгдэхийн хэрээр элементүүдийн шинж чанар өөрчлөгддөг. Тиймээс нүүрстөрөгч ба цахиур нь ердийн металл бус, цагаан тугалга, хар тугалга нь металл юм. Энэ нь юуны түрүүнд нүүрстөрөгч нь энгийн металл бус бодис (алмаз) үүсгэдэг бөгөөд хар тугалга нь ердийн металл юм.
Германиум нь завсрын байр суурийг эзэлдэг. Атомын электрон бүрхүүлийн бүтцийн дагуу IV бүлгийн p-элементүүд исэлдэлтийн төлөвтэй байна: +4, +2, – 4. Устөрөгчийн хамгийн энгийн нэгдлүүдийн томъёо нь EN 4, ба E-N холболтуудковалент ба эквивалент s- ба p-орбиталуудын эрлийзжүүлэлтийн улмаас тетраэдр өнцөгт чиглэсэн sp 3 орбиталууд үүсдэг.
Металл бус элементийн шинж чанар суларч байгаа нь дэд бүлэгт (C-Si-Ge-Sn-Pb) хамгийн өндөр эерэг исэлдэлтийн төлөв +4 улам бүр багасч, исэлдэлтийн төлөв +2 илүү ердийн шинж чанартай болж байна гэсэн үг юм. Тиймээс хэрэв нүүрстөрөгчийн хувьд хамгийн тогтвортой нэгдлүүд нь +4 исэлдэлтийн төлөвтэй байдаг бол хар тугалганы хувьд +2 исэлдэлтийн төлөвтэй нэгдлүүд хамгийн тогтвортой байдаг.
Элементүүдийн нэгдлүүдийн тогтвортой байдлын талаар бид юу хэлж чадах вэ? сөрөг зэрэгисэлдэлт -4? VII-V бүлгийн металл бус элементүүдтэй харьцуулахад IV бүлгийн p-элементүүд нь металл бус элементийн шинж тэмдгийг бага хэмжээгээр харуулдаг. Тиймээс нүүрстөрөгчийн дэд бүлгийн элементүүдийн хувьд сөрөг исэлдэлтийн төлөв нь хэвийн бус байдаг.
^
Тасалбарын дугаар 3.
Органик бус нэгдлүүд дэх химийн бондын төрөл ба тэдгээрийн үүсэх аргууд: ковалент (туйлт, туйлт бус, энгийн ба олон холбоо), ион, устөрөгч.
^ Ковалент холбоо хоёр атомын электрон үүлний давхцалаас үүссэн. Атом бүр нэг химийн холбоо үүсгэхийн тулд нэг хосгүй электроныг оруулдаг бөгөөд энэ нь үүснэ хуваалцсан электрон хос. Хэрэв хоёр ижил атомын хооронд ковалент холбоо үүссэн бол үүнийг гэнэ туйлшралгүй.

Хэрэв хоёр өөр атомын хооронд ковалент холбоо үүссэн бол хуваалцсан электрон хос нь илүү их электрон сөрөг шинж чанартай атом руу шилждэг (цахим сөрөг гэдэг нь атомын электронуудыг татах чадвар юм). Энэ тохиолдолд байдаг туйлын ковалент холбоо.

Ковалентын бондын онцгой тохиолдол бол донор-хүлээн авагчийн холбоо. Үүнийг үүсгэхийн тулд нэг атом нь гаднах электрон түвшинд чөлөөт тойрог замтай байх ёстой, нөгөө нь хос электронтой байх ёстой. Нэг атом (донор) нөгөө атомыг (хүлээн авагч) электрон хосоор хангадаг бөгөөд үүний үр дүнд энэ нь хуваагдаж, үүсдэг. химийн холбоо. Жишээ - CO молекул:

^ Ионы холбоомаш өөр цахилгаан сөрөг хүчинтэй атомуудын хооронд үүссэн. Энэ тохиолдолд нэг атом электроноо өгөөд эерэг цэнэгтэй ион, электрон хүлээн авсан атом сөрөг цэнэгтэй болж хувирдаг. Ионууд нь электростатик татах хүчний нөлөөгөөр хоорондоо холбогддог.

^ Устөрөгчийн холбоо эсрэг цэнэгийн таталцлаас болж туйлын молекулуудын (ус, спирт, аммиак) хооронд үүсдэг.

Устөрөгчийн бондын хүч нь ион эсвэл ковалент холбооноос хамаагүй бага (~20 дахин).
n1.doc
2. Химийн атом-молекулын сургаал.Үндсэн заалтуудыг Ломоносов материйн бүтцийн тухай капсулын онол хэлбэрээр томъёолсон - бүх бодисууд нь бүхэл бүтэн бодистой ижил найрлагатай, тасралтгүй хөдөлгөөнд байдаг капсулуудын (молекулуудын) хамгийн жижиг хэсгүүдээс бүрддэг. Химийн бүрэлдэхүүн ижил төрлийн атом юм эерэг цэнэгцөм. Атом - химийн элементийн шинж чанарыг зөөвөрлөх хамгийн жижиг тоосонцор. Атом бол хууль тогтоомжид захирагддаг цахилгаан саармаг микросистем юм квант физикэерэг цэнэгтэй цөм, сөрөг цэнэгтэй электронуудаас бүрддэг. Молекул – шинж чанарыг тодорхойлдог, бие даан оршин тогтнох чадвартай бодисын хамгийн жижиг бөөмс. Атомуудыг химийн холбоо ашиглан молекул болгон нэгтгэдэг бөгөөд үүсэхэд голчлон гадаад (валент) электронууд оролцдог.
1911 онд Рутерфорд атомын бүтцийг тодорхой болгох туршилт хийж 1913 онд Бор-Рутерфордын “устөрөгчийн атом”-ын хамгийн энгийн гаригийн загвар гарч ирэв.
Энэ загвар нь одоогоор атомын нийтээр хүлээн зөвшөөрөгдсөн "албан ёсны" загвар юм.
давуу тал нь энгийн байдал Энэ загвараар атом нь авсаархан эерэг цөм ба түүний эргэн тойронд "хөдөлгөөнгүй дугуй тойрог замд" эргэдэг электроноос бүрдэх ёстой байсан.Эдгээр дутагдал нь ердөө л гайхалтай юм.
1) төв талбар дахь биеийн хөдөлгөөний асуудлын шийдлийн дагуу атомын эргэн тойронд электрон тойрог зам дагуу хөдөлж чадахгүй. Замууд нь зууван хэлбэртэй байх ёстой.Гэхдээ ийм загварт эллипс байх боломжгүй
Н.БорАтом нь зөвхөн тусгай хөдөлгөөнгүй төлөвт байж болно, тус бүр нь тодорхой энергитэй байдаг. Хөдөлгөөнгүй төлөвт атом нь цахилгаан соронзон долгион ялгаруулдаггүй.
Атомын энерги ялгарах, шингээх нь нэг хөдөлгөөнгүй төлөвөөс нөгөөд огцом шилжих үед тохиолддог. Давуу тал:
Устөрөгчтэй төстэй атомуудын энергийн төлөв байдлын салангид байдлыг тайлбарлав.
Борын онол нь атомын доторх үйл явцын тайлбарт цоо шинэ байр сууринаас хандаж, атомын анхны хагас квант онол болсон. Алдаа дутагдал
Спектрийн шугамын эрчмийг тайлбарлаж чадсангүй.
Зөвхөн устөрөгчтэй төстэй атомуудад хүчинтэй байх ба үелэх систем дэх атомын дараа ажиллахгүй.
3.Б1924 Г. Францын физикч Луи де Бройль бодис нь долгионы болон корпускуляр шинж чанартай байдаг гэсэн санааг дэвшүүлсэн. Де Бройлийн тэгшитгэлийн дагуу (квант механикийн үндсэн тэгшитгэлүүдийн нэг)
өөрөөр хэлбэл, v хурдтай хөдөлж буй m масстай бөөмс урттай долгионтой тохирч байна уу?; h- Планкийн тогтмол. m масстай, мэдэгдэж буй v хурдтай аливаа бөөмийн хувьд де Бройлийн долгионы уртыг тооцоолж болно. Де Бройлийн санаа 1927 онд электронуудын долгионы болон корпускуляр шинж чанарыг нээснээр туршилтаар батлагдсан. 1927 онд Германы эрдэмтэн В.Гейзенберг тодорхойгүй байдлын зарчмыг дэвшүүлсэн бөгөөд энэ зарчмын дагуу бичил бөөмийн хувьд X бөөмийн координат болон импульсийн px бүрэлдэхүүнийг х тэнхлэгийн дагуу нэгэн зэрэг нарийн тодорхойлох боломжгүй юм. Нэг электрон нь цөмийн талбарт хөдөлж буй электронуудын харилцан үйлчлэлийн нарийн төвөгтэй систем боловч атомд электрон тус бүрийн төлөв байдлын тухай ойлголтыг хөдөлгөөнгүй гэж тусад нь оруулах боломжтой болох нь тодорхой болжээ. Цөм бусад бүх электронуудын хамт үүсгэсэн зарим үр дүнтэй төв тэгш хэмийн талбар дахь электрон хөдөлгөөний төлөв. Атом дахь янз бүрийн электронуудын хувьд эдгээр талбарууд нь ерөнхийдөө ялгаатай бөгөөд тэдгээр нь тус бүр нь бусад бүх электронуудын төлөв байдлаас хамаардаг тул тэдгээрийг нэгэн зэрэг тодорхойлох ёстой. Ийм талбарыг өөрөө тууштай гэж нэрлэдэг.Өөртөө нийцсэн талбар нь төвлөрсөн тэгш хэмтэй байдаг тул электроны төлөв бүр нь түүний тодорхой утгаараа тодорхойлогддог. тойрог замын момент/.Өгөгдсөн / дахь бие даасан электроны төлөвүүдийг n = /+1, /+2, ... утгуудаар дамждаг үндсэн квант тоог n ашиглан дугаарлана (энергийн өсөлтийн дарааллаар); Энэ дугаарлалтын дарааллыг устөрөгчийн атомд тохирсон дарааллаар тогтооно. Гэхдээ янз бүрийн / нарийн төвөгтэй атомуудын энергийн түвшинг нэмэгдүүлэх дараалал нь ерөнхийдөө устөрөгчийн атомд тохиолддогоос ялгаатай юм.
4. Орбиталуудыг дүүргэх зарчим.
1. Паули зарчим. Атомд бүх квант тоонуудын (n, l, m, s) утгууд нь ижил байх хоёр электрон байж болохгүй, өөрөөр хэлбэл. Орбитал бүр хоёроос илүүгүй электрон (эсрэг эргэлттэй) агуулж болно.
Хар-каков. St.
Гэрлийн энерги, гэрлийн урт, ханалт, чиглэл.
12.VS арга.
Зоригтой. Зураг Сонго. Гадна талд байрлах электронуудыг нийгэмшүүлэх замаар нягтрал. Электрон. Түвшин.
Алдаа дутагдал
Зарим нэгдлүүдийн уурын соронзон шинж чанарыг тайлбарлаж чадаагүй. (t -220 үед O нь шингэн болж, соронзонд татагддаг)
Амьтад Мол. Ионууд (He 2+, H 2+, O 2-)
заалтууд
Зураг. x/s нь электронууд атомын орбиталуудаас тодорхой энергитэй шинэ түвшинд шилжсэний үр дүн юм. Бүгдээрээ атом. Молекулууд
Зургийн дараа. Мол. Орбитал - атом Бөмбөрцөг. Тэд хувийн шинж чанараа алддаг.
Тулгуур бүр Бөмбөрцөг. Хариулах Тодорхойлогдсон эрчим хүч.
Молекул дахь электронууд нь орон нутгийн бус байдаг. Цөм хоорондын зайд 2 атомыг олоорой. Цөмийн зэвсгийн хүрээнд
Гибридизаци өөрөө бий болдог. Хэлбэр ба эрчим хүчийг тэгшлэх үйл явц.
13. MO арга
Валент холболтын аргын сайжруулсан хувилбар. Зарчмууд дээр үндэслэсэн. 1. Атомуудын хоорондох химийн холбоо нь нэг буюу хэд хэдэн электрон хосоор дамжин явагддаг. 2. Нийтлэг электрон хос үүсэхэд электрон үүлнүүд давхцдаг. Илүү хүчтэй давхцах тусам химийн холбоо илүү хүчтэй болно. 3. Нийтлэг электрон хос үүсэх үед электроны эргэлт нь эсрэг параллель байх ёстой. 4. Нийтлэг электрон хос үүсэхэд зөвхөн атомын хосгүй электронууд оролцож болно. Бонд үүсгэхийн тулд хосолсон электронуудыг салгах ёстой. 5. Хоёр атомын тодорхой тооны электрон үүлнээс ковалент холбоо үүсэхэд хоёр атомд хамаарах молекулын ижил тооны электрон үүл үүснэ. 6. Электрон үүл нэгдэх үед тэдгээрийн харилцан давхцаж молекулын үүл үүсэх, харилцан түлхэлт нь молекулын сулрах үүл үүсэх боломжтой. 7. Молекулын орбиталуудыг электроноор дүүргэх нь хамгийн бага энергийн зарчмын дагуу явагддаг ба Паули (Атом нь бүх 4 квант тооны ижил утгатай 2 электронтой байж болохгүй. 2-оос илүү электрон байж болохгүй. нэг тойрог замд байрладаг). 8. Бондын орбитал дахь электронуудын тоо эсрэгтөрөгчийн орбиталуудынхаас их байвал холбоо үүснэ. Ковалентын бондын шинж чанарууд. Энэ нь удаан эдэлгээтэй байдаг. Ханах шинж чанартай. Орон зайд чиглэлтэй байдаг.
14.хим. Термодинамик нь энергийг судалдаг. Өөрчлөлт.харгалзаж байнамуж дахь үйл явц Тэнцвэрт p-I нэг бол эхлээгүй эсвэл дуусаагүй бөгөөд урсгалууд гадагшаа урсдаг. Ямар ч орчин байхгүй.
Термодин. Систем гэдэг нь сэтгэцийн орчноос тусгаарлагдсан макроскоп бие юм. эсвэл физик хясаа.
Үе шатуудын тоогоор:
Нэг төрлийн (системийн бүх бүрэлдэхүүн хэсэг нь нэг үе шатанд байдаг)
Гетероген (химийн урвал өөр өөр фазын хэсгүүдэд явагддаг)
Хүрээлэн буй орчинтой харьцах шинж чанарын дагуу. Лхагва гараг:
Нээлттэй (юм, энерги солилцох), хаалттай (эрчим хүч солилцох), тусгаарлагдсан (солилцоо байхгүй)
Бүх тээврийн хэрэгсэл нь параметрүүдээр тодорхойлогддог: даралт, хэмнэл, эзэлхүүн, масс. Термодин. Системийн шилжилтийг судалдаг. Нэг найрлагаас. Нөгөө талаар - үйл явц: Аливаа химийн бодисыг тэнцвэржүүлэх. бүрэлдэхүүнээрээ дүүрэг Тэнцвэр, хөдөлгөөнгүй.
Изобарик(тогтмол даралт), изохорик(тогтмол эзэлхүүн), изотерм(тогтмол температур)
Тээврийн хэрэгслийн эрчим хүч: E = K + P + дельта U (дотоод)
Хими. термодин 2 хууль дээр үндэслэсэн
Хууль. Хадгалах Эрчим хүч - нэмэлт өөрчлөлт. Эрчим хүч Систем. Def. Гарсан дулааны хэмжээ ба гүйцэтгэсэн ажлын хэмжээ
Стандарт энтальпи - энтальпи тэр бүс нутагүүнээс 1 моль бодис үүсдэг энгийн хүмүүстогтвортой std дээр. Нөхцөл.
15.Термодинамикийн нэгдүгээр хууль
Энтальпи – төлөвийн функц тэнцүү дотоод энергисистем + өргөтгөлийн ажил. . Тогтмол даралттай үед
1 хууль-дулааны нөлөө p-i = дулаан. Ef. Урвуу p-i, гэхдээ тэмдгээр нь эсрэг байна.(Илүү их дулаан. Нийлмэл бодис үүсэх нөлөөлөл нь төдий чинээ тогтвортой байна).
16. Хессийн хууль - дулаан. Ef. Хими. p-i нь түүний урсах замаас хамаарахгүй, харин анхны болон эцсийн төлөвөөс хамаарна. систем.
Үр дагавар
- хууран мэхлэх Энтальпийн хим. r-i нь int тооноос хамаарахгүй. үе шатууд
Өндөр сонголттой
Катализаторын шинж чанарыг зохицуулах чадвар.
24.
Химийн
тэнцвэрт байдал
– урагш болон урвуу урвалын хурд тэнцүү байх системийн төлөв байдал.
Урвуу хамгаалалттай. Бүрэн биш, ийм r-р харилцан бүтээгдэхүүн. зургуудаас. ref. дотогшоо.
Эргэж буцахгүй r-i- алдагдсан. эцэс хүртэл, бүрэн хэрэглээ хүртэл. ref. дотогшоо болон бүтээгдэхүүн. r-i (тундас, хий, усны зураг)
Тогтмол
химийн тэнцвэрт байдал урвал = урвалын тэгшитгэлд авсан урвалын бүтээгдэхүүний концентрацийн үржвэрийг урвалын тэгшитгэл дэх стехиометрийн коэффициентүүдийн хүчин чадалд авсан эхлэлийн бодисын концентрацийн үржвэрт хуваасан.
25.
 потенциал буурвал үйл явц аяндаа урагшаа урагшилдаг тул тэнцвэрийн тогтмол нь 1-ээс их байна. Бүтээгдэхүүний концентрац > эхлэл бодисын концентрац. Хэрэв эсрэгээрээ бол бараг ямар ч хариу үйлдэл үзүүлээгүй. Температур нэмэгдэхэд тэнцвэр нь эндотермик урвал руу, температур буурах үед экзотермик урвал руу шилждэг. Даралт ихсэх тусам тэнцвэр нь хийн бодисын эзэлхүүн буурах үед үүсэх урвалын чиглэлд, даралт буурах үед хэмжээ ихсэх үед үүсэх урвалын чиглэлд шилждэг. Эхлэх бодисын концентраци нэмэгдэхийн хэрээр тэнцвэр шууд урвал руу шилждэг.
потенциал буурвал үйл явц аяндаа урагшаа урагшилдаг тул тэнцвэрийн тогтмол нь 1-ээс их байна. Бүтээгдэхүүний концентрац > эхлэл бодисын концентрац. Хэрэв эсрэгээрээ бол бараг ямар ч хариу үйлдэл үзүүлээгүй. Температур нэмэгдэхэд тэнцвэр нь эндотермик урвал руу, температур буурах үед экзотермик урвал руу шилждэг. Даралт ихсэх тусам тэнцвэр нь хийн бодисын эзэлхүүн буурах үед үүсэх урвалын чиглэлд, даралт буурах үед хэмжээ ихсэх үед үүсэх урвалын чиглэлд шилждэг. Эхлэх бодисын концентраци нэмэгдэхийн хэрээр тэнцвэр шууд урвал руу шилждэг.
Ле Шателье-Браун зарчим . Хэрэв тэнцвэрт байдалд байгаа системд гадны нөлөөлөл үзүүлэх юм бол тэнцвэр нь энэ нөлөөллийг сулруулах чиглэлд шилжинэ.
26. Шийдэл - хатуу, шингэн, хий - нэгэн төрлийн систем. зураг. өсөлт, өсөлт, бүтээгдэхүүн. Тэдний харилцан үйлчлэл
Уусгагч нь дүүргэгчээ өөрчилдөггүй бүрэлдэхүүн хэсэг юм. comp. зургуудтай. шийдлүүд
Концентраци - уусмалын тоо хэмжээ. нэгжээр ras-ra эсвэл rast-la-ийн эзэлхүүн буюу масс.
27.
Уусах чадвар гэдэг нь тухайн бодис нь бие даасан атом, ион, молекул эсвэл бөөмс хэлбэрээр агуулагддаг бусад бодисуудтай нэг төрлийн систем үүсгэх чадвар юм.
Өсөлтийн процесс нь нарийн төвөгтэй физик, химийн шинж чанартай байдаг. yavl., физикийн нэг. үзэгдлийн үйл явц Диффузын шийдэл. аяндаа хөдөлгөөний энэ үйл явцын өсөлтөд. Тархалтын хүч нь Халуун. Хөдөлгөөн
Ялгааны шалтгаан нь энтропийн өсөлт ба уусмалын хурд юм. тархалтын хурдаас хамаарна.
Шоронгийн үе шатуудын дүрэм
28.
хийг шингэн болгон уусгах. эктотерм процесс.(хий нь шингэн болж задрах үед.
Генригийн хууль:
Өгөгдсөн температурт хийн масс. Мөн энэ хэмжээ нь шингэн юм. шууд пропорциональ хэсэгчилсэн даралт хий
Далтоны хууль:
Тогтмол үед хольцын хийн бүрэлдэхүүн хэсэг бүрийн өсөлт. Температур, шууд пропорциональ. хэсэгчилсэн даралт шингэн бүрэлдэхүүн хэсэг мөн ерөнхий даралтаас хамаардаггүй. холимог болон хувь хүн бүрэлдэхүүн хэсэг.
Сеченовын хууль:
Электролит байгаа тохиолдолд хий нь шингэн болж хувирдаг. буурах
29. Коллежнэр төвлөрлөөс хамааран гэгээнтнүүд. растер, гэхдээ хамааралгүй. тэдний химээс. comp.
Даралт
баян
хос
шингэн
дуудсан Шингэний ууршилтын хурд = уурыг шингэн болгон конденсацлах үед шингэний дээгүүр тогтсон даралт. 1
хууль
Раул.
Уусмалаас дээш уусгагчийн уурын даралтын харьцангуй бууралт = ууссан бодисын моль фракц
Шийдэл
захирагч
энэ
хууль
гэж нэрлэдэг
тохиромжтой. 2
хууль
Раул.
Эбулиоскопийн.
Электролит бус уусмалын буцлах температурын өсөлт нь ууссан бодисын молийн концентрацтай пропорциональ байна.  , Э-эбуллиоскопийн тогтмол. E = 1000 г уусгагчд ууссан 1 моль бодисоос үүссэн буцлах температурын өсөлт. Криоскоп.
Электролитийн бус уусмалын хөлдөх цэгийн бууралт нь пропорциональ байна молийн концентрациууссан бодис.
, Э-эбуллиоскопийн тогтмол. E = 1000 г уусгагчд ууссан 1 моль бодисоос үүссэн буцлах температурын өсөлт. Криоскоп.
Электролитийн бус уусмалын хөлдөх цэгийн бууралт нь пропорциональ байна молийн концентрациууссан бодис.  ,
К-криоскоп = 1000 г уусгагч тутамд 1 моль ууссан электролит агуулагдах уусмалын хөлдөх цэгийг бууруулах.
,
К-криоскоп = 1000 г уусгагч тутамд 1 моль ууссан электролит агуулагдах уусмалын хөлдөх цэгийг бууруулах.
30. Тархалт ба осмос.
Осмос гэдэг нь ууссан бодисыг нэвчүүлэхгүй мембранаар дамжуулан уусмал дахь уусгагчийн молекулуудын нэг талын тархалтыг хэлнэ.
урвал,
хуваагдсан
дээр
ажил
концентраци
эх
бодисууд
авсан
В
градус
тэдний
стехиометрийн.
K*-г KH 2 O гэж тэмдэглэе. Хэмжигдэхүүнийг усны ионы бүтээгдэхүүн гэнэ. Ионик
ажил
ус= устөрөгчийн катионуудын концентраци ба концентрацийн үржвэр гидроксидын анионууд.Усны диссоциацийн тогтмол  . Уусмал дахь протон ба гидроксидын ионуудын концентрацийг өөрчилснөөр хүчиллэг эсвэл шүлтлэг орчин үүсдэг. -7 - шүлтлэг,
. Уусмал дахь протон ба гидроксидын ионуудын концентрацийг өөрчилснөөр хүчиллэг эсвэл шүлтлэг орчин үүсдэг. -7 - шүлтлэг,
>10 -7 - хүчиллэг.  .
Устөрөгч
үзүүлэлт (рН)тоогоор = эсрэг тэмдгээр авсан устөрөгчийн катионуудын концентрацийн аравтын логарифм.
.
Устөрөгч
үзүүлэлт (рН)тоогоор = эсрэг тэмдгээр авсан устөрөгчийн катионуудын концентрацийн аравтын логарифм.  , гидроксидын индексийг ижил төстэй байдлаар тооцдог
, гидроксидын индексийг ижил төстэй байдлаар тооцдог  . Төвийг сахисан орчны хувьд [рН] =7, шүлтлэг - [рН] >7, хүчиллэг - [рН]
. Төвийг сахисан орчны хувьд [рН] =7, шүлтлэг - [рН] >7, хүчиллэг - [рН]
38. Давсны гидролиз. Гидролизийн тогтмол ба зэрэг. Гидролиз– давсны устай урвалд орж сул электролит үүсгэдэг. Орчны рН-ийн өөрчлөлт дагалддаг. Жишээ Na 2 CO 3 =Na + +CO 3 2- диссоциаци, CO 3 2- +H 2 O=HCO 3 - +OH - гидролиз. Гидролиз нь ууссан давсны ионуудын усны молекулуудтай химийн харилцан үйлчлэлээс бүрдэх ба үүсэхэд хүргэдэг. бага зэрэг салсаннэгдлүүд ба хүрээлэн буй орчны урвалын өөрчлөлт. Тоон үнэ цэнэ шинж чанаргидролизийг гидролизийн зэрэг гэж нэрлэдэг h. Зэрэг гидролиз- тооны харьцаа гидролиз болсондавсны молекулыг ууссан давсны молекулын нийт тоонд. . Гидролизийн зэрэглэлийн хамаарал. Төвлөрөл бодисууд– шингэрүүлэлт их байх тусам гидролизийн зэрэг нэмэгдэнэ. Температур – температур өндөр байх тусам гидролиз илүү хүчтэй болно. Нэмэлт танихгүй хүмүүс бодисууд- шүлтлэг урвал үүсгэдэг бодисыг нэвтрүүлэх, рН > 7 давсны гидролизийг дарангуйлж, рН-тай гидролизийг сайжруулдаг. 7 ба эсрэгээр хүрээлэн буй орчинд хүчиллэг урвал үүсгэдэг бодисууд нь рН > 7 байхад гидролизийг нэмэгдүүлж, рН-ээр дарангуйлдаг. 7. байгаль ууссан бодисууд– Гидролизийн зэрэг нь химийн бодисоос хамаарна. ууссан давсны шинж чанар. 3 сонголт байна.
42.Хоол хийх арга:
Уусмалгүйгээр (бамбайлагдсан хэмжээний шингэнийг холих замаар; уусмалд хамгаалах хэмжээний хатуу бодис нэмэх замаар)
p-i тэгшитгэлийн дагуу
43.Буфер шийдлүүд- тодорхой хэмжээгээр хүчтэй хүчил эсвэл хүчтэй суурьт шингэлсэн эсвэл нэмэхэд рН-ийн утгыг бараг өөрчилдөггүй уусмалууд.
Буфер хүчин чадал. рН-ийн утгыг нэгээр өөрчлөхийн тулд 1 литр буфер уусмалд нэмэх шаардлагатай хүчтэй хүчил эсвэл суурьтай тэнцэх бодисын хэмжээгээр илэрхийлнэ.
44. Гетероген тэнцвэрт байдал
At холбоо барихуусгагчтай хатуу бодис, бодис уусч, тогтсоны дараа эхэлдэг термодинамиктэнцвэрт байдалд ханасан уусмал үүснэ. Хэзээ бага зэрэг уусдагхарьцангуй ханасан усан уусмал дахь электролит бага зэрэг уусдагэлектролит.
Уусах чадварын бүтээгдэхүүн - ионы концентрацийн бүтээгдэхүүн бага зэрэг уусдагТогтмол температур ба даралтад түүний ханасан уусмал дахь электролит. Ажил уусах чадвар-утгатогтмол.
Ионы бүтээгдэхүүн нь уусах чадвараас их байвал тунадас үүснэ
45.ORP. Redox урвалууд- нэгдлүүдийг бүрдүүлдэг элементүүдийн исэлдэлтийн төлөв өөрчлөгдөхөд тохиолддог ийм урвалууд. Исэлдэлтийн төлөв нь дахин хуваарилалтын үр дүнд үүссэн молекул дахь атомын бодит цэнэг юм. электрон нягт.
46. Исэлдэлт нь электроноо алдаж, CO-ийн хэмжээг ихэсгэхэд хүргэдэг. Исэлдүүлэгч бодисууд: энгийнбодис, их цахилгаан сөрөг нөлөөтэй атомууд (F, O. CE); агуулсан бодисууд. Хамгийн их CO дахь элементүүд; ME ба N катионууд.
Бууруулах бодис: атомууд нь бага ЭО-той энгийн бодисууд; Өө, чи доод талд байна. CO
47.Молекул хоорондын- өөрчлөх Янз бүрийн молекул дахь CO exl.comproportionation(за,Энэ нь ижил имэйл боловч өөр өөр CO-д байна)
Молекул доторх -изм. Нэг молекул дахь CO
2. Клечковскийн дүрэм (хамгийн бага энергийн зарчим). Үндсэн төлөвт электрон бүр энерги нь хамгийн бага байхаар зохион байгуулагдсан байдаг. Нийлбэр (n + l) бага байх тусам тойрог замын энерги бага байна. Өгөгдсөн утгын хувьд (n + l) бага n-тэй тойрог зам нь хамгийн бага энергитэй байна. Орбиталуудын энерги дараах дарааллаар нэмэгддэг.
1S
3. Хундын дүрэм. Үндсэн төлөвт байгаа атом нь тодорхой дэд түвшинд хамгийн их хосгүй электронтой байх ёстой.
Атомын электронуудын боломжит хамгийн бага энергитэй төлөвийг үндсэн буюу өдөөгдээгүй төлөв гэж нэрлэдэг. Гэсэн хэдий ч атомууд гаднаас энерги авдаг бол (жишээлбэл, цацраг туяа, халаах үед) гаднах электрон давхаргын электронууд "уураар" хуваагдаж, илүү их энергиээр тодорхойлогддог чөлөөт тойрог замд шилжиж болно. Атомын энэ төлөвийг өдөөгдсөн гэж нэрлэдэг.
5.Үе үе хууль.Элементүүдийн шинж чанар, тэдгээрийн нэгдлүүдийн бүтэц, шинж чанар нь атомын цөмийн цэнэгээс үе үе хамаардаг. Элементийн атомын дугаар = түүний цөмийн цэнэг ба электронуудын тоо. Нейтроны тоо = атомын масс - атомын дугаар. Үе бүр s - элементүүд (s 1 шүлтлэг металл) -аар эхэлж, p - элемент (s 2 p 6 инертийн хий) -ээр төгсдөг. 1-р үе нь 2 s-элемент агуулдаг. 2-3 нь 2 s - элемент, 6 p - элемент агуулдаг. 4-5 d-д элементүүд нь s ба p-ийн хооронд шаантагтай байна. Цахим түвшний тоо = хугацааны дугаар. Үндсэн дэд бүлгүүдийн элементүүдийн хувьд электронуудын тоо = бүлгийн дугаар. Дээрээс доош бүлэгт металлын шинж чанар нэмэгддэг. Зүүнээс баруун тийш металл бус шинж чанар (электроныг хүлээн авах чадвар) нэмэгддэг. s-, p- ба d элементүүдийн шинж чанарын өөрчлөлтийн давтамж.
Атомын хими. Элемент нь эерэг цэнэгтэй протон, цэнэггүй нейрон, сөрөг цэнэгтэй электрон гэсэн 3 үндсэн энгийн бөөмсөөс бүрдэнэ. Атомын төвд протон, нейтроноос бүрдсэн цөм байдаг бөгөөд электронууд нь тойрог замд эргэлддэг. Электронуудын тоо = цөмийн цэнэг. Химийн бүрэлдэхүүн– тодорхой цөмийн цэнэгтэй атомын төрөл. Изотопууд- ижил цөмийн цэнэгтэй боловч өөр өөр масстай ижил элементийн атомууд. Изобарууд - өөр өөр цөмийн цэнэгтэй, гэхдээ ижил атомын масстай өөр өөр элементийн атомууд. Орчин үеийн загвар нь 2 дээр суурилдаг суурьквант физикийн зарчмууд. 1. Электрон нь бөөмс болон долгионы шинж чанарыг нэгэн зэрэг эзэмшдэг. 2. бөөмс нь нарийн тодорхойлогдсон координат ба хурдтай байдаггүй. Эрчим хүч түвшин(квант тоо n) – цөмөөс зай. n ихсэх тусам электрон энерги нэмэгддэг. Эрчим хүчний түвшний тоо = тухайн элемент байрлах хугацааны тоо. Электроны хамгийн их тоог N=2n 2-оор тодорхойлно. Эрчим хүч дэд түвшинүсгээр тэмдэглэсэн s (бөмбөрцөг), х (гантель хэлбэртэй), d (4 дэлбээтэй сарнай), f (илүү төвөгтэй). Гадаад соронзон оронтой электрон үүлний соронзон квант тооны харилцан үйлчлэл. Спин квант тоо нь электроны тэнхлэгийг тойрон эргэх эргэлт юм .
7. x/s- харилцан үйлчлэлийн үр дүн атомын хөтөч. дүрс рүү хим. молекулууд.
8. эрчим хүч- x/c-ийн хагарал үүсэхэд зайлшгүй шаардлагатай буюу x/c үүсэх үед суллагдсан.
Урт нь харилцан үйлчилж буй атомуудын цөм хоорондын хамгийн богино зай юм
Ханалт-тоодүрслэх боломжтой x/s. Өгөгдсөн элементийн атом.
Ханалт - валент
Анхаарал хандуулах - хатуубайршил гурван хэмжээст орон зайд x/s
9.1.Баримтлал-харилцан.Харилцаа холбоо 2 ба түүнээс дээш давхартай бол. Тэд хэлэхдээ
2. индукц - нэг моль. Туйлт, хоёр дахь нь тийм биш
3. тараах - зурагтай холбоотой. Агшин зуурын диполь (пол бус моль шинж чанар)
10.Inon гэрлийн үр дүнгийн электростат. харилцан м/y ионууд.(хуурамч талбайн хязгаарлах тохиолдол. St.) нийт цахилгаан. Хос гэдэг нь харилцан үйлчлэлийн зөвхөн нэгийг хэлнэ. Атомууд.
туйлшрал-үзэгдэл Шүлс. Атомын деформаци илэрсэн. Үйл ажиллагааны бүсэд тогтмол эсвэл цахилгаан Молек. катод (-) анод (+)
ионы туйлшрал (туйлшрал) -д орох чадвар, радиус.
11.Ков х/с - электронуудын нийгэмших үйл явц олддог. Гадна талд Эрч хүчтэй Түвшин.
Туйлгүй (Н2 ялгаагүй) туйл (NSE)
Механизмын зураг.
Солилцоо -зураг руу x/c оролцоо Атом бүрээс нэг электрон
Хандивлагч-хүлээн авагч- хандивлагч (цахим хос) хүлээн авагч (орбиталь)
Үзэсгэлэнт-төрөл бүрийн Хандивлагч-хүлээн авах. Үүнд атом тус бүр нэгэн зэрэг гарч ирдэг. Хандивлагч, хүлээн авагч хоёулаа
- энтальпи
x/r
=
нийлбэр
энтальпи
бүтээгдэхүүний зураг
дүүрэг
ард
хасах
хэмжээ
энтальпи
арр.
Египетээс гарсан.
зүйл
1 Органик бус нэгдлүүдийн хамгийн чухал ангилал: исэл, гидроксид, хүчил, давс.
2 Матери хадгалагдах хууль.
3 Комплекс нэгдлүүдийн үндсэн төрлүүд (c.s.). c.s-ийн зан байдал. усан уусмалд. Тогтворгүй байдлын тогтмол.
4 Комплекс нэгдлүүдийн нэршил. Зохицуулах дугаар.
5 Амфотерийн гидроксид.
6 Нарийн төвөгтэй холболтууд. Комплекс үүсгэгч, лигандууд.
7 Сул суурь ба хүчтэй хүчлээс үүссэн давсны гидролиз. Гидролизийн зэрэг.
8 Хатуу бодисыг уусгах. Уусмалын дулаан ямар бүрэлдэхүүн хэсгүүдээс бүрддэг вэ? хатуушингэнд үү?
9 Редокс урвалын төрлүүд.
10 Найрлагын тогтмол байдлын хууль. Дальтонидууд, бертолидууд.
11 Шингэрүүлсэн ба төвлөрсөн уусмалын талстжилт. Кристал гидрат.
12 Ион солилцооны урвал. уусах чадварын бүтээгдэхүүн.
13 Олон тооны харьцааны хууль.
14 Усны цахилгаан химийн диссоциаци. Усны ионы бүтээгдэхүүн. Устөрөгчийн индекс.
15 Металл ба давсны болон хүхрийн хүчлийн харьцаа (шингэрүүлсэн ба баяжуулсан.
16. Redox процесст нөлөөлөх хүчин зүйлс. Редокс урвал дахь коэффициентүүдийн зохион байгуулалт.
17 Эквивалентуудын тухай хууль. Энгийн ба нийлмэл бодисын эквивалентийг тодорхойлох.
18 Уусмалын концентрацийг илэрхийлэх арга: моляр, хэвийн, титр.
19 Атомын бүтцийн квант механик онол. Луис де Бройлийн тэгшитгэл. Гейзенбергийн тодорхойгүй байдлын зарчим.
20 Калийн перманганатын исэлдэлтийн шинж чанар.
21 Атомын бүтэц, элементүүдийн шинж чанарын үечилсэн байдал.
22 Сул суурь ба сул хүчлээс үүссэн давсны гидролиз.
23 Сул электролит. Диссоциацийн зэрэг. Диссоциацийн тогтмол.
24 Металлуудын азотын хүчлийн хамаарал.
25 Гидролиз. Гидролизийн процесст нөлөөлөх хүчин зүйлс.
26 Атомын электрон бүтэц. Атомын S-, p-, d-, f-электрон гэр бүл.
27 Уусах чадвар. Хий, шингэн, хатуу бодисыг уусгах. Уусмалын физик-химийн онол.
28 Элементийн атомын тоо нэмэгдэхийн хэрээр атом дахь атомын орбиталуудыг дүүргэх (Клечковскийн дүрэм).
29 Шингэн дээрх уурын даралт. Раульын анхны хууль.
30 Атомын бүтцийн цөмийн загвар. Атомын цөмүүд, тэдгээрийн найрлага. Изотопууд, изобарууд.
31 Хүчтэй электролитийн уусмал.
32 Квантын тоо: үндсэн, тойрог зам, соронзон, спин.
33 Ерөнхий ойлголтшийдлүүдийн талаар. Уусмалын концентрацийг илэрхийлэх арга замууд: молалит, массын фракц, титр.
34 Хүчтэй суурь ба сул хүчлээс үүссэн давсны гидролиз.
35 Осмос. Осмосын даралт.
36 Хүчтэй электролит.
37 Планкийн гэрлийн квант онол. Атомын бүтцийн тухай Борын онол.
38. Ус. Усны физик, химийн шинж чанар.
39 Эквивалентуудын тухай хууль. Химийн элемент. Хүчил, суурь, давсны эквивалентийг тодорхойлох.
40 Раульын хоёр дахь хууль.
41 Электродын потенциал. Ненерсийн тэгшитгэл.
42 Химийн гүйдлийн эх үүсвэрүүд (FC, зай, GE).
43 Зэврэлт (химийн, цахилгаан химийн).
44 Металлыг зэврэлтээс хамгаалах арга.