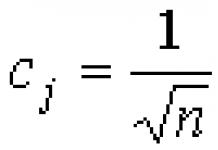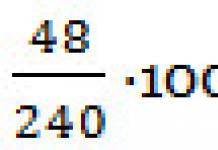Цахилгаан сөрөг чанар (EO) гэдэг нь атомуудын бусад атомуудтай холбогдох үед электронуудыг татах чадвар юм .
Электрон сөрөг чанар нь цөм ба валентийн электронуудын хоорондох зай, валентийн бүрхүүл дуусахад хэр ойрхон байгаагаас хамаарна. Атомын радиус бага байх тусам валентын электронууд их байх тусам түүний ЭО өндөр байна.
Фтор бол хамгийн электрон сөрөг элемент юм. Нэгдүгээрт, түүний валентийн бүрхүүлд 7 электрон байдаг (октетт зөвхөн 1 электрон дутуу), хоёрдугаарт, энэ валентын бүрхүүл (...2s 2 2p 5) цөмтэй ойрхон байрладаг.
Шүлт ба шүлтлэг шороон металлын атомууд хамгийн бага электрон сөрөг байдаг. Тэдгээр нь том радиустай бөгөөд гаднах электрон бүрхүүлүүд нь бүрэн гүйцэд биш юм. Тэдний хувьд валентийн электронуудаа өөр атомд өгөх нь электрон "олж авах"-аас хамаагүй хялбар байдаг (дараа нь гаднах бүрхүүл бүрэн болно).
Электрон сөрөг чанарыг тоон хэлбэрээр илэрхийлж, элементүүдийг нэмэгдүүлэх дарааллаар эрэмбэлж болно. Америкийн химич Л.Паулингын санал болгосон цахилгаан сөрөг байдлын хэмжүүрийг ихэвчлэн ашигладаг.
 Нэгдлийн элементүүдийн электрон сөрөг байдлын ялгаа ( ΔX) нь химийн бондын төрлийг шүүх боломжийг танд олгоно. Хэрэв үнэ цэнэ ΔX= 0 - холболт ковалент туйлт бус.
Нэгдлийн элементүүдийн электрон сөрөг байдлын ялгаа ( ΔX) нь химийн бондын төрлийг шүүх боломжийг танд олгоно. Хэрэв үнэ цэнэ ΔX= 0 - холболт ковалент туйлт бус.
Цахилгаан сөрөг байдлын зөрүү 2.0 хүртэл байвал холбоог дуудна ковалент туйл, жишээ нь: Фтор устөрөгчийн молекул дахь H-F холбоо HF: Δ X = (3.98 - 2.20) = 1.78
2.0-ээс их цахилгаан сөрөг байдлын зөрүүтэй холбоог авч үзнэ ион. Жишээ нь: NaCl нэгдэл дэх Na-Cl холбоо: Δ X = (3.16 - 0.93) = 2.23.
Исэлдэлтийн төлөв
Исэлдэлтийн төлөв (CO) нь молекулын атомын нөхцөлт цэнэг бөгөөд молекул нь ионуудаас бүрдэх ба ерөнхийдөө цахилгаанаар саармаг байдаг гэсэн таамаглалаар тооцоолсон цэнэг юм.


Ионы холбоо үүсэх үед электрон нь бага цахилгаан сөрөг атомаас илүү цахилгаан сөрөг атом руу шилжихэд атомууд цахилгаан саармаг байдлаа алдаж, ион болж хувирдаг. бүхэл тооны хураамж үүсдэг. Ковалентын туйлын холбоо үүсэхэд электрон бүрэн шилждэггүй, харин хэсэгчлэн дамждаг тул хэсэгчилсэн цэнэгүүд үүсдэг (доорх зураг дээрх HCl). Электрон устөрөгчийн атомаас хлор руу бүрэн шилжиж, устөрөгч дээр +1, хлор дээр -1 гэсэн бүхэл бүтэн эерэг цэнэг үүссэн гэж төсөөлье. Ийм ердийн цэнэгийг исэлдэлтийн төлөв гэж нэрлэдэг.


Энэ зураг нь эхний 20 элементийн исэлдэлтийн төлөвийг харуулж байна.
Анхаарна уу. Хамгийн их CO нь үелэх систем дэх бүлгийн дугаартай тэнцүү байдаг. Үндсэн дэд бүлгүүдийн металууд нь нэг шинж чанартай CO-тэй байдаг бол металл бус металлууд нь дүрмээр бол CO-ийн тархалттай байдаг. Тиймээс металл бус нь олон тооны нэгдлүүдийг үүсгэдэг бөгөөд металуудтай харьцуулахад илүү "олон янзын" шинж чанартай байдаг.
Исэлдэлтийн төлөвийг тодорхойлох жишээ
Нэгдлүүд дэх хлорын исэлдэлтийн төлөвийг тодорхойлъё.

Бидний авч үзсэн дүрмүүд нь өгөгдсөн аминопропан молекул зэрэг бүх элементийн CO-ийг тооцоолох боломжийг бидэнд үргэлж олгодоггүй.

Энд дараахь техникийг ашиглах нь тохиромжтой.
1) Бид молекулын бүтцийн томъёог дүрсэлсэн, зураас нь холбоо, хос электрон юм.
2) Бид зураасыг илүү EO атом руу чиглэсэн сум болгон хувиргадаг. Энэ сум нь электроныг атом руу шилжүүлэхийг бэлэгддэг. Хэрэв хоёр ижил атом холбогдсон бол бид шугамыг байгаагаар нь үлдээдэг - электрон дамжуулалт байхгүй.
3) Бид хэдэн электрон "ирсэн" ба "зүүн" гэдгийг тоолдог.
Жишээлбэл, эхний нүүрстөрөгчийн атомын цэнэгийг тооцоолъё. Гурван сум атом руу чиглэсэн бөгөөд энэ нь 3 электрон ирсэн гэсэн үг, цэнэг -3.
Хоёр дахь нүүрстөрөгчийн атом: устөрөгч түүнд электрон, азот нь нэг электрон авчээ. Төлбөр өөрчлөгдөөгүй, тэг болсон. гэх мэт.
Валент
Валент(Латин valēns "хүчтэй" гэсэн үгнээс) - атомуудын бусад элементийн атомуудтай тодорхой тооны химийн холбоо үүсгэх чадвар.

Үндсэндээ валент гэдэг нь атомуудын тодорхой тооны ковалент холбоо үүсгэх чадвар. Хэрэв атом байгаа бол nхосгүй электрон ба мдан электрон хос бол энэ атом үүсч болно n+mбусад атомуудтай ковалент холбоо, өөрөөр хэлбэл. түүний валент нь тэнцүү байх болно n+m. Хамгийн их валентыг тооцоолохдоо "сэтгэл хөдөлсөн" төлөвийн цахим тохиргооноос эхлэх хэрэгтэй. Жишээлбэл, бериллий, бор, азотын атомын хамгийн их валент нь 4 (жишээлбэл, Be(OH) 4 2-, BF 4 - ба NH 4 +), фосфор - 5 (PCl 5), хүхэр - 6 ( H 2 SO 4), хлор - 7 (Cl 2 O 7).
Зарим тохиолдолд валент нь исэлдэлтийн төлөвтэй тоогоор давхцаж болох боловч тэдгээр нь хоорондоо ямар ч байдлаар ижил байдаггүй. Жишээлбэл, N2 ба CO молекулуудад гурвалсан холбоо үүсдэг (өөрөөр хэлбэл атом бүрийн валент нь 3), харин азотын исэлдэлтийн төлөв 0, нүүрстөрөгч +2, хүчилтөрөгч -2 байна.




 Азотын хүчилд азотын исэлдэлтийн төлөв +5 байдаг бол азот нь 4-өөс их валенттай байж болохгүй, учир нь энэ нь гаднах түвшинд ердөө 4 орбиталтай байдаг (мөн холбоог давхардсан орбиталь гэж үзэж болно). Ерөнхийдөө хоёр дахь үеийн аль ч элемент ижил шалтгаанаар 4-өөс их валенттай байж болохгүй.
Азотын хүчилд азотын исэлдэлтийн төлөв +5 байдаг бол азот нь 4-өөс их валенттай байж болохгүй, учир нь энэ нь гаднах түвшинд ердөө 4 орбиталтай байдаг (мөн холбоог давхардсан орбиталь гэж үзэж болно). Ерөнхийдөө хоёр дахь үеийн аль ч элемент ижил шалтгаанаар 4-өөс их валенттай байж болохгүй.

Ихэнхдээ алдаа гаргадаг хэд хэдэн "зөв" асуултууд.
I хэсэг
1. Исэлдэлтийн төлөв (s.o.) байнанийлмэл бодис дахь химийн элементийн атомуудын ердийн цэнэгийг энгийн ионуудаас бүрддэг гэсэн таамаглалд үндэслэн тооцдог.
Та дараах зүйлсийг мэдэх байх ёстой!
1) -тэй холбоотой. О. устөрөгч = +1, гидридээс бусад.
2) -тай холбоотой. О. хүчилтөрөгч = -2, хэт ислийг эс тооцвол ![]() болон фторууд
болон фторууд
3) Металлын исэлдэлтийн төлөв үргэлж эерэг байдаг.
Эхний гурван бүлгийн үндсэн дэд бүлгийн металлын хувьд -тай. О. тогтмол:
IA бүлэг металлууд - х. О. = +1,
IIA бүлгийн металлууд - х. О. = +2,
IIIA бүлгийн металлууд - х. О. = +3.
4) Чөлөөт атом ба энгийн бодисуудад х. О. = 0.
5) Нийт с. О. холболтын бүх элементүүд = 0.
2. Нэр үүсгэх аргахоёр элементийн (хоёртын) нэгдлүүд.

4. “Хоёртын нэгдлүүдийн нэр, томьёо” хүснэгтийг бөглөнө үү.

5. Үсгийн үсгээр тодруулсан нийлмэл нэгдлийн элементийн исэлдэлтийн төлөвийг тодорхойлно.

II хэсэг
1. Нэгдлүүдийн химийн элементүүдийн исэлдэлтийн төлөвийг томъёогоор нь тодорхойлно. Эдгээр бодисуудын нэрийг бич.

2. FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3 бодисуудыг ялгана.хоёр бүлэгт хуваана. Бодисын исэлдэлтийн төлөвийг харуулсан нэрсийг бич.

3. Химийн элементийн атомын нэр ба исэлдэлтийн төлөв болон нэгдлийн томъёоны хоорондын уялдааг тогтоо.

4. Бодисын нэрээр томъёо зохиох.

5. 48 г хүхрийн (IV) исэлд хэдэн молекул байдаг вэ?

6. Интернэт болон бусад мэдээллийн эх сурвалжийг ашиглан дараах төлөвлөгөөний дагуу аливаа хоёртын нэгдлийг ашиглах тухай мэдээг бэлтгэ.
1) томъёо;
2) нэр;
3) шинж чанар;
4) өргөдөл.
H2O ус, устөрөгчийн исэл.
Хэвийн нөхцөлд ус нь шингэн, өнгөгүй, үнэргүй, зузаан давхаргатай цэнхэр өнгөтэй байдаг. Буцлах цэг нь 100⁰С орчим байна. Сайн уусгагч юм. Усны молекул нь хоёр устөрөгчийн атом, нэг хүчилтөрөгчийн атомаас бүрддэг бөгөөд энэ нь түүний чанарын болон тоон найрлага юм. Энэ бол нарийн төвөгтэй бодис бөгөөд дараахь химийн шинж чанаруудаар тодорхойлогддог: шүлтлэг металл, шүлтлэг шороон металлуудтай харилцан үйлчлэлцэх. Устай солилцох урвалыг гидролиз гэж нэрлэдэг. Эдгээр урвалууд нь химийн хувьд маш чухал юм.
7. K2MnO4 нэгдэл дэх манганы исэлдэлтийн төлөв дараах байдалтай тэнцүү байна.
3) +6
8. Хром нь нэгдлийн хамгийн бага исэлдэлтийн төлөвтэй бөгөөд томъёо нь:
1) Cr2O3
9. Хлор нь нэгдэлд хамгийн их исэлдэлтийн төлөвөө харуулдаг бөгөөд томъёо нь:
3) Cl2O7
Хүснэгт. Химийн элементүүдийн исэлдэлтийн төлөв.
Хүснэгт. Химийн элементүүдийн исэлдэлтийн төлөв.
Исэлдэлтийн төлөвнь бүх холбоог ионы төрлийн гэсэн таамаглалаар тооцсон нэгдэл дэх химийн элементийн атомуудын нөхцөлт цэнэг юм. Исэлдэлтийн төлөв нь эерэг, сөрөг эсвэл тэг утгатай байж болох тул тэдгээрийн атомын тоог харгалзан молекул дахь элементүүдийн исэлдэлтийн төлөвийн алгебрийн нийлбэр нь 0, ион дахь ионы цэнэгтэй тэнцүү байна. .
|
Хүснэгт: Тогтмол исэлдэлтийн төлөвтэй элементүүд. |
|
Хүснэгт. Цагаан толгойн үсгийн дарааллаар химийн элементүүдийн исэлдэлтийн төлөв.
|
Хүснэгт. Химийн элементүүдийн исэлдэлтийн төлөвийг тоогоор нь.
|
Нийтлэлийн үнэлгээ:
Зөв байрлуулахын тулд исэлдэлтийн төлөв, та дөрвөн дүрмийг санаж байх хэрэгтэй.
1) Энгийн бодисын хувьд аливаа элементийн исэлдэлтийн төлөв 0. Жишээ нь: Na 0, H 0 2, P 0 4.
2) Та онцлог шинж чанаруудыг санаж байх хэрэгтэй тогтмол исэлдэлтийн төлөв. Тэдгээрийг бүгдийг нь хүснэгтэд жагсаасан болно.
3) Элементийн исэлдэлтийн хамгийн их төлөв нь тухайн элементийн байрлаж буй бүлгийн тоотой давхцдаг (жишээлбэл, фосфор нь V бүлэгт, фосфорын хамгийн их s.d. нь +5 байна). Чухал үл хамаарах зүйлүүд: F, O.
4) Бусад элементүүдийн исэлдэлтийн төлөвийг хайх нь энгийн дүрэм дээр суурилдаг.
Төвийг сахисан молекулын хувьд бүх элементийн исэлдэлтийн төлөвийн нийлбэр нь тэг, ионы хувьд ионы цэнэг байна.
Исэлдэлтийн төлөвийг тодорхойлох цөөн хэдэн энгийн жишээ
Жишээ 1. Аммиак дахь элементүүдийн исэлдэлтийн төлөвийг олох шаардлагатай (NH 3).
Шийдэл. Урлагийг бид аль хэдийн мэддэг (2-ыг үзнэ үү). БОЛЖ БАЙНА УУ. устөрөгч нь +1. Азотын хувьд энэ шинж чанарыг олох нь хэвээр байна. Хүссэн исэлдэлтийн төлөвийг x гэж үзье. Бид хамгийн энгийн тэгшитгэлийг үүсгэнэ: x + 3 (+1) = 0. Шийдэл нь ойлгомжтой: x = -3. Хариулт: N -3 H 3 +1.
Жишээ 2. H 2 SO 4 молекул дахь бүх атомын исэлдэлтийн төлөвийг заана уу.
Шийдэл. Устөрөгч ба хүчилтөрөгчийн исэлдэлтийн төлөвийг аль хэдийн мэддэг болсон: H(+1) ба O(-2). Хүхрийн исэлдэлтийн төлөвийг тодорхойлох тэгшитгэлийг үүсгэнэ: 2 (+1) + x + 4 (-2) = 0. Энэ тэгшитгэлийг шийдэж, бид: x = +6 олно. Хариулт: H +1 2 S +6 O -2 4.
Жишээ 3. Al(NO 3) 3 молекулын бүх элементийн исэлдэлтийн төлөвийг тооцоол.
Шийдэл. Алгоритм өөрчлөгдөөгүй хэвээр байна. Хөнгөн цагаан нитратын "молекул" -ын найрлагад нэг Al атом (+3), хүчилтөрөгчийн 9 атом (-2), азотын 3 атом багтдаг бөгөөд тэдгээрийн исэлдэлтийн төлөвийг бид тооцоолох ёстой. Харгалзах тэгшитгэл нь: 1 (+3) + 3х + 9 (-2) = 0. Хариулт: Al +3 (N +5 O -2 3) 3.
Жишээ 4. (AsO 4) 3- ионы бүх атомын исэлдэлтийн төлөвийг тодорхойлно уу.
Шийдэл. Энэ тохиолдолд исэлдэлтийн төлөвийн нийлбэр нь тэг байхаа больсон, харин ионы цэнэгтэй, өөрөөр хэлбэл -3 байх болно. Тэгшитгэл: x + 4 (-2) = -3. Хариулт: As(+5), O(-2).
Хоёр элементийн исэлдэлтийн төлөв тодорхойгүй бол яах вэ
Үүнтэй төстэй тэгшитгэлийг ашиглан хэд хэдэн элементийн исэлдэлтийн төлөвийг нэг дор тодорхойлох боломжтой юу? Хэрэв бид энэ асуудлыг математикийн үүднээс авч үзвэл хариулт нь сөрөг байх болно. Хоёр хувьсагчтай шугаман тэгшитгэл нь өвөрмөц шийдэлтэй байж чадахгүй. Гэхдээ бид тэгшитгэлээс илүү ихийг шийдэж байна!
Жишээ 5. (NH 4) 2 SO 4 дахь бүх элементийн исэлдэлтийн төлөвийг тодорхойлно уу.
Шийдэл. Устөрөгч ба хүчилтөрөгчийн исэлдэлтийн төлөвийг мэддэг боловч хүхэр, азотыг мэддэггүй. Хоёр үл мэдэгдэх асуудлын сонгодог жишээ! Бид аммонийн сульфатын нэг "молекул" биш, харин NH 4 + ба SO 4 2- гэсэн хоёр ионы нэгдэл гэж үзэх болно. Ионы цэнэг бидэнд мэдэгдэж байгаа бөгөөд тус бүр нь үл мэдэгдэх исэлдэлтийн төлөвтэй зөвхөн нэг атом агуулдаг. Өмнөх асуудлыг шийдвэрлэхэд олж авсан туршлагаа ашиглан бид азот, хүхрийн исэлдэлтийн төлөвийг хялбархан олох боломжтой. Хариулт: (N -3 H 4 +1) 2 S +6 O 4 -2.
Дүгнэлт: Хэрэв молекул нь тодорхойгүй исэлдэлтийн төлөвтэй хэд хэдэн атом агуулдаг бол молекулыг хэд хэдэн хэсэгт "хуваахыг" оролдоорой.
Органик нэгдлүүдийн исэлдэлтийн төлөвийг хэрхэн зохион байгуулах вэ
Жишээ 6. CH 3 CH 2 OH дахь бүх элементүүдийн исэлдэлтийн төлөвийг заана уу.
Шийдэл. Органик нэгдлүүдийн исэлдэлтийн төлөвийг олох нь өөрийн гэсэн онцлогтой. Ялангуяа нүүрстөрөгчийн атом бүрийн исэлдэлтийн төлөвийг тусад нь олох шаардлагатай. Та дараах байдлаар тайлбарлаж болно. Жишээлбэл, метилийн бүлгийн нүүрстөрөгчийн атомыг авч үзье. Энэ С атом нь 3 устөрөгчийн атом болон хөрш нүүрстөрөгчийн атомтай холбогддог. C-H бондын дагуу электрон нягт нь нүүрстөрөгчийн атом руу шилждэг (С-ийн цахилгаан сөрөг чанар нь устөрөгчийн EO-ээс давсан тул). Хэрэв энэ нүүлгэн шилжүүлэлт бүрэн хийгдсэн бол нүүрстөрөгчийн атом -3 цэнэг авах болно.
-CH 2 OH бүлгийн С атом нь хоёр устөрөгчийн атом (электрон нягтын С руу шилжих шилжилт), нэг хүчилтөрөгчийн атом (электрон нягтын О руу шилжих шилжилт) болон нэг нүүрстөрөгчийн атомтай (энэ нь шилжилт гэж үзэж болно) холбогддог. электрон нягтралд энэ тохиолдолд тохиолддоггүй). Нүүрстөрөгчийн исэлдэлтийн төлөв -2 +1 +0 = -1.
Хариулт: C -3 H +1 3 C -1 H +1 2 O -2 H +1.
"Валент" ба "исэлдэлтийн төлөв" гэсэн ойлголтыг бүү андуур!
Исэлдэлтийн тоог валенттай андуурдаг. Энэ алдааг бүү хий. Би үндсэн ялгааг жагсаах болно:
- исэлдэлтийн төлөв нь (+ эсвэл -) тэмдэгтэй, валент нь байхгүй;
- нийлмэл бодист ч исэлдэлтийн төлөв тэг байж болно; тэгтэй тэнцүү валент нь дүрмээр бол тухайн элементийн атом нь бусад атомуудтай холбоогүй гэсэн үг юм (бид ямар ч төрлийн нэгдлүүд болон бусад "экзотикууд" -ын талаар ярихгүй. энд);
- исэлдэлтийн төлөв гэдэг нь зөвхөн ионы холбоо бүхий нэгдлүүдэд жинхэнэ утгыг олж авдаг албан ёсны ойлголт бөгөөд эсрэгээр "валент" гэсэн ойлголтыг ковалент нэгдлүүдтэй харьцуулахад хамгийн тохиромжтой байдаг.
Исэлдэлтийн төлөв (илүү нарийвчлалтай, түүний модуль) нь валенттай тоон хувьд тэнцүү байдаг боловч ихэнхдээ эдгээр утгууд давхцдаггүй. Жишээлбэл, CO 2 дахь нүүрстөрөгчийн исэлдэлтийн төлөв нь +4; С-ийн валент нь мөн IV-тэй тэнцүү байна. Гэхдээ метанол (CH 3 OH) -д нүүрстөрөгчийн валент нь ижил хэвээр, С-ийн исэлдэлтийн төлөв -1-тэй тэнцүү байна.
"Исэлдэлтийн төлөв" сэдвээр богино хэмжээний тест
Энэ сэдвийн талаарх ойлголтоо шалгахын тулд хэдэн минут зарцуулаарай. Та таван энгийн асуултанд хариулах хэрэгтэй. Амжилт хүсье!
"А авах" видео хичээл нь математикийн улсын нэгдсэн шалгалтыг 60-65 оноотой амжилттай өгөхөд шаардлагатай бүх сэдвүүдийг багтаасан болно. Математикийн улсын нэгдсэн шалгалтын 1-13 дугаар бүх даалгаврыг гүйцээнэ үү. Мөн математикийн улсын нэгдсэн шалгалтыг өгөхөд тохиромжтой. Улсын нэгдсэн шалгалтыг 90-100 оноотой өгөхийг хүсвэл 1-р хэсгийг 30 минутад алдаагүй шийдэх хэрэгтэй!
10-11-р анги, багш нарт зориулсан Улсын нэгдсэн шалгалтанд бэлтгэх курс. Математикийн улсын нэгдсэн шалгалтын 1-р хэсгийг (эхний 12 бодлого) болон 13-р бодлого (тригонометр) шийдвэрлэхэд шаардлагатай бүх зүйл. Энэ бол Улсын нэгдсэн шалгалтын 70-аас дээш оноо бөгөөд 100 оноотой оюутан ч, хүмүүнлэгийн ухааны оюутан ч тэдэнгүйгээр хийж чадахгүй.
Шаардлагатай бүх онол. Улсын нэгдсэн шалгалтын шуурхай шийдэл, бэрхшээл, нууц. FIPI Даалгаврын Банкны 1-р хэсгийн одоогийн бүх ажлуудад дүн шинжилгээ хийсэн. Хичээл нь 2018 оны Улсын нэгдсэн шалгалтын шаардлагыг бүрэн хангасан.
Хичээл нь тус бүр 2.5 цагийн 5 том сэдэвтэй. Сэдэв бүрийг эхнээс нь энгийн бөгөөд ойлгомжтойгоор өгсөн болно.
Улсын нэгдсэн шалгалтын олон зуун даалгавар. Үгийн бодлого ба магадлалын онол. Асуудлыг шийдвэрлэх энгийн бөгөөд санахад хялбар алгоритмууд. Геометр. Улсын нэгдсэн шалгалтын бүх төрлийн даалгаврын онол, лавлах материал, дүн шинжилгээ. Стереометр. Нарийн төвөгтэй шийдэл, ашигтай хууран мэхлэлт, орон зайн төсөөллийг хөгжүүлэх. Тригонометрийг эхнээс нь асуудал хүртэл 13. Шатаж байхын оронд ойлгох. Нарийн төвөгтэй ойлголтуудын тодорхой тайлбар. Алгебр. Үндэс, хүч ба логарифм, функц ба дериватив. Улсын нэгдсэн шалгалтын 2-р хэсгийн нарийн төвөгтэй асуудлыг шийдвэрлэх үндэс.