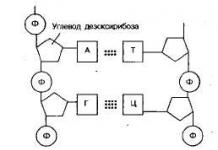
2с 2х 3с 3х
Цахим тохиргоо хөнгөн цагаанВ сэтгэл хөдөлсөн байдал :
+13Al * 1с 2
2с 2 2х 6 3с 1 3х 2 1s 2s 2p 3s 3p ![]()
Хөнгөн цагаанпарамагнит шинж чанарыг харуулдаг. Хөнгөн цагаан нь агаарт хурдан үүсдэг удаан эдэлгээтэй оксидын хальс, цаашдын харилцан үйлчлэлээс гадаргууг хамгаалах, тиймээс зэврэлтэнд тэсвэртэй.
Физик шинж чанар
Хөнгөн цагаан – хөнгөн металлмөнгөлөг цагаан өнгөтэй, хэвэнд оруулах, цутгах, машинлахад хялбар. Дулаан болон цахилгаан дамжуулах өндөр чадвартай.
Хайлах цэг 660 o C, буцлах температур 1450 o C, хөнгөн цагааны нягт 2.7 г/см 3 .
Байгальд байх
Хөнгөн цагаан- байгальд хамгийн түгээмэл металл бөгөөд бүх элементүүдийн дунд хамгийн элбэг байдаг 3-т (хүчилтөрөгч, цахиурын дараа). Агуулга дэлхийн царцдас- ойролцоогоор 8%.
Байгальд хөнгөн цагаан нь нэгдлүүдийн хэлбэрээр үүсдэг.
Боксит Al 2 O 3 H 2 O(бохирдолтой SiO2, Fe 2 O 3, CaCO 3)- хөнгөн цагаан оксидын гидрат
Корунд Al 2 O 3 .Улаан корундыг бадмаараг, хөх корундыг индранил гэдэг.
Олж авах аргууд
Хөнгөн цагаанхүчтэйг бүрдүүлдэг химийн холбоохүчилтөрөгчтэй. Тиймээс исэлээс ангижруулах замаар хөнгөн цагаан үйлдвэрлэх уламжлалт аргууд нь их хэмжээний эрчим хүч шаарддаг. Учир нь аж үйлдвэрийн Хөнгөн цагааныг Hall-Heroult процессыг ашиглан үйлдвэрлэдэг. Хөнгөн цагааны оксидын хайлах цэгийг бууруулах хайлсан криолитэд ууссан(960-970 o C температурт) Na 3 AlF 6 ба дараа нь нүүрстөрөгчийн электродтой электролиз. Криолит хайлмагт ууссан үед хөнгөн цагааны исэл нь ион болж задардаг.
Al 2 O 3 → Al 3+ + AlO 3 3-
Асаалттай катодболж байна хөнгөн цагааны ионыг багасгах:
K: Al 3+ +3e → Al 0
Асаалттай анодисэлдэлт үүсдэг aluminate ионууд:
A: 4AlO 3 3- - 12e → 2Al 2 O 3 + 3O 2
Хайлсан хөнгөн цагаан ислийн электролизийн ерөнхий тэгшитгэл нь:
2Al 2 O 3 → 4Al + 3O 2
Лабораторийн аргаХөнгөн цагааны үйлдвэрлэл нь усгүй хөнгөн цагаан хлоридоос хөнгөн цагааныг калийн металлаар бууруулахад оршино.
AlCl 3 + 3K → 4Al + 3KCl
Чанарын урвалууд
Хөнгөн цагааны ионуудын чанарын урвал - харилцан үйлчлэл илүүдэлшүлттэй хөнгөн цагааны давс . Энэ нь цагаан аморфыг үүсгэдэг тунадас хөнгөн цагаан гидроксид.
Жишээлбэл , хөнгөн цагаан хлорид-тай харьцдаг натрийн гидроксид:
Цаашид шүлт нэмснээр амфотер хөнгөн цагааны гидроксид уусч үүснэ тетрагидроксиалюминат:
Al(OH) 3 + NaOH = Na
тэмдэглэл , хэрэв бид хөнгөн цагааны давс хийвэл илүүдэл шүлтийн уусмал, дараа нь хөнгөн цагаан гидроксидын цагаан тунадас үүсэхгүй, учир нь шүлтээс хэтэрсэн тохиолдолд хөнгөн цагааны нэгдлүүд шууд болж хувирдаг цогцолбор:
AlCl 3 + 4NaOH = Na
Хөнгөн цагааны давсыг аммиакийн усан уусмал ашиглан илрүүлж болно. Уусдаг хөнгөн цагааны давс нь аммиакийн усан уусмалтай харилцан үйлчилдэг Хөнгөн цагааны гидроксидын тунгалаг желатин тунадас үүснэ.
AlCl 3 + 3NH 3 H 2 O = Al(OH) 3 ↓ + 3 NH 4 Cl
Аль 3+ + 3NH 3 H 2 O= Al(OH) 3 ↓ + 3 NH 4 +
Видео туршлагахөнгөн цагаан хлоридын уусмал ба аммиакийн уусмалын харилцан үйлчлэлийг харж болно
Химийн шинж чанар
1. Хөнгөн цагаан - хүчтэй бууруулагч бодис . Тиймээс тэр олон хүнтэй хариу үйлдэл үзүүлдэг металл бус .
1.1. Хөнгөн цагаан нь урвалд ордог галогенболовсролтой галогенид:
1.2. Хөнгөн цагаан нь урвалд ордог хүхэртэйболовсролтой сульфидууд:
2Al + 3S → Al 2 S 3
1.3. Хөнгөн цагааны урвал-тай фосфор. Энэ тохиолдолд хоёртын нэгдлүүд үүсдэг - фосфидууд:
Al + P → AlP
Хөнгөн цагаан хариу үйлдэл үзүүлэхгүй устөрөгчтэй .
1.4. Азотын хамт хөнгөн цагаан 1000 oС хүртэл халаахад урвалд ордог нитрид:
2Al +N 2 → 2AlN
1.5. Хөнгөн цагаан нь урвалд ордог нүүрстөрөгчтэйболовсролтой хөнгөн цагаан карбид:
4Al + 3C → Al 4 C 3
1.6. Хөнгөн цагаан нь харилцан үйлчилдэг хүчилтөрөгчболовсролтой исэл:
4Al + 3O 2 → 2Al 2 O 3
Видео туршлагахөнгөн цагааны харилцан үйлчлэл агаар дахь хүчилтөрөгч(агаарт хөнгөн цагааны шаталт) харж болно.
2. Хөнгөн цагаан нь харилцан үйлчилдэг нарийн төвөгтэй бодисууд:
2.1. Хариуцлагатай юу? хөнгөн цагаан-тай ус? Хэрэв та ой санамжаа бага зэрэг судалбал энэ асуултын хариултыг амархан олох болно. Та амьдралдаа ядаж нэг удаа хөнгөн цагаан тогоо, хөнгөн цагаан хутгатай тааралдсан нь лавтай. Энэ бол шалгалтын үеэр оюутнуудаас асуух дуртай асуулт юм. Хамгийн гайхалтай нь би өөр өөр хариулт авсан явдал юм - зарим хүмүүсийн хувьд хөнгөн цагаан устай урвалд ордог. "Хөнгөн цагаан нь халах үед устай урвалд ордог уу?" Гэсэн асуултын дараа маш олон хүн бууж өгсөн. Халах үед хөнгөн цагаан нь судалгаанд оролцогчдын тал хувь нь устай урвалд орсон))
Гэсэн хэдий ч хөнгөн цагаан хэвээр байгаа гэдгийг ойлгоход хялбар байдаг устайхэвийн нөхцөлд (халсан ч гэсэн) харьцдаггүй. Яагаад гэдгийг бид аль хэдийн дурдсан: боловсролын улмаас оксидын хальс . Гэхдээ хөнгөн цагааныг оксидын хальснаас цэвэрлэвэл (жишээлбэл, нэгтгэх), дараа нь энэ нь харьцах болно ус маш идэвхтэйболовсролтой хөнгөн цагаан гидроксидТэгээд устөрөгч:
2Al 0 + 6H 2 + O → 2Al +3 ( OH) 3 + 3H 2 0
Хөнгөн ус (II) хлоридын уусмалд хөнгөн цагааны хэсгүүдийг хадгалах замаар хөнгөн цагаан амалгамыг гаргаж авч болно.
Видео туршлагаХөнгөн цагааны амальгам болон устай харилцан үйлчлэлийг харж болно.
2.2. Хөнгөн цагаан нь харилцан үйлчилдэг эрдэс хүчил (давс, фосфор, шингэрүүлсэн хүхрийн хүчилтэй) дэлбэрэлттэй. Энэ нь давс, устөрөгчийг үүсгэдэг.
Жишээлбэл, хөнгөн цагаан нь хүчтэй урвалд ордог давсны хүчил :
2.3. Хэвийн нөхцөлд хөнгөн цагаан хариу үйлдэл үзүүлэхгүй-тай төвлөрсөн хүхрийн хүчил учир нь идэвхгүй байдал- нягт ислийн хальс үүсэх. Халах үед урвал үргэлжилж, үүсдэг хүхрийн (IV) исэл, хөнгөн цагаан сульфатТэгээд ус:
2Al + 6H 2 SO 4 (conc.) → Al 2 (SO 4) 3 + 3SO 2 + 6H 2 O
2.4. Хөнгөн цагаан нь урвалд ордоггүй төвлөрсөн азотын хүчил мөн идэвхгүй байдлаас үүдэлтэй.
ХАМТ шингэрүүлсэн азотын хүчил хөнгөн цагаан нь урвалд орж молекул үүсгэдэг азотын:
10Al + 36HNO 3 (шингэрүүлсэн) → 3N 2 + 10Al(NO 3) 3 + 18H 2 O
Нунтаг хэлбэрийн хөнгөн цагаан нь харилцан үйлчлэлцэх үед маш шингэрүүлсэн азотын хүчил үүсгэж болно аммонийн нитрат:
8Al + 30HNO 3(их шингэрүүлсэн) → 8Al(NO 3) 3 + 3NH 4 NO 3 + 9H 2 O
2.5. Хөнгөн цагаан - амфотерметалл учраас харилцан үйлчилдэг шүлттэй. Хөнгөн цагааны харилцан үйлчлэлцэх үед шийдэлшүлт үүсдэг тетрагидроксиалюминатТэгээд устөрөгч:
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2
Видео туршлагаХөнгөн цагааны шүлт ба устай харилцан үйлчлэлийг харж болно.
Хөнгөн цагаан нь урвалд ордог хайлахформацтай шүлт хөнгөн цагаанТэгээд устөрөгч:
2Al + 6NaOH → 2Na 3 AlO 3 + 3H 2
Үүнтэй ижил урвалыг өөр хэлбэрээр бичиж болно (Улсын нэгдсэн шалгалтанд би хариу урвалыг энэ хэлбэрээр бичихийг зөвлөж байна):
2Al + 6NaOH → NaAlO 2 + 3H 2 + Na 2 O
2.6. Хөнгөн цагааныг сэргээдэг -аас бага идэвхтэй металлууд ислүүд . Металлыг исэлээс ангижруулах процессыг нэрлэдэг алюминотерми .
Жишээлбэл, хөнгөн цагаан нүүлгэн шилжүүлж байна зэс-аас зэс (II) оксид.Урвал нь маш экзотермик юм:
Илүү жишээ: хөнгөн цагаан сэргээнэ төмөр-аас төмөр масштаб, төмрийн (II, III) исэл:
8Al + 3Fe 3 O 4 → 4Al 2 O 3 + 9Fe
Сэргээх шинж чанархөнгөн цагаан нь хүчтэй исэлдүүлэгч бодисуудтай харьцахдаа мөн илэрдэг. натрийн хэт исэл, нитратуудТэгээд нитритүүдшүлтлэг орчинд, перманганатууд, хромын нэгдлүүд(VI):
2Al + 3Na 2 O 2 → 2NaAlO 2 + 2Na 2 O
8Al + 3KNO 3 + 5KOH + 18H 2 O → 8K + 3NH 3
10Al + 6KMnO 4 + 24H 2 SO 4 → 5Al 2 (SO 4) 3 + 6MnSO 4 + 3K 2 SO 4 + 24H 2 O
2Al + NaNO 2 + NaOH + 5H 2 O → 2Na + NH 3
Al + 3KMnO 4 + 4KOH → 3K 2 MnO 4 + K
4Al + K 2 Cr 2 O 7 → 2Cr + 2KAlO 2 + Al 2 O 3
Хөнгөн цагаан бол дахин боловсруулах боломжтой үйлдвэрийн үнэ цэнэтэй металл юм. Та хөнгөн цагааныг боловсруулахад хүлээн авах, мөн энэ төрлийн металлын одоогийн үнийн талаар илүү ихийг олж мэдэх боломжтой. .
Хөнгөн цагааны исэл
Олж авах аргууд
Хөнгөн цагааны исэлянз бүрийн аргаар олж авч болно:
1. Шатаж байнаагаар дахь хөнгөн цагаан:
4Al + 3O 2 → 2Al 2 O 3
2. Задаргаа хөнгөн цагаан гидроксидхалах үед:
3. Хөнгөн цагааны ислийг авч болно хөнгөн цагаан нитратын задрал :
Химийн шинж чанар
Хөнгөн цагааны исэл - Ердийн амфотерийн исэл . Хүчиллэг ба үндсэн исэл, хүчил, шүлттэй харилцан үйлчилдэг.
1. Хөнгөн цагааны исэл нь харилцан үйлчлэх үед үндсэн оксидууд давс үүсдэг хөнгөн цагааны бодисууд.
Жишээлбэл, хөнгөн цагаан исэл нь харилцан үйлчилдэг исэл натри:
Na 2 O + Al 2 O 3 → 2NaAlO 2
2. Хөнгөн цагааны исэлхарилцан үйлчилдэг Хаана хайлмал доторүүсдэг давс—хөнгөн цагаан,болон дотор уусмал - нарийн төвөгтэй давс . Энэ тохиолдолд хөнгөн цагааны исэл илэрдэг хүчиллэг шинж чанар.
Жишээлбэл, хөнгөн цагаан исэл нь харилцан үйлчилдэг натрийн гидроксидтогтоцтой хайлмал дахь натрийн алюминатТэгээд ус:
2NaOH + Al 2 O 3 → 2NaAlO 2 + H 2 O
Хөнгөн цагааны исэл уусдагхэтэрсэн шүлтболовсролтой тетрагидроксиалюминат:
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na
3. Хөнгөн цагааны исэл урвалд ордоггүй устай.
4. Хөнгөн цагааны исэл урвалд ордог хүчиллэг исэл (хүчтэй хүчил). Энэ тохиолдолд, давсхөнгөн цагаан Энэ тохиолдолд хөнгөн цагааны исэл илэрдэг үндсэн шинж чанарууд.
Жишээлбэл, хөнгөн цагаан исэл нь харилцан үйлчилдэг хүхрийн (VI) исэлболовсролтой хөнгөн цагаан сульфат:
Al 2 O 3 + 3SO 3 → Al 2 (SO 4) 3
5. Хөнгөн цагааны исэл нь урвалд ордог уусдаг хүчил боловсролтой дунд болон хүчиллэг давс.
Жишээлбэл хүхрийн хүчил:
Al 2 O 3 + 3H 2 SO 4 → Al 2 (SO 4) 3 + 3H 2 O
6. Хөнгөн цагаан исэл нь сул шинж чанартай байдаг исэлдүүлэх шинж чанар .
Жишээлбэл, хөнгөн цагаан исэл нь урвалд ордог кальцийн гидридболовсролтой хөнгөн цагаан, устөрөгчТэгээд кальцийн исэл:
Al 2 O 3 + 3CaH 2 → 3CaO + 2Al + 3H 2
Цахилгаан сэргээдэгоксидын хөнгөн цагаан (хөнгөн цагааны үйлдвэрлэл):
2Al 2 O 3 → 4Al + 3O 2
7. Хөнгөн цагаан исэл нь хатуу бөгөөд дэгдэмхий биш юм. Тэгээд тэр илүү дэгдэмхий ислийг нүүлгэн шилжүүлдэг (ихэвчлэн нүүрстөрөгчийн давхар исэл) давснаасхайлуулах үед.
Жишээлбэл, -аас натрийн карбонат:
Al 2 O 3 + Na 2 CO 3 → 2NaAlO 2 + CO 2
Хөнгөн цагааны гидроксид
Олж авах аргууд
1. Уусмалын үйлчлэлээр хөнгөн цагааны гидроксидыг авч болно аммиакдээр хөнгөн цагаан давс.
Жишээлбэл, хөнгөн цагаан хлорид нь урвалд ордог аммиакийн усан уусмалболовсролтой хөнгөн цагаан гидроксидТэгээд аммонийн хлорид:
AlCl 3 + 3NH 3 + 3H 2 O = Al(OH) 3 + 3NH 4 Cl
2. Хажуугаар нь нүүрстөрөгчийн давхар исэл , хүхрийн давхар исэл эсвэл устөрөгчийн сульфид натрийн тетрагидроксиалюминат уусмалаар:
Na + CO 2 = Al(OH) 3 + NaHCO 3
Энэ урвал хэрхэн явагдаж байгааг ойлгохын тулд та энгийн аргыг ашиглаж болно: нарийн төвөгтэй Na бодисыг түүний бүрэлдэхүүн хэсгүүдэд хуваана: NaOH ба Al(OH) 3 . Дараа нь бид эдгээр бодис тус бүртэй нүүрстөрөгчийн давхар исэл хэрхэн урвалд орж байгааг тодорхойлж, тэдгээрийн харилцан үйлчлэлийн бүтээгдэхүүнийг бүртгэдэг. Учир нь Al (OH) 3 нь CO 2-тэй урвалд ордоггүй, дараа нь бид Al (OH) 3-ыг баруун талд нь өөрчлөлтгүйгээр бичнэ.
3. Хөнгөн цагааны гидроксидыг бэлтгэж болно шүлтийн дутагдал дээр илүүдэл хөнгөн цагаан давс.
Жишээлбэл, хөнгөн цагаан хлорид-тай хариу үйлдэл үзүүлдэг калийн гидроксидын дутагдалболовсролтой хөнгөн цагаан гидроксидТэгээд калийн хлорид:
AlCl 3 + 3KOH (хангалтгүй) = Al(OH) 3 ↓+ 3KCl
4. Мөн хөнгөн цагааны гидроксид нь уусдаг бодисын харилцан үйлчлэлээр үүсдэг хөнгөн цагаан давсуусдаг карбонат, сульфит ба сульфид . Усан уусмал дахь хөнгөн цагааны сульфид, карбонат, сульфит.
Жишээлбэл: хөнгөн цагаан бромид-тай хариу үйлдэл үзүүлдэг натрийн карбонат. Энэ тохиолдолд хөнгөн цагаан гидроксидын тунадас үүсч, нүүрстөрөгчийн давхар исэл ялгарч, натрийн бромид үүсдэг.
2AlBr 3 + 3Na 2 CO 3 + 3H 2 O = 2Al(OH) 3 ↓ + CO 2 + 6NaBr
Хөнгөн цагаан хлорид-тай хариу үйлдэл үзүүлдэг натрийн сульфидхөнгөн цагааны гидроксид, устөрөгчийн сульфид, натрийн хлорид үүсэх үед:
2AlCl 3 + 3Na 2 S + 6H 2 O = 2Al(OH) 3 + 3H 2 S + 6NaCl
Химийн шинж чанар
1. Хөнгөн цагааны гидроксид нь урвалд ордог уусдаг хүчил. Энэ тохиолдолд, дунд эсвэл хүчиллэг давс, урвалжуудын харьцаа болон давсны төрлөөс хамаарна.
Жишээлбэл азотын хүчилболовсролтой хөнгөн цагаан нитрат:
Al(OH) 3 + 3HNO 3 → Al(NO 3) 3 + 3H 2 O
Al(OH) 3 + 3HCl → AlCl 3 + 3H 2 O
2Al(OH) 3 + 3H 2 SO 4 → Al 2 (SO 4) 3 + 6H 2 O
Al(OH) 3 + 3HBr → AlBr 3 + 3H 2 O
2. Хөнгөн цагааны гидроксид нь урвалд ордог хүчтэй хүчлүүдийн хүчиллэг исэл .
Жишээлбэл, хөнгөн цагааны гидроксид нь урвалд ордог хүхрийн (VI) исэлболовсролтой хөнгөн цагаан сульфат:
2Al(OH) 3 + 3SO 3 → Al 2 (SO 4) 3 + 3H 2 O
3. Хөнгөн цагааны гидроксид урвалд ордог уусдаг суурьтай (шүлтлэг).Хаана хайлмал доторүүсдэг давс—хөнгөн цагаан,болон дотор уусмал - нарийн төвөгтэй давс . Энэ тохиолдолд хөнгөн цагааны гидроксид илэрдэг хүчиллэг шинж чанар.
Жишээлбэл, хөнгөн цагааны гидроксид нь урвалд ордог калийн гидроксидтогтоцтой хайлмал дахь калийн алюминатТэгээд ус:
2KOH + Al(OH) 3 → 2KAlO 2 + 2H 2 O
Хөнгөн цагааны гидроксид уусдагхэтэрсэн шүлтболовсролтой тетрагидроксиалюминат:
Al(OH) 3 + KOH → K
4. Гхөнгөн цагаан гидроксид задардагхалах үед:
2Al(OH) 3 → Al 2 O 3 + 3H 2 O
Видео туршлагахөнгөн цагааны гидроксидын харилцан үйлчлэл давсны хүчилТэгээд шүлт(хөнгөн цагааны гидроксидын амфотер шинж чанар) харж болно.
Хөнгөн цагааны давс
Хөнгөн цагааны нитрат ба сульфат
Хөнгөн цагааны нитратхалах үед энэ нь задардаг хөнгөн цагаан исэл, азотын исэл (IV)Тэгээд хүчилтөрөгч:
4Al(NO 3) 3 → 2Al 2 O 3 + 12NO 2 + 3O 2
Хөнгөн цагааны сульфатхүчтэй халах үед энэ нь ижил төстэй байдлаар задардаг хөнгөн цагаан исэл, хүхрийн давхар исэлТэгээд хүчилтөрөгч:
2Al 2 (SO 4) 3 → 2Al 2 O 3 + 6SO 2 + 3O 2
Хөнгөн цагааны нарийн төвөгтэй давс
Хөнгөн цагааны давсны шинж чанарыг тодорхойлохын тулд - гидроксоалюминатуудДараах техникийг ашиглахад тохиромжтой: тетрагидроксоалюминатыг хоёр тусдаа молекул болгон хуваана - хөнгөн цагааны гидроксид ба шүлтлэг металлын гидроксид.
Жишээлбэл, натрийн тетрагидроксиалюминат нь хөнгөн цагааны гидроксид ба натрийн гидроксид болж задардаг.
Нагэж хуваана NaOH ба Al(OH) 3
Бүхэл бүтэн цогцолборын шинж чанарыг эдгээр бие даасан нэгдлүүдийн шинж чанараар тодорхойлж болно.
Тиймээс хөнгөн цагааны гидроксо цогцолборууд нь урвалд ордог хүчиллэг исэл .
Жишээлбэл, гидроксо цогцолбор нь илүүдэл нөлөөгөөр устгагдана нүүрстөрөгчийн давхар исэл. Энэ тохиолдолд NaOH нь CO 2-тэй урвалд орж хүчиллэг давс үүсгэдэг (илүүдэл CO 2), амфотер хөнгөн цагааны гидроксид нь нүүрстөрөгчийн давхар исэлтэй урвалд ордоггүй тул зүгээр л тунадас үүсгэдэг.
Na + CO 2 → Al(OH) 3 ↓ + NaHCO 3
Үүний нэгэн адил калийн тетрагидроксиалюминат нь нүүрстөрөгчийн давхар исэлтэй урвалд ордог.
K + CO 2 → Al(OH) 3 + KHCO 3
Үүнтэй ижил зарчмаар тетрагидроксоалюминатууд урвалд ордог хүхрийн давхар исэл SO 2:
Na + SO 2 → Al(OH) 3 ↓ + NaHSO 3
K + SO 2 → Al(OH) 3 + KHSO 3
Гэхдээ нөлөөн дор илүүдэл хүчтэй хүчил тунадас үүсэхгүй, учир нь амфотер хөнгөн цагааны гидроксид нь хүчтэй хүчилтэй урвалд ордог.
Жишээлбэл, Хамт давсны хүчил:
Na + 4HCl (илүүдэл) → NaCl + AlCl 3 + 4H 2 O
Үнэн, бага хэмжээний нөлөөн дор ( дутагдалтай ) хүчтэй хүчилТунадас үүссэн хэвээр байх болно, хөнгөн цагааны гидроксидыг уусгахад хангалттай хүчил байхгүй болно.
Na + HCl (дутагдал) → Al(OH) 3 ↓ + NaCl + H 2 O
Сул талдаа ч мөн адил азотын хүчилхөнгөн цагаан гидроксидын тунадас:
Na + HNO 3 (дутагдал) → Al(OH) 3 ↓ + NaNO 3 + H 2 O
-тэй харьцах үед цогцолбор нь устдаг хлорын ус (хлорын усан уусмал) Cl 2:
2Na + Cl 2 → 2Al(OH) 3 ↓ + NaCl + NaClO
Үүний зэрэгцээ хлор тэнцвэргүй байдал.
Цогцолбор нь илүүдэлтэй урвалд орж болно хөнгөн цагаан хлорид. Энэ тохиолдолд хөнгөн цагааны гидроксидын тунадас нь:
AlCl 3 + 3Na → 4Al(OH) 3 ↓ + 3NaCl
Хэрэв та нарийн төвөгтэй давсны уусмалаас усыг ууршуулж, үүссэн бодисыг халаавал ердийн алюминат давстай үлдэх болно.
Na → NaAlO 2 + 2H 2 O
K → KAlO 2 + 2H 2 O
Хөнгөн цагааны давсны гидролиз
Уусдаг хөнгөн цагааны давс, хүчтэй хүчлүүд нь гидролизд ордог катионоор. Гидролиз явагдаж байна алхам алхмаар, буцаах боломжтой, өөрөөр хэлбэл бага зэрэг:
I шат: Al 3+ + H 2 O = AlOH 2+ + H +
II шат: AlOH 2+ + H 2 O = Al(OH) 2 + + H +
III шат: Al(OH) 2 + + H 2 O = Al(OH) 3 + H +
Гэсэн хэдий ч сульфид, сульфит, карбонат хөнгөн цагаанмөн тэд исгэлэн давсгидролиз эргэлт буцалтгүй, бүрэн, өөрөөр хэлбэл усан уусмалд байхгүй, гэхдээ усаар задардаг:
Al 2 (SO 4) 3 + 6NaHSO 3 → 2Al(OH) 3 + 6SO 2 + 3Na 2 SO 4
2AlBr 3 + 3Na 2 CO 3 + 3H 2 O → 2Al(OH) 3 ↓ + CO 2 + 6NaBr
2Al(NO 3) 3 + 3Na 2 CO 3 + 3H 2 O → 2Al(OH) 3 ↓ + 6NaNO 3 + 3CO 2
2AlCl 3 + 3Na 2 CO 3 + 3H 2 O → 2Al(OH) 3 ↓ + 6NaCl + 3CO 2
Al 2 (SO 4) 3 + 3K 2 CO 3 + 3H 2 O → 2Al(OH) 3 ↓ + 3CO 2 + 3K 2 SO 4
2AlCl 3 + 3Na 2 S + 6H 2 O → 2Al(OH) 3 + 3H 2 S + 6NaCl
Хөнгөн цагааны бодисууд
Хөнгөн цагааны хүчиллэг үлдэгдэл (алюминат) болох давсууд нь үүнээс үүсдэг хөнгөн цагаан исэлцагт шүлтүүдтэй нэгдэхба үндсэн оксидууд:
Al 2 O 3 + Na 2 O → 2NaAlO 2
Алюминатуудын шинж чанарыг ойлгохын тулд тэдгээрийг хоёр тусдаа бодис болгон задлах нь маш тохиромжтой.
Жишээлбэл, бид натрийн алюминатыг хоёр бодис болгон хуваадаг. хөнгөн цагааны исэл ба натрийн исэл.
NaAlO2гэж хуваана Na 2 O ба Al 2 O 3
Дараа нь хөнгөн цагааны бодисууд урвалд ордог нь бидэнд тодорхой болно хүчлүүд нь хөнгөн цагааны давс үүсгэдэг :
KAlO 2 + 4HCl → KCl + AlCl 3 + 2H 2 O
NaAlO 2 + 4HCl → AlCl 3 + NaCl + 2H 2 O
NaAlO 2 + 4HNO 3 → Al(NO 3) 3 + NaNO 3 + 2H 2 O
2NaAlO 2 + 4H 2 SO 4 → Al 2 (SO 4) 3 + Na 2 SO 4 + 4H 2 O
Илүүдэл усны нөлөөн дор хөнгөн цагааны бодисууд нь нарийн төвөгтэй давс болж хувирдаг.
KAlO 2 + H 2 O = K
NaAlO 2 + 2H 2 O = Na
Хоёртын нэгдлүүд
Хөнгөн цагааны сульфидазотын хүчлийн нөлөөн дор сульфат болж исэлддэг.
Al 2 S 3 + 8HNO 3 → Al 2 (SO 4) 3 + 8NO 2 + 4H 2 O
эсвэл хүхрийн хүчилд (нөлөөллийн дор халуун төвлөрсөн хүчил):
Al 2 S 3 + 30HNO 3 (конк. давхрага) → 2Al(NO 3) 3 + 24NO 2 + 3H 2 SO 4 + 12H 2 O
Хөнгөн цагааны сульфид задардаг ус:
Al 2 S 3 + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2 S
Хөнгөн цагаан карбидмөн хөнгөн цагааны гидроксид болон халах үед усаар задардаг метан:
Al 4 C 3 + 12H 2 O → 4Al(OH) 3 + 3CH 4
Хөнгөн цагааны нитридөртөх үед задардаг эрдэс хүчилхөнгөн цагаан ба аммонийн давс дээр:
AlN + 4HCl → AlCl 3 + NH 4 Cl
Мөн хөнгөн цагаан нитрид нь өртөх үед задардаг ус:
AlN + 3H 2 O → Al(OH) 3 ↓ + NH 3
Хөнгөн цагаан- атомын дугаар 13-тай химийн элементүүдийн үелэх системийн 13 (III) бүлгийн элемент. Al тэмдгээр тэмдэглэнэ. Хөнгөн металлын бүлэгт хамаарна. Хамгийн түгээмэл металл, гурав дахь хамгийн түгээмэл металл химийн элементдэлхийн царцдас (хүчилтөрөгч ба цахиурын дараа).
Хөнгөн цагааны исэл Al2O3- байгальд хөнгөн цагаан галд тэсвэртэй нунтаг хэлбэрээр тархсан, хатуулагаараа алмазтай ойролцоо.
Хөнгөн цагааны исэл нь боксит эсвэл хөнгөн цагааны гидроксидын дулааны задралаас гаргаж авах боломжтой байгалийн нэгдэл юм.
2Al(OH)3 = Al2O3 + 3H2O;
Al2O3 нь амфотерийн исэл бөгөөд хүчтэй болор тортой тул химийн хувьд идэвхгүй байдаг. Энэ нь усанд уусдаггүй, хүчил ба шүлтийн уусмалуудтай харьцдаггүй, зөвхөн хайлсан шүлттэй урвалд ордог.
Ойролцоогоор 1000°C температурт энэ нь шүлт ба шүлтлэг металлын карбонатуудтай эрчимтэй харилцан үйлчилж, алюминат үүсгэдэг.
Al2O3 + 2KOH = 2KAlO2 + H2O; Al2O3 + Na2CO3 = 2NaAlO2 + CO2.
Al2O3-ийн бусад хэлбэрүүд нь илүү идэвхтэй бөгөөд хүчил ба шүлтийн уусмалуудтай урвалд орж, α-Al2O3 нь зөвхөн халуун төвлөрсөн уусмалаар урвалд ордог: Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Хөнгөн цагааны оксидын амфотер шинж чанар нь хүчиллэг ба үндсэн ислүүдтэй харилцан үйлчлэхэд давс үүсгэдэг.
Al2O3 + 3SO3 = Al2(SO4)3 (үндсэн шинж чанар), Al2O3 + Na2O = 2NaAlO2 (хүчиллэг шинж чанар).
Хөнгөн цагааны гидроксид, Al(OH)3- хөнгөн цагааны исэл ба усны хослол. Усанд муу уусдаг цагаан желатин бодис нь амфотер шинж чанартай байдаг. Хөнгөн цагааны давсыг шүлтийн усан уусмалтай урвалд оруулснаар олж авна: AlCl3+3NaOH=Al(OH)3+3NaCl
Хөнгөн цагааны гидроксид нь ердийн амфотерийн нэгдэл бөгөөд шинээр олж авсан гидроксид нь хүчил, шүлтлэгт уусдаг.
2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O. Al(OH)3 + NaOH + 2H2O = Na.
Халах үед энэ нь задардаг, шингэн алдалтын процесс нь нэлээд төвөгтэй бөгөөд схемийн дагуу дараах байдлаар дүрслэгдэж болно.
Al(OH)3 = AlOOH + H2O. 2AlOOH = Al2O3 + H2O.
Алюминатууд -Шинэхэн тунасан хөнгөн цагааны гидроксид шүлтийн үйлчлэлээр үүссэн давс: Al(OH)3 + NaOH = Na (натрийн тетрагидроксоалюминат)
Мөн хөнгөн цагаан металлыг (эсвэл Al2O3) шүлтлэгт уусгах замаар алюминатыг гаргаж авдаг: 2Al + 2NaOH + 6H2O = 2Na + 3H2
Гидроксоалюминатууд Al(OH)3-ийн илүүдэл шүлттэй харилцан үйлчлэлцснээр үүсдэг: Al(OH)3 + NaOH (ex) = Na
Хөнгөн цагааны давс.Бараг бүх хөнгөн цагааны давсыг хөнгөн цагааны гидроксидээс гаргаж авч болно. Бараг бүх хөнгөн цагааны давс нь усанд уусдаг; Хөнгөн цагааны фосфат нь усанд муу уусдаг.
Уусмал дахь хөнгөн цагааны давс нь хүчиллэг урвалыг харуулдаг. Жишээлбэл, хөнгөн цагаан хлоридын устай урвуу нөлөө үзүүлэх:
AlCl3+3H2O«Al(OH)3+3HCl
Олон тооны хөнгөн цагаан давс нь практик ач холбогдолтой юм. Жишээлбэл, усгүй хөнгөн цагаан хлорид AlCl3 нь химийн практикт газрын тос боловсруулахад катализатор болгон ашигладаг.
Хөнгөн цагааны сульфат Al2(SO4)3 18H2O нь цоргоны усыг цэвэршүүлэх, түүнчлэн цаас үйлдвэрлэхэд коагулянт болгон ашигладаг.
Давхар хөнгөн цагааны давсыг өргөн хэрэглэдэг - alum KAl(SO4)2 12H2O, NaAl(SO4)2 12H2O, NH4Al(SO4)2 12H2O гэх мэт - тэдгээр нь хүчтэй зөөлрүүлэх шинж чанартай бөгөөд арьс шир боловсруулах, түүнчлэн эмнэлгийн практикт ашиглагддаг. цус тогтоогч бодис болгон.
Өргөдөл- Цогц шинж чанартай учир дулааны төхөөрөмжид өргөн хэрэглэгддэг - Хөнгөн цагаан ба түүний хайлш нь хэт өндөр температурт бат бөх чанарыг хадгалдаг. бага температурӨө. Үүнээс үүдэн криоген технологид өргөн хэрэглэгддэг.- Хөнгөнцагаан нь толь үйлдвэрлэхэд тохиромжтой материал юм.- Барилгын материалын үйлдвэрлэлд хий үүсгэгч бодис юм.- Хөнгөнцагаанжуулалт нь ган болон бусад хайлшийг зэврэлт, масштабын эсэргүүцлийг бий болгодог. .- Хөнгөн цагааны сульфидыг хүхэрт устөрөгч үйлдвэрлэхэд ашигладаг - Хөөсрүүлсэн хөнгөн цагааныг онцгой бат бөх, хөнгөн материал болгон хөгжүүлэх судалгаа хийгдэж байна.
Бууруулах бодис болгон- Термитийн бүрэлдэхүүн хэсэг болох алюминотермийн хольцууд - Пиротехникийн салбарт - Хөнгөн цагааныг ховор металлыг исэл эсвэл галогенээс нь нөхөн сэргээхэд ашигладаг. (Алюминотерми)
Алюминотерми.- металл, металл бус (түүнчлэн хайлш) тэдгээрийн ислийг металл хөнгөн цагаанаар багасгах замаар үйлдвэрлэх арга.
Хөнгөн цагааны гидроксид - Химийн бодис, энэ нь хөнгөн цагааны оксидын устай нэгдэл юм. Энэ нь шингэн болон хатуу төлөвт байж болно. Шингэн гидроксид нь вазелин шиг тунгалаг бодис бөгөөд усанд маш муу уусдаг. Хатуу гидроксид нь идэвхгүй химийн шинж чанартай цагаан талст бодис бөгөөд бараг ямар ч бусад элемент эсвэл нэгдлүүдтэй урвалд ордоггүй.
Хөнгөн цагааны гидроксидыг бэлтгэх
Хөнгөн цагааны гидроксид нь химийн солилцооны урвалаар үүсдэг. Үүнийг хийхийн тулд аммиакийн усан уусмал, хөнгөн цагааны давс, ихэвчлэн хөнгөн цагаан хлоридыг хэрэглэнэ. Энэ аргаар шингэн бодисыг олж авдаг. Хэрэв хатуу гидроксид шаардлагатай бол нүүрстөрөгчийн давхар исэл нь ууссан натрийн тетрагидроксодиакваалюминат шүлтээр дамждаг. Туршилтын олон хайрлагчид гэртээ хөнгөн цагаан гидроксидыг хэрхэн яаж авах вэ гэсэн асуултанд санаа зовж байна. Үүнийг хийхийн тулд төрөлжсөн дэлгүүрээс шаардлагатай урвалж, химийн шилэн эдлэл худалдаж авахад хангалттай.
Авахын тулд хатууМөн танд тусгай тоног төхөөрөмж хэрэгтэй тул шингэн хувилбартай байх нь дээр. Урвал хийхдээ агааржуулалт сайтай газар ашиглах шаардлагатай, учир нь дайвар бүтээгдэхүүнүүдийн аль нэг нь хий эсвэл хүчтэй үнэртэй бодис байж болох бөгөөд энэ нь хүний сайн сайхан, эрүүл мэндэд сөргөөр нөлөөлдөг. Ихэнх хүчил нь арьсанд хүрэхэд химийн түлэгдэлт үүсгэдэг тул тусгай хамгаалалтын бээлийтэй ажиллах нь зүйтэй. Мөн тусгай нүдний шилний хэлбэрээр нүдний хамгаалалтыг анхаарч үзэх нь зүйтэй юм. Аливаа бизнесийг эхлүүлэхдээ юуны түрүүнд аюулгүй байдлыг хангах талаар бодох хэрэгтэй!
Шинээр нийлэгжүүлсэн хөнгөн цагааны гидроксид нь ихэнх идэвхтэй хүчил, шүлтүүдтэй урвалд ордог. Ийм учраас үүссэн бодисыг цэвэр хэлбэрээр нь хадгалахын тулд аммиакийн усыг гаргаж авдаг. Хүчил эсвэл шүлтийг үйлдвэрлэхэд ашиглахдаа элементүүдийн эзлэх хувийг аль болох нарийвчлалтай тооцоолох шаардлагатай, эс тэгвээс илүүдэл байвал үүссэн хөнгөн цагааны гидроксид нь шингээгүй суурийн үлдэгдэлтэй харилцан үйлчилж, бүрэн уусдаг. Энэ нь хөнгөн цагаан ба түүний нэгдлүүдийн химийн идэвхжил өндөртэй холбоотой юм.
Үндсэндээ металлын ислийн агууламж өндөртэй бокситын хүдрээс хөнгөн цагааны гидроксидыг гаргаж авдаг. Уг процедур нь хаягдал чулуулгаас ашигтай элементүүдийг хурдан бөгөөд харьцангуй хямдаар салгах боломжийг олгодог. Хөнгөн цагааны гидроксидын хүчилтэй урвалд орох нь давсыг багасгаж, ус үүсэхэд хүргэдэг бөгөөд шүлтүүдтэй бол нарийн төвөгтэй гидроксоалюминий давс үүсэхэд хүргэдэг. Хатуу гидроксид нь хайлуулах замаар хатуу шүлтүүдтэй нийлж мета-алюминат үүсгэдэг.
Бодисын үндсэн шинж чанар
Физик шинж чанархөнгөн цагааны гидроксид: нягтрал - нэг шоо см тутамд 2.423 грамм, усанд уусах түвшин - бага, өнгө - цагаан эсвэл ил тод. Уг бодис нь дөрвөн полиморф хувилбарт байж болно. Бага температурт өртөхөд баерит хэмээх альфа гидроксид үүсдэг. Халуунд өртөх үед гамма гидроксид эсвэл гиббситийг олж авч болно. Хоёр бодис нь устөрөгч хоорондын молекулын холбоо бүхий талст молекулын тортой байдаг. Мөн бета-гидроксид эсвэл нордстандрит ба триклиник гибизит гэсэн хоёр өөрчлөлтийг олж болно. Эхнийх нь байерит эсвэл гиббситийг шохойжуулах замаар олж авдаг.Хоёр дахь нь болор торны мономорф биш харин триклиник бүтцээрээ бусад төрлөөс ялгаатай.
Хөнгөн цагааны гидроксидын химийн шинж чанар: молийн масс - 78 моль, д шингэн төлөвИдэвхтэй хүчил, шүлтлэгт сайн уусдаг, халах үед задардаг, амфотер шинж чанартай байдаг. Аж үйлдвэрт ихэнх тохиолдолд шингэн гидроксидыг ашигладаг тул ачаар өндөр түвшинхимийн идэвхжил, боловсруулахад хялбар бөгөөд катализатор эсвэл тусгай урвалын нөхцлийг шаарддаггүй.
Хөнгөн цагааны гидроксидын амфотер шинж чанар нь түүний мөн чанарын хоёрдмол шинж чанараар илэрдэг. Энэ нь янз бүрийн нөхцөлд хүчиллэг эсвэл шүлтлэг шинж чанарыг харуулж чадна гэсэн үг юм. Гидроксид нь шүлтлэг байдлаар урвалд ороход хөнгөн цагаан нь эерэг цэнэгтэй катион болох давс үүсдэг. Хөнгөн цагааны гидроксид нь хүчлийн үүрэг гүйцэтгэдэг бөгөөд гарц дээр давс үүсгэдэг. Гэхдээ энэ тохиолдолд метал аль хэдийн сөрөг цэнэгтэй анионы үүрэг гүйцэтгэдэг. Хоёрдмол шинж чанар нь энэхүү химийн нэгдлийг ашиглах өргөн боломжийг нээж өгдөг. Үүнийг хийхэд анагаах ухаанд ашигладаг эм, бие махбод дахь хүчил-суурь тэнцвэрийг зөрчсөн тохиолдолд тогтоосон.

Хөнгөн цагааны гидроксид нь цочроох хүчин зүйлийн эсрэг биеийн хамгаалалтын хариу урвалыг сайжруулдаг бодис болгон вакцинд ордог. Хөнгөн цагааны гидроксидын тунадас нь усанд уусдаггүй нь бодисыг ус цэвэршүүлэх зорилгоор ашиглах боломжийг олгодог. Химийн нэгдэл нь маш хүчтэй шингээгч бөгөөд уснаас олон тооны хортой элементүүдийг зайлуулах боломжийг олгодог.
Аж үйлдвэрийн хэрэглээ
Аж үйлдвэрт гидроксидын хэрэглээ нь цэвэр хөнгөн цагааны үйлдвэрлэлтэй холбоотой. Технологийн процесс нь хөнгөн цагааны исэл агуулсан хүдрийг боловсруулахаас эхэлдэг бөгөөд энэ нь процесс дууссаны дараа гидроксид болж хувирдаг. Энэ урвалын гарц нь хангалттай өндөр бөгөөд дууссаны дараа үлдсэн зүйл нь үндсэндээ нүцгэн чулуулаг юм. Дараа нь хөнгөн цагааны гидроксидын задралын үйл ажиллагаа явагдана.
Уг процедур нь тусгай нөхцөл шаарддаггүй, учир нь бодис нь 180 хэмээс дээш температурт халаахад сайн задардаг. Энэ алхам нь хөнгөн цагааны ислийг тусгаарлах боломжийг олгодог. Энэ холболт нь үндсэн буюу туслах материалолон тооны үйлдвэр, гэр ахуйн бүтээгдэхүүн үйлдвэрлэхэд зориулагдсан. Хэрэв цэвэр хөнгөн цагааныг авах шаардлагатай бол уусмалд натрийн криолит нэмж электролизийн процессыг хэрэглэнэ. Катализатор нь исэлээс хүчилтөрөгч авч, цэвэр хөнгөн цагаан нь катод дээр тогтдог.
Хөнгөн цагааны исэл - Al2O3. Физик шинж чанарууд:Хөнгөн цагааны исэл нь цагаан аморф нунтаг эсвэл маш хатуу цагаан талст юм. Молекулын жин = 101.96, нягт - 3.97 г/см3, хайлах цэг - 2053 ° C, буцлах температур - 3000 ° C.
Химийн шинж чанар:Хөнгөн цагааны исэл нь амфотер шинж чанарыг харуулдаг - хүчиллэг исэл ба үндсэн оксидын шинж чанар, хүчил ба суурьтай урвалд ордог. Кристалл Al2O3 нь химийн идэвхгүй, аморф нь илүү идэвхтэй байдаг. Хүчиллэг уусмалуудтай харилцан үйлчлэлцэх нь дундаж хөнгөн цагааны давс, суурийн уусмалаар - нарийн төвөгтэй давс үүсгэдэг. металлын гидроксиалюминатууд:
Хөнгөн цагааны ислийг хатуу металл шүлттэй холиход давхар давс үүсдэг. метаалюминатууд(усгүй алюминатууд):
Хөнгөн цагааны исэл нь устай харьцдаггүй бөгөөд усанд уусдаггүй.
Баримт бичиг:Хөнгөн цагаан ислийг металыг исэлээс нь хөнгөн цагаанаар нь ангижруулах аргаар гаргаж авдаг: хром, молибден, вольфрам, ванади гэх мэт. металлотерми, нээлттэй Бекетов:
Хэрэглээ:Хөнгөн цагааны ислийг хөнгөн цагаан үйлдвэрлэхэд, нунтаг хэлбэрээр - галд тэсвэртэй, химийн тэсвэртэй, элэгдэлд тэсвэртэй материалд, талст хэлбэрээр - лазер, синтетик үнэт чулуу (бадмаараг, индранил гэх мэт) үйлдвэрлэхэд ашигладаг. , бусад металлын ислийн хольцоор будсан - Cr2O3 (улаан), Ti2O3 ба Fe2O3 (цэнхэр).
Хөнгөн цагааны гидроксид – A1(OH)3. Физик шинж чанарууд:Хөнгөн цагааны гидроксид - цагаан аморф (гель хэлбэртэй) эсвэл талст. Усанд бараг уусдаггүй; молекул жин – 78.00, нягт – 3.97 г/см3.
Химийн шинж чанар:Ердийн амфотерийн гидроксид урвалд ордог:
1) хүчилтэй, дунд зэргийн давс үүсгэдэг: Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O;
2) шүлтийн уусмалаар нийлмэл давс үүсгэдэг - гидроксоалюминатууд: Al(OH)3 + KOH + 2H2O = K.
Al(OH)3-ийг хуурай шүлттэй холиход метаалюминатууд үүснэ: Al(OH)3 + KOH = KAlO2 + 2H2O.
Баримт бичиг:
1) шүлтийн уусмалын нөлөөн дор хөнгөн цагааны давснаас: AlCl3 + 3NaOH = Al(OH)3 + 3H2O;
2) хөнгөн цагаан нитридыг усаар задлах: AlN + 3H2O = Al(OH)3 + NH3?;
3) гидроксо цогцолборын уусмалаар CO2-ийг дамжуулах: [Al(OH)4]-+ CO2 = Al(OH)3 + HCO3-;
4) Al-ийн давсны аммиакийн гидрат үйлчлэл; өрөөний температурт Al(OH)3 үүснэ.
62. Хромын дэд бүлгийн ерөнхий шинж чанар
Элементүүд хромын дэд бүлгүүдшилжилтийн металлын цувралд завсрын байр суурийг эзэлдэг. Тэд өндөр хайлах, буцалгах цэгүүдтэй, электрон тойрог замд хоосон зайтай байдаг. Элементүүд хромТэгээд молибденхэвийн бус электрон бүтэцтэй - тэдгээр нь гаднах s-орбиталд нэг электронтой байдаг (VB дэд бүлгийн Nb гэх мэт). Эдгээр элементүүд нь гаднах d- ба s-орбиталуудад 6 электронтой байдаг тул бүх орбиталууд хагасаар дүүрсэн, өөрөөр хэлбэл тус бүр нэг электронтой байдаг. Үүнтэй төстэй электрон тохиргоотой элемент нь ялангуяа тогтвортой, исэлдэлтэнд тэсвэртэй байдаг. Гянт болд-аас илүү хүчтэй металлын холбоо байдаг молибден. Хромын дэд бүлгийн элементүүдийн исэлдэлтийн зэрэг нь ихээхэн ялгаатай байдаг. Тохиромжтой нөхцөлд бүх элементүүд 2-оос 6 хүртэлх эерэг исэлдэлтийн тоог харуулдаг бөгөөд хамгийн их исэлдэлтийн тоо нь бүлгийн дугаартай тохирч байна. Элементүүдийн исэлдэлтийн бүх төлөв тогтвортой байдаггүй, хром нь хамгийн тогтвортой нь - +3.
Бүх элементүүд нь MVIO3 ислийг үүсгэдэг; бага исэлдэлтийн төлөвтэй оксидыг бас мэддэг.Энэ дэд бүлгийн бүх элементүүд амфотерик байдаг - тэдгээр нь үүсдэг нарийн төвөгтэй нэгдлүүдболон хүчил.
Хром, молибденТэгээд вольфрамметаллурги, цахилгааны инженерийн салбарт эрэлт хэрэгцээтэй . Агаарт эсвэл исэлдүүлэгч хүчлийн орчинд хадгалахад авч үзэх бүх металлыг идэвхгүй оксидын хальсаар хучдаг. Киноыг химийн болон механик аргаар арилгаснаар металлын химийн идэвхийг нэмэгдүүлэх боломжтой.
Chromium.Элементийг хромит хүдрээс Fe(CrO2)2 гаргаж, нүүрсээр багасгаж: Fe(CrO2)2 + 4C = (Fe + 2Cr) + 4CO?.
Цэвэр хромыг хөнгөн цагааны тусламжтайгаар Cr2O3-ийг багасгах эсвэл хромын ион агуулсан уусмалыг электролизээр гаргаж авдаг. Электролиз ашиглан хромыг тусгаарласнаар гоёл чимэглэлийн болон хамгаалалтын хальс болгон ашигладаг хромын бүрээсийг авах боломжтой.
Феррохромыг гангийн үйлдвэрлэлд ашигладаг хромоос гаргаж авдаг.
Молибден.Сульфидын хүдрээс гаргаж авсан . Түүний нэгдлүүдийг гангийн үйлдвэрлэлд ашигладаг. Металлыг өөрөө ислийг нь багасгах замаар олж авдаг. Молибдений ислийг төмрөөр шохойжуулснаар ферромолибден авч болно. Ороомог зуух, цахилгаан контактуудад утас, хоолой хийхэд ашигладаг. Молибден нэмсэн ганг автомашины үйлдвэрлэлд ашигладаг.
Гянт болд.Баяжуулсан хүдрээс гаргаж авсан исэлээс гаргаж авсан . Хөнгөн цагаан эсвэл устөрөгчийг багасгах бодис болгон ашигладаг. Үүний үр дүнд вольфрамын нунтаг нь өндөр даралт, дулааны боловсруулалт (нунтаг металлурги) дор үүсдэг. Энэ хэлбэрээр вольфрамыг утас үйлдвэрлэхэд ашигладаг бөгөөд ган дээр нэмдэг.
Аж үйлдвэрт хамгийн өргөн хэрэглэгддэг бодисуудын нэг бол хөнгөн цагааны гидроксид юм. Энэ нийтлэлд энэ тухай ярих болно.
Гидроксид гэж юу вэ?
Энэ химийн нэгдэл, энэ нь исэл устай урвалд ороход үүсдэг. Тэдгээрийн гурван төрөл байдаг: хүчиллэг, үндсэн ба амфотер. Эхний болон хоёр дахь нь химийн идэвхжил, шинж чанар, томьёогоор нь бүлэгт хуваагддаг.
Амфотер бодис гэж юу вэ?
Оксид ба гидроксид нь амфотер шинж чанартай байж болно. Эдгээр нь урвалын нөхцөл, ашигласан урвалж гэх мэтээс хамааран хүчиллэг болон үндсэн шинж чанарыг харуулах хандлагатай бодисууд юм. Амфотерийн исэлд хоёр төрлийн төмрийн исэл, манганы исэл, хар тугалга, берилли, цайр, хөнгөн цагаан зэрэг орно. Сүүлийнх нь ихэвчлэн түүний гидроксидоос гаргаж авдаг. Амфотерийн гидроксид нь бериллийн гидроксид, төмрийн гидроксид, хөнгөн цагааны гидроксид багтдаг бөгөөд бид өнөөдөр бидний нийтлэлд авч үзэх болно.
Хөнгөн цагааны гидроксидын физик шинж чанар
Энэхүү химийн нэгдэл нь хатуу бодис юм цагаан бодис. Энэ нь усанд уусдаггүй.

Хөнгөн цагааны гидроксид - химийн шинж чанар
Дээр дурдсанчлан энэ нь амфотерийн гидроксидын бүлгийн хамгийн тод төлөөлөгч юм. Урвалын нөхцлөөс хамааран энэ нь үндсэн болон хүчиллэг шинж чанарыг харуулж чадна. Энэ бодис нь хүчилд уусч, давс, ус үүсгэдэг.

Жишээлбэл, хэрэв та үүнийг перхлорт хүчилтэй тэнцүү хэмжээгээр холих юм бол хөнгөн цагаан хлоридыг устай тэнцүү хэмжээгээр авах болно. Мөн хөнгөн цагааны гидроксидтэй урвалд ордог өөр нэг бодис нь натрийн гидроксид юм. Энэ бол ердийн үндсэн гидроксид юм. Хэрэв та энэ бодис болон натрийн гидроксидын уусмалыг тэнцүү хэмжээгээр холивол натрийн тетрагидроксиалюминат хэмээх нэгдэл гарч ирнэ. Түүний химийн бүтэц нь натрийн атом, хөнгөн цагаан атом, хүчилтөрөгч, устөрөгчийн дөрвөн атомыг агуулдаг. Гэсэн хэдий ч эдгээр бодисыг нэгтгэх үед урвал нь арай өөрөөр явагдах бөгөөд энэ нэгдэл үүсэхээ больсон. Энэ процессын үр дүнд ижил хэмжээний хуурай натри, хөнгөн цагааны гидроксидыг хольж, ижил хэмжээгээр холих тохиолдолд натрийн метаалюминатыг (түүний томьёо нь нэг атом натри, хөнгөн цагаан, хүчилтөрөгчийн хоёр атом агуулдаг) устай тэнцүү хэмжээгээр авах боломжтой. өндөр температурт өртөх. Хэрэв та натрийн гидроксидтэй өөр харьцаатай холивол натрийн гурван атом, нэг хөнгөн цагаан атом, зургаан хүчилтөрөгч, устөрөгч агуулсан натрийн гексагидроксиалюминатыг авч болно. Энэ бодис үүсэхийн тулд та тухайн бодис болон натрийн гидроксидын уусмалыг 1: 3 харьцаатай холих хэрэгтэй. Дээр дурдсан зарчмыг ашиглан калийн тетрагидроксоалюминат ба калийн гексагидроксоалюминат гэж нэрлэгддэг нэгдлүүдийг авч болно. Мөн тухайн бодис нь маш өндөр температурт өртөх үед задрах чадвартай байдаг. Энэ төрлийн химийн урвалын үр дүнд амфотер шинж чанартай хөнгөн цагаан исэл, ус үүсдэг. Хэрэв та 200 г гидроксидыг аваад халаавал 50 г исэл, 150 г ус авна. Химийн өвөрмөц шинж чанараас гадна энэ бодис нь бүх гидроксидын нийтлэг шинж чанарыг харуулдаг. Энэ нь хөнгөн цагаанаас бага химийн идэвхжилтэй металлын давстай харилцан үйлчилдэг. Жишээлбэл, бид 2: 3 харьцаатай зэсийн хлорид ба түүний хоорондох урвалыг авч үзэж болно. Энэ тохиолдолд усанд уусдаг хөнгөн цагаан хлорид ба купрумын гидроксид хэлбэрийн тунадас 2: 3 харьцаатай ялгарна. Тухайн бодис нь ижил төстэй металлын ислүүдтэй урвалд ордог; жишээлбэл, бид ижил зэсийн нэгдлийг авч болно. Урвалыг явуулахын тулд 2: 3 харьцаатай хөнгөн цагааны гидроксид ба купрумын исэл хэрэгтэй бөгөөд ингэснээр хөнгөн цагааны исэл ба зэсийн гидроксид үүснэ. Бусад амфотерийн гидроксидууд, тухайлбал төмөр эсвэл бериллийн гидроксид нь дээр дурдсан шинж чанартай байдаг.
Натрийн гидроксид гэж юу вэ?
Дээр дурдсанчлан олон сонголтууд байдаг химийн урвалнатрийн гидроксид бүхий хөнгөн цагаан гидроксид. Энэ ямар төрлийн бодис вэ? Энэ нь ердийн үндсэн гидроксид, өөрөөр хэлбэл реактив, усанд уусдаг суурь юм. Энэ нь үндсэн гидроксидын шинж чанартай бүх химийн шинж чанартай байдаг.

Өөрөөр хэлбэл, энэ нь хүчилд уусдаг, жишээлбэл, натрийн гидроксидыг перхлорт хүчилтэй тэнцүү хэмжээгээр холих үед та ширээний давс (натрийн хлорид), усыг 1: 1 харьцаатай авч болно. Энэхүү гидроксид нь натрийн химийн идэвхжил багатай металлын давс, тэдгээрийн ислүүдтэй урвалд ордог. Эхний тохиолдолд стандарт солилцооны урвал явагдана. Жишээлбэл, түүнд мөнгөн хлорид нэмэхэд натрийн хлорид, мөнгөний гидроксид үүсдэг бөгөөд тэдгээр нь тунадас үүсгэдэг (түүний үр дүнд үүссэн бодисуудын аль нэг нь тунадас, хий эсвэл ус байвал солилцооны урвал явагдах боломжтой). Жишээлбэл, цайрын ислийг натрийн гидроксид нэмэхэд бид сүүлчийн гидроксид ба усыг олж авдаг. Гэсэн хэдий ч дээр дурдсан AlOH гидроксидын урвал илүү тодорхой байна.
AlOH бэлтгэх
Бид түүний гол зүйлийг аль хэдийн авч үзсэн үед Химийн шинж чанар, хэрхэн олборлож байгаа талаар ярилцаж болно. Энэ бодисыг олж авах гол арга бол хөнгөн цагааны давс ба натрийн гидроксидын хооронд химийн урвал явуулах явдал юм (калийн гидроксидыг бас ашиглаж болно).

Энэ төрлийн урвалын үед AlOH өөрөө үүсдэг бөгөөд энэ нь цагаан тунадас, мөн шинэ давс болж тунадаг. Жишээлбэл, хэрэв та хөнгөн цагаан хлорид авч, түүнд 3 дахин их калийн гидроксид нэмбэл үүссэн бодисууд нь өгүүлэлд дурдсан химийн нэгдэл, 3 дахин их калийн хлорид болно. Мөн хөнгөн цагааны давсны уусмал ба үндсэн металлын карбонатын хооронд химийн урвал явагдах AlOH-ийг үйлдвэрлэх арга байдаг; жишээ болгон натри авч үзье. Хөнгөн цагааны гидроксид, гал тогооны давс, нүүрстөрөгчийн давхар ислийг 2: 6: 3 харьцаатай авахын тулд 2: 3: 3 харьцаатай хөнгөн цагаан хлорид, натрийн карбонат (сод), усыг холих шаардлагатай.
Хөнгөн цагааны гидроксидыг хаана хэрэглэдэг вэ?
Хөнгөн цагааны гидроксид нь анагаах ухаанд ашиглагддаг.

Хүчиллэгийг саармагжуулах чадвартай тул зүрхний шархыг агуулсан бэлдмэлийг хэрэглэхийг зөвлөж байна. Энэ нь мөн гэдэсний шархлаа, цочмог ба архаг үрэвсэлт үйл явцыг эмчлэхэд зориулагдсан байдаг. Үүнээс гадна хөнгөн цагааны гидроксидыг эластомер үйлдвэрлэхэд ашигладаг. Энэ нь бас өргөн хэрэглэгддэг химийн үйлдвэрхөнгөн цагаан исэл, натрийн алюминатыг нийлэгжүүлэхэд - эдгээр процессуудыг дээр авч үзсэн. Үүнээс гадна усыг бохирдуулагчаас цэвэрлэхэд ихэвчлэн ашигладаг. Энэ бодисыг гоо сайхны бүтээгдэхүүн үйлдвэрлэхэд өргөн ашигладаг.
Түүний тусламжтайгаар авч болох бодисуудыг хаана хэрэглэдэг вэ?
Гидроксидын дулааны задралын улмаас олж авах боломжтой хөнгөн цагаан исэл нь керамик үйлдвэрлэлд ашиглагддаг бөгөөд янз бүрийн химийн урвалыг явуулахад катализатор болгон ашигладаг. Натрийн тетрагидроксиалюминат нь даавууг будах технологид ашигладаг.