Хүний биед уургийн үүрэг маш том байдаг. Үүний зэрэгцээ, бодис нь урьдчилан тодорхойлсон бүтцийг олж авсны дараа л ийм нэрийг авч болно. Энэ хүртэл энэ нь полипептид, зүгээр л амин хүчлийн гинж бөгөөд зориулалтын үүргээ гүйцэтгэж чадахгүй. Ерөнхийдөө уургийн орон зайн бүтэц (анхдагч, хоёрдогч, гуравдагч, домэйн) нь тэдгээрийн задгай бүтэц юм. Түүнээс гадна хоёрдогч, гуравдагч, домайн бүтэц нь организмын хувьд хамгийн чухал юм.
Уургийн бүтцийг судлах урьдчилсан нөхцөл
Бүтцийг судлах аргуудын дунд химийн бодисуудРентген туяаны дифракцийн талстографи онцгой үүрэг гүйцэтгэдэг. Түүгээр дамжуулан молекулын нэгдлүүдийн атомуудын дараалал, тэдгээрийн орон зайн зохион байгуулалтын талаархи мэдээллийг авах боломжтой. Энгийнээр хэлэхэд, 20-р зууны 30-аад оны үед боломжтой болсон нэг молекулын хувьд рентген зураг авах боломжтой.
Тэр үед судлаачид олон уураг нь зөвхөн шугаман бүтэцтэй төдийгүй мушгиа, ороомог, домэйнд байрладаг болохыг олж мэдсэн. Шинжлэх ухааны олон тооны туршилтуудын үр дүнд уургийн хоёрдогч бүтэц нь эцсийн хэлбэр болох нь тогтоогджээ. бүтцийн уурагфермент ба иммуноглобулины завсрын бодис. Энэ нь эцсийн эцэст гуравдагч эсвэл дөрөвдөгч бүтэцтэй бодисууд "боловсорч гүйцэх" үе шатанд хоёрдогч бүтцийн онцлог шинж чанартай спираль үүсэх үе шатыг туулах ёстой гэсэн үг юм.

Хоёрдогч уургийн бүтэц үүсэх
Эсийн эндоплазмын барзгар сүлжээн дэх рибосомууд дээрх полипептидийн нийлэгжилт дуусмагц уургийн хоёрдогч бүтэц үүсч эхэлдэг. Полипептид нь өөрөө урт молекул бөгөөд маш их зай эзэлдэг бөгөөд тээвэрлэх, үүргээ гүйцэтгэхэд тохиромжгүй байдаг. Тиймээс түүний хэмжээг багасгаж, онцгой шинж чанарыг өгөхийн тулд хоёрдогч бүтэц бий болдог. Энэ нь альфа спираль ба бета давхарга үүсэх замаар явагддаг. Ийнхүү хоёрдогч бүтэцтэй уураг олж авдаг бөгөөд энэ нь ирээдүйд гуравдагч ба дөрөвдөгч болж хувирах эсвэл энэ хэлбэрээр ашиглагдах болно.

Хоёрдогч бүтцийн зохион байгуулалт
Олон тооны судалгаагаар уургийн хоёрдогч бүтэц нь альфа спираль, бета давхарга эсвэл эдгээр элементүүдтэй ээлжлэн хэсгүүд байдаг болохыг харуулсан. Түүнээс гадна хоёрдогч бүтэц нь уургийн молекулыг мушгих, эргүүлэх арга юм. Энэ нь полипептид дэх амин хүчлийн үлдэгдлийн туйлын бүсүүдийн хооронд үүссэн устөрөгчийн холбооноос болж үүсдэг эмх замбараагүй процесс юм.
Альфа мушгиа хоёрдогч бүтэц
Полипептидийн биосинтезд зөвхөн L-амин хүчлүүд оролцдог тул уургийн хоёрдогч бүтэц үүсэх нь мушгиа цагийн зүүний дагуу (баруун гараараа) мушгихад эхэлдэг. Мушгиа эргэлт бүрт 3.6 амин хүчлийн үлдэгдэл байдаг бөгөөд мушгиа тэнхлэгийн дагуух зай нь 0.54 нм байна. тэр ерөнхий шинж чанарууднийлэгжилтэнд оролцдог амин хүчлүүдийн төрлөөс хамаардаггүй уургийн хоёрдогч бүтцийн хувьд.

Полипептидийн гинж бүхэлдээ спираль хэлбэртэй биш гэдгийг тогтоосон. Түүний бүтэц нь шугаман хэсгүүдийг агуулдаг. Ялангуяа пепсиний уургийн молекул нь зөвхөн 30% мушгиа, лизоцим - 42%, гемоглобин - 75% байна. Энэ нь уургийн хоёрдогч бүтэц нь нарийн мушгиа биш, харин түүний хэсгүүдийн шугаман эсвэл давхаргатай хослуулсан гэсэн үг юм.
Бета давхаргын хоёрдогч бүтэц
Бодисын бүтцийн зохион байгуулалтын хоёр дахь хэлбэр нь устөрөгчийн холбоогоор холбогдсон хоёр ба түүнээс дээш полипептидийн хэлхээ болох бета давхарга юм. Сүүлийнх нь чөлөөт CO NH2 бүлгүүдийн хооронд үүсдэг. Ийм байдлаар голчлон бүтцийн (булчингийн) уургууд холбогддог.
Энэ төрлийн уургийн бүтэц нь дараах байдалтай байна: терминалын тэмдэглэгээ бүхий полипептидийн нэг хэлхээ талбай A-Bнөгөөтэйгөө параллель. Цорын ганц анхааруулга нь хоёр дахь молекул нь эсрэг параллель байрладаг бөгөөд B-A гэж тэмдэглэгдсэн байдаг. Олон тооны устөрөгчийн бондоор холбогдсон дурын олон тооны полипептидийн гинжээс бүрдэх бета давхарга ингэж үүсдэг.
устөрөгчийн холбоо
Уургийн хоёрдогч бүтэц нь янз бүрийн цахилгаан сөрөг утгатай атомуудын олон туйлын харилцан үйлчлэлд суурилсан холбоо юм. Фтор, хүчилтөрөгч, азот, устөрөгч гэсэн дөрвөн элемент ийм холбоо үүсгэх хамгийн их чадвартай байдаг. Уургууд нь фтороос бусад бүх зүйлийг агуулдаг. Тиймээс устөрөгчийн холбоо үүсч, улмаар полипептидийн гинжийг бета давхарга, альфа спираль болгон нэгтгэх боломжтой болгодог.

Устөрөгчийн холбоо үүсэх нь диполь болох усны жишээгээр хамгийн амархан тайлбарлагддаг. Хүчилтөрөгч нь хүчтэй сөрөг цэнэгтэй бөгөөд туйлшрал ихтэй байдаг O-N холболтустөрөгчийг эерэг гэж үздэг. Энэ төлөвт молекулууд нь тодорхой орчинд байдаг. Мөн тэдний олонх нь хүрч, мөргөлддөг. Дараа нь эхний усны молекул дахь хүчилтөрөгч нөгөөгөөсөө устөрөгчийг татдаг. Гинж дээр гэх мэт.
Үүнтэй төстэй үйл явц нь уурагуудад тохиолддог: пептидийн бондын электрон сөрөг хүчилтөрөгч нь бусад амин хүчлийн үлдэгдлийн аль ч хэсгээс устөрөгчийг татаж, устөрөгчийн холбоо үүсгэдэг. Энэ нь сул туйлын коньюгаци бөгөөд үүнийг таслахад ойролцоогоор 6.3 кЖ энерги шаардагдана.
Харьцуулбал, уургийн хамгийн сул ковалент холбоог таслахад 84 кЖ энерги шаардагдана. Хамгийн хүчтэй ковалент холбоонд 8400 кЖ шаардлагатай. Гэсэн хэдий ч уургийн молекул дахь устөрөгчийн бондын тоо маш их тул тэдгээрийн нийт энерги нь молекулыг түрэмгий нөхцөлд оршин тогтнох, орон зайн бүтцийг хадгалах боломжийг олгодог. Үүнээс болж уураг байдаг. Энэ төрлийн уургийн бүтэц нь булчин, яс, шөрмөсний үйл ажиллагаанд шаардлагатай хүчийг өгдөг. Бие махбодид уургийн хоёрдогч бүтцийн ач холбогдол маш их байдаг.
Уургууд нь полипептидийн гинжийг бүрдүүлдэг бөгөөд уургийн молекул нь нэг, хоёр ба түүнээс дээш гинжээс бүрдэж болно. Гэсэн хэдий ч физик, биологийн болон Химийн шинж чанарбиополимерууд нь зөвхөн химийн ерөнхий бүтцээр тодорхойлогддог бөгөөд энэ нь "утгагүй" байж болох төдийгүй уургийн молекулын зохион байгуулалтын бусад түвшний оролцоотойгоор тодорхойлогддог.
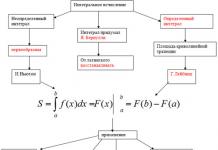
Тоо хэмжээ, чанараар тодорхойлогддог амин хүчлийн найрлага. Пептидийн холбоо нь анхдагч бүтцийн үндэс юм. Энэхүү таамаглалыг анх 1888 онд А.Я.Данилевский илэрхийлсэн бөгөөд хожим түүний таамаглалыг Э.Фишер хийсэн пептидийн нийлэгжилтээр баталжээ. Уургийн молекулын бүтцийг А.Я.Данилевский, Е.Фишер нар нарийвчлан судалсан. Энэ онолын дагуу уургийн молекулууд нь пептидийн холбоогоор холбогдсон олон тооны амин хүчлийн үлдэгдэлээс бүрддэг. Уургийн молекул нь нэг буюу хэд хэдэн полипептидийн гинжтэй байж болно.
Уургийн анхдагч бүтцийг судлахдаа химийн бодис, протеолитик ферментийг ашигладаг. Тиймээс Эдманы аргыг ашиглан терминалын амин хүчлийг тодорхойлох нь маш тохиромжтой.
Уургийн хоёрдогч бүтэц нь уургийн молекулын орон зайн тохиргоог харуулдаг. Хоёрдогч бүтцийн дараах төрлүүд байдаг: альфа мушгиа, бета мушгиа, коллаген мушгиа. Эрдэмтэд пептидийн бүтэц нь альфа спиралын хамгийн онцлог шинж чанартай болохыг тогтоожээ.
Уургийн хоёрдогч бүтцийг цахилгаан сөрөг азотын атомтай холбосон нэг пептидийн холбоо ба түүнээс дөрөв дэх амин хүчлийн карбонил хүчилтөрөгчийн атомын хооронд үүссэнээр тогтворжуулж, спираль дагуу чиглүүлдэг. Эрчим хүчний тооцоолол нь уугуул уурагт байдаг баруун альфа спираль нь эдгээр амин хүчлүүдийн полимержихэд илүү үр дүнтэй болохыг харуулж байна.
Уургийн хоёрдогч бүтэц: бета хуудасны бүтэц
Бета атираа дахь полипептидийн гинж бүрэн сунгагдсан байдаг. Бета атираа нь хоёр пептидийн бондын харилцан үйлчлэлээр үүсдэг. Энэ бүтэц нь (кератин, фиброин гэх мэт) онцлог шинж чанартай байдаг. Ялангуяа бета-кератин нь полипептидийн гинжин хэлхээний зэрэгцээ зохицуулалтаар тодорхойлогддог бөгөөд тэдгээр нь гинжин хэлхээ хоорондын дисульфидын бондоор нэмэлт тогтворжсон байдаг. Торгоны фиброины хувьд зэргэлдээх полипептидийн гинж нь эсрэг параллель байдаг.
Уургийн хоёрдогч бүтэц: коллаген мушгиа
Энэ формац нь саваа хэлбэртэй тропоколлагены гурван спираль гинжээс бүрддэг. Спираль хэлбэрийн гинж нь мушгиж, супер ороомог үүсгэдэг. Спираль нь нэг гинжин хэлхээний амин хүчлийн үлдэгдэл пептидийн амин бүлгийн устөрөгч ба нөгөө гинжин хэлхээний амин хүчлийн үлдэгдэл карбонил бүлгийн хүчилтөрөгчийн хооронд үүсдэг устөрөгчийн холбоогоор тогтворждог. Үзүүлсэн бүтэц нь коллагены өндөр хүч чадал, уян хатан чанарыг өгдөг.
Уургийн гуравдагч бүтэц
Төрөлхийн ихэнх уургууд нь амин хүчлийн радикалуудын хэлбэр, хэмжээ, туйлшрал, түүнчлэн амин хүчлийн дарааллаар тодорхойлогддог маш нягт бүтэцтэй байдаг.
Уургийн уугуул конформаци буюу гуравдагч бүтэц үүсэхэд гидрофоб ба ионоген харилцан үйлчлэл, устөрөгчийн холбоо гэх мэт чухал нөлөө үзүүлдэг.Эдгээр хүчний үйлчлэлээр уургийн молекулын термодинамикийн тохиромжтой конформац, тогтворжилтыг хангадаг. .
Дөрөвдөгчийн бүтэц
Энэ төрлийн молекулын бүтэц нь хэд хэдэн дэд нэгжийг нэг цогц молекул болгон нэгтгэсний үр дүнд үүсдэг. Дэд хэсэг бүр нь анхдагч, хоёрдогч, гуравдагч бүтцийг агуулдаг.
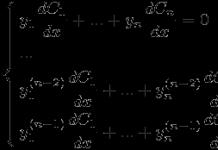
Хоёрдогч бүтэц нь нэг гинжин хэлхээний пептидийн бүлгүүд эсвэл зэргэлдээх полипептидийн гинжний хооронд устөрөгчийн холбоо үүссэний улмаас полипептидийн гинжийг эмх цэгцтэй бүтэц болгон байрлуулах арга юм. Тохиргоогоор хоёрдогч бүтэц нь мушгиа (α-спираль) ба давхарга-атираат (β-бүтэц ба хөндлөн β-хэлбэр) гэж хуваагддаг.

α-геликс. Энэ бол нэг полипептидийн гинжин хэлхээний доторх устөрөгчийн интерпептидийн холбооноос үүссэн ердийн спираль хэлбэртэй уургийн хоёрдогч бүтэц юм. Пептидийн бондын бүх шинж чанарыг харгалзан үзсэн α-геликсийн бүтцийн загварыг (Зураг 2) Полинг, Кори нар санал болгосон. α-геликсийн үндсэн шинж чанарууд:
мушгиа тэгш хэмтэй полипептидийн гинжин хэлхээний мушгиа тохиргоо;
эхний болон дөрөв дэх амин хүчлийн үлдэгдэл тус бүрийн пептидийн бүлгүүдийн хооронд устөрөгчийн холбоо үүсэх;
спираль эргэлтүүдийн тогтмол байдал;
· α-геликс дэх бүх амин хүчлийн үлдэгдэл тэдгээрийн хажуугийн радикалуудын бүтцээс үл хамааран тэнцүү байх;
амин хүчлүүдийн хажуугийн радикалууд α-геликс үүсэхэд оролцдоггүй.
Гаднах байдлаар α-геликс нь цахилгаан зуухны бага зэрэг сунгасан мушгиа шиг харагдаж байна. Нэг ба дөрөв дэх пептидийн бүлгүүдийн хоорондох устөрөгчийн бондын тогтмол байдал нь полипептидийн гинжин хэлхээний эргэлтийн тогтмол байдлыг тодорхойлдог. Нэг эргэлтийн өндөр буюу α-геликсийн давирхай нь 0.54 нм; Энэ нь 3.6 амин хүчлийн үлдэгдэл агуулдаг, өөрөөр хэлбэл амин хүчлийн үлдэгдэл бүр тэнхлэгийн дагуу (нэг амин хүчлийн үлдэгдлийн өндөр) 0.15 нм (0.54: 3.6 = 0.15 нм) хөдөлдөг бөгөөд энэ нь бүх амин хүчлийн эквивалентийн талаар ярих боломжийг бидэнд олгодог. α-геликс дэх үлдэгдэл. α-геликсийн тогтмол хугацаа нь 5 эргэлт буюу 18 амин хүчлийн үлдэгдэл; нэг үеийн урт нь 2.7 нм. Цагаан будаа. 3. Pauling-Corey α-helix загвар
β-бүтэц. Энэ нь полипептидийн гинжин хэлхээний бага зэрэг муруй хэлбэртэй, нэг полипептидийн гинж эсвэл зэргэлдээх полипептидийн гинжин хэлхээний салангид хэсгүүдийн доторх интерпептидийн устөрөгчийн холбоог ашиглан үүсдэг хоёрдогч бүтэц юм. Үүнийг давхар атираат бүтэц гэж нэрлэдэг. Төрөл бүрийн β-бүтэцүүд байдаг. Уургийн нэг полипептидийн гинжин хэлхээнээс үүссэн хязгаарлагдмал давхаргат бүсүүдийг хөндлөн β-хэлбэр (богино β-бүтэц) гэж нэрлэдэг. Хөндлөн β хэлбэрийн устөрөгчийн холбоо нь полипептидийн гинжин хэлхээний гогцоонуудын пептидийн бүлгүүдийн хооронд үүсдэг. Өөр нэг төрөл болох иж бүрэн β-бүтэц нь сунасан хэлбэртэй бөгөөд зэргэлдээх параллель полипептидийн гинжин хэлхээний хоорондох интерпептидийн устөрөгчийн холбоогоор тогтоогдсон бүх полипептидийн гинжин хэлхээний онцлог шинж юм (Зураг 3). Энэ бүтэц нь баян хуурын хөөрөгийг санагдуулдаг. Түүнээс гадна, β-бүтцийн хувилбарууд боломжтой: тэдгээрийг зэрэгцээ гинжээр (полипептидийн гинжин хэлхээний N-терминалууд нэг чиглэлд чиглүүлдэг) болон антипараллель (N-терминалууд өөр өөр чиглэлд чиглүүлдэг) үүсгэж болно. Нэг давхаргын хажуугийн радикалууд нь нөгөө давхаргын хажуугийн радикалуудын хооронд байрладаг.
Уургийн хувьд устөрөгчийн холбоог өөрчилснөөр α-бүтэцээс β-бүтэц рүү болон эсрэгээр шилжих боломжтой. Гинжин дагуух ердийн интерпептидийн устөрөгчийн бондуудын оронд (тэдгээрийн улмаас полипептидийн гинж нь спираль хэлбэрээр эргэлддэг) спираль хэлбэртэй хэсгүүд нь мушгиагүй бөгөөд полипептидийн гинжин хэлхээний сунасан хэсгүүдийн хооронд устөрөгчийн холбоо хаалттай байдаг. Ийм шилжилт нь үсний уураг болох кератинд байдаг. Үсийг шүлтлэг бодисоор угаах үед угаалгын нунтагβ-кератины спираль бүтэц нь амархан устаж, α-кератин руу шилждэг (буржгар үс шулуун болдог).
Болор хайлахтай адил уургийн ердийн хоёрдогч бүтцийг (α-спираль ба β-бүтэц) устгахыг полипептидийн "хайлах" гэж нэрлэдэг. Энэ тохиолдолд устөрөгчийн холбоо тасарч, полипептидийн гинж нь санамсаргүй ороомог хэлбэртэй байдаг. Тиймээс хоёрдогч бүтцийн тогтвортой байдал нь интерпептидийн устөрөгчийн холбоогоор тодорхойлогддог. Цистеины үлдэгдэл байрлах полипептидийн гинжин хэлхээний дагуух дисульфидын холбоог эс тооцвол бусад төрлийн бондууд үүнд бараг оролцдоггүй. Дисульфидын холбооноос үүдэлтэй богино пептидүүд нь мөчлөгт хаалттай байдаг. Олон уураг нь нэгэн зэрэг α-спираль бүс ба β-бүтэцтэй байдаг. 100% α-геликсээс бүрдэх байгалийн уураг бараг байдаггүй (үл хамаарах зүйл бол парамиозин, булчингийн уураг нь 96-100% α-геликс), синтетик полипептидүүд нь 100% спиральтай байдаг.
Бусад уургууд нь тэгш бус геликийн зэрэгтэй байдаг. Парамозин, миоглобин, гемоглобин зэрэгт α-спираль бүтцийн өндөр давтамж ажиглагддаг. Үүний эсрэгээр, трипсин, рибонуклеазын хувьд полипептидийн гинжин хэлхээний нэлээд хэсэг нь давхаргат β-бүтэцтэй тохирдог. Дэмжих эдийн уураг: кератин (үсний уураг, ноос), коллаген (шөрмөсний уураг, арьс), фиброин (байгалийн торгоны уураг) нь полипептидийн гинжин хэлхээний β-тохиргоотой байдаг. Уургийн полипептидийн гинжин хэлхээний спиральжилтын янз бүрийн зэрэг нь полипептидийн гинжин хэлхээний тогтмол нугалааг хэсэгчлэн тасалдуулах эсвэл "таслах" хүч байдгийг харуулж байна. Үүний шалтгаан нь уургийн полипептидийн гинжин хэлхээний тодорхой эзэлхүүнтэй, өөрөөр хэлбэл гуравдагч бүтэцтэй илүү нягт савлагаатай байдаг.
Хүний биед уургийн үүрэг маш том байдаг. Үүний зэрэгцээ, бодис нь урьдчилан тодорхойлсон бүтцийг олж авсны дараа л ийм нэрийг авч болно. Энэ хүртэл энэ нь полипептид, зүгээр л амин хүчлийн гинж бөгөөд зориулалтын үүргээ гүйцэтгэж чадахгүй. Ерөнхийдөө уургийн орон зайн бүтэц (анхдагч, хоёрдогч, гуравдагч, домэйн) нь тэдгээрийн задгай бүтэц юм. Түүнээс гадна хоёрдогч, гуравдагч, домайн бүтэц нь организмын хувьд хамгийн чухал юм.
Уургийн бүтцийг судлах урьдчилсан нөхцөл
Химийн бодисын бүтцийг судлах аргуудын дотроос рентген туяаны дифракцийн талстографи онцгой үүрэг гүйцэтгэдэг. Түүгээр дамжуулан молекулын нэгдлүүдийн атомуудын дараалал, тэдгээрийн орон зайн зохион байгуулалтын талаархи мэдээллийг авах боломжтой. Энгийнээр хэлэхэд, 20-р зууны 30-аад оны үед боломжтой болсон нэг молекулын хувьд рентген зураг авах боломжтой.
Тэр үед судлаачид олон уураг нь зөвхөн шугаман бүтэцтэй төдийгүй мушгиа, ороомог, домэйнд байрладаг болохыг олж мэдсэн. Шинжлэх ухааны олон тооны туршилтуудын үр дүнд уургийн хоёрдогч бүтэц нь бүтцийн уургийн эцсийн хэлбэр, фермент, иммуноглобулины завсрын хэлбэр болох нь тогтоогджээ. Энэ нь эцсийн эцэст гуравдагч эсвэл дөрөвдөгч бүтэцтэй бодисууд "боловсорч гүйцэх" үе шатанд хоёрдогч бүтцийн онцлог шинж чанартай спираль үүсэх үе шатыг туулах ёстой гэсэн үг юм.

Хоёрдогч уургийн бүтэц үүсэх
Эсийн эндоплазмын барзгар сүлжээн дэх рибосомууд дээрх полипептидийн нийлэгжилт дуусмагц уургийн хоёрдогч бүтэц үүсч эхэлдэг. Полипептид нь өөрөө урт молекул бөгөөд маш их зай эзэлдэг бөгөөд тээвэрлэх, үүргээ гүйцэтгэхэд тохиромжгүй байдаг. Тиймээс түүний хэмжээг багасгаж, онцгой шинж чанарыг өгөхийн тулд хоёрдогч бүтэц бий болдог. Энэ нь альфа спираль ба бета давхарга үүсэх замаар явагддаг. Ийнхүү хоёрдогч бүтэцтэй уураг олж авдаг бөгөөд энэ нь ирээдүйд гуравдагч ба дөрөвдөгч болж хувирах эсвэл энэ хэлбэрээр ашиглагдах болно.

Хоёрдогч бүтцийн зохион байгуулалт
Олон тооны судалгаагаар уургийн хоёрдогч бүтэц нь альфа спираль, бета давхарга эсвэл эдгээр элементүүдтэй ээлжлэн хэсгүүд байдаг болохыг харуулсан. Түүнээс гадна хоёрдогч бүтэц нь уургийн молекулыг мушгих, эргүүлэх арга юм. Энэ нь полипептид дэх амин хүчлийн үлдэгдлийн туйлын бүсүүдийн хооронд үүссэн устөрөгчийн холбооноос болж үүсдэг эмх замбараагүй процесс юм.
Альфа мушгиа хоёрдогч бүтэц
Полипептидийн биосинтезд зөвхөн L-амин хүчлүүд оролцдог тул уургийн хоёрдогч бүтэц үүсэх нь мушгиа цагийн зүүний дагуу (баруун гараараа) мушгихад эхэлдэг. Мушгиа эргэлт бүрт 3.6 амин хүчлийн үлдэгдэл байдаг бөгөөд мушгиа тэнхлэгийн дагуух зай нь 0.54 нм байна. Эдгээр нь нийлэгжилтэнд оролцдог амин хүчлүүдийн төрлөөс хамаардаггүй уургийн хоёрдогч бүтцийн ерөнхий шинж чанарууд юм.

Полипептидийн гинж бүхэлдээ спираль хэлбэртэй биш гэдгийг тогтоосон. Түүний бүтэц нь шугаман хэсгүүдийг агуулдаг. Ялангуяа пепсиний уургийн молекул нь зөвхөн 30% мушгиа, лизоцим - 42%, гемоглобин - 75% байна. Энэ нь уургийн хоёрдогч бүтэц нь нарийн мушгиа биш, харин түүний хэсгүүдийн шугаман эсвэл давхаргатай хослуулсан гэсэн үг юм.
Бета давхаргын хоёрдогч бүтэц
Бодисын бүтцийн зохион байгуулалтын хоёр дахь хэлбэр нь устөрөгчийн холбоогоор холбогдсон хоёр ба түүнээс дээш полипептидийн хэлхээ болох бета давхарга юм. Сүүлийнх нь чөлөөт CO NH2 бүлгүүдийн хооронд үүсдэг. Ийм байдлаар голчлон бүтцийн (булчингийн) уургууд холбогддог.
Энэ төрлийн уургийн бүтэц нь дараах байдалтай байна: A-B терминалын хэсгүүдийн тэмдэглэгээ бүхий полипептидийн нэг хэлхээ нь нөгөөгийнхөө дагуу зэрэгцээ байрладаг. Цорын ганц анхааруулга нь хоёр дахь молекул нь эсрэг параллель байрладаг бөгөөд B-A гэж тэмдэглэгдсэн байдаг. Олон тооны устөрөгчийн бондоор холбогдсон дурын олон тооны полипептидийн гинжээс бүрдэх бета давхарга ингэж үүсдэг.
устөрөгчийн холбоо
Уургийн хоёрдогч бүтэц нь янз бүрийн цахилгаан сөрөг утгатай атомуудын олон туйлын харилцан үйлчлэлд суурилсан холбоо юм. Фтор, хүчилтөрөгч, азот, устөрөгч гэсэн дөрвөн элемент ийм холбоо үүсгэх хамгийн их чадвартай байдаг. Уургууд нь фтороос бусад бүх зүйлийг агуулдаг. Тиймээс устөрөгчийн холбоо үүсч, улмаар полипептидийн гинжийг бета давхарга, альфа спираль болгон нэгтгэх боломжтой болгодог.

Устөрөгчийн холбоо үүсэх нь диполь болох усны жишээгээр хамгийн амархан тайлбарлагддаг. Хүчилтөрөгч нь хүчтэй сөрөг цэнэгтэй бөгөөд O-H бондын туйлшрал ихтэй тул устөрөгчийг эерэг гэж үздэг. Энэ төлөвт молекулууд нь тодорхой орчинд байдаг. Мөн тэдний олонх нь хүрч, мөргөлддөг. Дараа нь эхний усны молекул дахь хүчилтөрөгч нөгөөгөөсөө устөрөгчийг татдаг. Гинж дээр гэх мэт.
Үүнтэй төстэй үйл явц нь уурагуудад тохиолддог: пептидийн бондын электрон сөрөг хүчилтөрөгч нь бусад амин хүчлийн үлдэгдлийн аль ч хэсгээс устөрөгчийг татаж, устөрөгчийн холбоо үүсгэдэг. Энэ нь сул туйлын коньюгаци бөгөөд үүнийг таслахад ойролцоогоор 6.3 кЖ энерги шаардагдана.
Харьцуулбал, уургийн хамгийн сул ковалент холбоог таслахад 84 кЖ энерги шаардагдана. Хамгийн хүчтэй ковалент холбоонд 8400 кЖ шаардлагатай. Гэсэн хэдий ч уургийн молекул дахь устөрөгчийн бондын тоо маш их тул тэдгээрийн нийт энерги нь молекулыг түрэмгий нөхцөлд оршин тогтнох, орон зайн бүтцийг хадгалах боломжийг олгодог. Үүнээс болж уураг байдаг. Энэ төрлийн уургийн бүтэц нь булчин, яс, шөрмөсний үйл ажиллагаанд шаардлагатай хүчийг өгдөг. Бие махбодид уургийн хоёрдогч бүтцийн ач холбогдол маш их байдаг.
устөрөгчийн холбоо
Ялгах a-спираль, б-бүтэц (цэвэр).
Бүтэц α-мушгиа санал болгов Полингболон Кори

коллаген
б-бүтэц
Цагаан будаа. 2.3. б-бүтэц
Бүтэц нь бий хавтгай хэлбэр зэрэгцээ b-бүтэц; хэрэв эсрэгээр бол эсрэг параллель б бүтэц
супер ороомог. протофибрил микрофибрил 10 нм диаметртэй.
bombyx mori фиброин
эмх замбараагүй хэлбэр.
Хэт хоёрдогч бүтэц.
ИЛҮҮ ИХИЙГ ҮЗЭХ:
УУРГИЙН БҮТЭЦИЙН ЗОХИОН БАЙГУУЛАЛТ
Уургийн молекулын бүтцийн зохион байгуулалтын 4 түвшин байгаа нь батлагдсан.
Уургийн анхдагч бүтэц- полипептидийн гинжин хэлхээнд амин хүчлийн үлдэгдлийн дараалал. Уургийн хувьд бие даасан амин хүчлүүд хоорондоо холбоотой байдаг. пептидийн холбооА-карбоксил ба а-амин бүлгийн амин хүчлүүдийн харилцан үйлчлэлийн үр дүнд үүсдэг.

Өнөөдрийг хүртэл хэдэн арван мянган янз бүрийн уургийн анхдагч бүтцийг тайлсан байна. Уургийн анхдагч бүтцийг тодорхойлохын тулд гидролизийн аргууд нь амин хүчлийн найрлагыг тодорхойлдог. Дараа нь эцсийн амин хүчлүүдийн химийн шинж чанарыг тодорхойлно. Дараагийн алхам бол полипептидийн гинжин хэлхээнд амин хүчлүүдийн дарааллыг тодорхойлох явдал юм. Үүний тулд сонгомол хэсэгчилсэн (химийн болон ферментийн) гидролизийг ашигладаг. Рентген туяаны дифракцийн шинжилгээ, түүнчлэн ДНХ-ийн нэмэлт нуклеотидын дарааллын талаархи мэдээллийг ашиглах боломжтой.
Уургийн хоёрдогч бүтэц– полипептидийн гинжин хэлхээний тохиргоо, өөрөөр хэлбэл. полипептидийн гинжийг тодорхой конформацид савлах арга. Энэ үйл явц эмх замбараагүй, үндсэн бүтцэд заасан хөтөлбөрийн дагуу явагддаг.
Хоёрдогч бүтцийн тогтвортой байдлыг голчлон устөрөгчийн бондоор хангадаг боловч ковалент холбоо - пептид ба дисульфид нь тодорхой хувь нэмэр оруулдаг.
Бөмбөрцөг уургийн бүтцийн хамгийн их магадлалтай төрлийг авч үздэг а-спираль. Полипептидийн гинжин хэлхээний мушгиралт нь цагийн зүүний дагуу явагддаг. Уураг бүр өөрийн гэсэн онцлог шинж чанартай байдаг зарим зэрэгспиральжилт. Хэрэв гемоглобины гинж 75% спираль хэлбэртэй бол пепсин ердөө 30% байна.
Үс, торго, булчингийн уурагт агуулагддаг полипептидийн гинжин хэлхээний хэлбэрийг нэрлэдэг. б-бүтэцүүд.
Пептидийн гинжин хэлхээний сегментүүд нь нэг давхаргад байрладаг бөгөөд баян хуур болгон нугалсан хуудастай төстэй дүрсийг үүсгэдэг. Давхаргыг хоёр буюу хоёроор үүсгэж болно их хэмжээнийпептидийн гинж.
Байгальд бүтэц нь β- эсвэл a-бүтэцтэй тохирохгүй уураг байдаг, жишээлбэл, коллаген нь хүн, амьтны холбогч эдийн дийлэнх хэсгийг бүрдүүлдэг фибрилляр уураг юм.
Уургийн гуравдагч бүтэц- полипептидийн спираль орон зайн чиг баримжаа эсвэл тодорхой эзэлхүүнтэй полипептидийн гинжийг тавих арга. Гуравдагч бүтэц нь рентген туяаны дифракцийн шинжилгээгээр тодорхойлогдсон анхны уураг бол эр бэлгийн халимны миоглобин юм (Зураг 2).
Үүнээс гадна уургийн орон зайн бүтцийг тогтворжуулахад ковалент холбоо, гол үүрэг нь ковалент бус холбоо (устөрөгч, цэнэглэгдсэн бүлгүүдийн электростатик харилцан үйлчлэл, молекул хоорондын ван дер Ваалсын хүч, гидрофобик харилцан үйлчлэл гэх мэт) гүйцэтгэдэг.
By орчин үеийн санаанууд, нийлэгжилт дууссаны дараа уургийн гуравдагч бүтэц нь аяндаа үүсдэг. Гол хөдөлгөгч хүч нь амин хүчлийн радикалуудын усны молекулуудтай харилцан үйлчлэлцэх явдал юм. Энэ тохиолдолд амин хүчлүүдийн туйлшралгүй гидрофобик радикалууд уургийн молекул дотор дүрж, туйлын радикалууд ус руу чиглэнэ. Полипептидийн гинжин хэлхээний уугуул орон зайн бүтцийг бий болгох үйл явц гэж нэрлэдэг нугалах. Эсүүд гэж нэрлэгддэг тусгаарлагдсан уураг байдаг харгалзагч нар.Тэд нугалахад оролцдог. Хүний удамшлын хэд хэдэн өвчнийг тодорхойлсон байдаг бөгөөд тэдгээрийн хөгжил нь нугалах үйл явцын мутаци (пигментоз, фиброз гэх мэт) -тэй холбоотой зөрчилтэй холбоотой байдаг.
Хоёрдогч ба гуравдагч бүтцийн хоорондын завсрын уургийн молекулын бүтцийн зохион байгуулалтын түвшин байгаа нь рентген туяаны дифракцийн шинжилгээний аргуудаар нотлогдсон. Домэйннь полипептидийн гинжин хэлхээнд багтах авсаархан бөмбөрцөг хэлбэрийн бүтцийн нэгж юм (Зураг 3). Бүтэц, үйл ажиллагааны хувьд өөр өөр домэйнуудаас бүрдэх, өөр өөр генээр кодлогдсон олон уураг (жишээлбэл, иммуноглобулин) илрүүлсэн.
Бүгд биологийн шинж чанаруураг гэж нэрлэгддэг гуравдагч бүтцийг хадгалахтай холбоотой байдаг уугуул. Уургийн бөмбөрцөг нь туйлын хатуу бүтэц биш: пептидийн гинжин хэлхээний хэсгүүдийн урвуу хөдөлгөөн хийх боломжтой. Эдгээр өөрчлөлтүүд нь молекулын ерөнхий хэлбэрийг алдагдуулдаггүй. Уургийн молекулын конформацид орчны рН, уусмалын ионы хүч, бусад бодисуудтай харилцан үйлчлэл нөлөөлдөг. Молекулын унаган хэлбэрийг зөрчихөд хүргэдэг аливаа нөлөөлөл нь түүний биологийн шинж чанарын уургийн хэсэгчилсэн буюу бүрэн алдагдал дагалддаг.
Дөрөвдөгчийн уургийн бүтэц- ижил буюу өөр анхдагч, хоёрдогч, гуравдагч бүтэцтэй бие даасан полипептидийн гинжийг сансарт байрлуулах, бүтцийн болон үйл ажиллагааны хувьд нэг макромолекулын формацийг бий болгох арга.
Хэд хэдэн полипептидийн гинжээс бүрдсэн уургийн молекулыг нэрлэдэг олигомер, үүнд багтсан гинж бүр - протомер. Олигомерын уургууд нь ихэвчлэн тэгш тооны протомеруудаас бүрддэг, жишээлбэл, гемоглобины молекул нь хоёр a- ба хоёр б-полипептидийн гинжээс бүрдэнэ (Зураг 4).
Дөрөвдөгч бүтэц нь гемоглобин, иммуноглобулин зэрэг уургийн 5 орчим хувийг агуулдаг. Дэд нэгжийн бүтэц нь олон ферментийн онцлог шинж юм.
Дөрөвдөгч бүтэцтэй уургийг бүрдүүлдэг уургийн молекулууд нь рибосомууд дээр тус тусад нь үүсдэг ба нийлэгжилт дууссаны дараа л нийтлэг супрамолекулын бүтцийг бүрдүүлдэг. Уураг нь түүний бүрэлдэхүүн хэсгүүдийн протомерууд нэгдэх үед л биологийн идэвхийг олж авдаг. Гуравдагч бүтцийг тогтворжуулахтай ижил төрлийн харилцан үйлчлэл нь дөрөвдөгч бүтцийг тогтворжуулахад оролцдог.
Зарим судлаачид уургийн бүтцийн зохион байгуулалтын тав дахь түвшин байдаг гэдгийг хүлээн зөвшөөрдөг. тэр метаболонууд -субстратын хувиргалтын бүх замыг хурдасгадаг янз бүрийн ферментүүдийн олон үйлдэлт макромолекулын цогцолборууд (дээд синтетазууд) өөх тосны хүчил, пируватдегидрогеназын цогцолбор, амьсгалын замын гинж).
Уургийн хоёрдогч бүтэц
Хоёрдогч бүтэц - полипептидийн гинжийг эмх цэгцтэй бүтэц болгон байрлуулах арга. Хоёрдогч бүтэц нь анхдагч бүтцээр тодорхойлогддог. Анхдагч бүтэц нь генетикийн хувьд тодорхойлогддог тул полипептидийн гинж нь рибосомоос гарах үед хоёрдогч бүтэц үүсэх боломжтой. Хоёрдогч бүтэц тогтворждог устөрөгчийн холбоо, эдгээр нь пептидийн бондын NH- ба CO-бүлгийн хооронд үүсдэг.
Ялгах a-спираль, б-бүтэцба эмх замбараагүй конформаци (цэвэр).
Бүтэц α-мушгиа санал болгов Полингболон Кори(1951). Энэ нь ердийн спираль шиг харагддаг уургийн хоёрдогч бүтцийн нэг төрөл юм (Зураг 2.2). α-геликс нь саваа хэлбэртэй бүтэц бөгөөд пептидийн холбоо нь спираль дотор байрладаг ба амин хүчлийн хажуугийн гинж нь гадна талд байрладаг. А-геликс нь мушгиа тэнхлэгтэй параллель орших устөрөгчийн холбоогоор тогтворжиж, эхний ба тав дахь амин хүчлийн үлдэгдэл хооронд үүсдэг. Тиймээс уртассан мушгиа бүсэд амин хүчлийн үлдэгдэл бүр нь хоёр устөрөгчийн холбоо үүсэхэд оролцдог.

Цагаан будаа. 2.2. α-геликсийн бүтэц.
Спираль нэг эргэлтэнд 3,6 амин хүчлийн үлдэгдэл байдаг ба мушгиа 0,54 нм, нэг амин хүчлийн үлдэгдэлд 0,15 нм байна. Спираль өнцөг 26 °. А-геликсийн тогтмол хугацаа нь 5 эргэлт буюу 18 амин хүчлийн үлдэгдэл юм. Хамгийн түгээмэл нь зөв a-helices, i.e. спираль мушгирах нь цагийн зүүний дагуу байна. А-геликс үүсэхээс пролин, амин хүчлүүд нь цэнэгтэй, том радикалууд (электростатик ба механик саад тотгор) саад болдог.
Спираль хэлбэрийн өөр нэг хэлбэр байдаг коллаген . Хөхтөн амьтдад коллаген давамгайлдаг тоон хувьдУураг: Нийт уургийн 25%-ийг эзэлдэг. Коллаген нь янз бүрийн хэлбэрээр, ялангуяа холбогч эдэд байдаг. Энэ нь эргэлт бүрт 0.96 нм, 3.3 үлдэгдэл бүхий зүүн гар талын мушгиа бөгөөд α-геликсээс илүү зөөлөн байдаг. Энд α-геликсээс ялгаатай нь устөрөгчийн гүүр үүсэх боломжгүй юм. Коллаген нь ер бусын амин хүчлийн найрлагатай: 1/3 нь глицин, ойролцоогоор 10% пролин, түүнчлэн гидроксипролин ба гидроксилизин юм. Сүүлийн хоёр амин хүчлүүд нь коллагены биосинтезийн дараа орчуулгын дараах өөрчлөлтөөр үүсдэг. Коллагены бүтцэд gly-X-Y триплет байнга давтагддаг бөгөөд X байрлалыг ихэвчлэн пролин, Y-г гидроксилизин эзэлдэг. Коллаген нь зүүн гартай гурван үндсэн мушгианаас мушгирсан баруун гартай гурвалсан мушгиа хэлбэрээр хаа сайгүй байдаг гэсэн баттай нотолгоо бий. Гурвалсан спиральд гурав дахь үлдэгдэл бүр нь төв хэсэгт дуусдаг бөгөөд энд стерик шалтгааны улмаас зөвхөн глицин байрладаг. Коллагены молекул бүхэлдээ 300 нм урттай.
б-бүтэц(b-атираат давхарга). Энэ нь бөмбөрцөг уургууд, түүнчлэн зарим фибрилляр уураг, жишээлбэл, торго фиброин (Зураг 2.3) -д тохиолддог.
Цагаан будаа. 2.3. б-бүтэц
Бүтэц нь бий хавтгай хэлбэр. Полипептидийн гинж нь бараг бүхэлдээ уртассан, а-геликс шиг нягт мушгиагүй. Пептидийн бондын хавтгай нь цаасны жигд нугалаа шиг орон зайд байрладаг.
Полипептид ба уургийн хоёрдогч бүтэц
Энэ нь хөрш зэргэлдээх полипептидийн гинжин хэлхээний пептидийн CO ба NH бүлгүүдийн хоорондох устөрөгчийн холбоогоор тогтворждог. Хэрэв b бүтцийг бүрдүүлдэг полипептидийн гинж ижил чиглэлд явбал (жишээлбэл, C ба N терминалууд давхцдаг) - зэрэгцээ b-бүтэц; хэрэв эсрэгээр бол эсрэг параллель б бүтэц. Нэг давхаргын хажуугийн радикалууд нь нөгөө давхаргын хажуугийн радикалуудын хооронд байрладаг. Хэрэв нэг полипептидийн гинж нугалж, өөртэйгээ параллель гүйдэг бол энэ нь эсрэг параллель б-загалмай бүтэц. В-загалмайн бүтэц дэх устөрөгчийн холбоо нь полипептидийн гинжин хэлхээний гогцоонуудын пептидийн бүлгүүдийн хооронд үүсдэг.
Өнөөдрийг хүртэл судлагдсан уургууд дахь a-helices-ийн агууламж маш олон янз байдаг. Зарим уураг, жишээлбэл, миоглобин ба гемоглобины хувьд а-геликс нь бүтцийн үндэс суурь бөгөөд 75%, лизоцимд - 42%, пепсинд ердөө 30% -ийг бүрдүүлдэг. Бусад уургууд, жишээлбэл, хоол боловсруулах фермент химотрипсин нь бараг а-спираль бүтэцгүй бөгөөд полипептидийн гинжин хэлхээний нэлээд хэсэг нь давхаргат b-бүтэцтэй тохирдог. Дэмжих эдийн уураг коллаген (шөрмөсний уураг, арьс), фиброин (байгалийн торгоны уураг) нь полипептидийн гинжин хэлхээний b-тохиргоотой байдаг.
α-геликс үүсэхийг glu, ala, leu, β-бүтэцүүд нь met, val, ile; полипептидийн гинжин гулзайлтын газруудад - gly, pro, asn. Зургаан бүлэглэсэн үлдэгдлийг мушгиа үүсгэхэд хувь нэмэр оруулдаг дөрөв нь мушгиа төв гэж үзэж болно гэж үздэг. Энэ төвөөс мушгиа нь хоёр чиглэлд ургадаг бөгөөд эдгээр мушгиа үүсэхээс сэргийлдэг үлдэгдэлээс бүрдэх тетрапептид юм. β-бүтэц үүсэх үед үрийн үүргийг таваас гурав нь амин хүчлийн үлдэгдэл гүйцэтгэдэг бөгөөд энэ нь β-бүтэц үүсэхэд хувь нэмэр оруулдаг.
Ихэнх бүтцийн уургийн хувьд хоёрдогч бүтцийн аль нэг нь давамгайлдаг бөгөөд энэ нь тэдний амин хүчлийн найрлагаар тодорхойлогддог. α-геликс хэлбэрээр бүтээгдсэн бүтцийн уураг нь α-кератин юм. Амьтны үс (ноос), өд, зүү, хумс, туурай нь голчлон кератинаас бүрддэг. Завсрын утаснуудын бүрэлдэхүүн хэсэг болох кератин (цитокератин) нь эсийн араг ясны чухал бүрэлдэхүүн хэсэг юм. Кератины хувьд пептидийн гинжин хэлхээний ихэнх хэсэг нь баруун α-спираль хэлбэртэй нугалж байна. Хоёр пептидийн гинж нь нэг зүүнийг үүсгэдэг супер ороомог.Хэт ороомогтой кератин димерүүд нийлж тетрамеруудыг үүсгэдэг бөгөөд тэдгээр нь нэгтгэгдэж үүсдэг протофибрил 3 нм диаметртэй. Эцэст нь найман протофибрил үүсдэг микрофибрил 10 нм диаметртэй.
Үс нь ижил фибрилээс үүсдэг. Тэгэхээр 20 микрон диаметртэй нэг ширхэг ноосон ширхэгт сая сая ширхэгүүд хоорондоо холбогддог. Тусдаа кератины гинж нь олон тооны дисульфидын бондоор холбогддог бөгөөд энэ нь тэдэнд нэмэлт хүч өгдөг. Пермийн үед дараахь процессууд явагдана: эхлээд дисульфидын гүүрийг тиолоор бууруулж устгаж, дараа нь үсийг хүссэн хэлбэрт оруулахын тулд халааж хатаана. Үүний зэрэгцээ, агаар мандлын хүчилтөрөгчтэй исэлдэлтийн улмаас үсний засалт хэлбэрийг хадгалдаг шинэ дисульфидын гүүрүүд үүсдэг.
Торгог торгоны хорхойн хүр хорхойноос гаргаж авдаг ( bombyx mori) болон холбогдох зүйлүүд. Торгоны үндсэн уураг фиброин, антипараллель атираат давхаргын бүтэцтэй бөгөөд давхаргууд нь хоорондоо параллель байрлаж, олон тооны давхаргыг үүсгэдэг. Атирааны бүтцэд амин хүчлийн үлдэгдлийн хажуугийн гинж нь босоогоор дээш доош чиглэсэн байдаг тул бие даасан давхаргын хоорондох зайд зөвхөн авсаархан бүлгүүд багтах боломжтой. Үнэн хэрэгтээ фиброин нь 80% глицин, аланин, серинээс бүрддэг, i.e. хамгийн жижиг хажуугийн гинж бүхий гурван амин хүчил. Фиброин молекул нь ердийн давтагдах фрагментийг (гли-ала-гли-ала-гли-сер) агуулдаг.
эмх замбараагүй хэлбэр.Уургийн молекулын мушгиа болон атираат бүтцэд хамаарахгүй хэсгүүдийг эмх замбараагүй гэж нэрлэдэг.
Хэт хоёрдогч бүтэц.Уургууд дахь альфа спираль ба бета бүтцийн бүсүүд хоорондоо болон бие биетэйгээ харилцан үйлчилж, нэгдэл үүсгэдэг. Уугуул уургуудад байдаг хоёрдогч дээд бүтэц нь энергийн хувьд хамгийн тохиромжтой байдаг. Үүнд, хоёр α-спираль нь бие биентэйгээ харьцуулахад мушгиж, зүүн гар талын супер ороомог (бактериорходопсин, гемеритрин) үүсгэдэг хэт ороомогтой α-геликс; полипептидийн гинжин хэлхээний α-спираль ба β-бүтцийн хэсгүүд (жишээлбэл, дегидрогеназын ферментийн молекулуудын NAD+-ийн холбох бүсэд олдсон Россманны дагуу βαβαβ холбоос); антипараллель гурван судалтай β-бүтэцийг (βββ) β-зигзаг гэж нэрлэдэг бөгөөд олон тооны бичил биетэн, эгэл биетэн, сээр нуруутан амьтдын ферментүүдэд байдаг.
Өмнөх234567891011121314151617Дараагийн
ИЛҮҮ ИХИЙГ ҮЗЭХ:
Уургийн хоёрдогч бүтэц
Уургийн пептидийн гинж нь устөрөгчийн бондоор тогтворжсон хоёрдогч бүтэцтэй байдаг. Пептидийн бүлэг бүрийн хүчилтөрөгчийн атом нь пептидийн холбоонд тохирох NH бүлэгтэй устөрөгчийн холбоо үүсгэдэг. Үүний зэрэгцээ, дараах бүтэц: a-мушгиа, б-бүтэц ба б-нугаралт. а-Спираль.Термодинамикийн хувьд хамгийн таатай бүтцийн нэг бол зөв а-геликс юм. a-геликс нь карбонилийн бүлэг бүр гинжин хэлхээний дагуу дөрөв дэх NH бүлэгтэй устөрөгчийн холбоо үүсгэдэг тогтвортой бүтцийг илэрхийлдэг.
Уургууд: Уургийн хоёрдогч бүтэц
a-helix-д нэг эргэлтэнд 3.6 амин хүчлийн үлдэгдэл байдаг, мушгиа нь ойролцоогоор 0.54 нм, үлдэгдэл хоорондын зай 0.15 нм байна. L-амин хүчлүүд нь зөвхөн баруун гарт а-спираль үүсгэдэг бөгөөд хажуугийн радикалууд нь тэнхлэгийн хоёр талд байрлаж, гадагшаа чиглэсэн байдаг. a-helix-д устөрөгчийн холбоо үүсгэх боломжийг бүрэн ашигладаг тул b-бүтцээс ялгаатай нь хоёрдогч бүтцийн бусад элементүүдтэй устөрөгчийн холбоо үүсгэх чадваргүй байдаг. α-геликс үүсэх үед амин хүчлүүдийн хажуугийн гинж нь бие биедээ ойртож, гидрофобик эсвэл гидрофилик нягт хэсгүүдийг үүсгэдэг. Эдгээр цэгүүд нь уургийн орон зайн бүтцэд α-геликийг савлахад ашиглагддаг тул уургийн макромолекулын гурван хэмжээст хэлбэрийг бүрдүүлэхэд чухал үүрэг гүйцэтгэдэг. Спираль бөмбөг.Уургууд дахь a-helices-ийн агууламж харилцан адилгүй бөгөөд уургийн макромолекул бүрийн бие даасан шинж чанар юм. Миоглобин зэрэг зарим уургийн хувьд а-геликс нь бүтцэд оршдог бол химотрипсин зэрэг зарим уургийн хувьд а-геликсийн бүс байдаггүй. Дунджаар бөмбөрцөг уургууд нь 60-70% -ийн спираль зэрэгтэй байдаг. Спираль хэлбэртэй хэсгүүд нь эмх замбараагүй ороомогтой ээлжлэн солигдож, денатурацийн үр дүнд мушгиа-ороомогуудын шилжилт нэмэгддэг. Полипептидийн гинжин хэлхээний спиральжилт нь түүнийг үүсгэдэг амин хүчлийн үлдэгдэлээс хамаардаг. Ийнхүү бие биенээсээ ойрхон байрладаг глютамины хүчлийн сөрөг цэнэгтэй бүлгүүд хоорондоо хүчтэй түлхэлт үүсгэдэг бөгөөд энэ нь а-геликс дэх харгалзах устөрөгчийн холбоо үүсэхээс сэргийлдэг. Үүнтэй ижил шалтгааны улмаас лизин эсвэл аргинин зэрэг эерэг цэнэгтэй химийн бүлгүүд хоорондоо нягт уялдаатай байдаг тул гинжин хэлхээ нь хэцүү байдаг. Амин хүчлийн радикалуудын том хэмжээ нь полипептидийн гинжин хэлхээний спиральжилт (серин, треонин, лейцин) хэцүү байдаг шалтгаан юм. А-геликс үүсэхэд саад болох хамгийн түгээмэл хүчин зүйл бол амин хүчлийн пролин юм. Үүнээс гадна азотын атомд устөрөгчийн атом байхгүй тул пролин нь гинжин доторх устөрөгчийн холбоо үүсгэдэггүй. Тиймээс полипептидийн гинжин хэлхээнд пролин үүсэх бүх тохиолдолд а-муйсан бүтэц эвдэрч, ороомог буюу (b-гулзайлтын) үүсдэг. б-бүтэц. a-геликсээс ялгаатай нь b-бүтэц нь үүснэ хоорондын хэлхээПолипептидийн гинжин хэлхээний зэргэлдээ хэсгүүдийн хоорондох устөрөгчийн холбоо, учир нь гинжин хэлхээний холбоо байхгүй. Хэрэв эдгээр хэсгүүдийг нэг чиглэлд чиглүүлсэн бол ийм бүтцийг параллель, эсрэг чиглэлд байгаа бол эсрэг параллел гэж нэрлэдэг. b-бүтэц дэх полипептидийн гинж нь хүчтэй сунасан бөгөөд мушгиа биш, харин зигзаг хэлбэртэй байдаг. Тэнхлэгийн дагуух амин хүчлийн үлдэгдлүүдийн хоорондох зай нь 0.35 нм, өөрөөр хэлбэл, а-геликсээс 3 дахин их, нэг эргэлтийн үлдэгдлийн тоо 2. b-бүтцийн зэрэгцээ байрлалтай тохиолдолд устөрөгчийн холбоо Амин хүчлийн үлдэгдлийн эсрэг параллель байрлалтай харьцуулахад хүч чадал багатай байдаг. Устөрөгчийн бондоор ханасан а-геликсээс ялгаатай нь b-бүтэц дэх полипептидийн гинжин хэлхээний хэсэг бүр нэмэлт устөрөгчийн холбоо үүсэхэд нээлттэй байдаг. Дээр дурдсан зүйл нь параллель ба эсрэг параллель б бүтцэд хоёуланд нь хамаатай боловч эсрэг параллель бүтцэд бондууд илүү тогтвортой байдаг. В-бүтцийг бүрдүүлдэг полипептидийн гинжин хэлхээний сегментэд гурваас долоон амин хүчлийн үлдэгдэл байдаг бөгөөд b-бүтэц нь өөрөө 2-6 гинжээс бүрддэг боловч тэдгээрийн тоо илүү байж болно. b-бүтэц нь харгалзах a-нүүрстөрөгчийн атомуудаас хамааран атираат хэлбэртэй байна. Түүний гадаргуу нь тэгш, зүүн гартай байж болох тул гинжний бие даасан сегментүүдийн хоорондох өнцөг нь 20-25 ° байна. б-нугалах.Бөмбөрцөг уургууд нь бөмбөрцөг хэлбэртэй байдаг нь гол төлөв полипептидийн гинж нь гогцоо, зигзаг, үсний хавчаараар тодорхойлогддог бөгөөд гинжний чиглэл нь 180 ° хүртэл өөрчлөгдөж болно. Сүүлчийн тохиолдолд b-тохойлт байна. Энэ гулзайлт нь үсний хавчаар хэлбэртэй бөгөөд нэг устөрөгчийн холбоогоор тогтворждог. Хажуугийн том радикалууд нь түүний үүсэхээс сэргийлдэг хүчин зүйл байж болох тул хамгийн жижиг амин хүчлийн үлдэгдэл болох глицин үүнд ихэвчлэн ажиглагддаг. Энэ тохиргоо нь уургийн бөмбөрцгийн гадаргуу дээр үргэлж байдаг тул B-атираа нь бусад полипептидийн гинжтэй харилцан үйлчлэлд оролцдог. супер хоёрдогч бүтэц.Уургийн супер хоёрдогч бүтцийг анх удаа дэвшүүлж, дараа нь Л.Паулинг, Р.Кори нар нээсэн. Жишээ нь, хоёр а мушгиа нь зүүн гар талын супер мушгиа болгон мушгисан супер ороомогтой а-геликс юм. Гэсэн хэдий ч ихэвчлэн хэт ороомог бүтэц нь a-shelices болон b-sheets хоёуланг нь агуулдаг. Тэдний найрлагыг дараах байдлаар илэрхийлж болно: (aa), (ab), (ba) болон (bXb). Сүүлчийн сонголт нь хоёр зэрэгцээ атираат хуудас бөгөөд тэдгээрийн хооронд статистикийн ороомог (bСb) байдаг.Хоёрдогч ба хэт дунд зэргийн бүтцийн хоорондын харьцаа нь өндөр хэлбэлзэлтэй байдаг бөгөөд үүнээс хамаардаг. хувь хүний онцлогнэг буюу өөр уургийн макромолекул. Домэйн нь хоёрдогч бүтцийн зохион байгуулалтын илүү төвөгтэй түвшин юм. Эдгээр нь полипептидийн гинжин хэлхээний нугас гэж нэрлэгддэг богино хэсгүүдээр бие биентэйгээ холбогдсон тусгаарлагдсан бөмбөрцөг хэсгүүд юм. Д.Бирктофт химотрипсиний домайн зохион байгуулалтыг анхлан тодорхойлсон хүмүүсийн нэг бөгөөд энэ уурагт хоёр домэйн байгааг тэмдэглэжээ.
Уургийн хоёрдогч бүтэц
Хоёрдогч бүтэц - полипептидийн гинжийг эмх цэгцтэй бүтэц болгон байрлуулах арга. Хоёрдогч бүтэц нь анхдагч бүтцээр тодорхойлогддог. Анхдагч бүтэц нь генетикийн хувьд тодорхойлогддог тул полипептидийн гинж нь рибосомоос гарах үед хоёрдогч бүтэц үүсэх боломжтой. Хоёрдогч бүтэц тогтворждог устөрөгчийн холбоо, эдгээр нь пептидийн бондын NH- ба CO-бүлгийн хооронд үүсдэг.
Ялгах a-спираль, б-бүтэцба эмх замбараагүй конформаци (цэвэр).
Бүтэц α-мушгиа санал болгов Полингболон Кори(1951). Энэ бол ердийн спираль шиг харагддаг уургийн хоёрдогч бүтэц юм (Зураг 1).
Полипептидийн гинжин хэлхээний хэлбэр. Полипептидийн гинжин хэлхээний хоёрдогч бүтэц
2.2). α-геликс нь саваа хэлбэртэй бүтэц бөгөөд пептидийн холбоо нь спираль дотор байрладаг ба амин хүчлийн хажуугийн гинж нь гадна талд байрладаг. А-геликс нь мушгиа тэнхлэгтэй параллель орших устөрөгчийн холбоогоор тогтворжиж, эхний ба тав дахь амин хүчлийн үлдэгдэл хооронд үүсдэг. Тиймээс уртассан мушгиа бүсэд амин хүчлийн үлдэгдэл бүр нь хоёр устөрөгчийн холбоо үүсэхэд оролцдог.

Цагаан будаа. 2.2. α-геликсийн бүтэц.
Спираль нэг эргэлтэнд 3,6 амин хүчлийн үлдэгдэл байдаг ба мушгиа 0,54 нм, нэг амин хүчлийн үлдэгдэлд 0,15 нм байна. Спираль өнцөг 26 °. А-геликсийн тогтмол хугацаа нь 5 эргэлт буюу 18 амин хүчлийн үлдэгдэл юм. Хамгийн түгээмэл нь зөв a-helices, i.e. спираль мушгирах нь цагийн зүүний дагуу байна. А-геликс үүсэхээс пролин, амин хүчлүүд нь цэнэгтэй, том радикалууд (электростатик ба механик саад тотгор) саад болдог.
Спираль хэлбэрийн өөр нэг хэлбэр байдаг коллаген . Хөхтөн амьтдын биед коллаген нь тоон утгаараа зонхилох уураг байдаг: энэ нь нийт уургийн 25% -ийг бүрдүүлдэг. Коллаген нь янз бүрийн хэлбэрээр, ялангуяа холбогч эдэд байдаг. Энэ нь эргэлт бүрт 0.96 нм, 3.3 үлдэгдэл бүхий зүүн гар талын мушгиа бөгөөд α-геликсээс илүү зөөлөн байдаг. Энд α-геликсээс ялгаатай нь устөрөгчийн гүүр үүсэх боломжгүй юм. Коллаген нь ер бусын амин хүчлийн найрлагатай: 1/3 нь глицин, ойролцоогоор 10% пролин, түүнчлэн гидроксипролин ба гидроксилизин юм. Сүүлийн хоёр амин хүчлүүд нь коллагены биосинтезийн дараа орчуулгын дараах өөрчлөлтөөр үүсдэг. Коллагены бүтцэд gly-X-Y триплет байнга давтагддаг бөгөөд X байрлалыг ихэвчлэн пролин, Y-г гидроксилизин эзэлдэг. Коллаген нь зүүн гартай гурван үндсэн мушгианаас мушгирсан баруун гартай гурвалсан мушгиа хэлбэрээр хаа сайгүй байдаг гэсэн баттай нотолгоо бий. Гурвалсан спиральд гурав дахь үлдэгдэл бүр нь төв хэсэгт дуусдаг бөгөөд энд стерик шалтгааны улмаас зөвхөн глицин байрладаг. Коллагены молекул бүхэлдээ 300 нм урттай.
б-бүтэц(b-атираат давхарга). Энэ нь бөмбөрцөг уургууд, түүнчлэн зарим фибрилляр уураг, жишээлбэл, торго фиброин (Зураг 2.3) -д тохиолддог.
Цагаан будаа. 2.3. б-бүтэц
Бүтэц нь бий хавтгай хэлбэр. Полипептидийн гинж нь бараг бүхэлдээ уртассан, а-геликс шиг нягт мушгиагүй. Пептидийн бондын хавтгай нь цаасны жигд нугалаа шиг орон зайд байрладаг. Энэ нь хөрш зэргэлдээх полипептидийн гинжин хэлхээний пептидийн CO ба NH бүлгүүдийн хоорондох устөрөгчийн холбоогоор тогтворждог. Хэрэв b бүтцийг бүрдүүлдэг полипептидийн гинж ижил чиглэлд явбал (жишээлбэл, C ба N терминалууд давхцдаг) - зэрэгцээ b-бүтэц; хэрэв эсрэгээр бол эсрэг параллель б бүтэц. Нэг давхаргын хажуугийн радикалууд нь нөгөө давхаргын хажуугийн радикалуудын хооронд байрладаг. Хэрэв нэг полипептидийн гинж нугалж, өөртэйгээ параллель гүйдэг бол энэ нь эсрэг параллель б-загалмай бүтэц. В-загалмайн бүтэц дэх устөрөгчийн холбоо нь полипептидийн гинжин хэлхээний гогцоонуудын пептидийн бүлгүүдийн хооронд үүсдэг.
Өнөөдрийг хүртэл судлагдсан уургууд дахь a-helices-ийн агууламж маш олон янз байдаг. Зарим уураг, жишээлбэл, миоглобин ба гемоглобины хувьд а-геликс нь бүтцийн үндэс суурь бөгөөд 75%, лизоцимд - 42%, пепсинд ердөө 30% -ийг бүрдүүлдэг. Бусад уургууд, жишээлбэл, хоол боловсруулах фермент химотрипсин нь бараг а-спираль бүтэцгүй бөгөөд полипептидийн гинжин хэлхээний нэлээд хэсэг нь давхаргат b-бүтэцтэй тохирдог. Дэмжих эдийн уураг коллаген (шөрмөсний уураг, арьс), фиброин (байгалийн торгоны уураг) нь полипептидийн гинжин хэлхээний b-тохиргоотой байдаг.
α-геликс үүсэхийг glu, ala, leu, β-бүтэцүүд нь met, val, ile; полипептидийн гинжин гулзайлтын газруудад - gly, pro, asn. Зургаан бүлэглэсэн үлдэгдлийг мушгиа үүсгэхэд хувь нэмэр оруулдаг дөрөв нь мушгиа төв гэж үзэж болно гэж үздэг. Энэ төвөөс мушгиа нь хоёр чиглэлд ургадаг бөгөөд эдгээр мушгиа үүсэхээс сэргийлдэг үлдэгдэлээс бүрдэх тетрапептид юм. β-бүтэц үүсэх үед үрийн үүргийг таваас гурав нь амин хүчлийн үлдэгдэл гүйцэтгэдэг бөгөөд энэ нь β-бүтэц үүсэхэд хувь нэмэр оруулдаг.
Ихэнх бүтцийн уургийн хувьд хоёрдогч бүтцийн аль нэг нь давамгайлдаг бөгөөд энэ нь тэдний амин хүчлийн найрлагаар тодорхойлогддог. α-геликс хэлбэрээр бүтээгдсэн бүтцийн уураг нь α-кератин юм. Амьтны үс (ноос), өд, зүү, хумс, туурай нь голчлон кератинаас бүрддэг. Завсрын утаснуудын бүрэлдэхүүн хэсэг болох кератин (цитокератин) нь эсийн араг ясны чухал бүрэлдэхүүн хэсэг юм. Кератины хувьд пептидийн гинжин хэлхээний ихэнх хэсэг нь баруун α-спираль хэлбэртэй нугалж байна. Хоёр пептидийн гинж нь нэг зүүнийг үүсгэдэг супер ороомог.Хэт ороомогтой кератин димерүүд нийлж тетрамеруудыг үүсгэдэг бөгөөд тэдгээр нь нэгтгэгдэж үүсдэг протофибрил 3 нм диаметртэй. Эцэст нь найман протофибрил үүсдэг микрофибрил 10 нм диаметртэй.
Үс нь ижил фибрилээс үүсдэг. Тэгэхээр 20 микрон диаметртэй нэг ширхэг ноосон ширхэгт сая сая ширхэгүүд хоорондоо холбогддог. Тусдаа кератины гинж нь олон тооны дисульфидын бондоор холбогддог бөгөөд энэ нь тэдэнд нэмэлт хүч өгдөг. Пермийн үед дараахь процессууд явагдана: эхлээд дисульфидын гүүрийг тиолоор бууруулж устгаж, дараа нь үсийг хүссэн хэлбэрт оруулахын тулд халааж хатаана. Үүний зэрэгцээ, агаар мандлын хүчилтөрөгчтэй исэлдэлтийн улмаас үсний засалт хэлбэрийг хадгалдаг шинэ дисульфидын гүүрүүд үүсдэг.
Торгог торгоны хорхойн хүр хорхойноос гаргаж авдаг ( bombyx mori) болон холбогдох зүйлүүд. Торгоны үндсэн уураг фиброин, антипараллель атираат давхаргын бүтэцтэй бөгөөд давхаргууд нь хоорондоо параллель байрлаж, олон тооны давхаргыг үүсгэдэг. Атирааны бүтцэд амин хүчлийн үлдэгдлийн хажуугийн гинж нь босоогоор дээш доош чиглэсэн байдаг тул бие даасан давхаргын хоорондох зайд зөвхөн авсаархан бүлгүүд багтах боломжтой. Үнэн хэрэгтээ фиброин нь 80% глицин, аланин, серинээс бүрддэг, i.e. хамгийн жижиг хажуугийн гинж бүхий гурван амин хүчил. Фиброин молекул нь ердийн давтагдах фрагментийг (гли-ала-гли-ала-гли-сер) агуулдаг.
эмх замбараагүй хэлбэр.Уургийн молекулын мушгиа болон атираат бүтцэд хамаарахгүй хэсгүүдийг эмх замбараагүй гэж нэрлэдэг.
Хэт хоёрдогч бүтэц.Уургууд дахь альфа спираль ба бета бүтцийн бүсүүд хоорондоо болон бие биетэйгээ харилцан үйлчилж, нэгдэл үүсгэдэг. Уугуул уургуудад байдаг хоёрдогч дээд бүтэц нь энергийн хувьд хамгийн тохиромжтой байдаг. Үүнд, хоёр α-спираль нь бие биентэйгээ харьцуулахад мушгиж, зүүн гар талын супер ороомог (бактериорходопсин, гемеритрин) үүсгэдэг хэт ороомогтой α-геликс; полипептидийн гинжин хэлхээний α-спираль ба β-бүтцийн хэсгүүд (жишээлбэл, дегидрогеназын ферментийн молекулуудын NAD+-ийн холбох бүсэд олдсон Россманны дагуу βαβαβ холбоос); антипараллель гурван судалтай β-бүтэцийг (βββ) β-зигзаг гэж нэрлэдэг бөгөөд олон тооны бичил биетэн, эгэл биетэн, сээр нуруутан амьтдын ферментүүдэд байдаг.
Өмнөх234567891011121314151617Дараагийн
ИЛҮҮ ИХИЙГ ҮЗЭХ:
УУРАГ 1-р хувилбар A1.Уургийн бүтцийн холбоос нь: ...
5-9 анги
УУРАГ
Сонголт 1
A1. Уургийн бүтцийн холбоос нь:
ГЭХДЭЭ)
Аминууд
AT)
Амин хүчлүүд
B)
Глюкоз
G)
Нуклеотидууд
А2. Спираль үүсэх нь дараахь шинж чанартай байдаг.
ГЭХДЭЭ)
Уургийн анхдагч бүтэц
AT)
Уургийн гуравдагч бүтэц
B)
Уургийн хоёрдогч бүтэц
G)
Дөрөвдөгчийн уургийн бүтэц
A3. Уургийн эргэлт буцалтгүй денатурацид ямар хүчин зүйл нөлөөлдөг вэ?
ГЭХДЭЭ)
Хар тугалга, төмөр, мөнгөн усны давсны уусмалуудтай харилцан үйлчлэл
B)
Азотын хүчлийн төвлөрсөн уусмалаар уурагт үзүүлэх нөлөө
AT)
Хүчтэй халаалт
G)
Дээрх бүх хүчин зүйлүүд зөв байна.
А4. Баяжуулсан азотын хүчил уургийн уусмалд үйлчлэхэд юу ажиглагдаж байгааг тодорхойл.
ГЭХДЭЭ)
Цагаан тунадас орно
AT)
Улаан ягаан өнгийн будалт
B)
хар тунадас
G)
Шар будалт
А5. Катализаторын үүрэг гүйцэтгэдэг уурагуудыг:
ГЭХДЭЭ)
Гормонууд
AT)
Ферментүүд
B)
витаминууд
G)
уураг
A6. Гемоглобины уураг нь дараахь үүргийг гүйцэтгэдэг.
ГЭХДЭЭ)
катализатор
AT)
Барилга
B)
Хамгаалах
G)
тээвэрлэлт
Б хэсэг
B1. Харьцуулах:
Уургийн молекулын төрөл
Өмч
1)
Бөмбөрцөг уургууд
ГЭХДЭЭ)
Молекул эргэлдэв
2)
фибрилляр уураг
B)
Усанд уусдаггүй
AT)
усанд уусгах буюу коллоид уусмал үүсгэнэ
G)
утаслаг бүтэц
хоёрдогч бүтэц
Уураг:
ГЭХДЭЭ)
Амин хүчлийн үлдэгдэлээс бүтээгдсэн
B)
Зөвхөн нүүрстөрөгч, устөрөгч, хүчилтөрөгч агуулдаг
AT)
Хүчиллэг ба шүлтлэг орчинд гидролиз
G)
денатураци хийх чадвартай
D)
Полисахаридууд
E)
Эдгээр нь байгалийн полимер юм
C хэсэг
C1. Этанол ба органик бус бодисоос глицин гаргаж авах урвалын тэгшитгэлийг бич.