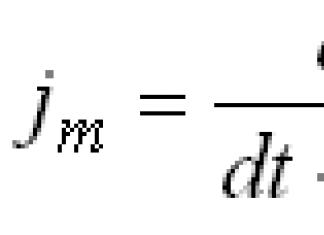20-р зууны эхэн үед. Э.Рутерфорд нимгэн тугалган цаасыг альфа тоосонцороор цацрагаар цацах туршилт хийснээр атомын бүтцийг тодорхойлжээ. Тэрээр атом нь гаригийн загвартай (Зураг 3), өөрөөр хэлбэл энэ нь нягт эерэг цэнэгтэй цөмөөс бүрдэх ба түүний эргэн тойронд сул электрон бүрхүүл эргэлддэг болохыг харуулсан.
Цагаан будаа. 3.Э.Резерфордын атомын бүтцийн гаригийн загвар
Ерөнхийдөө атом нь химийн элементийн цахилгаан саармаг элементийн бүтэц юм. Z элементийн серийн дугаарын физик утга тогтмол хүснэгтэлементүүдийг Рутерфордын атомын гаригийн загварт тогтоосон. Z нь цөм дэх эерэг элементар цэнэгийн тоотой давхцдаг бөгөөд өмнөх элементээс дараагийн элемент рүү шилжих үед аяндаа нэгээр нэмэгддэг. Элементүүдийн химийн шинж чанар ба тэдгээрийн олон тооны физик шинж чанарууд нь тэдгээрийн атомуудын гадаад гэж нэрлэгддэг валентийн электронуудын зан үйлээр тайлбарлагддаг.
Тиймээс химийн элементүүдийн шинж чанаруудын үе үе нь янз бүрийн элементийн атом дахь электронуудын зохион байгуулалтын тодорхой үе үетэй холбоотой байх ёстой. Тогтмол системийн онол нь дараах зарчмууд дээр суурилдаг.
a) химийн элементийн серийн дугаар нийт тоотухайн элементийн атом дахь электронууд;
б) атом дахь электронуудын төлөвийг тэдгээрийн квант тооны багцаар тодорхойлно П,л, мТэгээд мс . Атом дахь электронуудын энергийн төлөвт хуваарилалт нь хамгийн бага боломжит энергийн зарчмыг хангасан байх ёстой: электронуудын тоо ихсэх тусам дараагийн электрон бүр хамгийн бага энергитэй боломжит энергийн төлөвийг эзлэх ёстой;
в) атом дахь энергийн төлөвийг электроноор дүүргэх нь Паули зарчмын дагуу явагдах ёстой.
Атом дахь электронууд нь үндсэн квант тооны ижил утгатай олон төлөвийг эзэлдэг. П, электрон бүрхүүл буюу электрон давхарга үүсгэдэг. Үнэт зүйлсээс хамаарна nДараах бүрхүүлүүд нь ялгагдана. TOцагт n = 1,Лцагт n = 2,Мцагт n= 3,Нцагт n = 4,ТУХАЙцагт П= 5 гэх мэт Паули зарчмын дагуу бүрхүүлд байж болох электронуудын хамгийн их тоо: in TO-бүрхүүл – 2 электрон, бүрхүүлд Л,М,НТэгээд ТУХАЙ 8, 18, 32, 50 электрон тус тус. Бүрхүүл бүрт электронууд нь тойрог замд квант тооны тодорхой утгатай тохирч байгаа дэд бүлэг эсвэл дэд бүрхүүлд хуваарилагддаг. Атомын физикт атом дахь электрон төлөвийг тэмдгээр тэмдэглэх нь заншилтай байдаг Пл, хоёр квант тооны утгыг илэрхийлнэ. Электронууд ижил квант тоогоор тодорхойлогддог мужуудад байрладаг nТэгээд л, эквивалент гэж нэрлэдэг. Тоо З-эквивалент электроныг тэмдэгт дэх илтгэгчээр тэмдэглэнэ nl z. Хэрэв электронууд квант тоонуудын тодорхой утгатай тодорхой төлөвт байгаа бол ПТэгээд л, дараа нь электрон тохиргоо гэж нэрлэгддэг өгөгдсөн гэж үзнэ. Жишээлбэл, хүчилтөрөгчийн атомын үндсэн төлөвийг дараах бэлгэдлийн томъёогоор илэрхийлж болно: 1s 2, 2s 2, 2p 4. Энэ нь хоёр электрон нь төлөвт байгааг харуулж байна n= 1 ба л= 0, хоёр электрон квант тоотой байна n= 2 ба л= 0 ба дөрвөн электрон нь в төлөвийг эзэлнэ n = 2 ба л= 1.
Электрон төлөвийг атомын бүрхүүлд, нэг бүрхүүл дотор - дэд бүлгүүдэд (дэд бүрхүүл) дүүргэх дараалал нь энергийн түвшинг өгөгдөлтэй зохицуулах дараалалтай тохирч байх ёстой. ПТэгээд л. Эхлээд хамгийн бага энергитэй мужуудыг дүүргэж, дараа нь улам их энергитэй мужуудыг дүүргэдэг. Хөнгөн атомуудын хувьд энэ дараалал нь жижиг хэмжээтэй бүрхүүлийг эхлээд дүүргэхтэй тохирч байна. ПЗөвхөн дараа нь дараагийн бүрхүүл электроноор дүүрэх ёстой. Нэг бүрхүүл дотор, -тэй байна л= 0, дараа нь томоор илэрхийлнэ л, Шалтгаална, хамаарна л=П– 1. Электронуудын харилцан үйлчлэл нь хангалттай том үндсэн квант тоонуудын хувьд nагуутай улсууд nмөн жижиг лбага энергитэй байж болно, өөрөөр хэлбэл багатай мужаас илүү эрч хүчтэй байж болно П, гэхдээ илүү их л. Дээр дурдсанаас харахад элементүүдийн химийн шинж чанаруудын үечилсэн байдал нь холбогдох элементүүдийн атомуудын гадаад электрон дэд бүлгүүдийн электрон тохиргооны давтагдах чадвараар тайлбарлагддаг.
Гэрлийн шинж чанарын долгион-бөөмийн хоёрдмол байдал.
"Оптик" хэсгийн үр дүнг нэгтгэн хүргэе.
Дотор геометрийн оптикгэрлийн мөн чанарыг харгалзан үзэхгүй. Геометрийн оптикийн хуулиудыг томъёолсон гэрлийн цацрагийн тухай ойлголтыг ашигладаг. Эдгээр хуулиуд нь цацрагийн зам дахь янз бүрийн саад бэрхшээлийн хэмжээ хангалттай том тохиолдолд гэрлийн цацрагийн замыг тооцоолох боломжийг олгодог. Эдгээр хуулиудыг ашигласнаар төрөл бүрийн оптик систем, багаж хэрэгсэл (линз, микроскоп, дуран, камер, слайд проектор) бий болгох боломжтой болсон.
Гэрлийг цахилгаан соронзон долгион гэж үзвэл гэрлийн интерференц, дифракци, туйлшрал зэрэг үзэгдлүүдийг ойлгох боломжтой байв. Гэрлийн долгионы зам дахь саадын хэмжээ нь долгионы урттай харьцуулах боломжтой үед гэрлийн долгионы шинж чанар илэрдэг. Гэрлийн интерференц, дифракц, туйлшралын үзэгдлүүд олон янз байдаг практик хэрэглээ(спектрометр, согог илрүүлэх, голограф) Төрөл бүрийн оптик системийг зохион бүтээхдээ гэрлийн долгионы шинж чанарыг харгалзан үзэх шаардлагатай.
Квантын оптикийн хувьд гэрэл нь бөөмийн урсгал эсвэл гэрлийн квант - фотон хэлбэрээр илэрдэг. Квантын үзэл баримтлалын хүрээнд биеийн дулааны цацраг, гадаад ба дотоод фотоэлектрик эффект, Комптон эффект гэх мэт үзэгдлүүдийн тайлбарыг олдог.
Зарим туршилтанд гэрэл долгионы шинж чанартай, заримд нь корпускуляр шинж чанартай байдаг нь энэ нь ихэвчлэн нэр томъёогоор тодорхойлогддог нарийн төвөгтэй хос шинж чанартай гэсэн үг юм. долгион-бөөмийн хоёрдмол байдал . Дараа нь материйн бөөмсийн долгион-бөөмийн хоёрдмол байдал бий болсон.
Г.Я.Мякишев, Б.Б.Буховцев, В.М.Чаругин. Физик. 11-р анги. Ерөнхий боловсролын сургалтын байгууллагын сурах бичиг.- М.: “Просвещение”, 2009, гэх мэт 11-р бүлэг.
Сэдэв 18. (2 цаг)
Атомын физик. Рутерфордын туршилтууд. Атомын гаригийн загвар. Борын квант постулатууд. Лазер.
Атомын цогц бүтцийг нээх нь түүний хөгжлийн хамгийн чухал үе шат юм орчин үеийн физик, энэ нь түүний цаашдын бүх хөгжилд ул мөрөө үлдээсэн. Атомын бүтцийн тоон онолыг бий болгох явцад атомын физик бий болсон нь атомын спектр, физик болон Химийн шинж чанарянз бүрийн бодисууд нь физикийн бусад салбаруудыг бий болгосон. Бичил бөөмсийн хөдөлгөөний хуулиудыг нээсэн - квант механикийн хуулиуд.
Атомын бүтцийн анхны загваруудын нэгийг 1903 онд санал болгосон. Ж.Ж. Томсон . Тэрээр атомыг бөмбөрцөг хэлбэртэй гэж үзсэн; эерэг цэнэг нь энэ бөмбөгний бүх эзлэхүүнд жигд тархсан бөгөөд сөрөг цэнэгтэй электронууд түүний дотор байрладаг. Атомын радиус нь ойролцоогоор 10-10 м.Гэхдээ туршилтын үр дүнд энэ загвар буруу болох нь батлагдсан.
Рутерфордын туршилтууд. Рутерфорд хурдны тархалтыг судлах туршилтынхаа үр дүнд атомын шинэ загварыг санал болгосон. α -бодисын атомууд дээрх бөөмс. Эдгээр туршилтуудад цацраг идэвхт эм 2 (радиум, 18.1-р зураг) хар тугалгатай саванд хийсэн 1. Нарийн цацраг 3. α - бөөмс (радиумаас ялгарах бүрэн ионжсон гелийн атомууд) нимгэн металл тугалган цаас руу чиглүүлсэн 4 . Үүний ард цайрын сульфидын талстаар бүрхэгдсэн, хурдан цэнэглэгдсэн бөөмсийн нөлөөн дор гэрэлтэх чадвартай дэлгэц 5 байрлуулсан байв. Дэлгэц дээр гялалзах нь ажиглагдсан Зураг 18.1
микроскоп ашиглах 6 .
Тэр нь тогтоогдсон α - бөөмс нь шулуун замаас бараг ямар ч хазайлтгүйгээр нимгэн металл хавтангаар нэвтэрдэг. Үүний зэрэгцээ альфа бөөмсийн багахан хэсэг нь нэлээд том (180 ○) өнцгөөр хазайсан.
Рутерфорд альфа бөөмсийг том өнцгөөр тарааж байгааг атомын эерэг цэнэг нь 10-10 м радиустай бөмбөлөгт жигд тархаагүй, харин атомын төв хэсэгт төвлөрдөгтэй холбон тайлбарлав. хамаагүй жижиг хэмжээтэй бүс нутаг.
Атомын бараг бүх масс нь атомын эерэг цэнэгтэй төв хэсэг болох атомын цөмд төвлөрдөг. Рутерфордын тооцоолол нь альфа бөөмсийн тархалтын туршилтыг тайлбарлахын тулд цөмийн радиусыг ойролцоогоор 10 -15 м-тэй тэнцүү авах шаардлагатайг харуулсан.Ийм жижиг радиустай үед хурцадмал байдал цахилгаан оронтүүний гадаргуугийн ойролцоох цөм нь маш том. Энэ талбарт хөдөлж байна α -бөөмс нь бөөмийг том өнцгөөр, тэр дундаа эсрэг чиглэлд хазайдаг том хүчинд өртдөг.
Резерфордын туршилтаар эерэг цэнэгтэй цөм олдсоны дараа электронууд атомын хаана байрладаг, түүний үлдсэн орон зайг юу эзэлдэг зэрэг асуултуудад хариулах шаардлагатай болсон. Рутерфорд атомыг гаригийн систем шиг бүтэцтэй гэж үзсэн. Гаригууд нарнаас маш хол зайд эргэдэгтэй адил электронууд атомын цөмийн цөмийг тойрон эргэдэг. Цөмөөс хамгийн алслагдсан электроны тойрог замын радиус нь атомын радиус юм. Атомын бүтцийн энэ загварыг нэрлэжээ гаригийн эсвэл цөмийн загвар.
Гэсэн хэдий ч атомын системүүд нь гаригийн системээс гарагууд болон электронуудыг тойрог замд нь барьж байдаг хүчний физик шинж чанараараа ялгаатай байдаг: гаригууд бүх нийтийн таталцлын хүчээр одод татагддаг, атомын цөмтэй электронуудын харилцан үйлчлэлд гол үүрэг гүйцэтгэдэг. Эсрэг цахилгаан цэнэгийн Кулоны таталцлын хүчээр тоглодог. Электрон ба атомын цөм хоорондын таталцлын хүч нь цахилгаан соронзонтой харьцуулахад маш бага юм.
Атомын цөмийн загвар нь цэнэгтэй бөөмсийн тархалтын үндсэн хуулиудыг сайн тайлбарладаг. Атомын цөм болон түүний эргэн тойронд эргэлдэж буй электронуудын хоорондох ихэнх орон зай хоосон байдаг тул хурдан цэнэглэгдсэн бөөмс нь хэдэн мянган атомын давхарга агуулсан бодисын давхаргуудаар бараг чөлөөтэй нэвтэрч чаддаг.
Электронтой мөргөлдөх үед альфа бөөмс бараг алга болдоггүй, учир нь түүний масс нь ойролцоогоор 8000 дахин их байдаг. илүү массэлектрон. Гэсэн хэдий ч альфа бөөмс нь атомын цөмийн аль нэгний ойролцоо нисэх тохиолдолд атомын цөмийн цахилгаан талбайн нөлөөн дор 180 ° хүртэл ямар ч өнцгөөр тархаж болно. Гэвч цөмийн хэмжээ нь атомын хэмжээтэй харьцуулахад бага байдаг тул ийм үйл явдал маш ховор тохиолддог.
Атомын цөмийн загвар нь матер дахь альфа бөөмсийг тараах туршилтын үр дүнг тайлбарлах боломжийг олгосон боловч өөр нэг үндсэн бэрхшээлтэй тулгарсан: Рутерфордын атом дахь электрон хөдөлгөөний хууль нь электродинамикийн хуулиудтай зөрчилдөж байв.
Мэдэгдэж байгаагаар цахилгаан цэнэгийн хурдацтай хөдөлгөөн нь цахилгаан соронзон долгионы ялгаралт дагалддаг. Тойргийн хөдөлгөөн нь түргэвчилсэн хөдөлгөөн тул атом дахь электрон нь цөмийн эргэн тойрон дахь эргэлтийн давтамжтай тэнцүү давтамжтай цахилгаан соронзон долгионыг ялгаруулах ёстой. Энэ нь электроны энерги буурч, аажмаар атомын цөмд ойртож, цөм рүү унахад хүргэдэг.
Ийнхүү сонгодог физикийн хуулиар атомын цөм, түүнийг тойрон эргэдэг электронуудаас бүрдсэн атом тогтворгүй байдаг. Гэвч бодит байдал дээр атомууд тогтвортой бөгөөд өдөөгддөггүй төлөвт гэрэл ялгаруулдаггүй.
19-р зууны эцэс хүртэл атомыг хуваагдашгүй гэж үздэг байв. Харин 1897 онд Английн физикч Жозеф Жон Томсон электроныг нээсний дараа эрдэмтдийн буруу байсан нь тодорхой болсон.
Томсон электроныг олж мэдээд энэ нь масстай, сөрөг цэнэгтэй гэсэн дүгнэлтэд хүрсэн. Электроныг атомын салшгүй хэсэг гэж үздэг байсан. Гэхдээ энэ нь сөрөг цэнэгтэй тул атом нь ерөнхийдөө төвийг сахисан тул эерэг цэнэгтэй хэсгүүдийг агуулсан байх ёстой.
Томсоны атомын загвар
Томсон атомын загвараа санал болгов. Тэрээр атомыг бөмбөг хэлбэртэй гэж үздэг байв. Энэ бөмбөгний дотор сөрөг цэнэгтэй электронууд байдаг эерэг цэнэгтэй бодис байдаг. Томсон загвар өмсөгчдөө "үзэмтэй боов" гэж хошигнон нэрлэжээ. Өөрөөр хэлбэл, түүний загварт электронууд нь боовны үзэм шиг эерэг цэнэгтэй масстай огтлолцсон байдаг.
Рутерфордын туршлага

Рутерфордын туршлага
Эрдэмтдийн атомын цаашдын судалгаа нь Томсоны санал болгосон загвар буруу болохыг харуулсан.
1909 онд Английн физикч Эрнест Рутерфорд химийн элементийн радийн задралын явцад үүссэн альфа бөөмсийг тараах туршилт хийжээ. Альфа бөөмсийн масс нь электроны массаас 8000 дахин их байна.
Рутерфордын туршилтаар альфа бөөмсийн цацрагийг нимгэн алтан тугалган цаасаар дамжуулсан. Тугалган цаас нь маш нимгэн байсан тул түүний зузаан нь бараг нэг давхарга молекул байсан гэж хэлэх ёстой. Хэрэв Томсон зөв байсан бөгөөд атом нь ямар нэгэн электрон үүлнээс бүрдсэн бол том масстай альфа бөөмс тугалган цаасаар амархан дамжих ёстой. Гэвч үнэн хэрэгтээ альфа хэсгүүдийн зарим нь зөвхөн жижиг өнцгөөр хазайж, зарим нь ямар нэгэн саад тотгортой тулгараад буцах шиг болсон нь тодорхой болсон. Энэ үнэхээр гайхалтай байсан. Дараа нь Рутерфорд өөрийн туршлагаа цаасан дээр 15 инчийн бүрхүүл буудсантай харьцуулав. Түүний туршилтын үр дүн нь сум цаасны салфеткаг нэвтэлж чадалгүй зогсохгүй үсэрч гарсан юм. Өөрөөр хэлбэл, атомын дотор альфа тоосонцорыг атомаар дамжихаас сэргийлдэг ямар нэг зүйл байсан. Альфа бөөмс эерэг цэнэгтэй байсан тул эерэг цэнэгтэй бусад бөөмсийн хажуугаар дамжин өнгөрдөг байж магадгүй юм. Мөн эдгээр бөөмсийн хэмжээ нь атомын хэмжээнээс хамаагүй бага байв. Алтны атом нь эерэг цэнэгтэй цөм, түүнийг тойрсон сөрөг цэнэгтэй электронуудаас бүрдэх ёстой байв.
Энэ бол цөмийн физикийн төрөлт байсан гэж бид хэлж чадна.
Атомын гаригийн загвар

Рутерфордын атомын загвар
Рутерфорд атомын бүтцийг тайлбарласан атомын загварыг санал болгосон. Тэрээр атомын бүхэл бүтэн хэсэг нь эерэг цэнэгтэй цөмд төвлөрсөн гэж үздэг. Мөн гаригууд нарыг тойрон эргэдэгтэй адил сөрөг цэнэгтэй электронууд энэ цөмийг тойрон эргэдэг. Мөн электронууд нь цөмөөс тэдэнд үйлчлэх Кулоны хүчний нөлөөн дор эргэлддэг. Рутерфордын загварыг гаригийн гэж нэрлэдэг.
Атом дахь электронууд нь маш их хурдтайгаар эргэлддэг тул цөмийн гадаргуугаас дээш нэг төрлийн үүл үүсгэдэг. Бүх атомууд бие биенээсээ тодорхой зайд байрладаг. Тэд "наалддаггүй", учир нь атом бүрийн цөмд сөрөг цэнэгтэй өөрийн гэсэн электрон "үүл" байдаг. Мөн энэ "үүл" нь өөр атомын сөрөг цэнэгтэй электрон "үүл"-ээс хөөгддөг.
Гэхдээ Рутерфордын атомын загвар нь алдаатай байсан. Энэ нь сонгодог физикийн хуультай нийцэхгүй байсан. Яагаад электрон цөмд унадаггүй вэ? Учир нь энэ нь түүний эргэн тойронд эргэлддэг. Гэвч эргэлдэж байхдаа цахилгаан соронзон долгион гаргаж, эрчим хүчээ алдах ёстой. Тэгээд бүх энергийг аажмаар зарцуулсны дараа электрон цөм дээр унах ёстой. Гэвч бодит байдал дээр ийм зүйл тохиолддоггүй. Өөрөөр хэлбэл, атомд тохиолддог процессууд нь сонгодог хуулиудад захирагддаггүй.
Үүний дараа Данийн физикч Нильс Бор энэ үзэгдлийн тайлбарыг өгсөн. Тэрээр атом дахь электронууд энерги ялгаруулдаггүй хөдөлгөөнгүй тойрог замд л хөдөлдөг байхыг санал болгосон. Бор зөв байсан.
Атомын бүтэц
Атомын физикийн цэнэг, масс, энергийн нэгжүүд.
Тиймээс аливаа бөөмийн цэнэг үргэлж бүхэл тооны энгийн цэнэгийг агуулна. Атом хэмжээтэй бөөмийн хувьд энэ бүхэл тоо нь бас бага байх болно. Үүнийг харгалзан атомын физикт э = 1.60 10-19 С энгийн цэнэгийг цахилгаан цэнэгийн нэгж болгон авах нь тохиромжтой. Атомын физикийн хувьд массын нэгжийг нүүрстөрөгчийн изотоп 12С-ийн атомын массын 1/12 гэж үздэг. Энэ изотопын атомын масс 12, молийн масс M = 12 10-3 кг / моль. Тиймээс атомын массын нэгж (a.m.u.) нь тэнцүү байна
Атомын массын нэгжийг мөн атомын масс 1-тэй элементийн атомын масс гэж тодорхойлж болно. Тиймээс атомын массын нэгжээр илэрхийлсэн атомын масс (илүү нарийвчлалтай, дундаж утга) нь атомын масстай тэнцүү байна. элементийн.
Атомын масстай элемент гэдгийг анхаарна уу нэгтэй тэнцүү, байгальд байдаггүй. Устөрөгчийн атомын масс нь нэгдмэл байдалтай ойролцоо боловч арай илүү: энэ нь 1.008-тай тэнцүү байна. Тэгэхээр хамгийн хөнгөн атомын масс 1.008 а байна. идэх.
Атомын физикт батлагдсан энергийн нэгж нь 1 В-ын потенциалын зөрүүг дамжин өнгөрөх үед e цэнэгтэй бөөмс (жишээлбэл, электрон) олж авсан энерги юм. Энэ нэгжийг электронволт гэж нэрлэдэг бөгөөд eV гэж тэмдэглэнэ. Цахилгаан орон дахь хөдөлгөөний үед цэнэгийн олж авсан энерги нь цэнэгийн үржвэр ба замын эхлэл ба төгсгөлийн боломжит зөрүүтэй тэнцүү байна.
1 эВ=1,6 10-19 С 1В=1,6 10-19Ж.
Электронвольтийн тодорхойлолтоос харахад U [V] потенциалын зөрүүгээр хурдассан электрон нь тоон хувьд U [eV]-тэй тэнцүү энергитэй байна. 2e цэнэгтэй ион нь ижил потенциалын зөрүүг даван туулж, 2U [eV] гэх мэт энергийг олж авдаг.
Зөвхөн цэнэглэгдсэн төдийгүй саармаг хэсгүүдийн энергийг электрон вольтоор хэмжиж болно. Жишээлбэл, v=103 м/с хурдтай хөдөлж буй хүчилтөрөгчийн атомын энергийг (m=16 amu) электрон вольтоор илэрхийлье.
Электронвольтийн үржвэртэй нэгжүүдийг мөн ашигладаг:
1 кеВ=103 эВ, 1 МэВ=106 эВ, 1 ГэВ=109 эВ, 1 ТеВ=1012 эВ.
Рутерфорд-Борын атомын загвар.
Бүх зүйл үүнээс бүрддэг энгийн бөөмс. Гэвч матери шууд энгийн бөөмсөөс тогтдоггүй. Бүх бодисыг бүрдүүлдэг барилгын материал буюу элементүүд нь атомууд юм. Эрдэмтэд 1912 он хүртэл атомыг сөрөг цэнэгтэй электрон агуулсан эерэг цэнэгтэй бөмбөлөг гэж үздэг байв. Электрон үзэмтэй аяганы бялуутай төстэй загварыг Томсоны нэрээр нэрлэгдсэн Жозеф Жон, Уильям Лорд Келвин нар санал болгосон.

Ерөнхийдөө ийм атом дахь эерэг ба сөрөг цэнэгүүдийг нөхөж, атом нь цахилгаан саармаг байдаг. Атомын бүх масс электронд төвлөрдөг гэж таамаглаж байсан. Электрон нь атомаас хамаагүй хөнгөн тул хамгийн энгийн атомууд хүртэл хэдэн мянган электрон агуулсан байх ёстой.
1909 онд Рутерфорд тухайн үеийн залуу физикч Марсденд альфа туяа нь нимгэн металл ялтсуудаар дамжих үед хэрхэн тархаж байгааг судлах даалгавар өгчээ. Ихэнх энгийн тоосонцор ялтсуудыг дайран өнгөрсний дараа бага зэргийн хазайлтыг мэдэрсэн. Гэсэн хэдий ч Марсден маш хүчтэй хазайсан бөөмсийг илрүүлж чадсан. Тэд маш цөөхөн байсан нь үнэн, гэхдээ тэд огт байдаг нь гайхмаар байв. Мэдээж Марсден үүнийг төсөөлж байсан байх. Альфа тоосонцорыг бүртгэхийн тулд спинтарископ ашигласан - тусгай флюресцент бодисоор бүрсэн жижиг тунгалаг дэлгэц. Энгийн тоосонцор ийм дэлгэцийг цохиход сул хагалалт үүсдэг. Флэш нь маш жижиг, сул. Энэ нь микроскопоор ажиглагддаг. Нүд үүнийг анзаарахын тулд хүн харанхуйд дасах ёстой. Үүнийг хийхийн тулд тэрээр ажиллаж эхлэхээсээ өмнө, өөрөөр хэлбэл гялбаа бүртгэж, тоолохын өмнө бүрэн харанхуйд хагас цаг суух ёстой. Тиймээс Марсден андуурсан байж магадгүй гэж таамаглах нь зүйн хэрэг.
Рутерфорд Марсденаас туршилтуудыг давтахыг хүссэн боловч энэ удаад 90 ° хүртэл том хазайлт авсан бөөмсийг тусгайлан хянадаг.
Хэдэн өдрийн дараа Марсден Рутерфордын өрөөнд орж ирээд "Ийм бөөмс байдаг" гэж хэлэхэд Рутерфорд гайхан утсаа унагав. Рутерфорд Марсденд эдгээр туршилтуудыг хийхийг санал болгосон ч өөрөө ийм үр дүнд хүрнэ гэж төсөөлөөгүй.
Рутерфорд хожим дурссан: " энэ бол миний амьдралын хамгийн гайхалтай үйл явдал байсан. 15 инчийн бүрхүүлийг салфетка руу харваж, бүрхүүл нь буцаж ирээд чамайг онохтой адил гайхалтай байсан.".
Туршилтуудыг дахин шалгасан боловч энэ удаад Гейгер туршилтад нэгдсэн. Уг үзэгдлийг туршилтаар судалж, туршилтын материалыг мөн онд хэвлүүлсэн. Гэсэн хэдий ч үр дүнгийн утга учир нь нууцлаг байсан. Томсоны атом өндөр хурдтай нисч буй альфа бөөмийг зогсоож чадаагүй.
1911 онд Рутерфорд "Альфа ба бета бөөмсийг матераар тараах нь ба атомын бүтэц" гэсэн өгүүлэл нийтэлж, атомын алдартай гаригийн загварыг санал болгосон.

Тайлбарласан туршилтаар альфа бөөмөөс үсэрсэн жижиг, маш их эерэг цэнэгтэй цөм нь Рутерфордын атомын төвд байрладаг. Гэрлийн сөрөг цэнэгтэй электронууд цөмийн эргэн тойронд эргэлддэг. Атомын доторх ихэнх орон зай хоосон зүйлээр дүүрдэг. Ерөнхийдөө загвар нь манай Нарны аймагтай маш төстэй юм.
Рутерфордын нийтлэлийг чимээгүй хүлээж авсанд маш их харамсаж байна. Яагаад гэдгийг нь мэдээж Рутерфорд ойлгосон. Түүний атом богино настай байсан. Цөмийг тойрон эргэлдэж буй электрон нь цахилгаан соронзон долгионыг ялгаруулж, үүний үр дүнд энерги алдах ёстой. Үүний зэрэгцээ хурд нь удааширч, цөм рүү унах шаардлагатай болно. Гэсэн хэдий ч туршлагаас харахад байгаль дээрх бараг бүх атомууд тогтвортой байдаг.
Нилс Бор нөхцөл байдлыг засч залруулсан.
Борын онол
Борын постулатууд нь мөн чанараараа Кеплерийн хуулиудтай төстэй бөгөөд үүнээс гурван хууль байдаг. Аль аль нь туршилтын баримт дээр үндэслэн олж авсан таамагласан загварууд юм. Энэ нь Кеплерт бүр ч хэцүү байсан байх. Жишээлбэл, (томъёо) үр дүнд хэрхэн хүрэх вэ? Ньютон механикийн хуулиудыг томъёолсны дараа л Кеплерийн хуулиудыг тайлбарлах боломжтой болсон.
Рутерфордын загварын гол дутагдал нь цөмийн эргэн тойронд дугуй тойрог замд хөдөлж буй электрон цахилгаан соронзон долгионыг ялгаруулах ёстой боловч нотлох баримтаас харахад энэ нь тийм биш юм. Эрдэмтэд, түүний дотор Рутерфорд энэ зөрчилдөөнийг тайлбарлаж чадаагүй юм. Бор ч үүнийг хийж чадаагүй. Тэр зүгээр л баримтын талд оров: электронууд ялгардаггүй тул ийм байх ёстой. Анхны постулат ингэж гарч ирэв. Нийтдээ бид аль хэдийн хэлсэнчлэн эдгээрийн гурав нь байна.
Борын постулатууд
1. Электронууд атом дотор хөдөлгөөнгүй тойрог замд хөдөлдөг боловч энерги ялгаруулж, шингээдэггүй.
2. Тогтмол орбитууд нь электроны өнцгийн импульс байх болно mvrбүхэл үржвэртэй тэнцүү байна.
![]() , энд k = 1, 2, 3, 4...
, энд k = 1, 2, 3, 4...
3. Нэг тойрог замаас нөгөө тойрог замд шилжих үед электрон фотон хэлбэрээр энерги ялгаруулж эсвэл шингээдэг.
Электрон илүү алслагдсан тойрог замд байх тул илүү их энергитэй байдаг тул цөмд ойр орбит руу шилжихдээ энергийн хамт нэг фотоныг ялгаруулдаг.

Атом нь фотоныг шингээх үед электрон илүү өндөр түвшинд хүрч чадна.
Устөрөгчийн атомын хэмжээсүүд
Цөмийг тойрон эргэлдэж буй электрон нь түүн рүү чиглэсэн Кулоны таталцлын хүчийг мэдэрдэг.

атомын дугаар Z-тэй атомын цөмийн цэнэг хаана байна.
Ньютоны хоёр дахь хуулийн дагуу энэ хүч тэнцүү байх ёстой, тиймээс:  эсвэл
эсвэл  .
.
Борын хоёр дахь постулат нь тойрог замын радиус нь дур зоргоороо байж болохгүй, харин тэгшитгэлд захирагдах ёстойг бидэнд хэлдэг.
Энд бид k-р суурин тойрог замыг тэмдэглэнэ. Эндээс бид авдаг

 .
.
Бид Z серийн дугаартай атомын k-р хөдөлгөөнгүй орбитын радиусыг олж авлаа. Устөрөгчийн хувьд Z=1. Электрон хамгийн бага энергитэй байх эхний (k = 1) хамгийн дотоод тойрог замын радиусыг олъё.
Үүний үр дүнд устөрөгчийн атомын диаметр нь ойролцоогоор 0 байна, энэ нь туршилтын өгөгдөлтэй сайн тохирч байна.
k-р тойрог замд байгаа электроны энергийг олъё.
Түүний энерги нь үүнээс ирдэг кинетик энергитойрог замын хөдөлгөөн ба цөмтэй харилцан үйлчлэх боломжит электростатик энерги.
Тэд физикийн хөгжилд чухал алхам болсон. Рутерфордын загвар маш чухал байсан. Атомыг систем болгон, түүнийг бүрдүүлдэг бөөмсийг илүү нарийвчлалтай, нарийвчлан судалсан. Энэ нь цөмийн физик гэх мэт шинжлэх ухааныг амжилттай хөгжүүлэхэд хүргэсэн.
Материйн бүтцийн тухай эртний санаанууд
Эргэн тойрон дахь биетүүд жижиг хэсгүүдээс бүрддэг гэсэн таамаглал эрт дээр үеэс бий болсон. Тухайн үеийн сэтгэгчид атомыг аливаа бодисын хамгийн жижиг, хуваагдашгүй бөөмс гэж төсөөлдөг байв. Орчлон ертөнцөд атомаас жижиг хэмжээтэй зүйл байхгүй гэж тэд нотолсон. Ийм үзэл бодлыг эртний Грекийн агуу эрдэмтэн, гүн ухаантнууд болох Демокрит, Лукреций, Эпикур нар баримталдаг байв. Эдгээр сэтгэгчдийн таамаглалыг өнөөдөр "эртний атомизм" гэсэн нэрээр нэгтгэсэн.
Дундад зууны үеийн үзүүлбэрүүд
Эртний цаг үе өнгөрч, Дундад зууны үед бодисын бүтцийн талаар янз бүрийн таамаглал дэвшүүлсэн эрдэмтэд ч байсан. Гэсэн хэдий ч шашны давамгайлал философийн үзэл бодолТүүхийн тэр үеийн сүмийн хүч нь хүний оюун санааны материалист шинжлэх ухааны дүгнэлт, нээлтэд хүрэх аливаа оролдлого, хүсэл тэмүүллийг таслан зогсоосон. Дундад зууны үеийн инквизиция тухайн үеийн шинжлэх ухааны ертөнцийн төлөөлөгчидтэй маш эвгүй ханддаг байсныг та мэдэж байгаа. Эрт дээр үеэс үүссэн атомын хуваагдашгүй байдлын тухай тухайн үеийн гэгээлэг оюун ухаанд байсан гэж хэлэх хэрэгтэй.
18-19-р зууны судалгаа
18-р зуун нь материйн үндсэн бүтцийн салбарт ноцтой нээлтүүдээр тэмдэглэгдсэн байв. Антуан Лавуазье, Михаил Ломоносов зэрэг эрдэмтдийн хүчин чармайлтын ачаар тэд бие биенээсээ үл хамааран атомууд үнэхээр байдаг гэдгийг баталж чадсан юм. Гэхдээ тэдний тухай асуулт дотоод бүтэцнээлттэй хэвээр байв. 18-р зууны төгсгөл ийм чухал үйл явдлаар тэмдэглэгдсэн байв шинжлэх ухааны ертөнц, Д.И.Менделеевийн үелэх системийн нээлт химийн элементүүд. Энэ нь тухайн үеийн үнэхээр хүчирхэг нээлт байсан бөгөөд бүх атомууд нэг шинж чанартай, өөр хоорондоо холбоотой байдаг гэсэн ойлголтын хөшгийг арилгасан юм. Хожим нь 19-р зуунд атомын бүтцийг задлах бас нэг чухал алхам бол тэдгээрийн аль нэг нь электрон агуулдаг болохыг нотолсон явдал юм. Энэ үеийн эрдэмтдийн ажил 20-р зууны нээлтүүдэд үржил шимтэй хөрсийг бэлтгэсэн.

Томсоны туршилтууд
Английн физикч Жон Томсон 1897 онд атомуудад сөрөг цэнэгтэй электронууд байдгийг баталжээ. Энэ үе шатанд атом бол аливаа бодисын хуваагдах хязгаар гэсэн худал санааг бүрэн устгасан. Томсон электронууд байгааг хэрхэн баталж чадсан бэ? Эрдэмтэн туршилтдаа электродыг маш ховордсон хийд байрлуулж, дамжуулсан цахилгаан. Үүний үр дүнд катодын туяа гарч ирэв. Томсон тэдгээрийн онцлогийг сайтар судалж үзээд асар хурдтай хөдөлдөг цэнэгтэй бөөмсийн урсгал болохыг олж мэдэв. Эрдэмтэн эдгээр бөөмсийн масс болон тэдгээрийн цэнэгийг тооцоолж чадсан. Тэрээр мөн цахилгаан цэнэг нь тэдний мөн чанарын үндэс суурь болдог тул тэдгээрийг төвийг сахисан бөөмс болгон хувиргах боломжгүй гэдгийг олж мэдсэн. Тиймээс Томсон атомын бүтцийн дэлхийн анхны загварыг бүтээгч мөн. Үүний дагуу атом нь сөрөг цэнэгтэй электронууд жигд тархсан эерэг цэнэгтэй бодис юм. Эсрэг цэнэгүүд бие биенээ тэнцвэржүүлдэг тул энэ бүтэц нь атомуудын ерөнхий төвийг сахисан байдлыг тайлбарладаг. Жон Томсоны туршилтууд атомын бүтцийг цаашид судлахад үнэлж баршгүй чухал болсон. Гэсэн хэдий ч олон асуулт хариултгүй хэвээр байв.

Рутерфордын судалгаа
Томсон электронууд байдгийг нээсэн боловч атом дахь эерэг цэнэгтэй бөөмсийг олж чадаагүй юм. 1911 онд энэ үл ойлголцлыг зассан. Туршилтын үеэр хий дэх альфа бөөмсийн идэвхийг судалж байхдаа атом нь эерэг цэнэгтэй бөөмс агуулдаг болохыг олж мэдэв. Рутерфорд туяа нь хий эсвэл нимгэн металл хавтангаар дамжин өнгөрөхөд цөөн тооны бөөмс хөдөлгөөний замаас огцом хазайдаг болохыг олж харсан. Тэднийг шууд утгаараа буцааж хаясан. Эрдэмтэд энэ зан үйлийг эерэг цэнэгтэй бөөмстэй мөргөлдсөнөөр тайлбарласан гэж таамаглав. Ийм туршилтууд нь физикчдэд Рутерфордын атомын бүтцийн загварыг бий болгох боломжийг олгосон.

Гаригийн загвар
Одоо эрдэмтний санаанууд Жон Томсоны таамаглалаас арай өөр байв. Тэдний атомын загварууд бас өөр болсон. түүнд энэ чиглэлээр цоо шинэ онолыг бий болгох боломжийг олгосон. Эрдэмтдийн нээлт чухал ач холбогдолтой байв Цаашдын хөгжилфизик. Рутерфордын загварт атомыг цөм нь төвд байрладаг бөгөөд электронууд нь түүнийг тойрон хөдөлдөг гэж тодорхойлсон. Цөм нь эерэг цэнэгтэй, электронууд нь сөрөг цэнэгтэй. Рутерфордын атомын загвар нь электронууд цөмийг тойрон тодорхой траекторийн дагуу эргэдэг гэж үздэг. Эрдэмтний нээлт нь альфа бөөмсийн хазайлтын шалтгааныг тайлбарлахад тусалж, атомын цөмийн онолыг хөгжүүлэх түлхэц болсон. Рутерфордын атомын загвар нь гаригуудын хөдөлгөөнтэй ижил төстэй байдлыг харуулж байна нарны системНарны эргэн тойронд. Энэ бол маш зөв бөгөөд тод харьцуулалт юм. Иймээс атом цөмийг тойрог замд тойрон хөдөлдөг Рутерфордын загварыг гариг гэж нэрлэдэг.

Нильс Борын бүтээлүүд
Хоёр жилийн дараа Данийн физикч Нильс Бор атомын бүтцийн талаарх санааг квант шинж чанартай хослуулахыг оролдов. гэрлийн урсгал. Эрдэмтэн Рутерфордын атомын цөмийн загварыг шинэ онолдоо үндэс болгон ашигласан. Борын хэлснээр атомууд цөмийг тойрон тойрог замд эргэлддэг. Хөдөлгөөний энэ зам нь электронуудын хурдатгалд хүргэдэг. Нэмж дурдахад эдгээр бөөмсийн атомын төвтэй Кулоны харилцан үйлчлэл нь электронуудын хөдөлгөөнөөс үүссэн орон зайн цахилгаан соронзон орныг хадгалахын тулд энерги үүсгэж, зарцуулдаг. Ийм нөхцөлд сөрөг цэнэгтэй бөөмс хэзээ нэгэн цагт цөм дээр унах ёстой. Гэхдээ энэ нь тохиолддоггүй бөгөөд энэ нь атомууд систем болгон илүү тогтвортой байгааг харуулж байна. Максвеллийн тэгшитгэлээр тодорхойлсон сонгодог термодинамикийн хуулиуд атомын доторх нөхцөлд ажиллахгүй гэдгийг Нильс Бор ойлгосон. Тиймээс эрдэмтэн энгийн бөөмсийн ертөнцөд хүчинтэй байх шинэ хуулиудыг гаргах зорилтыг өөртөө тавьсан.

Борын постулатууд
Гол төлөв Рутерфордын загвар оршин тогтнож, атом болон түүний бүрэлдэхүүн хэсгүүдийг сайтар судалж үзсэний ачаар Нильс Бор өөрийн постулатуудыг бий болгоход ойртож чадсан юм. Тэдгээрийн эхнийх нь атомын энерги нь өөрчлөгддөггүй, харин электронууд замналаа өөрчлөхгүйгээр тойрог замд хөдөлдөг болохыг харуулж байна. Хоёр дахь постулатын дагуу электрон нэг тойрог замаас нөгөө тойрог руу шилжих үед энерги ялгардаг эсвэл шингэдэг. Энэ нь атомын өмнөх болон дараагийн төлөвүүдийн энергийн зөрүүтэй тэнцүү юм. Түүнээс гадна, хэрэв электрон цөмд ойрхон тойрог зам руу үсрэх юм бол цацраг туяа үүсдэг ба эсрэгээр. Электронуудын хөдөлгөөн нь тойрог дотор байрладаг тойрог замын замналтай бараг төстэй биш ч Борын нээлт нь шугаман спектрийн оршин тогтнох тухай маш сайн тайлбарыг олж авах боломжийг олгосон.. Үүний зэрэгцээ физикч Герц, Франк нар Германд амьдарч байсан тэрээр атомын хөдөлгөөнгүй, тогтвортой төлөв байдал, атомын энергийн утгыг өөрчлөх боломжийн тухай Нильс Борын сургаалийг баталжээ.

Хоёр эрдэмтний хамтын ажиллагаа
Дашрамд дурдахад, Рутерфорд удаан хугацаанд тодорхойлж чадаагүй юм.Марсден, Гейгер нар Эрнест Рутерфордын мэдэгдлийг давхар шалгахыг оролдсон бөгөөд нарийвчилсан, нарийн туршилт, тооцооллын үр дүнд энэ нь цөм юм гэсэн дүгнэлтэд хүрчээ. байна хамгийн чухал шинж чанаратом бөгөөд түүний бүх цэнэг түүнд төвлөрдөг. Дараа нь цөмийн цэнэгийн утга нь Д.И.Менделеевийн элементүүдийн үечилсэн систем дэх элементийн дарааллын тоотой тэнцүү байх нь батлагдсан. Сонирхолтой нь Нилс Бор удалгүй Рутерфордтой уулзаж, түүний үзэл бодолтой бүрэн санал нийлсэн байна. Дараа нь эрдэмтэд нэг лабораторид удаан хугацаанд хамтран ажилласан. Рутерфордын загвар, атомыг энгийн цэнэгтэй тоосонцороос бүрдэх систем - энэ бүгдийг Нильс Бор шударга гэж үзэж, электрон загвараа үүрд хойш нь тавьсан. Хамтарсан шинжлэх ухааны үйл ажиллагааэрдэмтэд маш их амжилтанд хүрч, үр жимсээ өгсөн. Тэд тус бүр нь энгийн бөөмсийн шинж чанарыг судалж, шинжлэх ухаанд чухал ач холбогдолтой нээлтүүдийг хийсэн. Хожим нь Рутерфорд цөмийн задралын боломжийг нээж, нотолсон боловч энэ бол өөр өгүүллийн сэдэв юм.