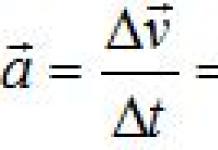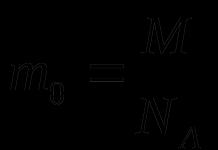Химийн элемент гэдэг нь тодорхой хэмжээний эерэг цөмийн цэнэгтэй, тодорхой шинж чанартай атомын төрөл юм.
Одоогийн байдлаар 112 химийн элемент мэдэгдэж байна. Зарим элементүүдийг хүмүүс эрт дээр үеэс хэрэглэж ирсэн бол заримыг нь 18-20-р зууны үед байгальд илрүүлсэн. Байгальд 20 орчим элемент байдаггүй бөгөөд тэдгээрийг цөмийн урвалын тусламжтайгаар зохиомлоор гаргаж авдаг.
Бүх элементүүд нь нэр, тэмдэгтэй байдаг. Элементийн тэмдэг нь химийн элементийн Латин нэрийн эхний үсэг эсвэл хоёр эхний үсгээр тэмдэглэгээ юм.
Оросын агуу химич Д.И. Менделеев бүх химийн элементүүдийн хооронд байгалийн хамаарал байдгийг тогтоосон бөгөөд үүнийг үечилсэн хууль гэж нэрлэсэн (1869). Энэхүү хуулийн дүрслэл нь бидний сайн мэдэх хүснэгт юм - Д.И. Менделеев. Энэ нь элементүүдийн тэмдэг, нэр, хамгийн чухал шинж чанаруудыг агуулдаг.
Анхаарна уу.Олон тооны химийн элементүүдийн тэмдэг нь тодорхой байдаг, учир нь тэдгээрийн орос, латин нэр нь гийгүүлэгч, жишээ нь Ca - кальци (Кальци), Na - натри (Натри) гэх мэт. Гэхдээ зарим элементийн хувьд Орос, Латин нэр нь маш өөр байдаг, жишээлбэл, Fe - төмөр (Феррум), Au - алт (Аурум), Ag - мөнгө (Аргентум), O - хүчилтөрөгч (Oxigenium), H - устөрөгч (Hidrogenium) , C - нүүрстөрөгч (Carboneum) гэх мэт. Химийн хичээлийг судлахдаа ашиглахыг зөвлөдөг лавлах ном (Стас Н.Ф. Ерөнхий ба органик бус химийн гарын авлага) нь үечилсэн хүснэгтийн хоёр хэлбэр (8 ба 18 нүд), орос, латин, англи, герман хэл дээрх хүснэгтийг агуулдаг. мөн франц хэлээр химийн элементүүдийг нэрлэдэг.
Хэрэв химийн элементийн тоо 112, элемент нь атомын нэг төрөл бол 112 төрлийн атом байх ёстой. Бодит байдал дээр энэ нь тийм биш юм. Бараг бүх химийн элемент хэд хэдэн зүйлийн нэгдэл байдаг нь тогтоогдсон изотопууд.Изотопууд нь цөмийн цэнэг нь ижил боловч цөм дэх нейтроны тоо өөр байдаг атомууд юм. Изотопуудыг химийн элементийн тэмдгээр тэмдэглэсэн бөгөөд зүүн дээд талд массын тоог харуулсан доод тэмдэгтэй. Атомын массын тоо (изотоп) нь атомын цөмд агуулагдах протон ба нейтронуудын нийлбэр юм, жишээлбэл: 35 Cl, 37 Cl, 29 Mg, 29 Mg, 29 Mg гэх мэт.
Атомын цөмийн масс (изотоп) үргэлж массын тооноос арай бага байдаг. Атомын цөм үүсэх үед массын бууралт ( массын согог) атомын цөмд протон ба нейтроны хооронд асар их татах хүч байдагтай холбон тайлбарладаг. Эдгээр хүчнүүд үүсэх нь Эйнштейний харьцангуйн онолын дагуу массын гажиг дагалддаг.
Аливаа изотопын массын тоо нь бүхэл тоо боловч элементийн атомын масс тийм биш юм. Үүнийг элементийн атомын масс нь түүний изотопуудын атомын массын дундаж утга бөгөөд тэдгээрийн байгаль дээрх элбэг дэлбэг байдлыг харгалзан тайлбарладаг.
Жишээ 1.... изотоптой ... атомын массыг тооцоол
3. Энгийн бодис ба нэгдлүүд
Энгийн бодисууд нь ижил химийн элементийн атомуудыг агуулсан бодис юм.
Энгийн бодис ба химийн элемент нь ижил ойлголт биш боловч заримдаа ийм тодорхойлолтыг андуурч гаргадаг. Түүхээс харахад энгийн бодисууд нь химийн элементүүдтэй ижил нэртэй байдаг боловч тэдгээр нь ижил зүйл биш юм. Жишээлбэл, тэд: 1) ус (H 2 O) нь хүчилтөрөгч агуулдаг; 2) бид хүчилтөрөгчөөр амьсгалдаг. Эхний тохиолдолд бид хүчилтөрөгчийн химийн элементийн тухай, хоёрдугаарт агаарт байдаг O 2 бодисын тухай ярьж байна.
Хэрэв "химийн элемент" ба "энгийн бодис" гэсэн ойлголтууд ижил ойлголт байсан бол химийн элементтэй адил олон энгийн бодис байх байсан (112), гэхдээ бодит байдал дээр тэдгээр нь хэдэн зуугаараа байдаг. Үүнийг олон элемент нэг биш, хэд хэдэн энгийн бодис үүсгэдэгтэй холбон тайлбарладаг. Энэ үзэгдлийг гэж нэрлэдэг аллотропи. Нэг химийн элементээс үүссэн өөр өөр энгийн бодисыг нэрлэдэг аллотропик өөрчлөлтүүдЭнэ бодисын (өөрчлөлт). Тэдгээр нь молекулуудын найрлагад (O 2, O 3), болор бүтэц (алмаз, бал чулуу) эсвэл хоёуланд нь (цагаан фосфор - P 4 молекул, улаан - полимер бодис) ялгаатай байдаг.
Нарийн төвөгтэй бодисууд нь янз бүрийн химийн элементүүдийн атомуудыг агуулсан бодис юм. Нарийн төвөгтэй бодис гэж нэрлэдэг химийн нэгдлүүд. Тэдгээрийг органик (тэдгээрийг органик хими судалдаг) ба органик бус гэж хуваадаг.
Органик бус нэгдлүүд нь найрлага, шинж чанараараа ялгаатай байдаг. Химийн практикт бид ихэвчлэн оксид, суурь, хүчил, давс гэсэн дөрвөн төрлийн органик бус нэгдлүүдийг авч үзэх шаардлагатай болдог. Эдгээр төрлийн органик бус нэгдлүүдийг үндсэн эсвэл үндсэн гэж нэрлэдэг. Чухал нэгдлүүдийн ангилал бүр нь эргээд ижил төстэй шинж чанартай бодисуудын бүлэгт хуваагддаг. Энэхүү гарын авлагын дараагийн бүлэг нь органик бус нэгдлүүдийн ангилал, шинж чанар, нэршилд зориулагдсан болно.
Маш олон янзын зүйл, объектууд, амьд ба амьгүй байгалийн биетүүд биднийг хүрээлж байдаг. Тэд бүгд өөрийн гэсэн найрлага, бүтэц, шинж чанартай байдаг. Амьд организмд амин чухал үйл явцыг дагалддаг биохимийн нарийн төвөгтэй урвал явагддаг. Амьд бус бие махбодь нь байгаль, биомассын амьдралд янз бүрийн үүрэг гүйцэтгэдэг бөгөөд нарийн төвөгтэй молекул, атомын найрлагатай байдаг.
Гэхдээ энэ гарагийн объектууд бүгд хамтдаа байдаг нийтлэг шинж чанар: Эдгээр нь химийн элементийн атом гэж нэрлэгддэг олон жижиг бүтцийн хэсгүүдээс бүрддэг. Тэд маш жижиг тул энгийн нүдээр харах боломжгүй. Химийн элементүүд гэж юу вэ? Тэд ямар шинж чанартай вэ, тэдний оршин тогтнохыг та яаж мэдсэн бэ? Үүнийг ойлгохыг хичээцгээе.
Химийн элементүүдийн тухай ойлголт
Нийтээр хүлээн зөвшөөрөгдсөн ойлголтоор химийн элементүүд нь атомуудын график дүрслэл юм. Орчлон ертөнцөд байгаа бүх зүйлийг бүрдүүлдэг бөөмс. Өөрөөр хэлбэл, "химийн элементүүд гэж юу вэ" гэсэн асуултад дараах хариултыг өгч болно. Эдгээр нь нарийн төвөгтэй жижиг бүтэц, атомын бүх изотопуудын цуглуулга бөгөөд нийтлэг нэрээр нэгдсэн, өөрийн гэсэн график тэмдэглэгээтэй (тэмдэг) юм.
Өнөөдрийг хүртэл хоёуланд нь 118 элемент илэрсэн нь мэдэгдэж байна байгалийн нөхцөл, мөн нийлэг байдлаар, цөмийн урвал болон бусад атомын цөмүүдийг явуулах замаар. Тэд тус бүр нь тодорхой шинж чанартай, өөрийн гэсэн байршилтай байдаг нийтлэг систем, нээлтийн түүх, нэр, мөн байгаль, амьд биетийн амьдралд тодорхой үүрэг гүйцэтгэдэг. Эдгээр шинж чанаруудыг химийн шинжлэх ухаан судалдаг. Химийн элементүүд нь молекул, энгийн ба нарийн төвөгтэй нэгдлүүд, улмаар химийн харилцан үйлчлэлийг бий болгох үндэс суурь болдог.
Нээлтийн түүх
Химийн элементүүд ямар байдгийг зөвхөн 17-р зуунд Бойлийн ажлын ачаар олж мэдсэн. Энэ үзэл баримтлалын талаар анх ярьж, дараах тодорхойлолтыг өгсөн хүн юм. Эдгээр нь эргэн тойрон дахь бүх зүйл, түүний дотор бүх нарийн төвөгтэй бодисуудаас бүрддэг хуваагдашгүй жижиг энгийн бодисууд юм.
Энэхүү бүтээлээс өмнө Эмпидокл, Аристотель гэсэн дөрвөн элементийн онолыг хүлээн зөвшөөрсөн хүмүүс, мөн "шатамхай зарчмууд" (хүхэр) ба "металл зарчмууд" (мөнгөн ус) нээсэн хүмүүс алхимичдын давамгайлсан үзэл бодол байв.
Бараг бүхэл бүтэн 18-р зууны туршид флогистоны бүрэн алдаатай онол өргөн тархсан байв. Гэсэн хэдий ч энэ хугацааны төгсгөлд Антуан Лоран Лавуазье үүнийг батлах боломжгүй гэдгийг нотолж байна. Тэрээр Бойлийн томъёоллыг давтаж байгаа боловч тэр үед мэдэгдэж байсан бүх элементүүдийг системчлэх анхны оролдлогоор баяжуулж, тэдгээрийг металл, радикал, шороо, металл бус гэсэн дөрвөн бүлэгт хуваасан.

Химийн элементүүд гэж юу болохыг ойлгох дараагийн том алхам нь Далтоноос ирсэн. Түүнийг атомын массыг нээсэн гэж үздэг. Үүний үндсэн дээр тэрээр мэдэгдэж буй химийн элементүүдийн заримыг атомын массыг нэмэгдүүлэх дарааллаар хуваарилдаг.
Шинжлэх ухаан, технологийн тогтвортой эрчимтэй хөгжил нь байгалийн биетүүдийн найрлага дахь шинэ элементүүдийн хэд хэдэн нээлт хийх боломжийг бидэнд олгодог. Тиймээс 1869 он гэхэд Д.И.Менделеевийн агуу бүтээлийн цаг үед шинжлэх ухаан 63 элемент байдгийг мэддэг болсон. Оросын эрдэмтний бүтээл нь эдгээр бөөмсийн анхны бүрэн бөгөөд үүрд тогтоогдсон ангилал болжээ.
Тухайн үед химийн элементүүдийн бүтэц тогтоогдоогүй байсан. Атом бол хуваагдашгүй, хамгийн жижиг нэгж гэж үздэг байсан. Цацраг идэвхит үзэгдлийг нээснээр бүтцийн хэсгүүдэд хуваагддаг нь батлагдсан. Бараг бүх хүмүүс хэд хэдэн байгалийн изотоп хэлбэрээр байдаг (ижил төстэй бөөмс, гэхдээ атомын массыг өөрчилдөг өөр өөр тооны нейтрон бүтэцтэй). Ийнхүү өнгөрсөн зууны дунд үе гэхэд үзэл баримтлалын тодорхойлолтод дэг журамд хүрэх боломжтой болсон химийн элемент.
Менделеевийн химийн элементүүдийн систем
Эрдэмтэн үүнийг атомын массын ялгаан дээр үндэслэж, бүх мэдэгдэж буй химийн элементүүдийг өсөн нэмэгдэж буй дарааллаар нь зохион байгуулж чадсан. Гэсэн хэдий ч түүний шинжлэх ухааны сэтгэлгээ, алсын харааны бүх гүн гүнзгий, суут ухаан нь Менделеев өөрийн системд хоосон орон зай, үл мэдэгдэх элементүүдийн нүдийг нээж өгсөнд оршдог бөгөөд эрдэмтдийн үзэж байгаагаар ирээдүйд нээгдэх болно.
Тэгээд бүх зүйл яг түүний хэлснээр болсон. Менделеевийн химийн элементүүд цаг хугацааны явцад бүх хоосон эсийг дүүргэсэн. Эрдэмтний таамагласан бүтэц бүрийг олж илрүүлсэн. Одоо бид химийн элементүүдийн системийг 118 нэгжээр төлөөлдөг гэж баттай хэлж чадна. Үнэн, гурав хамгийн сүүлийн үеийн нээлтүүдхараахан албан ёсоор батлагдаагүй байна.
Химийн элементүүдийн системийг өөрөө шинж чанар, цөмийн цэнэг, атомын электрон бүрхүүлийн бүтцийн онцлогийн дагуу элементүүдийг байрлуулсан хүснэгтэд графикаар харуулав. Тиймээс, үе (7 ширхэг) байдаг - хэвтээ эгнээ, бүлгүүд (8 ширхэг) - босоо, дэд бүлгүүд (бүлэг тус бүрийн доторх үндсэн ба хоёрдогч). Ихэнхдээ хоёр эгнээ гэр бүлийг хүснэгтийн доод давхаргад тусад нь байрлуулдаг - лантанид ба актинид.

Элементийн атомын масс нь протон ба нейтроноос бүрддэг бөгөөд тэдгээрийн хослолыг "массын тоо" гэж нэрлэдэг. Протоны тоог маш энгийнээр тодорхойлдог - энэ нь систем дэх элементийн атомын дугаартай тэнцүү юм. Атом нь бүхэлдээ цахилгаан саармаг систем, өөрөөр хэлбэл ямар ч цэнэггүй тул сөрөг электронуудын тоо үргэлж эерэг протоны тоосонцортой тэнцүү байдаг.
Тиймээс химийн элементийн шинж чанарыг түүний үелэх систем дэх байрлалаар нь өгч болно. Эцсийн эцэст бараг бүх зүйлийг эсэд дүрсэлсэн байдаг: серийн дугаар, электрон ба протон, атомын масс (өгөгдсөн элементийн одоо байгаа бүх изотопын дундаж утга). Бүтэц ямар хугацаанд байрлаж байгааг харж болно (энэ нь электронууд маш олон давхарга дээр байрлана гэсэн үг). Та мөн тоог урьдчилан таамаглах боломжтой сөрөг тоосонцорүндсэн дэд бүлгүүдийн элементүүдийн энергийн сүүлийн түвшинд - энэ нь тухайн элемент байрладаг бүлгийн тоотой тэнцүү байна.

Нейтроны тоог массын тоо, өөрөөр хэлбэл атомын дугаараас протоныг хасах замаар тооцоолж болно. Тиймээс химийн элемент тус бүрийн бүтцээр нь бүрэн дүүрэн электрон графикийн томьёог гаргаж, эмхэтгэх боломжтой бөгөөд энэ нь түүний бүтцийг нарийвчлан тусгаж, боломжит болон илрэх шинж чанарыг харуулах болно.
Байгаль дахь элементүүдийн тархалт
Энэ асуудлыг бүхэл бүтэн шинжлэх ухаан судалж байна - космохими. Манай гараг дээрх элементүүдийн тархалт нь орчлон ертөнц дэх ижил хэв маягийн дагуу явагддаг болохыг өгөгдөл харуулж байна. Хөнгөн, хүнд, дунд атомуудын цөмийн гол эх үүсвэр нь оддын дотоод хэсэгт тохиолддог цөмийн урвалууд - нуклеосинтез юм. Эдгээр үйл явцын ачаар Орчлон ертөнц болон сансар огторгуй нь манай гаригийг бүх химийн элементүүдээр хангасан.
Байгалийн эх сурвалжид мэдэгдэж байгаа нийт 118 төлөөлөгчийн 89-ийг нь хүмүүс нээсэн бөгөөд эдгээр нь үндсэн, хамгийн түгээмэл атомууд юм. Цөмийг нейтроноор бөмбөгдөх замаар химийн элементүүдийг зохиомлоор нийлэгжүүлсэн (лабораторийн нуклеосинтез).

Хамгийн олон нь азот, хүчилтөрөгч, устөрөгч зэрэг элементүүдийн энгийн бодисууд юм. Нүүрстөрөгч нь бүгдэд нь багтдаг органик бодис, энэ нь бас тэргүүлэх байр суурийг эзэлдэг гэсэн үг юм.
Атомын электрон бүтцээр нь ангилах
Системийн бүх химийн элементүүдийн хамгийн нийтлэг ангиллын нэг бол тэдгээрийн хуваарилалт юм цахим бүтэц. Атомын бүрхүүлд хэдэн энергийн түвшин агуулагдаж, тэдгээрийн аль нь сүүлчийн валентийн электронуудыг агуулж байгаагаас хамааран дөрвөн бүлгийн элементүүдийг ялгаж болно.
S-элементүүд
Эдгээр нь s-орбиталыг хамгийн сүүлд дүүргэдэг хүмүүс юм. Энэ гэр бүлд үндсэн дэд бүлгийн эхний бүлгийн элементүүд орно (эсвэл нэг электрон гадаад түвшинэдгээр төлөөлөгчдийн ижил төстэй шинж чанарыг хүчтэй бууруулагч бодис гэж тодорхойлдог.
P-элементүүд
Зөвхөн 30 ширхэг. Валент электронууд p-дэд түвшинд байрладаг. Эдгээр нь 3,4,5,6-р үеүүдэд хамаарах гурав дахь бүлгээс найм дахь бүлэг хүртэлх үндсэн дэд бүлгүүдийг бүрдүүлдэг элементүүд юм. Тэдгээрийн дотроос шинж чанарууд нь метал болон ердийн металл бус элементүүдийг агуулдаг.
d-элементүүд ба f-элементүүд
Эдгээр нь 4-өөс 7-р гол үе хүртэлх шилжилтийн металлууд юм. Нийтдээ 32 элемент байна. Энгийн бодисууд нь хүчиллэг ба үндсэн шинж чанарыг (исэлдүүлэх, багасгах) хоёуланг нь харуулж чаддаг. Мөн амфотер, өөрөөр хэлбэл хос.
f-бүлэгт сүүлийн электронууд f-орбиталд байрладаг лантанид ба актинидууд багтдаг.
Элементээр үүссэн бодисууд: энгийн
Мөн химийн элементүүдийн бүх ангиуд нь энгийн эсвэл нарийн төвөгтэй нэгдлүүд хэлбэрээр байж болно. Тиймээс энгийн нэг бүтцээс өөр өөр хэмжээгээр үүссэнийг энгийн гэж үздэг. Жишээлбэл, O 2 нь хүчилтөрөгч эсвэл давхар хүчилтөрөгч, O 3 нь озон юм. Энэ үзэгдлийг аллотропи гэж нэрлэдэг.

Ижил нэртэй нэгдлүүдийг үүсгэдэг энгийн химийн элементүүд нь үечилсэн хүснэгтийн төлөөлөгч бүрийн онцлог шинж чанартай байдаг. Гэхдээ тэдгээр нь бүгд ижил шинж чанартай байдаггүй. Тэгэхээр энгийн бодис, металл, металл бус гэж байдаг. Эхнийх нь 1-3 бүлэг бүхий үндсэн дэд бүлгүүд болон хүснэгтэд байгаа бүх хоёрдогч дэд бүлгүүдийг бүрдүүлнэ. 4-7-р бүлгийн үндсэн дэд бүлгүүдийг бус металлууд бүрдүүлдэг. Найм дахь үндсэн элемент нь тусгай элементүүдийг агуулдаг - эрхэм эсвэл идэвхгүй хий.
Өнөөдрийг хүртэл нээсэн бүх энгийн элементүүдээс 11 хий нь энгийн нөхцөлд мэдэгдэж байгаа бөгөөд 2 шингэн бодис(бром ба мөнгөн ус), бусад нь хатуу.
Нарийн төвөгтэй холболтууд
Эдгээрт хоёр ба түүнээс дээш химийн элементүүдээс бүрдэх бүх зүйл орно. Маш олон жишээ бий, учир нь химийн нэгдлүүд 2 сая гаруй нь мэдэгдэж байна! Эдгээр нь давс, исэл, суурь ба хүчил, цогцолбор юм нарийн төвөгтэй нэгдлүүд, бүх органик бодисууд.
Мөн үзнэ үү: Атомын дугаараар химийн элементүүдийн жагсаалт ба Цагаан толгойн үсгийн жагсаалтхимийн элементүүд Агуулга 1 Одоогоор ашиглагдаж байгаа тэмдэгтүүд ... Википедиа
Мөн үзнэ үү: Химийн элементүүдийн жагсаалт ба химийн элементүүдийн цагаан толгойн үсгийн жагсаалт Энэ нь атомын тоог нэмэгдүүлэх дарааллаар байрлуулсан химийн элементүүдийн жагсаалт юм. Хүснэгтэд... ... Википедиа дахь элемент, тэмдэг, бүлэг, цэгийн нэрийг харуулав
- (ISO 4217) Валют ба сангуудыг илэрхийлэх кодууд (Англи хэл) Кодууд pour la représentation des monnaies et type de fonds (Франц) ... Wikipedia
Тодорхойлох боломжтой материйн хамгийн энгийн хэлбэр химийн аргууд. Эдгээр нь ижил цөмийн цэнэгтэй атомуудын цуглуулгыг төлөөлдөг энгийн бөгөөд нарийн төвөгтэй бодисын бүрэлдэхүүн хэсэг юм. Атомын цөмийн цэнэгийг атом дахь протоны тоогоор тодорхойлно... Коллиерийн нэвтэрхий толь бичиг
Агуулга 1 Палеолитын эрин 2 МЭӨ 10-р мянган жил. д. МЭӨ 3 9-р мянган жил Өө... Википедиа
Агуулга 1 Палеолитын эрин 2 МЭӨ 10-р мянган жил. д. МЭӨ 3 9-р мянган жил Өө... Википедиа
Энэ нэр томъёо нь өөр утгатай, орос хэлийг үзнэ үү. Оросууд... Википедиа
Нэр томьёо 1: : dw Долоо хоногийн өдрийн дугаар. “1” нь Даваа гарагтай тохирч байна Төрөл бүрийн баримт бичгүүдээс авсан нэр томъёоны тодорхойлолт: dw DUT Москва болон UTC цагийн хоорондох бүхэл тоогоор илэрхийлэгдсэн ялгаа ... ...-аас авсан нэр томъёоны тодорхойлолт. Норматив, техникийн баримт бичгийн нэр томъёоны толь бичиг-лавлах ном
IN химийн урвалнэг бодисыг нөгөө бодис болгон хувиргах үйл явц тохиолддог. Энэ нь хэрхэн тохиолддогийг ойлгохын тулд байгалийн түүх, физикийн явцад бодисууд атомуудаас бүрддэг гэдгийг санах хэрэгтэй. Хязгаарлагдмал тооны атомууд байдаг. Атомууд хоорондоо янз бүрийн аргаар холбогдож болно. Цагаан толгойн үсгийг нэмэхэд хэдэн зуун мянган үсэг хэрхэн үүсдэг өөр өөр үгс, тиймээс өөр өөр бодисын молекулууд эсвэл талстууд ижил атомуудаас үүсдэг. Атомууд молекул үүсгэж болно- шинж чанараа хадгалдаг бодисын хамгийн жижиг хэсгүүд. Жишээлбэл, хүчилтөрөгчийн атом ба устөрөгчийн атом гэсэн хоёр төрлийн атомаас үүсдэг хэд хэдэн бодисыг мэддэг боловч янз бүрийн төрөлмолекулууд. Эдгээр бодисуудад ус, устөрөгч, хүчилтөрөгч орно. Усны молекул нь хоорондоо холбогдсон гурван ширхэгээс тогтдог. Эдгээр нь атомууд юм. Хүчилтөрөгчийн атом (хүчилтөрөгчийн атомыг химийн хувьд О үсгээр тэмдэглэсэн) нь хоёр устөрөгчийн атомд холбогдсон байдаг (тэдгээрийг H үсгээр тэмдэглэсэн). Хүчилтөрөгчийн молекул нь хүчилтөрөгчийн хоёр атомаас бүрдэнэ; Устөрөгчийн молекул нь хоёр устөрөгчийн атомаас тогтдог. Химийн өөрчлөлтийн үед молекулууд үүсч болно, эсвэл задрах боломжтой. Тиймээс усны молекул бүр хоёр устөрөгчийн атом, нэг хүчилтөрөгчийн атом болж задардаг. Хоёр усны молекул нь хоёр дахин их устөрөгч ба хүчилтөрөгчийн атом үүсгэдэг. Ижил атомууд хосоороо холбогдож шинэ бодисын молекул үүсгэдэг- устөрөгч ба хүчилтөрөгч. Ийнхүү молекулууд устаж, атомууд нь хадгалагдан үлддэг. Эртний Грек хэлнээс орчуулбал "атом" гэдэг үг эндээс гаралтай "хуваашгүй". Атомууд нь бодисын хамгийн жижиг химийн хуваагдашгүй хэсгүүд юм Химийн өөрчлөлтөд анхны бодисыг бүрдүүлсэн ижил атомуудаас бусад бодисууд үүсдэг. Микроскоп бий болсноор микробууд ажиглалт хийх боломжтой болсонтой адил атом, молекулууд ч илүү томруулж, бүр атом, молекулуудын гэрэл зургийг авах боломжтой болсон багаж хэрэгсэл бүтээснээр ажиглалт хийх боломжтой болсон. Ийм гэрэл зурагт атомууд нь бүдэг бадаг толбо, молекулууд нь ийм толбоны нэгдэл хэлбэрээр харагдана. Гэсэн хэдий ч атомууд хуваагддаг, нэг төрлийн атомууд бусад төрлийн атомууд болж хувирдаг үзэгдлүүд бас байдаг. Үүний зэрэгцээ байгальд байдаггүй атомуудыг хиймэл аргаар олж авдаг. Гэхдээ эдгээр үзэгдлийг хими биш, харин өөр шинжлэх ухаан - цөмийн физик судалдаг. Өмнө дурьдсанчлан устөрөгч ба хүчилтөрөгчийн атом агуулсан бусад бодисууд байдаг. Гэхдээ эдгээр атомууд нь усны молекулуудын нэг хэсэг эсвэл бусад бодисын нэг хэсэг эсэхээс үл хамааран эдгээр нь ижил химийн элементийн атомууд юм. Химийн элемент нь тодорхой төрлийн атом юм Хэдэн төрлийн атом байдаг вэ?Өнөөдөр хүмүүс 118 төрлийн атом, өөрөөр хэлбэл 118 химийн элемент байдгийг найдвартай мэддэг. Үүнээс 90 төрлийн атомыг байгальд, үлдсэнийг нь лабораторид хиймэл аргаар олж авдаг.
Химийн элементийн тэмдэг
Химийн шинжлэх ухаанд химийн элементүүдийг тодорхойлоход химийн тэмдэглэгээг ашигладаг. Энэ бол химийн хэл юм. Аль ч хэл дээрх яриаг ойлгохын тулд үсгийг мэдэх хэрэгтэй бөгөөд энэ нь химийн хувьд ч мөн адил юм. Бодисын шинж чанар, тэдгээрийн өөрчлөлтийг ойлгох, тайлбарлахын тулд юуны түрүүнд химийн элементүүдийн тэмдгүүдийг мэдэх хэрэгтэй. Алхимийн эрин үед одоогийнхоос хамаагүй бага химийн элементүүд мэддэг байсан. Алхимичид тэднийг гаригууд, төрөл бүрийн амьтад, эртний бурхадтай адилтгасан. Одоогоор Шведийн химич Йонс Якоб Берцелиусын нэвтрүүлсэн тэмдэглэгээний системийг дэлхий даяар хэрэглэж байна. Түүний системд химийн элементүүдийг тухайн элементийн латин нэрний эхний эсвэл дараагийн үсгүүдийн аль нэгээр нь тэмдэглэдэг. Жишээлбэл, мөнгөн элементийг - тэмдгээр төлөөлдөг. Аг (лат. Argentum).Хамгийн түгээмэл химийн элементүүдийн тэмдэг, тэмдэгт дуудлага, нэрсийг доор харуулав. Тэднийг цээжлэх хэрэгтэй! Оросын химич Дмитрий Иванович Менделеев химийн элементүүдийн олон янз байдлыг анхлан зохион байгуулсан бөгөөд өөрийн нээсэн Үелэх хуулинд үндэслэн химийн элементүүдийн үечилсэн системийг зохиосон. Химийн элементүүдийн үечилсэн хүснэгт хэрхэн зохион байгуулагдсан бэ? Зураг 58-д үечилсэн хүснэгтийн богино хугацааны хувилбарыг үзүүлэв. Үелэх хүснэгт нь босоо багана, хэвтээ мөрүүдээс бүрдэнэ. Хэвтээ шугамыг цэг гэж нэрлэдэг. Өнөөдрийг хүртэл бүх мэдэгдэж буй элементүүдийг долоон хугацаанд байрлуулсан. Хугацаа нь 1-ээс 7 хүртэлх араб тоогоор тодорхойлогддог. 1-3-р үеүүд нь нэг эгнээний элементүүдээс бүрддэг - тэдгээрийг жижиг гэж нэрлэдэг. 4-7-р үеүүд нь хоёр эгнээ элементээс бүрддэг бөгөөд тэдгээрийг үндсэн гэж нэрлэдэг. Үелэх системийн босоо багануудыг элементүүдийн бүлгүүд гэж нэрлэдэг. Нийт найман бүлэг байдаг бөгөөд тэдгээрийг тэмдэглэхийн тулд I-ээс VIII хүртэлх Ром тоонуудыг ашигладаг.Үндсэн болон хоёрдогч дэд бүлгүүд байдаг. Тогтмол хүснэгт – бүх нийтийн лавлах номхимич, түүний тусламжтайгаар та химийн элементүүдийн талаар мэдээлэл авах боломжтой. Өөр нэг үечилсэн систем байдаг - урт хугацаа.Үелэх хүснэгтийн урт хугацааны хэлбэрт элементүүдийг өөр өөрөөр бүлэглэж, 18 бүлэгт хуваадаг. Энэ хувилбарт Тогтмол системэлементүүдийг "гэр бүл" гэж ангилдаг, өөрөөр хэлбэл элемент бүрийн бүлэгт ижил төстэй шинж чанартай элементүүд байдаг. Энэ хувилбарт Тогтмол систем, бүлгийн дугаар, түүнчлэн цэгүүдийг араб тоогоор тэмдэглэнэ. Химийн элементүүдийн үечилсэн систем D.I. Менделеев Үелэх систем дэх элементийн шинж чанарБайгаль дахь химийн элементүүдийн тархалт
Байгальд байдаг элементийн атомууд маш жигд бус тархсан байдаг. Сансарт хамгийн түгээмэл элемент бол устөрөгч юм - үечилсэн системийн эхний элемент. Энэ нь орчлон ертөнцийн бүх атомын 93 орчим хувийг эзэлдэг. Ойролцоогоор 6.9% нь үечилсэн системийн хоёр дахь элемент болох гелийн атомууд юм. Үлдсэн 0.1% нь бусад бүх элементүүдээс гардаг.Дэлхийн царцдас дахь химийн элементүүдийн элбэг дэлбэг байдал нь Орчлон ертөнцийн элбэг дэлбэг байдлаас эрс ялгаатай. Дэлхийн царцдас нь хүчилтөрөгч, цахиурын хамгийн их атомыг агуулдаг. Тэд хөнгөн цагаан, төмрийн хамт үндсэн нэгдлүүдийг үүсгэдэг дэлхийн царцдас. Мөн төмөр, никель- манай гаригийн цөмийг бүрдүүлдэг гол элементүүд. Амьд организмууд нь янз бүрийн химийн элементүүдийн атомуудаас бүрддэг.Хүний биед хамгийн их нүүрстөрөгч, устөрөгч, хүчилтөрөгч, азотын атомууд байдаг.Химийн элементүүдийн талаархи нийтлэлээс бид дүгнэлт гаргадаг.
- Химийн элемент- тодорхой төрлийн атом
- Өнөөдөр хүмүүс 118 төрлийн атом, өөрөөр хэлбэл 118 химийн элемент байдгийг найдвартай мэддэг. Үүнээс 90 төрлийн атомыг байгальд, үлдсэнийг нь лабораторид хиймэл аргаар олж авдаг.
- Химийн элементүүдийн үечилсэн системийн хоёр хувилбар байдаг D.I. Менделеев - богино хугацаа, урт хугацаа
- Орчин үеийн химийн тэмдэг нь химийн элементүүдийн латин нэрнээс гаралтай
- Үе үе– үелэх системийн хэвтээ шугамууд. Хугацаа нь жижиг, том гэж хуваагддаг
- Бүлгүүд- үечилсэн хүснэгтийн босоо эгнээ. Бүлгүүдийг үндсэн ба хоёрдогч гэж хуваадаг
Бүх химийн элементүүдийг атомын бүтэц, түүнчлэн тэдгээрийн байрлалаас хамааран тодорхойлж болно Тогтмол хүснэгтД.И. Менделеев. Ерөнхийдөө химийн элементийг дараахь төлөвлөгөөний дагуу тодорхойлдог.
- химийн элементийн тэмдэг, түүнчлэн түүний нэрийг зааж өгөх;
- Үелэх систем дэх элементийн байрлал дээр үндэслэн D.I. Менделеев түүний дараалал, хугацааны дугаар, элемент байрлаж буй бүлэг (дэд бүлгийн төрөл) -ийг заана;
- атомын бүтцэд үндэслэн атом дахь цөмийн цэнэг, массын тоо, электрон, протон, нейтроны тоог заана;
- электрон тохиргоог тэмдэглэж, валентийн электронуудыг зааж өгөх;
- газар дээрх валентийн электронууд болон өдөөгдсөн (боломжтой бол) төлөвийн электрон график томъёог зурах;
- элементийн гэр бүл, түүнчлэн түүний төрлийг (металл эсвэл металл бус) заана;
- өндөр исэл ба гидроксидын томъёог зааж өгнө Товч танилцуулгатэдгээрийн шинж чанар;
- химийн элементийн хамгийн бага ба хамгийн их исэлдэлтийн төлөвийн утгыг заана.
Жишээ болгон ванадий (V) ашигласан химийн элементийн шинж чанар
Дээр дурдсан төлөвлөгөөний дагуу ванади (V) ашиглан химийн элементийн шинж чанарыг жишээ болгон авч үзье.
1. V – ванадий.
2. Ээлжийн дугаар – 23. Элемент нь 4-р үед, V бүлгийн А (үндсэн) дэд бүлэгт байна.
3. Z=23 (цөмийн цэнэг), M=51 (массын тоо), e=23 (электронуудын тоо), p=23 (протоны тоо), n=51-23=28 (нейтроны тоо).
4. 23 V 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 – электрон тохиргоо, валентын электронууд 3d 3 4s 2.
5. Газрын төлөв
Сэтгэл хөдөлсөн байдал

6. d-элемент, металл.
7. Илүү их оксид– V 2 O 5 - амфотер шинж чанарыг харуулдаг бөгөөд хүчиллэг нь давамгайлдаг.
V 2 O 5 + 2NaOH = 2NaVO 3 + H 2 O
V 2 O 5 + H 2 SO 4 = (VO 2) 2 SO 4 + H 2 O (рН)<3)
Ванади нь дараах найрлагатай гидроксидыг үүсгэдэг: V(OH) 2, V(OH) 3, VO(OH) 2. V(OH) 2 ба V(OH) 3 нь үндсэн шинж чанараараа (1, 2), VO(OH) 2 нь амфотер шинж чанартай (3, 4):
V(OH) 2 + H 2 SO 4 = VSO 4 + 2H 2 O (1)
2 V(OH) 3 + 3 H 2 SO 4 = V 2 (SO 4) 3 + 6 H 2 O (2)
VO(OH) 2 + H 2 SO 4 = VOSO 4 + 2 H 2 O (3)
4 VO(OH) 2 + 2KOH = K 2 + 5 H 2 O (4)
8. Исэлдэлтийн хамгийн бага төлөв нь “+2”, хамгийн их нь “+5”
Асуудлыг шийдвэрлэх жишээ
ЖИШЭЭ 1
| Дасгал хийх | Фосфорын химийн элементийг тайлбарла |
| Шийдэл | 1. P – фосфор. 2. Ээлжийн дугаар – 15. Элемент нь 3-р үед, V бүлгийн А (үндсэн) дэд бүлэгт байна. 3. Z=15 (цөмийн цэнэг), M=31 (массын тоо), e=15 (электронуудын тоо), p=15 (протоны тоо), n=31-15=16 (нейтроны тоо). 4. 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 – электрон тохиргоо, валентийн электронууд 3s 2 3p 3. 5. Газрын төлөв Сэтгэл хөдөлсөн байдал 6. p-элемент, металл бус. 7. Илүү өндөр исэл - P 2 O 5 - хүчиллэг шинж чанарыг харуулдаг: P 2 O 5 + 3Na 2 O = 2Na 3 PO 4 Өндөр исэлд тохирсон гидроксид - H 3 PO 4 нь хүчиллэг шинж чанартай байдаг. H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O 8. Исэлдэлтийн хамгийн бага төлөв “-3”, дээд тал нь “+5” |
ЖИШЭЭ 2
| Дасгал хийх | Калийн химийн элементийг тайлбарла |
| Шийдэл | 1. K - кали. 2. Ээлжийн дугаар – 19. Элемент нь 4-р үед, I бүлгийн А (үндсэн) дэд бүлэгт байна. |