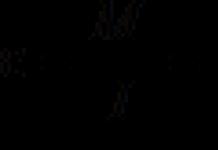Ферментийн үйл ажиллагааг зохицуулах.
Идэвхжүүлэх механизмууд.
1) Ковалентын өөрчлөлт (өөрөөр хэлбэл ферментүүдийн ковалент холбоо өөрчлөгддөг)
a) хэсэгчилсэн протеолиз (пепсиноген ба трипсиноген нь зөвхөн давсны хүчил ба энтерокиназын нөлөөнд өртөхөөс гадна идэвхтэй ферментүүд - пепсин ба трипсин тус тус нөлөөлж, өөрөөр хэлбэл автокатализ үүсдэг).
б) фосфоржилт ба дефосфоризаци. Фосфоржилтыг уургийн киназууд гүйцэтгэдэг.
2) Идэвхтэй төвийг дуусгах (ихэнхдээ эдгээр нь металлын ионууд, ялангуяа манганы ионууд боловч зарим тохиолдолд метал нь хүхэртэй нийлж, дараа нь хүхэр нь идэвхтэй төвтэй илүү амархан харьцдаг).
3) Аллостерийн идэвхжил. Дүрмээр бол нөлөө нь идэвхтэй төв байхгүй дэд нэгжид тохиолддог (өөрөөр хэлбэл энэ нь олигомеруудад ихэвчлэн тохиолддог) боловч энэ дэд хэсэг нь зарим метаболит (жишээлбэл, ADP) нөлөөлж болох зохицуулалтын газартай байдаг. мөн дэд нэгж нь түүний бүтцийг өөрчилдөг , үүнтэй зэрэгцэн идэвхтэй төвийг агуулсан дэд нэгжийн бүтцийг өөрчилж, улмаар субстрат руу илүү хүртээмжтэй болгодог. Дүрмээр бол аллостерийн идэвхжүүлэлт ба дарангуйлал нь завсрын эсвэл эцсийн метаболитууд нь урвалын хурдыг зохицуулах үед өөрийгөө зохицуулах үйл явц юм.
Бүтцийн зохион байгуулалтэс дэх фермент .
Эсийн бүтэц бүр нь тодорхой функцийг гүйцэтгэх боломжийг олгодог тодорхой ферментийн багцтай байдаг. Жишээлбэл, митохондри нь тодорхой субстратуудыг исэлдүүлж, үүссэн энергийг ашиглах чадвартай ферментүүдээр тоноглогдсон байдаг. Цөмүүд (тэдгээр нь удамшлын мэдээллийг хадгалах, дамжуулах чадвартай ДНХ ба РНХ-ийн нийлэгжилтийг агуулдаг), мөн тодорхой ферментүүд (РНХ ба ДНХ полимеразууд гэх мэт) байдаг. Лизосомууд (тэдгээр нь янз бүрийн нарийн төвөгтэй нэгдлүүдийг устгадаг) мөн тохирох ферментүүдтэй (гидролаза, лиаза гэх мэт) байдаг.
Эдгээр бүх ферментийн багц нь хатуу бүтэцтэй, өөрөөр хэлбэл, жишээлбэл, митохондрийн мембранд баригдсан байдаг ( амьсгалын замын гинж) тодорхой дарааллаар, цогцолборт байдаг (жишээлбэл, өөх тосны хүчлүүдийн нийлэгжилтийг хангадаг цогцолбор; пирувийн хүчлийг хувиргахад тусалдаг цогцолбор) заримдаа эсийн бүтцэд зориулсан индикатор (маркер) ферментүүдийн тухай ярьдаг (сукцинатдегидрогеназа) - митохондри, РНХ полимераза - цөмд, хүчиллэг фосфатаза лизосомын хувьд).
Бодисын солилцооны явцад ферментийн үйл ажиллагаа байнга зохицуулагддаг, өөрөөр хэлбэл фермент хэзээ ч нэг хэвийн ажилладаггүй. Ферментийн үйл ажиллагааг зохицуулах янз бүрийн арга байдаг.
1) ферментийн хэмжээ өөрчлөгдөж болно (өөрөөр хэлбэл ферментийн синтез нэмэгдэх эсвэл буурах). Энэ нь генийн илэрхийлэл өөрчлөгдсөнтэй холбоотой юм.
2) Ферментийн химийн өөрчлөлт (идэвхжүүлэгч, дарангуйлагч эсвэл рН-ийн өөрчлөлтийн нөлөөн дор) өөрчлөгдөж болно. Эдгээр нь хэсэгчилсэн протеолиз, фосфоржилт ба дефосфоризаци, сульфонжуулалт гэх мэт.
3) Гормоны нөлөөн дор ферментийн үйл ажиллагаа өөрчлөгддөг (янз бүрийн механизм).
4) Ферментийн идэвхжилд субстрат өөрөө эсвэл урвалын бүтээгдэхүүн (идэвхжүүлэгч эсвэл дарангуйлагч) нөлөөлж болно.
5) Тасалгааны үзэгдлийг эсүүдэд, өөрөөр хэлбэл тусламжтайгаар тэмдэглэдэг. биологийн мембрануудферментүүд болон эдгээр ферментүүд устгаж болох субстратуудыг ялгаж авдаг боловч эсэд үүнийг шаарддаггүй (жишээлбэл, лизосомын протеиназа, фосфатаза гэх мэт ферментүүд нь цитоплазмд байрлах бодисуудаас тусгаарлагддаг) эсвэл бие биендээ үл нийцэх бодисын солилцооны мембран ашиглан тусгаарлагддаг. процессууд нэгэн зэрэг явагддаг (жишээлбэл, өөх тосны хүчлүүдийн нийлэгжилт нь цитоплазмд, өөх тосны хүчлүүдийн задрал нь митохондрид тохиолддог). Бүх ферментүүд зохицуулалтанд хамрагддаггүй. Гэхдээ ферментийн урвалын гинжин хэлхээнд идэвхжүүлсэн эсвэл саатуулдаг гол ферментүүд байдаг.
Ферментийн тусгаарлах зарчим .
Ферментийг илрүүлэхийн тулд тэдгээрийн өвөрмөц шинж чанарыг ашигладаг. Тэд тодорхой (тодорхой) субстратыг авч, оновчтой нөхцөлийг (рН, температур) сонгож, ферментийг нэмж урвал явагдах эсэхийг шалгахын зэрэгцээ субстратын концентраци буурч, бүтээгдэхүүний үүсэх нь нэмэгддэг. Ферментийн тоон үнэлгээг тэдний үйл ажиллагаанаас (ферментүүд бага хэмжээгээр агуулагддаг) өгдөг, өөрөөр хэлбэл ферментийн урвалын хурдыг тодорхойлдог. Ферментийн үйл ажиллагааг тогтмол температурт (25 эсвэл 37 хэм) тодорхойлж, хамгийн оновчтой рН-ийг бий болгодог. Энэ тохиолдолд субстратын концентраци нэлээд өндөр байх ёстой. Эдгээр нөхцөлд урвалын хурд нь ферментийн концентрацаас шууд хамаардаг \/ = K[F]. Ферментийн үйл ажиллагааны нэгжийг түүний нэгж гэж үздэг хамгийн бага хэмжээ, ĸᴏᴛᴏᴩᴏᴇ оновчтой нөхцөлд нэг минутын дотор нэг микромол субстратын хувиргалтыг үүсгэдэг.
Өвөрмөц үйл ажиллагаа нь нэг мг уураг тутамд ферментийн идэвхжил юм. Олон улсын биохимийн холбооны комиссын ферментийн нэршлийн талаархи зөвлөмжийн дагуу ферментийн идэвхийг илэрхийлэхийн тулд катал ашиглахыг санал болгож байна. 1 катал - ϶ᴛᴏ каталитик идэвхжил, секундэд нэг мольтэй тэнцэх хурдтай урвал явуулах чадвартай.
Ферментийн үйл ажиллагааг зохицуулах. - үзэл баримтлал ба төрөл. "Ферментийн үйл ажиллагааны зохицуулалт" ангиллын ангилал ба онцлог. 2017, 2018 он.
Ферментийн үйл ажиллагааг зохицуулах. Анагаах ухааны энзимологи (биохими)
Ферментийн үйл ажиллагааг зохицуулах арга замууд:
1. Ферментийн хэмжээг өөрчлөх.
2. Ферментийн катализаторын үр ашгийн өөрчлөлт.
3. Урвалын нөхцөлийг өөрчлөх.
Ферментийн зохицуулалт
Эс дэх ферментийн молекулуудын тоог хоёр процессын харьцаагаар тодорхойлдог - уургийн ферментийн молекулын нийлэгжилт ба задралын хурд.
Эсэд хоёр төрлийн фермент байдаг:
1. Үндсэн ферментүүд- эсийн зайлшгүй бүрэлдэхүүн хэсэг бөгөөд тогтмол хурдаар тогтмол хэмжээгээр нийлэгждэг.
2. Дасан зохицох ферментүүд- тэдгээрийн үүсэх нь тодорхой нөхцлөөс хамаарна. Тэдгээрийн дотроос индукц болон дарангуйлагдах ферментүүдийг ялгадаг.
Дүрмээр бол катаболик функцтэй ферментүүд индукц болдог. Тэдний үүсэх нь тухайн ферментийн субстратаас үүдэлтэй эсвэл хурдасч болно. Ихэвчлэн дарангуйлдаг ферментүүд нь анаболик ферментүүд юм. Эдгээр ферментийн синтезийн дарангуйлагч (дарангуйлагч) нь энэхүү ферментийн урвалын эцсийн бүтээгдэхүүн байж болно.
Ферментийн катализаторын үр ашгийн өөрчлөлт
Энэ төрлийн зохицуулалтыг хэд хэдэн механизмаар хийж болно.
Идэвхжүүлэгч ба дарангуйлагчийн ферментийн үйл ажиллагаанд үзүүлэх нөлөө
Идэвхжүүлэгчид ферментийн идэвхийг янз бүрийн аргаар нэмэгдүүлэх боломжтой.
1. ферментийн идэвхтэй төвийг бүрдүүлэх;
2. фермент-субстратын цогцолбор үүсэхийг хөнгөвчлөх;
3. ферментийн уугуул бүтцийг тогтворжуулах;
4. идэвхтэй сайтын функциональ бүлгүүдийг хамгаалах.
Ферментийн дарангуйлагчдын ангилал:
1. Өвөрмөц бус.
2. Тодорхой:
Эргэж буцахгүй
Буцах боломжтой:
§ өрсөлдөх чадвартай
§ өрсөлдөх чадваргүй.
Өвөрмөц бус дарангуйлагчид нь ферментийн молекулын денатураци үүсгэдэг - эдгээр нь хүчил, шүлт, хүнд металлын давс юм. Тэдний үйлдэл нь ферментийн катализын механизмтай холбоогүй юм.
Буцааж болшгүй дарангуйлал
Дарангуйлагч молекул ба ферментийн хооронд тогтвортой ковалент холбоо үүссэн тохиолдолд эргэлт буцалтгүй дарангуйлал ажиглагддаг. Ихэнх тохиолдолд ферментийн идэвхтэй төв нь өөрчлөлтөд ордог. Үүний үр дүнд фермент нь катализаторын үүргээ гүйцэтгэж чадахгүй.
Эргэшгүй дарангуйлагчид ионууд орно хүнд металлууджишээлбэл, мөнгөн ус (Hg 2+), мөнгө (Ag +), хүнцэл (As 3+) зэрэг нь бага концентрацитай үед идэвхтэй хэсгийн сульфгидрил бүлгүүдийг блоклодог. Субстрат нь химийн өөрчлөлтөд орох боломжгүй.
Диизопропил фторофосфат (DFP) нь ферментийн идэвхтэй хэсэгт байгаа олон сериний үлдэгдлүүдийн зөвхөн нэгтэй нь тусгайлан урвалд ордог. DPP-тэй урвалд орох чадвартай Ser үлдэгдэл нь ижил эсвэл маш төстэй амин хүчлийн орчинтой байдаг. Бусад Сэр үлдэгдэлтэй харьцуулахад энэ үлдэгдэл өндөр урвалд ордог нь амин хүчлийн үлдэгдэлтэй холбоотой бөгөөд эдгээр үлдэгдэл нь ферментийн идэвхтэй хэсэгт мөн багтдаг.
DPP нь "серин" ферментийг үүсгэдэг өвөрмөц эргэлт буцалтгүй дарангуйлагч гэж ангилдаг. ковалент холбооидэвхтэй төвд байрлаж, катализийн үйл явцад гол үүрэг гүйцэтгэдэг сериний гидроксил бүлэгтэй.
Моноиодоцүний хүчил ба р-хлоромеркурибензоат нь уураг дахь цистеины үлдэгдлийн SH бүлгүүдтэй амархан урвалд ордог. Эдгээр дарангуйлагчид нь ямар ч чөлөөт SH бүлгийн уурагтай урвалд ордог тул өвөрмөц бус дарангуйлагчид гэж нэрлэгддэггүй. Хэрэв SH бүлгүүд катализд шууд оролцдог бол эдгээр дарангуйлагчдыг ашиглан катализ дахь ферментийн SH бүлгийн үүргийг тодорхойлох боломжтой юм.
Эмийн хувьд эргэлт буцалтгүй ферментийн дарангуйлагч
Үйл ажиллагаа нь эргэлт буцалтгүй ферментийн дарангуйлалд суурилдаг эмийн жишээ бол өргөн хэрэглэгддэг эмийн аспирин юм. Үрэвслийн эсрэг стероид бус эм аспирин нь арахидоны хүчлээс простагландин үүсэхийг хурдасгадаг циклоксигеназа ферментийг дарангуйлснаар фармакологийн нөлөө үзүүлдэг. Үр дүнд нь химийн урвалАспирины ацетил үлдэгдэл нь циклоксигеназын сериний чөлөөт терминал OH бүлэгт наалддаг.
Энэ нь биологийн өргөн хүрээний үйл ажиллагаа, түүний дотор үрэвслийн зуучлагч простагландины урвалын бүтээгдэхүүн үүсэхийг бууруулдаг.
Буцааж болох дарангуйлал
Урвуу ингибиторууд нь ковалент бус сул холбоогоор ферменттэй холбогддог ба тодорхой нөхцөлд ферментээс амархан салдаг. Урвалт дарангуйлагч нь өрсөлдөх чадвартай эсвэл өрсөлдөх чадваргүй байж болно.
Өрсөлдөөнт дарангуйлал
Өрсөлдөөнт дарангуйлал гэдэг нь ферментийн идэвхтэй хэсэгт холбогдож, фермент-субстратын цогцолбор үүсэхээс сэргийлдэг дарангуйлагчийн улмаас үүссэн ферментийн урвалын хурдыг буцаах бууралтыг хэлнэ. Энэ төрлийн дарангуйлал нь дарангуйлагч нь субстратын бүтцийн аналог байх үед ажиглагддаг бөгөөд үүний үр дүнд ферментийн идэвхтэй төвд байрлах субстрат ба дарангуйлагч молекулуудын хооронд өрсөлдөөн үүсдэг. Энэ тохиолдолд субстрат эсвэл дарангуйлагч нь ферменттэй харилцан үйлчилж, фермент-субстрат (ES) эсвэл фермент-дарангуйлагч (EI) цогцолборыг үүсгэдэг. Ферментийн дарангуйлагч (EI) цогцолбор үүсэх үед урвалын бүтээгдэхүүн үүсдэггүй.
Өрсөлдөөнт дарангуйллын сонгодог жишээ бол сукцинатын дегидрогеназын урвалыг малоны хүчлээр дарангуйлах явдал юм. Малоны хүчил нь сукцинатын бүтцийн аналог (хоёр карбоксил бүлэг байгаа) бөгөөд мөн сукцинатын дегидрогеназын идэвхтэй газартай харилцан үйлчилж чаддаг. Гэсэн хэдий ч малоны хүчлээс хоёр устөрөгчийн атомыг гаргаж авах боломжгүй; тиймээс урвалын хурд буурдаг.
Мансууруулах бодис нь өрсөлдөх чадвартай дарангуйлагч юм
Олон эм нь эмчилгээний үр нөлөөг өрсөлдөөнийг дарангуйлах механизмаар гүйцэтгэдэг. Жишээлбэл, дөрөвдөгч аммонийн суурь нь ацетилхолинестеразыг дарангуйлдаг бөгөөд энэ нь ацетилхолиныг холин ба цууны хүчил болгон гидролиз болгодог.
Дарангуйлагчийг нэмэхэд ацетилхолинэстеразын идэвхжил буурч, ацетилхолин (субстрат) -ийн концентраци нэмэгдэж, мэдрэлийн импульсийн дамжуулалт нэмэгддэг. Холинестеразын дарангуйлагчдыг булчингийн дистрофи эмчилгээнд хэрэглэдэг. Антихолинестеразын үр дүнтэй эмүүд - прозерин, эндрофони гэх мэт.
Метаболитийн эсрэг бодисууд
Антиметаболит гэж нэрлэгддэг бодисуудыг анагаах ухааны практикт өрсөлдөөнт механизмаар ферментийн дарангуйлагч болгон ашигладаг. Байгалийн субстратын бүтцийн аналог болох эдгээр нэгдлүүд нь нэг талаас ферментийн өрсөлдөх чадварыг дарангуйлдаг бөгөөд нөгөө талаас псевдосубстраттай ижил ферментүүдээр ашиглагддаг бөгөөд энэ нь хэвийн бус бүтээгдэхүүний нийлэгжилтэд хүргэдэг. Хэвийн бус бүтээгдэхүүн нь үйл ажиллагааны идэвхгүй; Үүний үр дүнд бодисын солилцооны тодорхой замуудын хурд буурч байна.
гэх мэт эмдараах антиметаболитуудыг хэрэглэнэ: эмчилгээнд хэрэглэдэг сульфаниламидын эм (пара-аминобензойн хүчлийн аналог). Халдварт өвчин, хорт хавдрын эмчилгээнд нуклеотидын аналогууд.
Өрсөлдөөнгүй дарангуйлал
Ферментийн урвалын өрсөлдөөнгүй дарангуйллыг дарангуйлагч нь ферменттэй идэвхтэй газраас өөр газар харилцан үйлчлэлцэх үед гэж нэрлэдэг. Өрсөлдөх чадваргүй дарангуйлагчид нь субстратын бүтцийн аналог биш юм.
Өрсөлдөх чадваргүй дарангуйлагч нь фермент эсвэл фермент-субстратын цогцолбортой холбогдож идэвхгүй цогцолбор үүсгэдэг. Өрсөлдөөнгүй дарангуйлагчийг нэмснээр ферментийн молекулын конформацид өөрчлөлт орж, ферментийн идэвхтэй төвтэй субстратын харилцан үйлчлэл тасардаг бөгөөд энэ нь ферментийн урвалын хурд буурахад хүргэдэг.
Аллостерийн зохицуулалт
Аллостерийн ферментүүд нь үйл ажиллагаа нь зөвхөн субстратын молекулуудын тооноос гадна эффектор гэж нэрлэгддэг бусад бодисоор зохицуулагддаг ферментүүд юм. Аллостерийн зохицуулалтад оролцдог эффекторууд нь ихэвчлэн эсийн метаболитууд байдаг тэр зам, тэд зохицуулдаг.
Эсийн бодисын солилцоонд аллостерийн ферментийн үүрэг. Аллостерийн ферментүүд нь эсийн дотоод төлөв байдлын өчүүхэн өөрчлөлтөд маш хурдан хариу үйлдэл үзүүлдэг тул бодисын солилцоонд чухал үүрэг гүйцэтгэдэг.
Аллостерийн зохицуулалт байдаг их ач холбогдолдараах тохиолдолд:
1. анаболик үйл явцын үед. Бодисын солилцооны эцсийн бүтээгдэхүүнээр дарангуйлах, анхны метаболитоор идэвхжүүлэх нь эдгээр нэгдлүүдийн нийлэгжилтийг зохицуулах боломжийг олгодог;
2. катаболик үйл явцын үед. Эсэд ATP хуримтлагдах үед энергийн нийлэгжилтийг хангадаг бодисын солилцооны замууд саатдаг. Энэ тохиолдолд субстратуудыг нөөц шим тэжээлийг хадгалах урвалд зарцуулдаг;
3. анаболик болон катаболик замыг зохицуулах. ATP ба ADP нь антагонистын үүрэг гүйцэтгэдэг аллостерик эффекторууд;
4. зэрэгцээ болон харилцан уялдаатай бодисын солилцооны замыг зохицуулах (жишээлбэл, нуклейн хүчлийн нийлэгжилтэд ашигладаг пурин ба пиримидин нуклеотидын нийлэгжилт). Тиймээс, эцсийн бүтээгдэхүүнБодисын солилцооны нэг зам нь нөгөө бодисын солилцооны замд аллостерик нөлөө үзүүлж болно.
Аллостерийн ферментийн бүтэц, үйл ажиллагааны онцлог:
1. ихэвчлэн эдгээр нь хэд хэдэн протомераас бүрдэх эсвэл домайн бүтэцтэй олигомер уураг юм;
2. тэдгээр нь катализаторын идэвхтэй төвөөс орон зайн алслагдсан аллостерийн төвтэй;
3. эффекторууд аллостерийн (зохицуулалтын) төвд ковалент бусаар ферменттэй холбогддог;
4. Аллостерийн төвүүд нь каталитик төвүүдтэй адил лигандуудтай харьцуулахад өөр өөр өвөрмөц шинж чанартай байж болно: энэ нь үнэмлэхүй ба бүлэг байж болно.
Зарим ферментүүд хэд хэдэн аллостерийн төвүүдтэй байдаг бөгөөд тэдгээрийн зарим нь идэвхжүүлэгчид, бусад нь дарангуйлагчдад зориулагдсан байдаг;
1. химийн урвал явагддаг идэвхтэй төвийг агуулсан каталитик протомероос ялгаатай нь аллостерийн төв байрладаг протомер нь зохицуулалтын протомер;
2. аллостерийн ферментүүд нь хамтын ажиллагааны шинж чанартай байдаг: аллостерийн эффекторын аллостерийн төвтэй харилцан үйлчлэлцэх нь бүх дэд хэсгүүдийн конформацид дараалсан хамтын өөрчлөлтийг үүсгэж, идэвхтэй төвийн конформацын өөрчлөлт, тэдгээрийн ойр дотно байдал өөрчлөгдөхөд хүргэдэг. ферментийн катализаторын идэвхийг бууруулж эсвэл нэмэгдүүлдэг субстратын фермент;
3. аллостерийн ферментийн зохицуулалт нь буцаах боломжтой: зохицуулалтын дэд нэгжээс эффекторыг салгаснаар ферментийн анхны катализаторын идэвхийг сэргээдэг;
4. Аллостерийн ферментүүд нь тухайн бодисын солилцооны зам дахь гол урвалуудыг хурдасгадаг.
Уураг-уургийн харилцан үйлчлэлээр ферментийн катализаторын үйл ажиллагааг зохицуулах.
Зарим ферментүүд уураг-уургийн харилцан үйлчлэлийн үр дүнд катализаторын үйл ажиллагааг өөрчилдөг.
Уураг-уургийн харилцан үйлчлэлийг ашиглан ферментийг идэвхжүүлэх 2 механизм байдаг.
1. зохицуулалтын уургийн хавсралтын үр дүнд ферментийг идэвхжүүлэх;
2. ферментийн протомеруудын нэгдэл буюу диссоциацийн улмаас ферментийн катализаторын идэвхи өөрчлөгдөх.
Фосфоризаци/дефосфоризациар ферментийн катализаторын үйл ажиллагааг зохицуулах.
Биологийн системд амин хүчлийн үлдэгдлийн ковалент өөрчлөлтийг ашиглан ферментийн үйл ажиллагааг зохицуулах механизм ихэвчлэн олддог. Ферментийн химийн өөрчлөлтийн хурдан бөгөөд өргөн тархсан арга бол фосфоржилт/дефосфоризаци юм. Ферментийн OH бүлгүүд өөрчлөлтөд ордог. Фосфоржилтыг уураг киназын ферментүүд, фосфоржилтыг фосфопротейн фосфатазууд гүйцэтгэдэг. Фосфорын хүчлийн үлдэгдэл нэмэх нь идэвхтэй төвийн конформаци болон түүний катализаторын үйл ажиллагааг өөрчлөхөд хүргэдэг. Энэ тохиолдолд үр дүн нь хоёр талтай байж болно: фосфоржилтын үед зарим фермент идэвхждэг бол зарим нь эсрэгээрээ идэвхгүй болдог.
Ферментийн катализаторын үйл ажиллагааг хэсэгчилсэн (хязгаарлагдмал) протеолизоор зохицуулах.
Эсийн гадна (ходоод гэдэсний зам эсвэл цусны сийвэн дэх) үйл ажиллагаа явуулдаг зарим ферментүүд хэлбэрээр нийлэгждэг. идэвхгүй өмнөхзөвхөн нэг буюу хэд хэдэн тодорхой пептидийн бондын гидролизийн үр дүнд идэвхждэг бөгөөд энэ нь урьдал уургийн молекулын нэг хэсгийг задлахад хүргэдэг. Үүний үр дүнд уургийн молекулын үлдсэн хэсэгт конформацийн өөрчлөлт үүсч, ферментийн идэвхтэй төв (трипсиноген - трипсин) үүсдэг.
Цусны сийвэнгийн ферментүүд
Гарал үүслээр нь цусны сийвэнгийн ферментийг 3 бүлэгт хувааж болно.
1. Цусны сийвэнгийн өөрийн ферментүүд (нууц). Эдгээр нь элгэнд үүсдэг боловч цусанд нөлөө үзүүлдэг. Эдгээрт цусны бүлэгнэлтийн системийн ферментүүд - протромбин, проакцелерин, проконвертин, түүнчлэн церулоплазмин, холинэстераза орно.
2. Шээс ялгаруулах ферментүүд - янз бүрийн шүүрэлээс цус руу ордог - арван хоёрдугаар гэдэсний шүүс, шүлс гэх мэт. Эдгээрт амилаза ба липаза орно.
3. Эсийн ферментүүд - эс, эд эс гэмтэх, устгах үед цус руу ордог.
Хүснэгт 4.1. Эрхтэн өвөрмөц ферментүүд (изоферментүүд)
Энзимопати
Олон өвчин нь эсийн ферментийн үйл ажиллагааны алдагдалд суурилдаг - энзимопати. Олдмол энзимопати нь ерөнхийдөө протеинопати шиг бүх өвчинд ажиглагддаг.
Анхан шатны энзимопатын үед согогтой ферментүүд нь голчлон аутосомын рецессив хэлбэрээр удамшдаг. Гетерозигот нь ихэвчлэн фенотипийн эмгэггүй байдаг. Анхан шатны энзимопати нь ихэвчлэн бодисын солилцооны өвчин гэж ангилагддаг, учир нь бодисын солилцооны тодорхой замууд эвдэрсэн байдаг. Энэ тохиолдолд өвчний хөгжил нь доор жагсаасан "хувилбар" -ын аль нэгийн дагуу үргэлжилж болно. Бодисын солилцооны замын бүдүүвч диаграммыг авч үзье.
E 1 E 2 E 3 E 4
A → B → C → D → P
Дараалсан ферментийн урвалын үр дүнд А бодис нь P бүтээгдэхүүн болж хувирдаг. Аливаа фермент, жишээлбэл Е 3 ферментийн удамшлын дутагдалтай үед бодисын солилцооны янз бүрийн эмгэгүүд үүсч болно.
Эцсийн бүтээгдэхүүн үүсэхийг зөрчих.
Энэхүү бодисын солилцооны замын эцсийн бүтээгдэхүүний дутагдал (синтезийн өөр зам байхгүй тохиолдолд) нь энэ өвчний шинж тэмдэг бүхий эмнэлзүйн шинж тэмдгүүдийн хөгжилд хүргэдэг.
Эмнэлзүйн илрэлүүд.Жишээлбэл, альбинизмыг авч үзье. Альбинизмын үед меланоцит дахь пигментүүд - меланинуудын нийлэгжилт алдагддаг. Меланин нь арьс, үс, цахилдаг, торлог бүрхэвчийн пигмент хучуур эдэд агуулагддаг бөгөөд тэдгээрийн өнгөт нөлөөлдөг. Альбинизмын үед тунгалаг хялгасан судасны улмаас арьсны сул пигментаци, шаргал үстэй, цахилдаг нь улаавтар өнгөтэй байдаг. Альбинизмын илрэл нь меланин үүсэх бодисын солилцооны замыг катализ болгодог ферментүүдийн нэг болох тирозин гидроксилаза (тирозиназа) ферментийн дутагдалтай холбоотой юм.
Урьдчилсан субстратын хуримтлал.
Хэрэв фермент дутагдалтай бол зарим бодисууд хуримтлагдаж, олон тохиолдолд тэдгээрийн өмнөх нэгдлүүд хуримтлагддаг. Гэмтэлтэй ферментийн прекурсоруудын субстратын өсөлт нь олон өвчний хөгжилд тэргүүлэх холбоос болдог.
Эмнэлзүйн илрэлүүд.Алкаптонури өвчин нь мэдэгдэж байгаа бөгөөд энэ нь эд эсэд гомогентисын хүчлийн исэлдэлт алдагддаг (гомогентисын хүчил нь тирозин катаболизмын завсрын метаболит юм). Ийм өвчтөнүүдэд гомогентисын хүчлийн исэлдэлтийн фермент болох гомогентизын хүчлийн диоксигеназын дутагдал ажиглагдаж, өвчний хөгжилд хүргэдэг. Үүний үр дүнд гомогентисын хүчлийн концентраци нэмэгдэж, шээсээр ялгарах нь нэмэгддэг. Хүчилтөрөгч байгаа тохиолдолд гомогентисиний хүчил нь хар нэгдэл - алкаптон болж хувирдаг. Тиймээс ийм өвчтөнүүдийн шээс нь агаарт гарах үед хар өнгөтэй болдог. Алкаптон нь мөн биологийн шингэнд үүсч, эд, арьс, шөрмөс, үе мөчүүдэд тогтдог. Үе мөчний хэсэгт алкаптон их хэмжээгээр хуримтлагдсанаар тэдний хөдөлгөөн мууддаг.
Эцсийн бүтээгдэхүүн үүсэх, прекурсорын субстратын хуримтлал буурах.
Бүтээгдэхүүний дутагдал, анхны субстратын хуримтлал хоёулаа эмнэлзүйн шинж тэмдэг илэрвэл өвчнийг тэмдэглэдэг.
Эмнэлзүйн илрэлүүд.Жишээлбэл, Gierke-ийн өвчин (I хэлбэрийн гликогеноз) өвчтэй хүмүүс хоолны хооронд цусан дахь глюкозын концентраци (гипогликеми) буурдаг. Энэ нь глюкоз-6-фосфатазын ферментийн согогийн улмаас элэг дэх гликоген задралд орсонтой холбоотой юм. Үүний зэрэгцээ, ийм хүмүүст ашиглагдаагүй гликоген хуримтлагдсанаас болж элэгний хэмжээ нэмэгддэг (гепатомегали).
Анагаах ухаанд ферментийн хэрэглээ
Ферментийн бэлдмэлийг анагаах ухаанд өргөн хэрэглэдэг. Эмнэлгийн практикт ферментийг оношилгоо (ферментийн оношлогоо) ба эмчилгээний (фермент эмчилгээний) бодис болгон ашигладаг.
Үүнээс гадна ферментийг хэд хэдэн бодисыг тодорхойлох тусгай урвалж болгон ашигладаг. Тиймээс глюкозын оксидаза нь шээс, цусан дахь глюкозын тоон хэмжээг тодорхойлоход ашиглагддаг. Уреаза ферментийг цус, шээсний мочевины хэмжээг тодорхойлоход ашигладаг. Төрөл бүрийн дегидрогеназыг ашиглан холбогдох субстратуудыг илрүүлдэг, жишээлбэл пируват, лактат, этилийн спирт гэх мэт.
Ферментийн оношлогоо
Ферментийн оношлогоо нь хүний биологийн шингэн дэх ферментийн идэвхийг тодорхойлоход үндэслэн өвчний (эсвэл хам шинж) оношийг тогтоох явдал юм.
Ферментийн оношлогооны зарчмууд нь дараахь байрлалд суурилдаг.
1. цус болон бусад биологийн шингэнд эсүүд гэмтэх үед (жишээлбэл, шээсэнд) гэмтсэн эсийн эсийн доторх ферментийн концентраци нэмэгддэг;
2. ялгарах ферментийн хэмжээ түүнийг илрүүлэхэд хангалттай;
3. эс гэмтсэн үед илэрсэн биологийн шингэн дэх ферментийн идэвхжил нь хангалттай удаан хугацаанд тогтвортой байх ба түүнээс ялгаатай хэвийн утгууд;
4. хэд хэдэн ферментүүд нь тодорхой эрхтнүүдэд давамгайлсан буюу үнэмлэхүй нутагшуулалттай байдаг (эрхтэн өвөрмөц);
5. Хэд хэдэн ферментийн эсийн доторх нутагшуулалтад ялгаатай байдаг.
зэрэг ферментийн хэрэглээ эм
Ферментийг эмчилгээний бодис болгон ашиглах нь дархлаа үүсгэх чадвар өндөртэй тул олон хязгаарлалттай байдаг.
Гэсэн хэдий ч ферментийн эмчилгээг дараахь чиглэлээр идэвхтэй хөгжүүлж байна.
1. орлуулах эмчилгээ - ферментийн дутагдалтай тохиолдолд хэрэглэх;
2. цогц эмчилгээний элементүүд - бусад эмчилгээтэй хослуулан фермент хэрэглэх.
Фермент орлуулах эмчилгээ нь хоол боловсруулах эрхтний шүүсний шүүрлийн дутагдалтай холбоотой ходоод гэдэсний өвчинд үр дүнтэй байдаг. Жишээлбэл, пепсиныг ачили, гипо- болон хүчиллэг ходоодны үрэвсэлд хэрэглэдэг. Нойр булчирхайн ферментийн дутагдлыг нойр булчирхайн гол ферментүүд (фестал, энзистал, мезим-форте гэх мэт) агуулсан эмийг залгих замаар нөхөж болно.
Ферментийг хэд хэдэн өвчинд нэмэлт эмчилгээний бодис болгон ашигладаг. Амьсгалын замын үрэвсэлт өвчний үед үхсэн эсийн уураг задлах, цусны өтгөрөлт, наалдамхай шүүрлийг арилгах зорилгоор протеолитик ферментүүд (трипсин, химотрипсин) нь идээт шархыг эмчлэхэд орон нутгийн хэмжээнд ашиглагддаг. Ферментийн бэлдмэлүүд нь тромбоз, тромбоэмболизмд өргөн хэрэглэгддэг болсон. Энэ зорилгоор фибринолизин, стрептолиаз, стрептодеказа, урокиназын бэлдмэлүүдийг хэрэглэдэг.
Гиалуроны хүчлийн задралыг хурдасгадаг гиалуронидаза (лидаза) ферментийг түлэгдэлт, мэс заслын дараах сорвийг арилгахын тулд арьсан дор болон булчинд тарьж хэрэглэдэг (гиалуроны хүчил нь холбогч эдэд хөндлөн холбоос үүсгэдэг).
Хорт хавдрын үед ферментийн бэлдмэлийг хэрэглэдэг. Аспарагины катаболизмын урвалыг хурдасгадаг аспарагиназа нь лейкемийн эмчилгээнд хэрэглэхийг олсон.
Аспарагиназын эсрэг лейкемийн нөлөө үзүүлэх урьдчилсан нөхцөл нь лейкемийн эсүүдэд аспарагины синтезийн урвалыг хурдасгадаг аспарагин синтетаза ферментийг илрүүлсэн явдал байв.
Лейкемийн эсүүд аспарагиныг нэгтгэж, цусны сийвэнгээс гаргаж авах боломжгүй байдаг. Хэрэв цусны сийвэн дэх аспарагиныг аспарагиназын нөлөөгөөр устгадаг бол лейкемийн эсүүдэд аспарагины дутагдал үүсч, улмаар эсийн бодисын солилцоо тасалдаж, өвчний явцыг зогсооно.
Хөдөлгөөнгүй ферментүүд нь хатуу тулгуурт холбогдсон эсвэл полимер капсулд байрлуулсан ферментүүд юм.
Ферментийг хөдөлгөөнгүй болгохын тулд хоёр үндсэн аргыг ашигладаг.
1. Ферментийн химийн өөрчлөлт.
2. Инерцийн материал дахь ферментийн физик тусгаарлалт.
Ихэнхдээ липидийн капсулууд - липосомууд нь мембранаар амархан нэвтэрч, эсийн дотор шаардлагатай нөлөө үзүүлдэг ферментийг хөдөлгөөнгүй болгоход ашиглагддаг.
Хөдөлгөөнгүй ферментийн давуу талууд:
1. Ферментийг дахин ашиглах боломжийг олгодог урвалын орчноос амархан тусгаарлагдсан. Бүтээгдэхүүн нь ферментээр бохирдоогүй.
2. Ферментийн процессыг тасралтгүй явуулж болно.
3. Ферментийн тогтвортой байдал нэмэгддэг.
Хөдөлгөөнгүй ферментийг аналитик болон бэлтгэлийн зорилгоор ашиглаж болно. Хөдөлгөөнгүй ферментийг аналитик зорилгоор ашигладаг хэд хэдэн төрлийн төхөөрөмж байдаг - фермент электрод, автомат анализатор, туршилтын систем гэх мэт.
Хөдөлгөөнгүй ферментийг үйлдвэрлэлд бэлтгэх:
1. Аминоацилаза ашиглан L-амин хүчлийг бэлтгэх.
2. Глюкоз изомераза ашиглан өндөр фруктозын сироп үйлдвэрлэх.
Ферментийн идэвхжил нь янз бүрийн нөлөөн дор өөрчлөгдөж болно гадаад хүчин зүйлүүд. Ферментийн үйл ажиллагаанд нөлөөлж болох бодисуудыг дараах байдлаар нэрлэнэ фермент модуляторууд. Хариуд нь модуляторуудыг хоёр бүлэгт хуваадаг.
1. Идэвхжүүлэгчид. Тэдний нөлөөн дор ферментийн үйл ажиллагаа нэмэгддэг. Металл катионууд нь идэвхжүүлэгчийн үүрэг гүйцэтгэдэг. Жишээлбэл, Na + нь хүний шүлсний булчирхайн амилазыг идэвхжүүлэгч юм.
2. Дарангуйлагчид.Нөлөөллийн дор ферментийн идэвхжил буурдаг бодисууд.
Дарангуйлагчид төлөөлдөг том бүлэгдарангуйлах үйл ажиллагааны механизмаар ялгаатай бодисууд.
Дарангуйлагч нөлөө үзүүлэх хугацаанаас хамааран дарангуйлагчдыг дараахь байдлаар хуваана.
· эргэлт буцалтгүй(ферменттэй харьцахдаа ферментийн үйл ажиллагааг бүрмөсөн хасдаг);
· буцаах боломжтой(энэ нь ферментийн үйл ажиллагааг түр бууруулдаг).
Эргэшгүй дарангуйлагчдын үйл ажиллагааны механизмыг дараахь томъёогоор тодорхойлж болно.
онд + Э EIn,
Хаана EIn– катализаторын шинж чанаргүй ингибитор бүхий ферментийн цогцолбор.
Дүрмээр бол эргэлт буцалтгүй дарангуйлагчид нь ферментийн идэвхтэй хэсгийн функциональ бүлгүүдтэй харилцан үйлчилдэг. Тэд ковалент байдлаар холбогдож, улмаар тэднийг хаадаг. Үүний үр дүнд фермент нь субстраттай харилцах чадвараа алддаг.
Эргэшгүй дарангуйлагчдын сонгодог жишээ бол фосфор юм органик бодис. Диизопропил фторофосфат (DFP) нь биохимийн судалгаанд олон жилийн турш ашиглагдаж ирсэн. Органофосфорын нэгдлүүд нь ферментийн идэвхтэй хэсэгт сериний үлдэгдэлтэй нийлдэг.
 |
Идэвхтэй хэсэгт серин агуулсан ферментүүд нь холинэстераза, трипсин, эластаза гэх мэт.
Бусад эргэлт буцалтгүй дарангуйлагчийн хувьд алкилизаторыг өргөн хэрэглэдэг. Эдгээр нэгдлүүд нь идэвхтэй талбайд цистеин эсвэл имидасал гистидиний радикалуудын SH бүлгүүдтэй харилцан үйлчилдэг. Иодацетамидын ферментийг эргэлт буцалтгүй дарангуйлах механизм:

Иодоацетамид, моноиодоацетат гэх мэтийг биохимид эргэлт буцалтгүй дарангуйлагч болгон алкилизатор болгон ашигладаг.
Аргагүй дарангуйлах үзэгдлийг үндэсний эдийн засаг, анагаах ухаанд ашигладаг. Энэ нь шавьж устгах бодис (шавьж устгах бодис) болон зарим эм (антихолинестеразын эм) хэрэглэх үндэс суурь болдог. Тэдгээрийн үндсэн дээр органик фосфорын нэгдлүүдийн бүлгийн мэдрэл-саажилттай химийн дайны бодисуудыг бий болгосон.
Эргэшгүй дарангуйлагчаас ялгаатай нь эргэлт буцалтгүй дарангуйлагчид ферментийн үйл ажиллагааг зөвхөн тодорхой хугацаанд бууруулдаг. Тэдний дарангуйлах нөлөөний механизмыг дараахь урвалын тэгшитгэлээр илэрхийлж болно.
онд+ Э EIn
онд + ES ESIn
Оруулсан урвалын тэгшитгэлээс харахад урвуу дарангуйлагчид фермент эсвэл фермент-субстратын цогцолборт урвуу байдлаар холбогддог. Энэ тохиолдолд фермент нь катализаторын шинж чанараа алддаг.
Дарангуйлах нөлөөллийн механизмын дагуу урвуу дарангуйлагчдыг дараахь байдлаар хуваана өрсөлдөх чадвартайТэгээд өрсөлдөх чадваргүй,ферментийг дарангуйлах нөлөөллийн механизмаараа бие биенээсээ ялгаатай.
Өрсөлдөөнгүй дарангуйлах үед дарангуйлагч нь ферментийг идэвхтэй газраас өөр газар руу буцаах замаар холбодог. Энэ тохиолдолд идэвхтэй төвийн конформаци өөрчлөгддөг бөгөөд энэ нь ферментийг урвуу идэвхгүй болгоход хүргэдэг. Өрсөлдөөнт дарангуйлагчийн нөлөөн дор ферментийн субстраттай холбоотой байдал өөрчлөгддөггүй, өөрөөр хэлбэл. үнэ цэнэ өөрчлөгдөхгүй TOм, гэхдээ ферментийн урвалын хамгийн их хурд буурдаг ( Вхамгийн их). Бодисын солилцооны завсрын бодисууд нь өрсөлдөх чадваргүй дарангуйлагчийн үүрэг гүйцэтгэдэг.
Өрсөлдөх чадвартай дарангуйлагчдын молекулууд нь ферментийн жинхэнэ субстраттай тодорхой төстэй байдаг. Өрсөлдөх чадвартай дарангуйлагчийн сонгодог жишээ бол сукцинатдегидрогеназа ферментийн идэвхийг бууруулж буй малоны хүчил юм.
Сукциний хүчил Малоны хүчил
Үзүүлсэн томъёоноос харахад малоны хүчил нь бүтэцээрээ сукциний хүчилтэй маш төстэй болох нь тодорхой байна. Бүтцийн ижил төстэй байдал нь малоны хүчил нь ферментийн сукцинатдегидрогеназын идэвхтэй хэсэгт холбогдох боломжийг олгодог. Гэсэн хэдий ч энэ нэгдэл нь энэ ферментийн катализаторын урвалд орох боломжгүй (усгүйжүүлэх урвал). Тиймээс дарангуйлагч нь ферментийн идэвхтэй хэсэгт наалдаж, улмаар түүний жинхэнэ субстраттай харилцан үйлчлэх боломжийг хаадаг. Ийнхүү өрсөлдөх чадвартай дарангуйлагчийн нөлөөн дор ферментийн субстраттай холбоотой байдал огцом буурдаг (үнэ цэнэ нэмэгддэг). TO m), гэхдээ утга өөрчлөгдөхгүй Вхамгийн их. Урвалын хольц дахь субстратын концентрацийг огцом нэмэгдүүлэх замаар өрсөлдөөнийг дарангуйлах үзэгдлийг арилгаж болно.
Тиймээс өрсөлдөөнт дарангуйлагчид нь өрсөлдөх чадваргүй дарангуйлагчдаас ялгаатай нь ферментийн идэвхтэй төвтэй холбогддог бөгөөд ингэснээр үнэ цэнэ нь огцом нэмэгддэг. TO m субстрат руу, түүний үйл ажиллагааны эргэлт буцалтгүй бууралтын үндэс суурь болдог.
Оксалик-цууны хүчил нь сукцинатдегидрогеназын физиологийн өрсөлдөх чадвартай дарангуйлагчийн үүрэг гүйцэтгэдэг. Үзүүлсэн зургаас харахад энэхүү бодисын солилцооны завсрын бүтээгдэхүүн нь сукцины хүчилтэй тодорхой бүтцийн ижил төстэй байдаг. Оксалик-цууны хүчлээр сукцинат дегидрогеназыг өрсөлдөөнт дарангуйлах нь митохондри дахь исэлдэлтийн өөрчлөлтийг зохицуулахад чухал үүрэг гүйцэтгэдэг.

Ферментийн үйл ажиллагааг зохицуулах өөр нэг төрөл байдаг - аллостерийн зохицуулалт. Энэ нь ферментийн тусгай бүлгийн онцлог шинж юм. аллостерийн ферментүүд. Аллостерийн ферментүүд нь бүтэц нь зохицуулалтын (аллостерийн) төвүүдийг агуулдаг олигомер уураг агуулдаг.
Аллостерийн ферментийн молекулууд нь хоёр төрлийн дэд нэгжийг агуулдаг.
1) катализатор(ХАМТ);
2) зохицуулалт (Р).
Каталитик дэд нэгжүүд нь ферментийн идэвхтэй төв байрладаг полипептидийн гинжээр илэрхийлэгддэг. Зохицуулах дэд нэгжүүд нь тэдгээрийн бүтцэд зохицуулалтын (аллостерик) төвийг агуулдаг. Аллостерийн төвнь фермент зохицуулагчтай тусгайлан харилцан үйлчлэх боломжтой молекулын хэсэг юм. Үүний дагуу зохицуулагчид ферментийг идэвхжүүлэгч ба дарангуйлагчийн үүрэг гүйцэтгэдэг.
Аллостерийн зохицуулагчийг зохицуулалтын төвтэй холбох нь түүний молекулын аллостерийн төвтэй стерик харгалзах замаар үүсдэг. Зохицуулагчийн молекулын гадаргуугийн геометрийн ижил төстэй байдал ба аллостерийн төвийн гурван хэмжээст бүтцийн улмаас тэдгээрийн хооронд урвуу өвөрмөц харилцан үйлчлэл үүсдэг. Сул харилцан үйлчлэлийн хүчээр тогтворжсон цогцолбор үүсдэг. Энэ тохиолдолд Ван дер Ваалсын хүч онцгой ач холбогдолтой юм. Тэдгээрээс гадна устөрөгчийн холбоо, түүнчлэн гидрофобик ба электростатик харилцан үйлчлэл нь аллостерийн төвтэй зохицуулагчийн цогцолборыг тогтворжуулахад оролцдог.
Уургийн молекул дахь аллостерийн дарангуйлагчтай ферментийн харилцан үйлчлэлийн үр дүнд зохицуулалтын дэд нэгжийн полипептидийн гинжин хэлхээнд конформацийн шилжилт үүсдэг. Тэдний илрэл нь харилцан үйлчлэлд нөлөөлдөг ХАМТ- Тэгээд Р- дэд нэгжүүд. Үүний үр дүнд катализаторын дэд нэгжийн полипептидийн гинжин хэлхээний хэлбэр нь хоёр дахь удаагаа өөрчлөгддөг. Ийм бүтцийн өөрчлөлт нь идэвхтэй төвийн бүтцэд өөрчлөлтүүд дагалддаг бөгөөд энэ нь субстраттай идэвхтэй төвийн хамаарал буурахад хүргэдэг (үнэ цэнэ нэмэгдэх). TO m), энэ нь ферментийн дарангуйллыг тодорхойлдог (Зураг 33).

Зураг 33 – Ферментийн аллостерик дарангуйлах механизм
Аллостерийн дарангуйлагчийг аллостерийн төвд хавсаргах нь ферментийн катализаторын дэд нэгж дээрх идэвхтэй төвийн конформацийг өөрчлөх, субстраттай харьцах харьцаа буурахад хүргэдэг.
Аллостерик дарангуйлал нь буцах боломжтой. Цогцолборын салалт Р-Дарангуйлагчтай дэд нэгжүүд нь дэд хэсгүүдийн полипептидийн гинжин хэлхээний анхны хэлбэрийг сэргээж дагалддаг бөгөөд үүний үр дүнд субстраттай идэвхтэй төвийн ойр дотно байдал сэргээгддэг.
Ихэнх тохиолдолд аллостерийн дарангуйлагчийн үүрэг нь фермент оролцдог урвал эсвэл бодисын солилцооны замын бүтээгдэхүүн юм. Урвалын бүтээгдэхүүнээр ферментийг дарангуйлах үйл явцыг гэнэ retroinhibition.
Retroinhibition нь бодисын солилцооны үйл явцыг зохицуулах, гомеостазыг хадгалахад сөрөг хариу урвалын механизмын үндэс суурь болдог. Энэ нь эс дэх янз бүрийн бодисын солилцооны завсрын бүтээгдэхүүнийг тогтмол түвшинд байлгах боломжийг олгодог. Глюкоз-6-фосфатын урвалын бүтээгдэхүүнээр гексокиназыг дарангуйлах нь ретроингибиторын жишээ юм.

Зарим тохиолдолд дарангуйлал нь урвалын эцсийн бүтээгдэхүүн биш, харин урвал явагдах үйл явцын эцсийн бүтээгдэхүүнээс шалтгаална. Ферментийн ретроинг дарангуйлал Э P процессын бүтээгдэхүүн:

Энд B, C, D, D нь завсрын бүтээгдэхүүн юм.
Энэхүү хувиргалтын дарааллаар ферментийн аллостерик дарангуйлагч юм Эүйл явцын бүтээгдэхүүн юм Р. Retroinhibition-ийн ижил төстэй механизм нь эсүүдэд өргөн тархсан байдаг. Үүний нэг жишээ бол өөх тосны хүчлийн нийлэгжилтийн эцсийн бүтээгдэхүүн болох пальмитийн хүчлээр өндөр өөх тосны хүчлүүдийн нийлэгжилтэнд оролцдог ацетил-КоА карбоксилаза ферментийг дарангуйлах явдал юм.
Тэд аллостерийн ферментүүд дээр ижил төстэй боловч эсрэгээр ажилладаг аллостерийн идэвхжүүлэгчид. Идэвхжүүлэгч байхгүй тохиолдолд фермент нь субстратад бага хамааралтай байдаг. Гэсэн хэдий ч аллостерийн төв нь идэвхжүүлэгчтэй нэгдэх үед субстратын каталитик төвийн хамаарал нэмэгдэж, субстратын хувиргах хурд нэмэгддэг. Урвалын субстратын молекул нь ихэвчлэн аллостерийн идэвхжүүлэгчийн үүрэг гүйцэтгэдэг. Энэ нь биологийн гүн утгатай. Эс дэх субстратын агууламж нэмэгдэж байгаа нөхцөлд дотоод орчныг тогтмол байлгахын тулд түүнийг зайлуулах шаардлагатай байдаг. Энэ нь түүний хувиргалтыг хурдасгадаг ферментийг идэвхжүүлснээр хүрдэг. Ийм идэвхжүүлэлтийн жишээ нь глюкозоор глюкокиназын идэвхжүүлэлт юм.
Субстрат нь идэвхжүүлэгчийн үүрэг гүйцэтгэдэг аллостерийн ферментийг гомотроп гэж нэрлэдэг. Эдгээр ферментүүд нь ижил бүтэцтэй хэд хэдэн субстрат холбох төвтэй бөгөөд эдгээр нь нөхцлөөс хамааран ферментийн зохицуулалтын болон катализаторын аль алиныг нь гүйцэтгэдэг.
Гомотроп ферментээс ялгаатай нь гетеротроп ферментүүд байдаг. Сүүлийнх нь бүтэц нь субстратаас ялгаатай модулятороор зохицуулагддаг. Тиймээс тэдгээрийн бүтцэд бүтцийн хувьд эрс ялгаатай байдаг идэвхтэйТэгээд аллостериктөвүүд.
Ихэнхдээ ижил аллостерийн фермент нь хэд хэдэн өөр өөр модуляторуудтай харьцах чадвартай байдаг - идэвхжүүлэгч ба дарангуйлагч. Үүний жишээ бол дараах урвалыг хурдасгадаг фермент фосфофрктокиназа (PPK) юм.
Энэ тохиолдолд өөр өөр модуляторууд нь дүрмээр бол ферментийн молекул дээр өөрийн гэсэн холбох газруудтай байдаг.
Гомотроп ферментийн кинетик нь аллостерийн бус ферментүүдийн кинетикээс ялгаатай. Урвалын хурд нь субстратын концентрацаас хамаарах график нь гипербол биш, харин сигмоид хэлбэртэй байна (Зураг 34).

Зураг 34 – Гомотроп ферментийн кинетик
Энэ шалтгааны улмаас тооцоолох TOМихаэлис-Ментенийн тэгшитгэл нь тэдний хувьд хүлээн зөвшөөрөгдөхгүй.
Аллостерийн ферментийн кинетикийн сигмоид шинж чанар нь ферментийн бие даасан дэд хэсгүүдийн субстраттай харилцан үйлчлэлийн тусгай хамтын шинж чанартай холбоотой юм. Дараагийн субстратын молекул бүрийг холбох газартай холбох нь хөрш зэргэлдээх дэд хэсгүүдэд конформацийн өөрчлөлтийг бий болгоход хувь нэмэр оруулдаг бөгөөд үүний үр дүнд тэдгээрийн субстраттай ойр дотно байдал нэмэгддэг.
Изоферментүүд
Эсийн доторх бодисын солилцооны үйл явцыг үр дүнтэй явуулахад чухал ач холбогдолтой изоферментүүд. Изоферментүүд нь ижил урвалыг хурдасгадаг, гэхдээ өөр өөр бүтэц, физик-химийн шинж чанартай ферментийн олон хэлбэрийг генетикийн хувьд тодорхойлдог.
Изоферментээр илэрхийлэгддэг ердийн фермент бол лактат дегидрогеназа (LDH) юм. Энэ фермент нь дараах урвалыг хурдасгадаг.
Хүний цусны ийлдсийн электрофорез нь цусан дахь лактат дегидрогеназын урвалыг хурдасгах чадвартай таван өөр уургийн фракцыг илрүүлдэг. Тиймээс бид таван LDH изоэнзим байдаг гэсэн дүгнэлтэд хүрч болно (Зураг 35).

Зураг 35 – Электрофорограмм дээрх LDH изоферментийн тархалт (электрофорезыг рН 6.8-д хийдэг)
Изоферментийн оршин тогтнох үзэгдлийг тайлбарлахад маш чухал ач холбогдолтой зүйл бол изоферментүүд зөвхөн фермент болох олигомер уурагт байдаг явдал юм. Тэдний молекул нь дор хаяж хоёр дэд нэгжээс бүрдэнэ.
LDH-ийн хувьд энэ фермент нь тетрамер, i.e. түүний молекул нь дөрвөн тусдаа дэд нэгжийг агуулдаг. LDH-ийн хоёр төрлийн дэд хэсэг байдаг - M-төрөл (булчин) ба H-төрөл (зүрх). Дэд нэгж нь полипептидийн гинж бөгөөд бүтэц нь изоферментүүдийн генетик шинж чанарыг тодорхойлдог харгалзах генээр кодлогдсон байдаг. Дэд нэгжийн полипептидүүд нь янз бүрийн генийн бүтээгдэхүүн учраас тэдгээр нь:
· өөр өөр амин хүчлийн найрлага (анхдагч бүтэц);
· тэгш бус физик, химийн шинж чанар (электрофоретик хөдөлгөөн);
· янз бүрийн эдэд синтезийн онцлог.
Бүтцийн ялгаатай байдлаас шалтгаалан изоферментүүд нь кинетик (субстратын хамаарал), үйл ажиллагааны зохицуулалтын онцлог, түүнчлэн эукариот эсийн нутагшуулалт, дээд организмын эд эсийн өвөрмөц шинж чанараараа ялгаатай байдаг.
Тетрамерын найрлагад LHD молекулууд багтаж болно янз бүрийн төрөлөөр өөр харьцаатай дэд нэгжүүд. Тетрамер үүсэх үед дараах дэд нэгжүүдийн хослол боломжтой.

Энэ шалтгааны улмаас яг таван LDH изоэнзим байдаг шалтгаан нь тодорхой болсон: LDH 1 нь хамгийн бага электрофорез хөдөлгөөнтэй, LDH 5 нь хамгийн их байдаг.
LDH изоферментийн генүүд нь янз бүрийн эдэд өөр өөрөөр илэрхийлэгддэг: зүрхний булчинд зөвхөн H хэлбэрийн дэд нэгж нийлэгждэг. Тиймээс энд зөвхөн LDH 1 үүсдэг бөгөөд энэ нь зөвхөн энэ төрлийн дэд хэсгүүдээс бүрддэг. Элгэнд болон араг ясны булчингуудЗөвхөн M төрлийн дэд нэгжийг нэгтгэдэг. Тиймээс зөвхөн M дэд нэгжээс бүрдэх LDH 5 изоэнзим л үүсч, энд ажилладаг. Бусад эдэд хамт өөр өөр хурдтай H ба M дэд нэгжийг хоёуланг нь кодлодог генүүд илэрхийлэгддэг. Тиймээс тэдгээрийн дотор LDH изоэнзимийн янз бүрийн завсрын хэлбэрүүд (LDG 2 - DG 4) үүсч болно.
Дэд хэсгүүд нь өөр өөр байдаг тул амин хүчлийн найрлага, тэдгээр нь өөр өөр молекул жинтэй ба цахилгаан цэнэг. Энэ нь тэдний янз бүрийн физик-химийн шинж чанарыг тодорхойлдог.
Физик-химийн шинж чанаруудын ялгаатай байдлаас гадна изоферментүүд нь каталитик шинж чанараараа ихээхэн ялгаатай байдаг (кинетик үзүүлэлтүүд: тэдгээр нь өөр өөр хурдаар тодорхойлогддог ( Вмакс) ба субстратын хамаарал ( TO m), түүнчлэн янз бүрийн зохицуулагчдын үйлдэлд мэдрэмтгий байдал).
Тиймээс LDH нь 1 утгатай байна TOсүүн хүчлийн хувьд m нь 0.0044 байна М, харин LDH 5 - 0.0256 М. Мочевин нь LDH 5-ийн эсрэг дарангуйлах шинж чанартай боловч LDH 1-д ямар ч нөлөө үзүүлэхгүй. Энэ тохиолдолд LDH 1-ийн дарангуйлагчийн үүрэг гүйцэтгэдэг пирувийн хүчил, энэ нь LDH 5-д ижил төстэй нөлөө үзүүлэхгүй.
Тиймээс изоферментүүд нь бүтэц, шинж чанараараа ялгагддаг бөгөөд тэдгээрийн оршин тогтнох нь генетикийн хувьд тодорхойлогддог. Энэ нь изоферментийн биологийн боломжийн талаар асуулт гарч ирдэг.
Энэ асуудлыг ойлгохын тулд эукариот эсийн янз бүрийн хэсгүүд (тасалгаанууд), түүнчлэн олон эсийн организмын янз бүрийн эдэд өөр өөр нөхцөл байдал байдаг гэдгийг санах нь зүйтэй. Эдгээр нь ижил субстрат ба хүчилтөрөгчийн тэгш бус концентрацийг агуулдаг. Тэдгээр нь өөр өөр рН-ийн утгаар тодорхойлогддог ионы найрлага. Тиймээс өөр өөр эд эсийн эсүүд, түүнчлэн эсийн өөр өөр хэсгүүдэд ижил химийн өөрчлөлтүүд өөр өөр нөхцөлд явагддаг. Үүнтэй холбогдуулан катализаторын болон зохицуулалтын шинж чанарын ялгаатай изоферментүүд байдаг
1) өөр өөр нөхцөлд ижил үр ашигтай ижил химийн хувиргалтыг хийх;
2) харгалзах эсийн тасалгаа болон өөр өөр эдэд зохицуулагчдын тархалтын шинж чанарын дагуу катализаторын хувиргалтын нарийн зохицуулалтыг хангах.
Үүнийг карбамойл фосфатын синтазын цитоплазм ба митохондрийн изоферментүүдийн шинж чанарын онцлогоор дүрсэлж болно. Энэ фермент нь карбамойл фосфатын нийлэгжилтийг хурдасгадаг.
Митохондрид үүссэн карбамойл фосфат нь митохондрийн изоферментийн нөлөөн дор мочевин үүсэх үйл явцад оролцдог бөгөөд цитоплазмын изоферментийн нөлөөн дор үүссэн карбамойл фосфатыг пиримидин нуклеотидын нийлэгжилтэд ашигладаг. Мэдээжийн хэрэг, огт өөр бодисын солилцооны үйл явцтай холбоотой эдгээр ферментүүд нь орон зайн хувьд тусгаарлагдсан бөгөөд өөр өөр катализатор, зохицуулалтын шинж чанартай байдаг. Тэдний нэг эсэд байх нь нэг прекурсорыг ашиглахтай холбоотой хоёр өөр процесс нэгэн зэрэг явагдах боломжийг олгодог.
Тиймээс изоферментийн оршин тогтнох нь биологийн чухал ач холбогдолтой бөгөөд ижил ферментийн үйл явц өөр өөр нөхцөлд явагдах боломжтой бөгөөд энэ шалтгааны улмаас генетикийн хувьд тодорхойлогддог.
Хяналтын асуултууд
1. Фермент ба уургийн бус катализаторын ижил төстэй болон ялгаатай талууд юу вэ?
2. Ферментийн үндсэн ангиллыг жагсааж, тэдгээрийн шинж чанарыг тодорхойлно уу.
3. Орчин үеийн олон улсын ферментийн нэршил юунд үндэслэсэн бэ?
4. Урвалын энергийн саад гэсэн ойлголтыг тодорхойл.
5. Ферментүүд урвалын энергийн саадыг багасгах механизмын талаар ямар үзэл бодол байдаг вэ?
6. Михаэлисын тогтмол ба хамгийн их урвалын хурдын физик утга нь юу вэ?
7. Михаэлисын тогтмол ба хамгийн их урвалын хурдыг ямар нэгжээр хэмжих вэ?
8. Урвалын хольцын температур хамгийн оновчтой температур хүртэл нэмэгдэхэд ферментийн урвалын хурд яагаад нэмэгддэг вэ?
9. Ферментийн өвөрмөц байдлын ямар төрлийг та мэдэх вэ? Ферментийн өвөрмөц чанар юу вэ?
10. Ферментийн идэвхжил яагаад орчны рН-ээс хамаардаг вэ? Энэ хүчин зүйлээс аль ферментийн идэвхжил хамгийн их хамааралтай вэ?
11. Ферментийн тоон тодорхойлох ямар аргуудыг та мэдэх вэ?
12. Ферментийн идэвхийг хэрхэн хэмждэг вэ?
13. Урвуу ба эргэлт буцалтгүй дарангуйлагчдын үндсэн ялгаа нь юу вэ?
14. Өрсөлдөөнт дарангуйлагч гэж юу вэ? Та ямар өрсөлдөөнт дарангуйлагчийг мэдэх вэ?
15. Аллостерик дарангуйлах механизм юу вэ?
16. Энэ юу вэ? биологийн боломжизоферментүүд байгаа эсэх?
17. Изоферментийн хуваагдлын ямар аргуудыг та мэдэх вэ?
Бүлэг 6. ВИТАМИН
Витаминхэвийн бодисын солилцоог хангахын тулд бага хэмжээгээр шаардлагатай органик бодис гэж нэрлэдэг ба физиологийн функцууд, бие махбодид нийлэгждэггүй бөгөөд хүнсний чухал бүрэлдэхүүн хэсэг юм.
Биеийн амин чухал үйл ажиллагааг хангах витамины хэрэгцээ нь тэдний ихэнх нь коэнзим үүсэхэд оролцдогтой холбоотой юм. Каталитик үйл явцын хэвийн явцыг хангахын тулд химийн урвалын явцад хэрэглэдэггүй маш бага хэмжээний ферментүүд шаардлагатай байдаг тул витамин нь биед маш бага хэмжээгээр шаардлагатай байдаг.
Одоогийн байдлаар 20 гаруй витаминыг мэддэг. Тэдний гол эх сурвалжууд нь:
· амьтан, ургамлын гаралтай хүнс;
бүдүүн гэдэсний сапрофит микрофлор;
· провитаминууд.
ПровитаминуудЭдгээр нь витамины урьдал бодис бөгөөд тэдгээрээс идэвхтэй витаминууд бие махбодид янз бүрийн аргаар үүсдэг. Үүнд каротин (провитамин А), 7-дегидрохолестерол (провитамин D) гэх мэт.
Витаминаас гадна тусгай бүлэг байдаг витаминтай төстэй бодисууд. Эдгээр бодисууд нь витамины шинж чанартай боловч хүний биед нийлэгждэг. Үүнд карнитин, инозитол, липоидын хүчил, холин, пангамийн хүчил, витамин U гэх мэт витаминтай төстэй бодисууд нь харгалзах зүйлийн организмд витамины шинж чанарыг харуулдаг.
Витаминуудаас гадна бүлгийн бодисууд байдаг - антагонистууд нь нэр томъёогоор тодорхойлогддог антивитамин. Эдгээрт витаминаас эсрэг үйлчилгээ үзүүлдэг бодисууд орно.
Антивитаминыг үзүүлэх нөлөөний механизмаас хамааран хоёр бүлэгт хувааж болно.
1. Витаминыг устгадаг ферментүүд. Энэ бүлгийн төлөөлөгчдийн жишээнд тиаминаза (В1 витаминыг хувиргах фермент), аскорбат оксидаза (витамин С-ийн хувиргалтыг хурдасгадаг фермент) гэх мэт орно.
2. Витаминтай төстэй бүтэцтэй бодисууд, тэдгээрийн улмаас тэд витаминтай өрсөлдөхүйц харилцаанд орох боломжтой байдаг нийтлэг холбох газрууд . Энэ бүлэгт витамин деривативууд (окситиамин гэх мэт) багтдаг.
Витамин хэрэгцээ нь олон янзын шалтгаанаас хамаардаг. Үүнд хүйс, нас, улирал, газарзүйн өргөрөг, биеийн байдал, ажлын шинж чанар, эрүүл мэндийн байдал гэх мэт.
Биеийн витамины хэрэгцээ ба түүний биед орох түвшин хоёрын хоорондын уялдаа холбоог зөрчсөн тохиолдолд витамины тэнцвэргүй байдал үүсдэг. Витамин тэнцвэргүй байдлын илрэл нь дараахь зүйлийг агуулж болно.
гиповитаминоз;
· avitaminosis;
· гипервитаминоз.
Гиповитаминозбие дэх витамины агууламж буурах нөхцөлүүд юм. Хоёр үндсэн бүлэг шалтгаан байдаг ( гаднаТэгээд дотоод) тэдгээр нь үүсэхэд хүргэдэг.
1. Гадны шалтгаан нь хоол хүнсээр бие махбодид витамины хангамж буурахад хүргэдэг шалтгаанууд (мацаг барих, бага хэмжээний витамин агуулсан хоол идэх, буруу болгосон).
2. Дотоод шалтгаан нь тодорхой нөхцөлд (хүүхэд нас, жирэмслэлт, бие махбодийн хүнд хөдөлмөр, стресс болон төрөл бүрийн дотоод өвчин) витамины хэрэгцээ ихсэх, эсвэл бие махбодид витамин шингээх чадвар муудсантай холбоотой (биеийн гэмтэлтэй холбоотой янз бүрийн өвчинтэй холбоотой). ходоод гэдэсний зам).
Гиповитаминоз нь нэлээд өргөн тархсан байдаг. Тэд хаврын улиралд ялангуяа түгээмэл байдаг.
Витамин дутагдалгиповитаминозын эрс тэс хэлбэрийг илэрхийлдэг. Эдгээр нь бие махбодоос тодорхой витамин алга болж тодорхойлогддог. Ихэнх тохиолдолд витамины дутагдлын шалтгаан нь хоол хүнсээр бие махбодид орох витаминыг зогсоох явдал юм. Одоогийн байдлаар энэ нөхцөл байдал нэлээд ховор тохиолддог. Энэ нь эрс тэс нөхцөлд ажилладаг хүмүүсийн бүлэгт (цэрэг, геологич, далайчин гэх мэт) тохиолдож болно.
Гипервитаминозбие махбод дахь витамины агууламж нэмэгдэх нөхцөл юм. Тэдний үүсэх шалтгаан нь ихэвчлэн хоол хүнснээс витамины хэрэглээ нэмэгдэх явдал юм. Өөх тосонд уусдаг витамины хувьд гипервитаминоз үүсэх нь хамгийн түгээмэл байдаг. Энэ нь тодорхой витаминаар баялаг хоол хүнс удаан хугацаагаар хэрэглэх, түүнчлэн витамины бэлдмэлийг хэтрүүлэн хэрэглэх үед тохиолдож болно.
Витаминуудын ангилал
Суурь орчин үеийн ангилалВитамин нь уусах чадвараас хамаардаг. Үүний үндсэн дээр бүх витаминыг дараахь байдлаар хуваана.
· тосонд уусдаг- A, D, E, K, F, Q витаминууд;
· усанд уусдаг– бүлгийн витаминууд (B 1, B 2, B 3, B 5, B 6, B 12, B c), түүнчлэн PP, C, H, rutin.
Өөх тосонд уусдаг витаминууд
Энэ бүлгийн витамин нь хэд хэдэн шинж чанартай байдаг ерөнхий шинж чанарууд:
1. Өөх тосонд уусдаг олон витаминуудын бүтцэд изопрен молекулын үлдэгдэл орно. Тэдгээр нь тодорхой урттай гинжээр хоорондоо холбогддог бөгөөд энэ нь өөхөнд уусдаг витамины усанд уусдаггүй, харин эсрэгээр нь органик уусгагчид сайн уусдаг.
2. Өөхөнд уусдаг витамины шимэгдэлтийг хангахын тулд хангалттай хэмжээгээр байх шаардлагатай. цөсний хүчилгэдэс дотор, түүнчлэн хангалттай хэмжээний өөх тос, тэдгээрийн уусгагч, хоол хүнсэнд байдаг.
3. Өөхөнд уусдаг витаминууд нь усанд уусдаггүй тул тусгай уураг тээгчээр цусаар дамжин биед ордог. Дүрмээр бол витамин бүр өөрийн тээгч уурагаар дамждаг.
4. Өөхөнд уусдаг витаминууд нь дотоод эрхтний эдэд хуримтлагдаж болно. Элэгний эд нь ихэвчлэн тэдний "депо" болдог. Өөх тосонд уусдаг витаминыг хоол хүнснээс авахаа болих нь тэр даруй гиповитаминоз үүсгэдэггүй. Энэ нь бие махбодь нь тэдгээрийг өөрийн "бааз" -аас хэсэг хугацаанд хангах чадвартай байдагтай холбоотой юм.
5. Өөх тосонд уусдаг витаминуудын ихэнх нь коэнзимийн үүрэг гүйцэтгэдэггүй.
6. Биологийн үүрэгөөхөнд уусдаг витаминууд нь генийн илэрхийлэлийг зохицуулах чадвартай байдагтай холбоотой юм.
Гэсэн хэдий ч тодорхой ижил төстэй байдлаас үл хамааран өөхөнд уусдаг витаминууд нь биологийн үр нөлөөгөөр мэдэгдэхүйц ялгаатай байдаг.
А аминдэм
Эс дэх ферментийн үйл ажиллагаа хувирамтгайцагтаа. Ферментүүд нь эсийг олж буй нөхцөл байдал, гадаад болон дотоодод нөлөөлж буй хүчин зүйлүүдэд мэдрэмтгий хариу үйлдэл үзүүлдэг. гол зорилго Ферментийн ийм мэдрэмж нь хүрээлэн буй орчны өөрчлөлтөд хариу үйлдэл үзүүлэх, эсийг шинэ нөхцөлд дасан зохицох, дааврын болон бусад өдөөлтөд зохих хариу үйлдэл үзүүлэх, зарим тохиолдолд эсийг амьд үлдэх боломжийг олгодог.
Ферментийн үйл ажиллагааг зохицуулах арга
Эсийн ферментийн үйл ажиллагааг зохицуулах хэд хэдэн арга байдаг - зарим аргууд нь ямар ч ферментэд тохиромжтой, бусад нь илүү тодорхой байдаг.
1. Субстрат буюу коэнзимийн хүртээмж
Энд ажилладаг массын үйл ажиллагааны хуульХимийн кинетикийн үндсэн хууль: тогтмол температурт химийн урвалын хурд нь урвалд орж буй бодисын концентрацийн бүтээгдэхүүнтэй пропорциональ байна. Эсвэл энгийнээр хэлбэл, бодисууд хоорондоо харилцан үйлчлэх хурд нь тэдгээрийн концентрацаас хамаардаг. Тиймээс дор хаяж нэг субстратын хэмжээг өөрчлөх нь урвалыг зогсоож эсвэл эхлүүлнэ.
5. Аллостерийн зохицуулалт
Аллостерийн ферментүүд үүсдэг хоёр ба түүнээс дээш дэд нэгжээс: зарим дэд нэгж нь катализаторын төвтэй, бусад нь аллостерийн төвтэй бөгөөд зохицуулалттай байдаг. Эффекторыг аллостерик (зохицуулалтын) дэд нэгжид хавсаргах нь уургийн зохицол, үүний дагуу катализаторын дэд нэгжийн идэвхийг өөрчилдөг.
Аллостерийн ферментүүд нь ихэвчлэн бодисын солилцооны эхэн үед тохиолддог бөгөөд дараагийн олон урвалын явц нь тэдний үйл ажиллагаанаас хамаардаг. Тиймээс тэдгээрийг ихэвчлэн дууддаг гол ферментүүд.

Биохимийн процессын эцсийн метаболит эсвэл энэ урвалын бүтээгдэхүүн нь сөрөг зохицуулагчийн үүрэг гүйцэтгэдэг, өөрөөр хэлбэл асаалттай байдаг. сөрөг хариу өгөх механизм. Хэрэв зохицуулагчид нь урвалын анхны метаболит эсвэл субстрат юм бол бид ярьдаг шууд зохицуулалт, энэ нь эерэг эсвэл сөрөг байж болно. Энэ урвалтай ямар нэгэн байдлаар холбоотой биохимийн замуудын метаболитууд нь зохицуулагч байж болно.

Эцсийн бүтээгдэхүүнээр фосфофруктокиназын зохицуулалт
Жишээлбэл, глюкозын энерги задлах фермент, фосфофруктокиназа, энэ задаргааны завсрын болон эцсийн бүтээгдэхүүнээр зохицуулагддаг. Энэ тохиолдолд ATP, нимбэгийн хүчил, фруктоз-1,6-бифосфат нь дарангуйлагч, фруктоз-6-фосфат, AMP нь фермент идэвхжүүлэгч юм.
Өөр нэг жишээ: биеийн ихэнх эсүүдэд (элэгнээс бусад) холестерины нийлэгжилтийг аллостерик дарангуйлагчаар зохицуулдаг. гол ферментэнэ үйл явц HMG-CoA редуктазахолестерин өөрөө гарч ирдэг бөгөөд энэ нь түүний хэмжээг хурдан бөгөөд үнэн зөв зохицуулдаг.
2. Уураг-уургийн харилцан үйлчлэлийн өөр нэг жишээ нь үйл ажиллагааны зохицуулалт байж болно уураг киназа Адамжуулан холбоо-салах механизм.
Уургийн киназа А нь 2 каталитик (C) ба зохицуулах (R) 2 дэд нэгжээс бүрддэг тетрамерийн фермент юм. Уургийн киназ А-ийн идэвхжүүлэгч нь cAMP юм. Ферментийн зохицуулалтын дэд хэсгүүдэд cAMP-ийг хавсаргах нь тэдгээрийг катализаторын дэд хэсгүүдээс салгахад хүргэдэг. Катализаторын дэд нэгжүүд идэвхждэг.

cAMP-ээр уураг киназа А-г идэвхжүүлэх
7. Ковалентын (химийн) өөрчлөлт
Ковалентын өөрчлөлт нь тодорхой бүлгийг буцаах боломжтой нэмэх буюу хасах, улмаар ферментийн идэвхийг өөрчилдөг. Ихэнхдээ ийм бүлэг нь фосфорын хүчил, бага ихэвчлэн метил ба ацетил бүлгүүд юм. Ферментийн фосфоржилт нь серин ба тирозины үлдэгдэлд явагддаг. Фосфорын хүчлийг уураг руу нэмэх нь ферментээр явагддаг уургийн киназууд, хуваах - уураг фосфатазууд.

Ферментийн үйл ажиллагааны өөрчлөлт
фосфоржилт-дефосфоржилтын үед
Ферментүүд хоёуланд нь идэвхтэй байж болно фосфоржуулсан, болон дотор фосфоргүйжүүлсэннөхцөл.
Жишээлбэл, булчингийн ферментүүд гликоген фосфорилазаТэгээд гликоген синтаза
- цагт ачаалалфосфоржуулж, гликоген фосфорилаза идэвхжиж, гликогенийг задалж, глюкозыг шатааж эхэлдэг бол гликоген синтаза идэвхгүй байдаг.
- үеэр амралтГликогенийн нийлэгжилтийн үед хоёр фермент хоёулаа фосфоржиж, синтаза идэвхжиж, фосфорилаза идэвхгүй болдог.
Ферментийн идэвхийг өөрчлөх нь урвалын хурдад нөлөөлөх хамгийн хурдан арга юм. Ферментийн үйл ажиллагаанд физик хүчин зүйл (температур, гэрэл, даралт гэх мэт) нөлөөлдөг бөгөөд эдгээр хүчин зүйлсийн үйлдэл нь ихэнх тохиолдолд өвөрмөц бус байдаг. Химийн хүчин зүйлүүд нь ферментийн үйл ажиллагаанд онцгой нөлөөлдөг. Энд хэд хэдэн тохиолдлыг онцолж болно. Нэгдүгээрт, энэ хүчин зүйл нь ферментийн идэвхтэй хэсэгт холбогдож чаддаг бөгөөд энэ нь ихэвчлэн катализаторын үйл ажиллагаа алдагдахад хүргэдэг. Субстрат өөрөө урвал явагдахад шаардлагатай хүчин зүйл байхгүй тохиолдолд ийм байдлаар ажиллах боломжтой, эсвэл өрсөлдөөнийг дарангуйлах тохиолдолд ферментийн идэвхтэй төвийг өөр бодисоор хааж болно. Хоёрдугаарт, өөр ферментийн нөлөөн дор ферментийн химийн өөрчлөлт үүсч болно.
Ферментийн үйл ажиллагааг зохицуулах хамгийн нарийн бөгөөд өргөн тархсан арга юм аллостерийн зохицуулалт . Энэ тохиолдолд зохицуулах хүчин зүйл нь ферментийн каталитик төвтэй биш харин түүний өөр хэсэгтэй холбогддог ( зохицуулалтын төв), ферментийн үйл ажиллагааг өөрчлөхөд хүргэдэг. Ийм байдлаар зохицуулагддаг ферментүүдийг нэрлэдэг аллостерик, Тэд ихэвчлэн бодисын солилцоонд гол байр суурийг эзэлдэг. Зохицуулах төвтэй холбогддог бодисыг нэрлэдэг эффектор , эффектор байж болно дарангуйлагч , магадгүй идэвхжүүлэгч Ерөнхийдөө эффекторууд нь биосинтетик замын эцсийн бүтээгдэхүүн (санал хүсэлтийг дарангуйлах) эсвэл концентраци нь эсийн бодисын солилцооны төлөв байдлыг илэрхийлдэг бодис (ATP, AMP, NAD+ гэх мэт) юм. Дүрмээр бол аллостерийн ферментүүд нь зарим метаболит үүсэх процессыг эхлүүлдэг урвалын аль нэгийг катализатор болгодог. Ихэвчлэн энэ үе шат нь бүхэлдээ үйл явцын хурдыг хязгаарладаг. Катаболик үйл явц дагалддаг ATP синтез ADP-ээс эцсийн бүтээгдэхүүн болох ATP нь ихэвчлэн катаболизмын эхний үе шатанд аллостерик дарангуйлагчийн үүрэг гүйцэтгэдэг. Анаболизмын эхний үе шатуудын аль нэгний аллостерик дарангуйлагч нь ихэвчлэн биосинтезийн эцсийн бүтээгдэхүүн, жишээлбэл, зарим амин хүчил юм. Жишээлбэл, аллостерийн фермент юм треонин деаминаза, треониноос изолейцины биосинтезийн эхний үе шатыг катализатор болгодог фермент; изолейцин нь энэ ферментийн дарангуйлагч юм (Зураг 31). Энэ бол санал хүсэлтийг дарангуйлах ердийн жишээ юм.
Цагаан будаа. 31. Сөрөг хариу урвалын механизмаар L-изолейцины биосинтезийг зохицуулах схем:
F1- аллостерик фермент треонин деаминаза; F2 – F5- изолейцин биосинтезийн завсрын үе шатуудыг катализатор болгодог ферментүүд. Сум нь энэхүү биосинтетик замын эцсийн бүтээгдэхүүн болох L-лейцинээр треонин деаминазыг дарангуйлж байгааг харуулж байна.
Зарим аллостерийн ферментийн үйл ажиллагаа нь тусгай идэвхжүүлэгчээр өдөөгддөг. Урвалын катаболик дарааллын аль нэгийг зохицуулдаг аллостерийн фермент нь жишээлбэл, эерэг эффекторууд - ADR эсвэл AMP - болон сөрөг нөлөө - ATP-ийн дарангуйлах нөлөөнд өртөж болно. Бодисын солилцооны замын аллостерийн фермент нь бусад бодисын солилцооны замуудын завсрын болон эцсийн бүтээгдэхүүнд тодорхой байдлаар хариу үйлдэл үзүүлэх тохиолдол байдаг. Үүний ачаар янз бүрийн ферментийн системийн үйл ажиллагааны хурдыг зохицуулах боломжтой.