Нэг үг дангаараа оршин тогтнож болно. Жишээлбэл, толь бичгийн оруулгад. Гэхдээ үг хэрэглэхдээ өөр үгтэй холбож чаддаг байх хэрэгтэй.
Өгүүлбэр дэх бүх үгс хоорондоо утга, дүрмийн хувьд холбогддог. Ийм холболтыг холбоо үг, үгийн дараалал, төгсгөл, угтвар үгээр үүсгэнэ. Зохицуулах, захирах гэсэн хоёр төрлийн холболт байдаг.
Зохицуулах холболт нь ижил хүчинтэй үгсийг нэгтгэдэг: бороо, цас; заримдаа хяруу, заримдаа гэсгээх.
Энэ холболт нь нэгэн төрлийн гишүүдээр өгүүлбэрийг түгээхэд шаардлагатай: I суусанхожуул дээр ба үзэж эхлэвдээр цэцэгТэгээд мод.
Захиргааны харилцаа нь үндсэн ба хамааралтай үгсийг тодруулахад суурилдаг: том Туслаач, сууэрэг дээр, уншихөчигдөр. Үг хэллэгээс өгүүлбэрүүд ийм байдлаар үүсдэг.
Үг бүхий угтвар үгс нь хэллэг биш юм: бидний хооронд, сургуулийн ойролцоо, эмийн сангийн эсрэг талд. Мөр нэгэн төрлийн гишүүдэсвэл өгүүлбэрийн тусгаарлагдсан гишүүд, түүнчлэн дүрмийн үндэслэл. Сэдэв болон предикатаас та өөр үг рүү асуулт тавьж болно.
Жишээлбэл, "Энгийн өдрүүдэд маш их чимээ шуугиантай байдаг манай гудамжинд чимээгүй байсан" гэсэн өгүүлбэрт өгүүлбэрүүд байдаг. янз бүрийн төрөл: зохицуулалт (манай гудамжинд, чимээ шуугиантай гудамжинд, энгийн өдрүүдэд), хяналт (гудамжинд зогсох, өдрүүдэд зогсох), зэргэлдээ (маш их чимээ шуугиантай).
Үндсэн үгийн дагуу хэллэгүүд нь үгийн, нэрлэсэн, adverbial байж болно.
Хамааралтай үг дээр үндэслэн та үгсийн хоорондын семантик харилцааны мөн чанарыг тодорхойлж болно: атрибутив ("аль нь?", "хэний вэ?" Гэсэн асуултанд тодорхойлолтоор хариулах), объектив (шууд бус тохиолдлын асуултууд, нэмэлтүүд), adverbial ( үйл үгийн асуулт).
Зөвшөөрөхдөө үндсэн ба хамааралтай үгс нь хүйс, тоо, тохиолдлоор бие биентэйгээ тохирч байна: миний найз, миний найз, миний найз, миний найзын тухай.
Энэ төрлийн холболтыг танихад хялбар байдаг тул та "аль нь?", "хэний?", "аль нь?" гэсэн асуултуудыг асуухад л хангалттай. Ийм асуултуудад ихэвчлэн нэр, төлөөний үг, тоо, оролцооны үгсээр хариулдаг. Тэд бүгд нэр үгээс хамаардаг: цэнхэр дээр мөс, шувуу найрал дуу, таны үзэгний сав, өөр байшин, эхлээд нэг удаа, шийдсэн даалгавар.
Удирдах үед үндсэн үг нь хамааралтай үгэнд тушаал өгч, түүнийг зарим тохиолдолд хэлбэрээр зогсоход хүргэдэг. Үндсэн үгийг өөрчилснөөр бид хамааралтай тохиолдлыг өөрчилж чадахгүй (би бодож байна - бодож байна - бодсон - бодох болно - өөрийнхөө тухай бодох). Үндсэн үгийн дагуу хяналт нь аман байна ( Би очиж байназам дагуу) эсвэл нэрлэсэн ( зөөлөннадтай).
Хамааралтай үг гэдэг нь угтвар үгтэй буюу угтвар үггүй нэр үг (утгал үг, угтвар үгийн бус хяналт) юм. Нэр үгээс илүү үйл үгээр илэрхийлэгддэг үндсэн үгнээс бидний асуудаг асуултуудыг шууд бус тохиолдлын асуултууд гэж нэрлэдэг. Хэдийгээр зарим үгсийг семантик асуултаар тавьж болно. Гэхдээ хамааралтай үг нь өөрчлөгдсөн үг гэдгийг бид санах ёстой. бичсэннайз, гэж боддогээжийн тухай, дуулахшувууд, түүхзохиолч, зохиолч алхсанчамд, хайхТа, баяннуурууд, Бага зэрэгномууд.
Зэргэлдээх нь тусгай нөхцөл дээр суурилдаг. Хамааралтай үг нь үндсэн үгтэй нийлж, ярианы хувиршгүй хэсэг бөгөөд семантик асуултуудад (яаж, хаана, хэзээ, хаанаас, яагаад, яагаад) хариулдаг. Зэргэлдээ үг ( гүйххурдан), герунд ( суувналуу), үйл үгийн тодорхойгүй хэлбэр ( явлаасуралцах, хүсэлбудаг), эзэмших төлөөний үгтүүний, түүний, тэдний (түүний үзэг).
Тиймээс, хэрэв та өгүүлбэрийн холболтын төрлийг хялбархан тодорхойлохыг хүсч байвал өгүүлбэрээс хэллэгүүдийг салгаж сур, үндсэн үгийг хурдан олж, энэ талаар асуулт асууж, ярианы хэсгүүдэд анхаарлаа хандуулаарай.
Уг өгүүлбэрт нарийвчилсан дүн шинжилгээ хийх журам
- Гол үгийг олж, ярианы хэсгийг тодорхойлно уу.
- Үндсэн үг (үйл үг, нэр, үйл үг) дээр үндэслэсэн хэллэгийн төрлийг заана уу.
- Хамааралтай үгийг олж, ярианы хэсгийг тодорхойлно уу.
- Хараат үг (атрибутив, зорилго эсвэл нэмэлт, adverbial) дээр үндэслэн үгсийн хоорондын утгын холбоог тодорхойлох.
- Асуултыг үндсэн үгнээс хамаарсан үг рүү оруулна.
- Өгүүлбэрийн холболтын төрлийг нэрлэнэ үү.
Өгүүлбэрийг задлан шинжлэх жишээ
Микроавтобусанд аав бүх хүн төрөлхтний бага насыг санаж байгаа мэт чимээгүйхэн, бодолтой цонхоор харав (Ю. Алешковский).
1. Микроавтобусны таксинд такси гэдэг гол үг нь нэр үг, нэр үг юм. "Маршрут" гэсэн хамааралтай үг нь нэр үг юм. Ямар такси вэ? – атрибутив харилцаа, хоёр үг хүйс, тоо, тохиолдлоор тохирдог – энэ бол тохиролцоо юм.
2. Тэр бодолтой харав - гол үг нь "харсан" - үйл үг, үйл үг хэллэг. "Бодлоготой" гэсэн хамааралтай үг нь дагалдах үг юм. Та үзсэн үү? - adverbial харилцаа, хамаарал нь гол зүйлтэй залгадаг - энэ бол нэмэлт юм.
3. Би бага насаа санав - гол үг нь "сансан" - үйл үг, үг хэллэг. "Хүүхэд нас" гэсэн хамааралтай үг нь Яллах тохиолдолд угтвар үггүй нэр үг юм. Юу санаж байна вэ? - объект эсвэл нэмэлт харилцаа, гол зүйл нь хамааралтай үгийг хянадаг - энэ бол менежмент юм.
4. Бүх хүн төрөлхтөн - "хүн төрөлхтөн" гэсэн үндсэн үг нь нэр үг, нэр үг юм. "Нийт" гэсэн хамааралтай үг нь төлөөний үг юм. Ямар хүн чанар вэ? - атрибутын харилцаа, хоёулаа хүйс, тоо, тохиолдлоор тохирдог - энэ нь тохиролцоо гэсэн үг юм.
5. Хүн төрөлхтний хүүхэд нас – гол үг нь “хүүхэд нас”, нэр үг, нэр үг. "Хүн төрөлхтөн"-ийн хамааралтай үг нь өмнөх үггүй нэр үг юм Генитив тохиолдол. Хэний бага нас вэ? - нэмэлт харилцаа, гол зүйл нь хамааралтай үгийг хянадаг - энэ бол менежмент юм.
Сургалт
Өгүүлбэрүүдээс өгүүлбэрүүдийг бичиж, холболтын төрлийг тодорхойлно уу.
Биднийг явахын өмнөх хугацаа нэлээд удаан үргэлжилсэн. Дөрөвдүгээр улирлын сүүлийн өдрөөс ч урт.
Тэгтэл нэгэн үзэсгэлэнт бүсгүй бидэнд тэнгэрт иддэг рашаан, амттан авчирч, бүх зорчигчдыг хамгаалах бүсээ бүслэхийг дахин захилаа.
Алсыг хараад тэр буцаж машиндаа суугаад бид цааш явлаа.
Хашааны гүнд жижигхэн цагаан байшин зогсож байв. Хашаа, гишгүүртэй ижил чулуугаар хийсэн зам түүн рүү хөтлөв. Замын хоёр талд өнгө өнгийн сарнай цэцэглэв.
Бие даасан ажил "Үг хэллэгийн төрөл"
СОНГОЛТ 1
Байшингууд
Хуучин гацуурын доод мөчрүүд өргөн тархаж, доороос нь улаан мөөгөнцөрийн бүхэл бүтэн одны цуваа сүүдэртэй зүлгэн дээр гарч ирэв.
3. Төрлийг тодорхойлох дэд холболт: бидний дуу хоолой гялалзаж, өндөрт хангинаж, зангилаа нэхэж, арчаагүй гарууд, хэсэг хугацаанд би инээж байсан, огт боломжгүй, ямар нэгэн байдлаар би зохиогчийг нь таньсан.
СОНГОЛТ 2
1. Өгүүлбэрийн бүх хэллэгийг бичээд жишээний дагуу ангил: at my house (at Байшингууд[хэний?] уурхай) – тодорхой утгатай нэрлэсэн гэрээ.
Нил ягаан өнгийн цэнхэр хонхнууд сэвшээ салхинд найгах нь намрын намуухан ойд зуны зүүдний салах ёс гүйцэтгэх симфонийг үүсгэж байгаа мэт.
2. Жишээний дагуу өгүүлбэрүүдийг ижил утгатай үг болгон хувирга: chintz dress - chintz dress.
Утасны хүлээн авагч, төмөр лааз, жуулчны хөтөчийн ард, хотын сониуч зан, санахад өвдөж байна, ороомог утас.
3. Дөнгөж анзаарагдахгүй, хэн нэгэн рүү, тэр охин руу инээмсэглэж, ямар нэгэн зүйл үнэртэж, бие бялдрын хувьд тааламжтай, гэрч болох, сэтгэцийн тэмдэглэл хийх, бусад хүмүүс, тэдний үгс, зуны улиралд бий болсон зэргийг тодорхойлох 3. Дэд холболтын төрлийг тодорхойлох.
СОНГОЛТ 3
1. Өгүүлбэрийн бүх хэллэгийг бичээд жишээний дагуу ангил: at my house (at Байшингууд[хэний?] уурхай) – тодорхой утгатай нэрлэсэн гэрээ.
Долоо хоног өнгөрөх болно, дараа нь дахин салхи үлээх болно - одоо алтан, улаан, хүрэн дугуй бүжиг дэлхий даяар эргэлдэнэ.
2. Жишээний дагуу өгүүлбэрүүдийг ижил утгатай үг болгон хувирга: chintz dress - chintz dress.
Хотын цонхнуудад Европын хувцас, шувууны үүр, загасны шөл, шилэн бүрээстэй, нарийвчлан дүрсэлсэн байдаг.
3. Дагалдах холбоосын төрлийг тодорхойл: Амьсгалаа алдсан, Туркээс авчирсан, одоо хүртэл асарч байгаа, найзын найз, чамайг эмчлэх гэж, зуухны цаанаас сугалж авсан, ороолт минь, урт байсан цаг хугацааны өмнө, тэдний ажил, харамсалтай байна.
СОНГОЛТ 4
1. Өгүүлбэрийн бүх хэллэгийг бичээд жишээний дагуу ангил: at my house (at Байшингууд[хэний?] уурхай) – тодорхой утгатай нэрлэсэн гэрээ.
Самар самар авахаасаа өмнө хошуугаараа зөөлөн цохиж, хоосон эсэхийг нь дуугаар нь тогтоодог юм байна.
2. Жишээний дагуу өгүүлбэрүүдийг ижил утгатай үг болгон хувирга: chintz dress - chintz dress.
Утасны хошигнол, нүүрний булчингууд, аавын хамт олон, санах ойд зориулсан гэрэл зураг, яндан дотор, уйтгар гуниггүй, урагдсан.
3. Дэд холболтын төрлийг тодорхойлох: инээж уйлж, бүх хүмүүс, ер бусын ашигтай, герман хэлээр ярьдаг, навчис унаж, цаг тухайд нь орхиж, эмчилнэ гэж амласан, нэг эвэртэй, тэд түүний тухай ярьж, саарал нүдтэй.
СОНГОЛТ 5
1. Өгүүлбэрийн бүх хэллэгийг бичээд жишээний дагуу ангил: at my house (at Байшингууд[хэний?] уурхай) – тодорхой утгатай нэрлэсэн гэрээ.
Улиран одож буй намрын нарийхан, госсамер шиг алтан дуугаралтаар агаар дүүрэн байх шиг надад санагддаг.
2. Жишээний дагуу өгүүлбэрүүдийг ижил утгатай үг болгон хувирга: chintz dress - chintz dress.
Азарган тахиа сам, нарны туяа, ойн шувуу, судалтай хивс, эхийн хайр, болгоомжтой цэвэрлэв.
3. Захиргааны холболтын төрлийг тодорхойлох: тэдний хувьд өөр, сайн мэддэг, энэ нээлтийн дараа бусдад харагдахгүй, манан үнэр, шүүдэр дусал, энэ сүүл, мөрнийхөө араас, сайн хооллосон үхэр, маш дурсамжтай.
СОНГОЛТ 6
1. Өгүүлбэрийн бүх хэллэгийг бичээд жишээний дагуу ангил: at my house (at Байшингууд[хэний?] уурхай) – тодорхой утгатай нэрлэсэн гэрээ.
Бүхэл бүтэн хонин сүрэг чулуун дэр, хайрга дээр бэлчиж, жижиг хайрга чулууг аажуухнаар цоолж байна.
2. Жишээний дагуу өгүүлбэрүүдийг ижил утгатай үг болгон хувирга: chintz dress - chintz dress.
Гааны иш, модон хайрцаг, цаасан туузан дээр, нар жаргах тэнгэр, харахад хэцүү, тоосгон байшин.
3. Захиргааны холболтын төрлийг тодорхойл: үүнээс өмнөхөн, одоо тэр будилсан, нөгөө эрэг дээр, ойн оройд гараа арчиж, түүний үнэрийг тэр мэдэж байсан, тэр итгэлтэйгээр явах болно, хөөрхий залуу, Хэтэрхий бага.
Ховор химийн бодисуудхимийн элементүүдийн бие даасан, хамааралгүй атомуудаас бүрддэг. Хэвийн нөхцөлд зөвхөн цөөн тооны язгуур хий гэж нэрлэгддэг хий нь ийм бүтэцтэй байдаг: гелий, неон, аргон, криптон, ксенон, радон. Ихэнх тохиолдолд химийн бодисууд нь тусгаарлагдсан атомуудаас тогтдоггүй, харин янз бүрийн бүлэгт нэгтгэгддэг. Атомуудын ийм холбоо нь хэд хэдэн, зуу, мянга, бүр илүү олон атомтай байж болно. Эдгээр атомуудыг ийм бүлэгт байлгадаг хүчийг нэрлэдэг химийн холбоо.
Өөрөөр хэлбэл, химийн холбоо нь бие даасан атомуудыг илүү нарийн бүтэцтэй (молекулууд, ионууд, радикалууд, талстууд гэх мэт) холбож өгдөг харилцан үйлчлэл гэж хэлж болно.
Химийн холбоо үүсэх шалтгаан нь илүү төвөгтэй бүтцийн энерги нь түүнийг бүрдүүлдэг бие даасан атомуудын нийт энергиээс бага байдагтай холбоотой юм.
Тиймээс, ялангуяа X ба Y атомуудын харилцан үйлчлэл нь XY молекулыг үүсгэдэг бол энэ бодисын молекулуудын дотоод энерги нь түүний үүссэн бие даасан атомуудын дотоод энергиээс бага байна гэсэн үг юм.
E(XY)< E(X) + E(Y)
Ийм учраас бие даасан атомуудын хооронд химийн холбоо үүсэхэд энерги ялгардаг.
Цөмтэй хамгийн бага холболтын энергитэй гадаад электрон давхаргын электронууд гэж нэрлэгддэг валент. Жишээлбэл, борын хувьд эдгээр нь 2-р энергийн түвшний электронууд юм - 2-д 2 электрон с-тойрог замууд ба 1-ээс 2 х- тойрог замууд:
Химийн холбоо үүсэх үед атом бүр нь язгуур хийн атомуудын электрон тохиргоог олж авах хандлагатай байдаг. Ингэснээр түүний гаднах электрон давхаргад 8 электрон байдаг (эхний үеийн элементүүдэд 2). Энэ үзэгдлийг октет дүрэм гэж нэрлэдэг.
Хэрэв эхэндээ ганц атомууд валентийн электроныхоо зарим хэсгийг бусад атомуудтай хуваалцдаг бол атомууд сайн хийн электрон тохиргоонд хүрэх боломжтой. Энэ тохиолдолд нийтлэг электрон хосууд үүсдэг.
Электрон хуваах зэргээс хамааран ковалент, ионы болон металлын холбоог ялгаж болно.
Ковалент холбоо
Ковалент холбоо нь ихэвчлэн металл бус элементүүдийн атомуудын хооронд үүсдэг. Хэрэв ковалент холбоо үүсгэгч металл бус атомууд өөр өөр химийн элементүүдэд хамаарах бол ийм холбоог туйлын ковалент холбоо гэж нэрлэдэг. Энэ нэрийн шалтгаан нь өөр өөр элементийн атомууд нийтлэг электрон хосыг татах өөр өөр чадвартай байдагт оршино. Мэдээжийн хэрэг, энэ нь нийтлэг электрон хосыг атомуудын аль нэг рүү шилжүүлэхэд хүргэдэг бөгөөд үүний үр дүнд үүн дээр хэсэгчилсэн сөрөг цэнэг үүсдэг. Хариуд нь хэсэгчилсэн нэг нь өөр атом дээр үүсдэг эерэг цэнэг. Жишээлбэл, устөрөгчийн хлоридын молекул дахь электрон хос нь устөрөгчийн атомаас хлорын атом руу шилждэг.
Туйлшсан ковалент холбоо бүхий бодисын жишээ:
CCl 4, H 2 S, CO 2, NH 3, SiO 2 гэх мэт.
Ижил химийн элементийн металл бус атомуудын хооронд ковалент туйлт бус холбоо үүсдэг. Атомууд нь ижил байдаг тул хуваалцсан электронуудыг татах чадвар нь мөн адил байна. Үүнтэй холбогдуулан электрон хосын шилжилт ажиглагдахгүй.
Хоёр атом хоёулаа электроноор хангаж, нийтлэг электрон хос үүсгэх үед ковалент холбоо үүсэх дээрх механизмыг солилцоо гэж нэрлэдэг.
Мөн донор хүлээн авагч механизм байдаг.
Донор-хүлээн авагч механизмаар ковалент холбоо үүсэхэд нэг атомын дүүрсэн орбитал (хоёр электронтой), нөгөө атомын хоосон орбиталаас болж хуваалцсан электрон хос үүснэ. Ганц хос электроныг хангадаг атомыг донор, хоосон орбиталтай атомыг хүлээн авагч гэнэ. N, O, P, S гэх мэт хосолсон электронтой атомууд электрон хосын донорын үүрэг гүйцэтгэдэг.
Жишээлбэл, донор-хүлээн авагч механизмын дагуу дөрөв дэх ковалент үүсэх N-H холболтуудаммонийн катион NH 4+-д:
Туйлшралаас гадна ковалент холбоо нь эрчим хүчээр тодорхойлогддог. Бондын энерги нь атомуудын хоорондын холбоог таслахад шаардагдах хамгийн бага энерги юм.
Холбогдсон атомуудын радиус нэмэгдэх тусам холболтын энерги буурдаг. Атомын радиус нь дэд бүлгүүдийг доошлуулдаг гэдгийг бид мэддэг тул жишээлбэл, галоген-устөрөгчийн бондын бат бэх нь цувралд нэмэгддэг гэж дүгнэж болно.
Сайн уу< HBr < HCl < HF
Мөн бондын энерги нь түүний олон талт байдлаас хамаардаг - бондын олон талт байдал их байх тусам түүний энерги их байдаг. Бондын олон талт байдал гэдэг нь хоёр атомын хоорондох электрон хосуудын тоог илэрхийлдэг.
Ионы холбоо
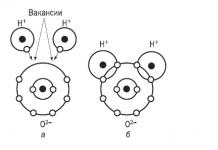
Ионы холбоог туйлын ковалент бондын онцгой тохиолдол гэж үзэж болно. Хэрэв ковалент-туйлт холбоонд нийтлэг электрон хос нь хос атомын аль нэгэнд хэсэгчлэн шилжсэн бол ионы холбоонд атомын аль нэгэнд бараг бүрэн "өгөгдсөн" болно. Электрон (үүд)-ийг өгч буй атом эерэг цэнэг авч, болдог катион, мөн түүнээс электрон авсан атом сөрөг цэнэг авч, болдог анион.
Тиймээс, ионы холбоокатионуудын анионуудад электростатик таталцлын улмаас үүссэн холбоо юм.
Энэ төрлийн холбоо үүсэх нь ердийн металл ба ердийн металл бус атомуудын харилцан үйлчлэлийн явцад тохиолддог.
Жишээлбэл, калийн фтор. Калийн катион нь саармаг атомаас нэг электроныг салгаснаар, фторын ион нь фторын атомд нэг электрон нэмснээр үүсдэг.

Үүссэн ионуудын хооронд электростатик таталцлын хүч үүсч, ионы нэгдэл үүснэ.
Химийн холбоо үүсэхэд натрийн атомаас электронууд хлорын атом руу шилжиж, эсрэгээр цэнэглэгдсэн ионууд үүссэн бөгөөд тэдгээр нь гадаад энергийн бүрэн түвшинд хүрсэн байна.
Металлын атомаас электронууд бүрэн салдаггүй, харин ковалент холбоонд байдаг шиг зөвхөн хлорын атом руу шилждэг нь тогтоогдсон.
Металл атом агуулсан ихэнх хоёртын нэгдлүүд нь ион юм. Жишээлбэл, исэл, галоген, сульфид, нитрид.
Ионы холбоо нь энгийн катионууд ба энгийн анионуудын (F −, Cl −, S 2-), түүнчлэн энгийн катионууд ба комплекс анионуудын (NO 3 −, SO 4 2-, PO 4 3-, OH −) хооронд үүсдэг. Иймээс ионы нэгдлүүдэд давс, суурь (Na 2 SO 4, Cu(NO 3) 2, (NH 4) 2 SO 4), Ca (OH) 2, NaOH) орно.
Металл холболт
Энэ төрлийн холбоо нь металлд үүсдэг.
Бүх металлын атомууд нь гаднах электрон давхаргад атомын цөмтэй холбоогүй энерги багатай электронуудтай байдаг. Ихэнх металлын хувьд гаднах электроноо алдах үйл явц нь энергийн хувьд таатай байдаг.
Цөмтэй ийм сул харилцан үйлчлэлийн улмаас метал дахь эдгээр электронууд нь маш хөдөлгөөнтэй байдаг бөгөөд металлын талст бүрт дараах процесс тасралтгүй явагддаг.
M 0 - ne - = M n +, энд M 0 нь төвийг сахисан металлын атом, M n + нь ижил металлын катион юм. Доорх зурагт болж буй үйл явцын дүрслэлийг харуулав.
Өөрөөр хэлбэл электронууд металлын талстыг дайрч, нэг металлын атомаас салж, түүнээс катион үүсгэж, өөр катионтой нэгдэж, төвийг сахисан атом үүсгэдэг. Энэ үзэгдлийг "электрон салхи" гэж нэрлэдэг ба металл бус атомын талст дахь чөлөөт электронуудын цуглуулгыг "электрон хий" гэж нэрлэдэг. Металлын атомуудын хоорондын ийм төрлийн харилцан үйлчлэлийг металлын холбоо гэж нэрлэдэг.
Устөрөгчийн холбоо
Хэрэв бодис дахь устөрөгчийн атом нь өндөр цахилгаан сөрөг нөлөөтэй элементтэй (азот, хүчилтөрөгч, фтор) холбогдсон бол энэ бодис нь устөрөгчийн холбоо гэж нэрлэгддэг үзэгдлээр тодорхойлогддог.
Устөрөгчийн атом нь электрон сөрөг атомтай холбогддог тул устөрөгчийн атом дээр хэсэгчилсэн эерэг цэнэг, электрон сөрөг элементийн атом дээр хэсэгчилсэн сөрөг цэнэг үүсдэг. Үүнтэй холбогдуулан нэг молекулын хэсэгчилсэн эерэг цэнэгтэй устөрөгчийн атом ба нөгөө молекулын электрон сөрөг атомын хооронд электростатик таталцал үүсэх боломжтой болдог. Жишээлбэл, усны молекулуудын хувьд устөрөгчийн холбоо ажиглагддаг.
Устөрөгчийн холбоо нь усны хэвийн бус хайлах цэгийг тайлбарладаг. Уснаас гадна устөрөгчийн фтор, аммиак, хүчилтөрөгч агуулсан хүчил, фенол, спирт, амин зэрэг бодисуудад устөрөгчийн хүчтэй холбоо үүсдэг.
Хими бол гайхалтай бөгөөд эргэлзээтэй шинжлэх ухаан юм. Зарим шалтгааны улмаас энэ нь тод туршилт, өнгөлөг туршилтын хоолой, уурын зузаан үүлтэй холбоотой юм. Гэхдээ энэ "ид шид" хаанаас ирдэг талаар цөөхөн хүн боддог. Үнэн хэрэгтээ урвалд орох бодисын атомуудын хооронд нэгдлүүд үүсэхгүйгээр нэг ч урвал явагддаггүй. Түүнээс гадна эдгээр "үсрэгчид" нь заримдаа энгийн элементүүдээс олддог. Эдгээр нь бодисын хариу үйлдэл үзүүлэх чадварт нөлөөлж, тэдгээрийн зарим физик шинж чанарыг тайлбарладаг.
Ямар төрлийн химийн холбоо байдаг бөгөөд тэдгээр нь нэгдлүүдэд хэрхэн нөлөөлдөг вэ?
Онол
Бид хамгийн энгийн зүйлээс эхлэх хэрэгтэй. Химийн холбоо гэдэг нь бодисын атомууд нийлж илүү нарийн төвөгтэй бодис үүсгэдэг харилцан үйлчлэл юм. Үүнийг зөвхөн давс, хүчил, суурь зэрэг нэгдлүүдийн шинж чанар гэж үзэх нь эндүүрэл юм - молекулууд нь хоёр атомаас бүрддэг энгийн бодисууд ч гэсэн ийм "гүүртэй" байдаг, хэрэв үүнийг холбоо гэж нэрлэж болно. Дашрамд хэлэхэд, зөвхөн өөр өөр цэнэгтэй атомууд нэгдэж чадна гэдгийг санах нь чухал (энэ бол физикийн үндэс юм: ижил цэнэгтэй бөөмс нь түлхэж, эсрэгээрээ татдаг), тиймээс нарийн төвөгтэй бодисуудад үргэлж катион (ионтой ион) байх болно. эерэг цэнэг) ба анион (сөрөг бөөмс), холболт нь өөрөө үргэлж төвийг сахисан байх болно.
Одоо химийн холбоо хэрхэн үүсдэгийг ойлгохыг хичээцгээе.
Боловсролын механизм
Аливаа бодис нь энергийн давхаргад тархсан тодорхой тооны электронтой байдаг. Хамгийн эмзэг нь ихэвчлэн эдгээр тоосонцорыг хамгийн бага хэмжээгээр агуулдаг гаднах давхарга юм. Та тэдгээрийн дугаарыг бүлгийн дугаараас (тогтмол хүснэгтийн дээд талд байгаа нэгээс найм хүртэлх тоонуудын шугам) олж мэдэх боломжтой. химийн элемент, ба энергийн давхаргын тоо нь хугацааны дугаартай тэнцүү байна (нэгээс долоо хүртэл, элементүүдийн зүүн талд босоо шугам).
Хамгийн тохиромжтой нь гаднах энергийн давхаргад найман электрон байдаг. Хэрэв тэдгээр нь хангалттай биш бол атом тэдгээрийг өөр бөөмсөөс шүүрэн авахыг оролддог. Гаднах энергийн давхаргыг дуусгахад шаардлагатай электронуудыг сонгох явцад бодисын химийн холбоо үүсдэг. Тэдний тоо өөр өөр байж болох бөгөөд энэ нь валент эсвэл хосгүй бөөмсийн тооноос хамаардаг (атомд хэдэн ширхэг байгааг мэдэхийн тулд та түүний электрон томъёог үүсгэх хэрэгтэй). Хос байхгүй электронуудын тоо нь үүссэн бондын тоотой тэнцүү байх болно.

Төрлийн талаар бага зэрэг дэлгэрэнгүй
Бодисын молекул дахь урвалын явцад үүссэн химийн бондын төрлүүд нь тухайн элементээс бүрэн хамаардаг. Атомуудын хооронд ион, металл, ковалент гэсэн гурван төрлийн "гүүр" байдаг. Сүүлийнх нь эргээд туйл ба туйл биш гэж хуваагддаг.
Атомууд ямар холбоогоор холбогдож байгааг ойлгохын тулд тэдгээр нь нэг төрлийн дүрмийг ашигладаг: хэрэв элементүүд нь хүснэгтийн баруун ба зүүн талд байгаа бол (өөрөөр хэлбэл тэдгээр нь металл ба металл бус, жишээлбэл NaCl) байдаг. Дараа нь тэдгээрийн холболт нь ионы бондын гайхалтай жишээ юм. Хоёр металл бус нь ковалент туйлын холбоо (HCl) үүсгэдэг ба нэг бодисын хоёр атом нь нэг молекул болж нийлж, ковалент туйлт бус холбоо (Cl 2, O 2) үүсгэдэг. Дээрх төрлийн химийн холбоо нь металаас бүрдэх бодисуудад тохиромжгүй байдаг - тэнд зөвхөн металлын холбоо байдаг.

Ковалентын харилцан үйлчлэл
Өмнө дурьдсанчлан, химийн бондын төрлүүд нь бодисуудад тодорхой нөлөө үзүүлдэг. Жишээлбэл, ковалент "гүүр" нь маш тогтворгүй байдаг тул түүнтэй холболт нь гадны өчүүхэн нөлөөлөл, жишээлбэл, халаалтаар амархан устдаг. Үнэн, энэ нь зөвхөн молекулын бодисуудад хамаарна. Молекулын бус бүтэцтэй тэдгээр нь бараг устаж үгүй болдог (хамгийн тохиромжтой жишээ бол алмазын болор - нүүрстөрөгчийн атомуудын нэгдэл).

Туйлт ба туйлшгүй ковалент холбоо руу буцъя. Туйлгүй бол бүх зүйл энгийн байдаг - хооронд нь "гүүр" үүсдэг электронууд атомуудаас ижил зайд байрладаг. Гэхдээ хоёр дахь тохиолдолд тэдгээр нь элементүүдийн аль нэгэнд шилждэг. "Олсын таталт"-ын ялагч нь электрон сөрөг чанар (электрон татах чадвар) илүү өндөр бодис байх болно. Энэ нь тусгай хүснэгтүүдийг ашиглан тодорхойлогддог бөгөөд хоёр элементийн хоорондох энэ утгын зөрүү их байх тусам тэдгээрийн хоорондын хамаарал илүү туйлшрах болно. Үнэн бол элементүүдийн электрон сөрөг байдлын талаархи мэдлэг нь ашигтай байж болох цорын ганц зүйл бол катион (эерэг цэнэг - энэ утга нь бага байх бодис) ба анион (татах чадвар сайтай сөрөг бөөмс) -ийг тодорхойлох явдал юм. электронууд).
Ионы холбоо
Бүх төрлийн химийн холбоо нь металл ба металл бусыг холбоход тохиромжгүй байдаг. Дээр дурдсанчлан, хэрэв элементүүдийн цахилгаан сөрөг байдлын ялгаа асар их байвал (мөн эдгээр нь хүснэгтийн эсрэг хэсэгт байрлах үед тохиолддог) тэдгээрийн хооронд ионы холбоо үүсдэг. Энэ тохиолдолд валентийн электронууд бага цахилгаан сөрөг утгатай атомаас өндөр атом руу шилжиж, анион, катион үүсгэдэг. Хамгийн тод жишээҮүнтэй төстэй холбоо нь галоген ба металлын нэгдэл, жишээлбэл AlCl 2 эсвэл HF юм.
Металл холболт
Металлаар бол бүр ч хялбар. Дээрх төрлийн химийн бондууд нь тэдэнд харь байдаг, учир нь тэдгээр нь өөрийн гэсэн шинж чанартай байдаг. Энэ нь нэг бодисын атомыг (Li 2) ба өөр (AlCr 2) хоёуланг нь холбож чаддаг бөгөөд сүүлчийн тохиолдолд хайлш үүсдэг. Хэрэв ярих юм бол физик шинж чанар, дараа нь металууд нь уян хатан байдал, хүч чадлыг хослуулдаг, өөрөөр хэлбэл тэдгээр нь өчүүхэн нөлөөллөөр нурж унахгүй, харин хэлбэрээ өөрчилдөг.

Молекул хоорондын холбоо
Дашрамд хэлэхэд химийн холбоо нь молекулуудад бас байдаг. Тэдгээрийг молекулууд гэж нэрлэдэг. Хамгийн түгээмэл төрөл бол устөрөгчийн атом нь өндөр цахилгаан сөрөг нөлөөтэй элементээс (жишээлбэл, усны молекул) электронуудыг зээлдэг устөрөгчийн холбоо юм.
Өгүүлбэр дэх харилцаа- энэ бол өгүүлбэрийн утга учир, бодлын бүрэн байдал, түүнчлэн логик, лексик, синтаксийн бүрэн байдлыг өгөх арга юм. Өгүүлбэрт хоёр төрлийн холболт байдаг - зохицуулах ба захирах.
Зохицуулах холболтӨгүүлбэр дэх бие биенээсээ хамааралгүй өгүүлбэрийн элементүүдийн нэгдэл юм: энгийн эсвэл нэг төрлийн гишүүд. энгийн өгүүлбэрүүднэгдлийн нэг хэсэг болгон.
Дэд холболтөгүүлбэрт бие биенээсээ хамааралтай элементүүдийн нэгдэл юм: хэллэг дэх үгс, өгүүлбэр эсвэл нийлмэл өгүүлбэрийн нэг хэсэг болох энгийн өгүүлбэрүүд.
Өгүүлбэр дэх холболтын төрлийг хэрхэн тодорхойлох вэ?
Юуны өмнө үүнийг хаях хэрэгтэй дүрмийн үндэс, сэдэв нь үргэлж предикаттай холбоотой байдаг тул оршил үгсийг оруулахгүй байх нь зүйтэй.
Жишээ. Би гадаа гарах гэсэн боловч хаалга түгжээтэй байв.
Хоёр бие даасан хэсэгтэй нийлмэл өгүүлбэр, нийлмэл. Үүний үндсэн дээр, in энэ саналашигласан харилцаа холбоог зохицуулах.
Өрөөний агаар маш хуучирсан байсан тул гадаа гарахыг хүссэн.
Байсан нийлмэл өгүүлбэр дэд холболт- нэг өгүүлбэр нь нөгөө өгүүлбэрийн учир шалтгааныг илтгэнэ. Өгүүлбэр нь нарийн төвөгтэй.
Дэд холболтын төрлүүд.
Байгаа гурван төрлийн дэд холбоос:
Зохицуулалт- энэ нь хамааралтай ба үндсэн үгсийг (нэр үг эсвэл нэр үгийн дүрд хамаарах ярианы өөр хэсэг) хүйс, тоо, тохиолдлын хувьд бие биентэйгээ харьцуулах холболтын төрөл юм. Хамгийн энгийн жишээнүүдгэрээ - хэллэгээр: жигшүүртэй бороо, баяр баясгалантай би, үл үзэгдэгч хэн нэгэн, санамсаргүй байдлаар өнгөрөх хүн, цуурайтах "zy".
гэх мэт хамааралтай үгсЗөвшөөрсөн тохиолдолд ярианы ямар ч хувирах хэсгүүд гарч ирж болно: нэр үг, төлөөний үг (эзэмших, шинж чанар, харуулах, сөрөг, тодорхойгүй) ба дарааллын тоо.
Мөнгөгүй, хөгжилтэй түүхч, таны эгч, анхны уулзсан хүнд.
Хяналт- харилцааны төрөл гол үгхамааралтай үгийн тусгай тохиолдлын хэлбэрийг шаарддаг. Кейс маягтҮүний зэрэгцээ энэ нь орос хэл дээрх морфологийн тодорхой хэм хэмжээгээр тодорхойлогддог. Өгүүлбэр, өгүүлбэрт хяналт байгаагийн гол шинж тэмдэг нь угтвар үг ашиглах явдал боловч угтвар үггүй хяналтын хэлбэр байдаг. Хэрэв хяналт байгаа бол хамааралтай үг нь шууд бус тохиолдлын асуултанд үргэлж хариулах болно.
Сарыг харж, сарыг биширч, хүлээн авахдаа гарын үсэг зурж, баримт бичигт гарын үсэг зурж, асуудлыг мартаж, томъёогоо март.
Эхлээд та үүнийг ойлгох хэрэгтэй хэллэг дээр тулгуурласан үгийн хослол гэж үзэж болно дэд холболт.Энэ нь юу гэсэн үг вэ? Энэ өгүүлбэрт орсон бүрэлдэхүүн хэсгүүдийн нэг нь нөгөөдөө захирагддаг. Энгийнээр хэлбэл, нэг үгнээс нөгөө үг рүү асуулт асууж болно.
Бидний асуулт асууж буй үг Гол нь. Бидний асууж буй үг бол энэ юм хамааралтай:
Өгүүлбэр дэх үгсийн хооронд ямар төрлийн холбоо байдаг вэ? Тэдгээрийн гурав нь: зохицуулалт, хяналт, зэргэлдээ байдал. Тодорхой хэллэг ямар төрлийн дэд холболтод хамаарахыг хэрхэн тодорхойлох вэ? Үүнийг хийх хамгийн хялбар арга бол тодорхойлох явдал юм ярианы аль хэсэг нь хамааралтай үг юм.
Зохицуулалт
At тохиролцоо хамааралтай үг - нэр үг буюу нэрийн шинж бүхий үгс :

Хяналт
At удирдлагахамааралтай үг - нэр үг буюу нэр үгийн онцлогтой үгс :

Зэргэлдээ байдал
At зэргэлдээ байдалхамааралтай үг - ярианы хувиршгүй хэсэг . Ихэнхдээ энэ adverb, gerund, эсвэл үйл үгийн хязгааргүй хэлбэр .