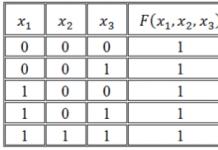
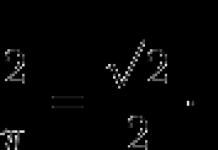Урвалж буй бодисыг бүрдүүлдэг атомуудын исэлдэлтийн төлөвийн өөрчлөлтийг үндэслэн химийн урвалыг хоёр төрөлд хуваадаг.
1) Атомын исэлдэлтийн төлөвийг өөрчлөхгүйгээр явагдах урвалууд.
Жишээлбэл:
2+4-2 т +2 -2 +4 -2
CaCO 3 = CaO + CO 2
Энэ урвалд атом бүрийн исэлдэлтийн төлөв өөрчлөгдөөгүй хэвээр байв.
2) Атомын исэлдэлтийн төлөв өөрчлөгдөхөд тохиолддог урвалууд.
Жишээлбэл:
0 +2 -1 0 +2 -1
Zn + CuCl 2 = Cu + ZnCl 2
Энэ урвалын үед цайр ба зэсийн атомуудын исэлдэлтийн төлөв өөрчлөгдсөн.
Редокс урвал нь хамгийн түгээмэл химийн урвал юм.
Практикт редокс урвал нь электронуудын олз эсвэл алдагдал юм. Зарим атомууд (ионууд, молекулууд) бусдаас электрон өгдөг эсвэл авдаг.
Исэлдэлт.
Атом, ион, молекул электроныг өгөх үйл явцыг гэнэ исэлдэлт.
Электронууд алга болох үед атомын исэлдэлтийн төлөв нэмэгддэг.
Атом, ион, молекулууд нь электроноо өгдөг бодисыг нэрлэдэг бууруулах бодис.
Бидний жишээнд исэлдэлтийн төлөв 0-ийн атомууд +2 исэлдэлтийн төлөвтэй атомууд руу шилжсэн. Энэ нь исэлдэлтийн процесс явагдсан гэсэн үг юм. Энэ тохиолдолд хоёр электрон хандивласан цайрын атом нь бууруулагч бодис юм (энэ нь исэлдэлтийн төлөвийг 0-ээс +2 хүртэл нэмэгдүүлсэн).
Исэлдэлтийн процессыг электрон тэгшитгэлээр бүртгэдэг бөгөөд энэ нь атомын исэлдэлтийн төлөвийн өөрчлөлт болон бууруулагчийн өгсөн электронуудын тоог харуулдаг.
Жишээлбэл:
0 +2 0
Zn – 2e – = Zn (исэлдэлт, Zn – бууруулагч).
Сэргээх.
Электрон нэмэх процессыг нэрлэдэг нөхөн сэргээлт.
Электрон нэмэхэд атомын исэлдэлтийн байдал буурдаг.
Атом, ион, молекулууд нь электрон авдаг бодисыг нэрлэдэг исэлдүүлэгч бодис.
Бидний жишээн дээр исэлдэлтийн түвшин +2 зэсийн атомууд 0 исэлдэлтийн төлөвтэй атомууд руу шилжих нь ангижрах процесс юм. Энэ тохиолдолд +2 исэлдэлтийн төлөвтэй зэсийн атом нь хоёр электрон хүлээн авснаар исэлдэлтийн төлөвийг +2-оос 0 хүртэл бууруулж, исэлдүүлэгч бодис юм.
Исэлдэлтийн процессыг мөн электрон тэгшитгэл ашиглан бичдэг.
2 0 0
Cu + 2e – = Cu (бууруулах, Cu нь исэлдүүлэгч бодис).
Бууруулах процесс ба исэлдэлтийн процесс нь салшгүй холбоотой бөгөөд нэгэн зэрэг явагддаг.
0 +2 0 +2
Zn + CuCl 2 = Cu + ZnCl 2
бууруулах бодис исэлдүүлэгч бодис
исэлдсэн бууруулсан
Исэлдэлтийн төлөвийн өөрчлөлтөөс хамааран бүх химийн урвалыг хоёр төрөлд хувааж болно.
I. Урвалж буй бодисыг бүрдүүлэгч элементүүдийн исэлдэлтийн төлөвийг өөрчлөхгүйгээр явагдах урвал. Ийм урвалыг ион солилцооны урвал гэж ангилдаг.
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2 + H 2 O.
II. Элементүүдийн исэлдэлтийн төлөв өөрчлөгдөхөд тохиолддог урвалууд
урвалд орох бодисуудад багтана. Ийм урвалыг исэлдэлтийн урвал гэж ангилдаг.
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O.
Исэлдэлтийн төлөв(исэлдэлт) - молекулын найрлага дахь элементийн атомын төлөв байдлын шинж чанар. Энэ нь элементийн атомуудын хоорондох электронуудын жигд бус хуваарилалтыг тодорхойлдог бөгөөд хэрэв химийн бондын бүх нийтлэг электрон хосууд илүү цахилгаан сөрөг элемент рүү шилжвэл элементийн атом олж авах цэнэгтэй тохирч байна. Бонд үүсгэгч элементүүдийн харьцангуй цахилгаан сөрөг байдлаас хамааран электрон хосыг атомын аль нэгэнд шилжүүлж эсвэл атомын цөмтэй харьцуулахад тэгш хэмтэй байрлаж болно. Тиймээс элементүүдийн исэлдэлтийн төлөв нь сөрөг, эерэг эсвэл тэг утгатай байж болно.
Атомууд нь бусад атомуудаас электрон хүлээн авдаг элементүүд нь сөрөг исэлдэлтийн төлөвтэй байдаг. Атомууд нь бусад атомуудад электроноо өгдөг элементүүд нь эерэг исэлдэлтийн төлөвтэй байдаг. Энгийн бодисын молекул дахь атомууд нь тэг исэлдэлтийн төлөвтэй, мөн хэрэв бодис атомын төлөвт байгаа бол.
Исэлдэлтийн төлөвийг +1, +2 гэж тэмдэглэнэ.
Ионы цэнэг 1+, 2+.
Нэгдлийн элементийн исэлдэлтийн төлөвийг дараах дүрмийн дагуу тодорхойлно.
1. Энгийн бодис дахь элементийн исэлдэлтийн түвшин тэг байна.
2. Зарим элементүүд нь бараг бүх нэгдлүүдэд исэлдэлтийн тогтмол төлөвийг харуулдаг. Эдгээр элементүүдэд:
+1 исэлдэлтийн төлөвтэй (металл гидридээс бусад).
O нь исэлдэлтийн төлөвтэй -2 (фтороос бусад).
3. Д.И.Менделеевийн элементүүдийн үелэх системийн үндсэн дэд бүлгүүдийн I, II, III бүлгийн элементүүд бүлгийн дугаартай тэнцүү тогтмол исэлдэлтийн төлөвтэй байна.
Na, Ba, Al элементүүд: исэлдэлтийн төлөв +1, +2, +3 тус тус.
4. Хувьсах исэлдэлтийн төлөвтэй элементүүдийн хувьд дээд ба доод исэлдэлтийн төлөв гэсэн ойлголт байдаг.
Элементийн исэлдэлтийн хамгийн их төлөв нь Д.И.Менделеевийн үелэх системийн элементүүдийн бүлгийн тоотой тэнцүү байна.
N, Cl элементүүд: хамгийн их исэлдэлтийн төлөв +5, +7.
Элементийн исэлдэлтийн хамгийн бага төлөв нь Д.И.Менделеевийн элементүүдийн үелэх системийн бүлгийн дугаартай тэнцүү бөгөөд үүнд хасах найм элемент байрладаг.
N, Cl элементүүд: хамгийн бага исэлдэлтийн төлөв -3, -1 тус тус.
5. Нэг элементтэй ионуудын хувьд элементийн исэлдэлтийн төлөв нь ионы цэнэгтэй тэнцүү байна.
Fe 3+ - исэлдэлтийн төлөв +3; S 2- - исэлдэлтийн төлөв -2.
6. Молекул дахь бүх элементийн атомын исэлдэлтийн төлөвийн нийлбэр тэг байна.
KNO 3; (+1) + X+ 3 · (-2) = 0; X= +5. Азотын исэлдэлтийн төлөв +5 байна.
7. Ионы бүх элементийн атомын исэлдэлтийн төлөвийн нийлбэр нь ионы цэнэгтэй тэнцүү байна.
SO 4 2-; X+ 4· (-2) = -2; X= +6. Хүхрийн исэлдэлтийн төлөв +6 байна.
8. Хоёр элементээс бүрдсэн нэгдлүүдийн баруун талд бичигдсэн элемент нь исэлдэлтийн хамгийн бага төлөвтэй байдаг.
Элементүүдийн исэлдэлтийн төлөв өөрчлөгдөх урвалыг исэлдэлтийн урвал /ORR/ гэж ангилдаг. Эдгээр урвалууд нь исэлдүүлэх, багасгах процессуудаас бүрддэг.
Исэлдэлтгэдэг нь атом, молекул эсвэл ионы нэг хэсэг болох элементийн электроныг өгөх үйл явц юм.
Al 0 – 3e = Al 3+
H 2 – 2e = 2H +
Fe 2+ - e = Fe 3+
2Cl - - 2e= Cl 2
Исэлдэлтийн үед элементийн исэлдэлтийн төлөв нэмэгддэг. Электрон өгдөг элемент агуулсан бодисыг (атом, молекул эсвэл ион) бууруулагч гэж нэрлэдэг. Al, H 2, Fe 2+, Cl - - бууруулагч бодисууд. Бууруулах бодис нь исэлддэг.
Сэргээхатом, молекул эсвэл ионы нэг хэсэг болох элементэд электрон нэмэх үйл явц юм.
Cl 2 + 2e = 2Cl -
Fe 3+ + e = Fe 2+
Бууруулах явцад элементийн исэлдэлтийн байдал буурдаг. Электрон хүлээн авах элемент агуулсан бодисыг (атом, молекул эсвэл ион) исэлдүүлэгч гэж нэрлэдэг. S, Fe 3+, Cl 2 нь исэлдүүлэгч бодис юм. Исэлдүүлэгч бодис багасна.
Химийн урвалын үед систем дэх электронуудын нийт тоо өөрчлөгддөггүй. Бууруулах бодисын өгсөн электронуудын тоо нь исэлдүүлэгчийн авсан электронуудын тоотой тэнцүү байна.
Уусмал дахь исэлдэх-багадах урвалын (ORR) тэгшитгэлийг бүрдүүлэхийн тулд ион-электрон аргыг (хагас урвалын арга) ашигладаг.
OVR нь хүчиллэг, төвийг сахисан эсвэл шүлтлэг орчинд тохиолдож болно. Урвалын тэгшитгэл нь орчны шинж чанараас хамааран уусмалд агуулагдах усны молекулууд (HOH) ба илүүдэл H + эсвэл OH - ионуудын боломжит оролцоог харгалзан үздэг.
хүчиллэг орчинд - HOH ба H + ионууд;
төвийг сахисан орчинд - зөвхөн NON;
шүлтлэг орчинд - HOH ба OH - ионууд.
OVR тэгшитгэлийг бүрдүүлэхдээ тодорхой дарааллыг баримтлах шаардлагатай.
1. Урвалын диаграммыг бич.
2.Исэлдэлтийн төлөвийг өөрчилсөн элементүүдийг ол.
3.Ион-молекул хэлбэрийн диаграммыг товч бичнэ үү: ион хэлбэрийн хүчтэй электролит, молекул хэлбэрийн сул электролит.
4. Исэлдэх, ангижруулах процессын тэгшитгэл зохиох (хагас урвалын тэгшитгэл). Үүнийг хийхийн тулд исэлдэлтийн төлөвийг бодит бөөмс (ион, атом, молекул) хэлбэрээр өөрчилдөг элементүүдийг бичиж, хагас урвалын зүүн ба баруун талд элемент тус бүрийн тоог тэнцүүл.
Жич:
Хэрэв эхлэлийн бодис нь бүтээгдэхүүнээс цөөн хүчилтөрөгчийн атом агуулдаг бол (P PO 4 3-) хүчилтөрөгчийн дутагдлыг хүрээлэн буй орчноос хангадаг.
Хэрэв эхлэлийн бодис нь бүтээгдэхүүнээс илүү хүчилтөрөгчийн атом агуулдаг бол (SO 4 2- SO 2) ялгарсан хүчилтөрөгч нь орчинд холбогддог.
5. Тэгшитгэлийн зүүн ба баруун талыг цэнэгийн тоогоор нь тэнцүүл. Үүнийг хийхийн тулд шаардлагатай тооны электроныг нэмж эсвэл хасах хэрэгтэй.
6.Исэлдүүлэх, ангижруулах хагас урвалын хүчин зүйлсийг сонгон исэлдэх үеийн электронуудын тоо нь ангижруулах үеийн электронуудын тоотой тэнцүү байна.
7.Олдсон хүчин зүйлсийг харгалзан исэлдэх, ангижруулах хагас урвалыг нэгтгэн дүгнэ.
8.Үүссэн ион-молекул тэгшитгэлийг молекул хэлбэрээр бич.
9. Хүчилтөрөгчийн шинжилгээ хийнэ.
Гурван төрлийн исэлдэлтийн урвал байдаг:
a) Молекул хоорондын - өөр өөр молекулуудыг бүрдүүлдэг элементүүдийн исэлдэлтийн төлөв өөрчлөгддөг урвалууд.
2KMnO 4 + 5NaNO 2 + 3H 2 SO 4 2MnSO 4 + 5NaNO 3 + K 2 SO 4 + 3H 2 O
б) Молекул доторх - нэг молекулыг бүрдүүлдэг элементүүдийн исэлдэлтийн төлөв өөрчлөгдөх урвалууд.
Исэлдэлтийн төлөвийн тооцоо
Дүгнэлт
1. Боловсон хүчнийг бүрдүүлэх нь боловсон хүчний менежерийн ажлын хамгийн чухал чиглэлүүдийн нэг юм.
2. Байгууллагыг шаардлагатай хүний нөөцөөр хангахын тулд гадаад орчин, үйл ажиллагааны технологи, компанийн бүтцэд тохирсон нөхцөл байдлыг бий болгох нь чухал юм; боловсон хүчний хэрэгцээг тооцоолох.
3. Ажилд авах хөтөлбөрийг боловсруулахын тулд тухайн бүс нутгийн боловсон хүчний нөхцөл байдалд дүн шинжилгээ хийж, нэр дэвшигчдийг татах, үнэлэх журмыг боловсруулж, байгууллагад шинэ ажилчдыг хамруулах дасан зохицох арга хэмжээ авах шаардлагатай.
Хяналтын асуултууд
- Байгууллагын бүтцийг бий болгохдоо ямар бүлэг хүчин зүйлсийг харгалзан үзэх шаардлагатай вэ?
- Байгууллагын дизайны ямар үе шатуудыг ялгаж салгаж болох вэ?
- “Боловсон хүчний хэрэгцээний чанарын үнэлгээ” гэсэн ойлголтыг тайлбарлана уу.
- “Нэмэлт боловсон хүчний хэрэгцээ” гэсэн ойлголтыг тайлбарлана уу.
- Бүс нутгийн боловсон хүчний нөхцөл байдалд дүн шинжилгээ хийх зорилго юу вэ?
- Гүйцэтгэлийн шинжилгээний зорилго юу вэ?
- Үйл ажиллагааны шинжилгээний ямар үе шатуудыг ялгаж болох вэ?
- Профессиограмм гэж юу болохыг тайлбарлана уу?
- Нэр дэвшигчдийг сонгон шалгаруулах үйл явцад хүрээлэн буй орчны ямар хүчин зүйл нөлөөлдөг вэ?
- Дотоод болон гадаад ажилд авах эх үүсвэрийг тайлбарлана уу.
- Багцын чанарыг хэрхэн үнэлэх вэ?
- Нэр дэвшигчдийг үнэлэхэд ямар арга хэрэглэдэг вэ?
- Та ямар өрсөлдөөнт ажилд авах парадигмуудыг мэддэг вэ?
- Байгууллага дахь ажилчдын дасан зохицох үе шатуудыг нэрлэнэ үү.
Элементийн исэлдэлтийн төлөвийг тооцоолохын тулд дараахь заалтуудыг анхаарч үзэх хэрэгтэй.
1. Энгийн бодис дахь атомуудын исэлдэлтийн төлөв 0-тэй тэнцүү байна (Na 0; H 2 0).
2. Молекулыг бүрдүүлэгч бүх атомын исэлдэлтийн төлөвийн алгебрийн нийлбэр үргэлж тэгтэй тэнцүү байх ба комплекс ионы хувьд энэ нийлбэр нь ионы цэнэгтэй тэнцүү байна.
3. Атомууд нь тогтмол исэлдэлтийн төлөвтэй байна: шүлтлэг металл (+1), шүлтлэг шороон металл (+2), устөрөгч (+1) (устөрөгчийн исэлдэлтийн төлөв нь - NaH, CaH 2 гэх мэт гидридээс бусад). 1), хүчилтөрөгч (-2 ) (F 2 -1 O +2 ба хүчилтөрөгчийн исэлдэлтийн төлөв нь -1 байдаг –O–O– бүлэг агуулсан хэт исэлээс бусад).
4. Элементүүдийн хувьд эерэг исэлдэлтийн төлөв нь үечилсэн системийн бүлгийн дугаартай тэнцүү утгаас хэтэрч болохгүй.
Жишээ нь:
V 2 +5 O 5 -2; Na 2 +1 B 4 +3 O 7 -2; K +1 Cl +7 O 4 -2; N -3 H 3 +1; K 2 +1 H +1 P +5 O 4 -2; Na 2 +1 Cr 2 +6 O 7 -2
Хоёр төрлийн химийн урвал байдаг:
A Элементүүдийн исэлдэлтийн төлөв өөрчлөгддөггүй урвалууд:
Нэмэлт урвалууд
SO 2 + Na 2 O Na 2 SO 3
Задрах урвалууд
Cu(OH) 2 – t CuO + H 2 O
Солилцооны урвал
AgNO 3 + KCl AgCl + KNO 3
NaOH + HNO 3 NaNO 3 + H 2 O
B Урвалж буй нэгдлүүдийг бүрдүүлдэг элементүүдийн атомуудын исэлдэлтийн төлөвт өөрчлөлт орсон урвалууд:
2Mg 0 + O 2 0 2Mg +2 O -2
2KCl +5 O 3 -2 – t 2KCl -1 + 3O 2 0
2KI -1 + Cl 2 0 2KCl -1 + I 2 0
Mn +4 O 2 + 4HCl -1 Mn +2 Cl 2 + Cl 2 0 + 2H 2 O
Ийм урвалыг нэрлэдэг redox.
Химийн урвал гэдэг нь анхдагч бодисыг урвалын бүтээгдэхүүн болгон хувиргах үйл явц юм. Урвал дууссаны дараа олж авсан бодисыг бүтээгдэхүүн гэж нэрлэдэг. Тэдгээр нь бүтэц, найрлага эсвэл хоёулангийнх нь хувьд анхныхаас ялгаатай байж болно.
Бүтцийн өөрчлөлтөөс хамааран дараахь төрлийн химийн урвалуудыг ялгадаг.
- бүрэлдэхүүний өөрчлөлттэй (ихэнх нь);
- найрлагыг өөрчлөхгүйгээр (нэг аллотропийн өөрчлөлтийг нөгөөд нь изомержуулах, хувиргах).
Хэрэв урвалын үр дүнд бодисын найрлага өөрчлөгдөөгүй бол түүний бүтэц өөрчлөгдөх ёстой, жишээлбэл: Кграфит↔Салмаз
Найрлагын өөрчлөлттэй холбоотой химийн урвалын ангиллыг илүү нарийвчлан авч үзье.
I. Бодисын тоо, найрлагын дагуу
Нийлмэл урвалууд
Ийм химийн процессын үр дүнд хэд хэдэн бодисоос нэг бодис үүсдэг: A + B + ... = C
Холбох боломжтой:
- энгийн бодисууд: 2Na + S = Na2S;
- комплекстэй энгийн: 2SO2 + O2 = 2SO3;
- хоёр нийлмэл: CaO + H2O = Ca(OH)2.
- хоёроос илүү бодис: 4Fe + 3O2 + 6H2O = 4Fe(OH)3
Задрах урвалууд
Ийм урвалын нэг бодис хэд хэдэн бодис болж задардаг: A=B+C+...
Энэ тохиолдолд бүтээгдэхүүн нь дараахь байж болно.
- энгийн бодисууд: 2NaCl = 2Na + Cl2
- энгийн бөгөөд төвөгтэй: 2KNO3 = 2KNO2 + O2
- хоёр төвөгтэй нэг нь: CaCO3 = CaO + CO2
- хоёроос дээш бүтээгдэхүүн: 2AgNO3 = 2Ag + O2 + 2NO2
Орлуулах урвалууд
Энгийн ба нийлмэл бодисууд хоорондоо урвалд орж, энгийн бодисын атомууд нийлмэл нэг элементийн атомыг орлуулдаг ийм урвалыг орлуулах урвал гэж нэрлэдэг. Схемийн хувьд атомыг орлуулах үйл явцыг дараах байдлаар харуулж болно: A + BC = B + AC.
Жишээлбэл, CuSO4 + Fe = FeSO4 + Cu
Солилцооны урвал
Энэ бүлэгт AB + CD = AD + CB гэсэн хоёр нийлмэл бодисууд хэсгүүдээ солилцох урвалууд орно. Бертоллегийн дүрмийн дагуу, дор хаяж нэг бүтээгдэхүүн байвал ийм урвал эргэлт буцалтгүй тохиолдох боломжтой.
- тунадас (уусдаггүй бодис): 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4;
- бага диссоциацийн бодис: NaOH + HCl = NaCl + H2O;
- хий: NaOH + NH4Cl = NaCl + NH3 + H2O (эхлээд аммиак гидрат NH3 H2O үүсдэг бөгөөд энэ нь хүлээн авсны дараа шууд аммиак ба ус руу задардаг).
II. Дулааны нөлөөгөөр
- Экзотермик
- дулаан ялгаруулахтай холбоотой үйл явц:
C + O2 = CO2 + Q - Эндотермик
- дулаан шингээх урвалууд:
Cu(OH)2 = CuO + H2O – Q
III. Химийн урвалын төрөл, чиглэл
- Буцах боломжтойЭнэ нь урагш ба урвуу чиглэлд нэгэн зэрэг явагдах урвалууд юм: N2+O2 ↔ 2NO
- Эргэж буцахгүй процессууд дуусч, өөрөөр хэлбэл урвалд орж буй бодисуудын дор хаяж нэг нь бүрэн дуусах хүртэл үргэлжилнэ. Эргэшгүй солилцооны урвалын жишээг дээр авч үзсэн.
IV. Катализатор байгаагийн дагуу

V. Бодисын нэгдлийн төлөвийн дагуу
- Хэрэв бүх урвалжууд нэгдэх төлөвт байгаа бол урвалыг дуудна нэгэн төрлийн. Ийм үйл явц бүхэл бүтэн эзлэхүүнд тохиолддог. Жишээ нь: NaOH + HCl = NaCl + H2O
- Нэг төрлийн бус Интерфейс дээр үүсдэг нэгтгэх янз бүрийн төлөвт байгаа бодисуудын хоорондох урвалууд юм. Жишээ нь: Zn + 2HCl = ZnCl2 + H2
VI. Урвалж буй бодисын исэлдэлтийн төлөвийн өөрчлөлт дээр үндэслэсэн химийн урвалын төрлүүд
- Redox (ORR) - урвалд орж буй бодисын исэлдэлтийн төлөв өөрчлөгдөх урвалууд.
- Гарч буй урвалууд исэлдэлтийн төлөвийг өөрчлөхгүйгээр урвалжууд (BISO).

Шатаах, орлуулах үйл явц нь үргэлж исэлдэлтийн процесс юм. Бодисын исэлдэлтийн төлөвийг өөрчлөхгүйгээр солилцооны урвал явагддаг. Бусад бүх процессууд нь OVR эсвэл BIOS байж болно.
1. Редокс урвалыг хэрхэн тодорхойлох вэ?
Химийн урвалын янз бүрийн ангилал байдаг. Тэдгээрийн нэг нь бие биетэйгээ харилцан үйлчилдэг бодисууд (эсвэл бодис өөрөө) элементүүдийн исэлдэлтийн төлөвийг өөрчилдөг бодисуудыг агуулдаг.
Жишээ болгон хоёр урвалыг авч үзье.
Zn 0 + 2Н +1 С1 -1 = Zn +2 Cl 2 -1 + Н 2 0 (1)
H +1 Cl -1 + K +1 O -2 H +1 = K +1 Cl -1 + H 2 +1 O -2 (2)
Урвал (1) нь цайр болон давсны хүчил. Цайр ба устөрөгч нь исэлдэлтийн төлөвөө өөрчилдөг бол хлор нь исэлдэлтийн төлөвөө хэвээр үлдээдэг.
Zn 0 - 2е = Zn 2+
2Н +1 + 2е = H 2 0
2Сl -1 = 2 Сl -1
Мөн урвалд (2), ( саармагжуулах урвал), хлор, устөрөгч, кали, хүчилтөрөгч нь исэлдэлтийн төлөвөө өөрчилдөггүй: Cl -1 = Cl -1, H +1 = H +1, K +1 = K +1, O -2 = O -2; Урвал (1) нь исэлдэлтийн төрөлд, урвал (2) нь өөр төрөлд хамаарна.
Өөрчлөлтийг агуулсан химийн урвалуудЭлементүүдийн исэлдэлтийн төлөв, редокс гэж нэрлэдэг. 
Редокс урвалыг тодорхойлохын тулд үүнийг тогтоох шаардлагатай тал хээрэлементүүдийн исэлдэлт байхгүйтэгшитгэлийн зүүн ба баруун талд. Үүнийг хийхийн тулд та тодорхой элементийн исэлдэлтийн төлөвийг хэрхэн тодорхойлохыг мэдэх хэрэгтэй.
Урвалын (1) тохиолдолд Zn ба H элементүүд нь электроноо алдаж эсвэл олж авах төлөвөө өөрчилдөг. Цайр нь 2 электроноос татгалзаж ионы төлөвт ордог - энэ нь Zn 2+ катион болдог. Энэ тохиолдолд процесс явагдана сэргээхмөн цайр исэлддэг. Устөрөгч нь 2 электрон авдаг исэлдүүлэхшинж чанар, өөрөө урвалын үйл явцад сэргээн засварлаж байна.
2. ТодорхойлолтЭлементүүдийн исэлдэлтийн төлөв.
Элементүүдийн исэлдэлтийн төлөвөгөгдсөн нэгдлийн бүх элементийн исэлдэлтийн төлөвийн нийт цэнэг тэгтэй тэнцүү байх байрлалд үндэслэн түүний нэгдлүүдийг тодорхойлно. Жишээлбэл, нэгдэл H 3 PO 4 исэлдэлтийн төлөв нь устөрөгчийн хувьд +1, фосфорын хувьд +5, хүчилтөрөгчийн хувьд -2; Математикийн тэгшитгэл зохиосны дараа бид нийт дүнг тодорхойлно бөөмсийн тоо(атом эсвэл ион) нь тэгтэй тэнцүү цэнэгийг бүрдүүлнэ: (+1)x3+(+5)+(-2)x4 = 0
Гэхдээ энэ жишээнд элементүүдийн исэлдэлтийн төлөвийг аль хэдийн зааж өгсөн болно. Жишээлбэл, нэгдэл дэх хүхрийн исэлдэлтийн төлөвийг хэрхэн тодорхойлох вэ? натрийн тиосульфат Na 2 S 2 O 3 буюу нэгдэл дэх манган калийн перманганат- KMnO 4? Үүнийг хийхийн тулд та мэдэх хэрэгтэй олон тооны элементийн тогтмол исэлдэлтийн төлөв. Тэд дараах утгатай байна.
1) Үелэх системийн I бүлгийн элементүүд (металл бус устөрөгчийг оруулаад) +1;
2) Үелэх системийн II бүлгийн элементүүд +2;
3) Үелэх системийн III бүлгийн элементүүд +3;
4) Хүчилтөрөгч (фтор эсвэл хэт ислийн нэгдлүүдийг хослуулахаас бусад) -2;
Исэлдэлтийн төлөвийн эдгээр тогтмол утгууд (натри ба хүчилтөрөгчийн хувьд) дээр үндэслэн бид тодорхойлно исэлдэлтийн төлөв Na 2 S 2 O 3 нэгдэл дэх хүхэр. Элементүүдийн бүх исэлдэлтийн төлөвийн нийт цэнэгийн хувьд найрлага нь өгөгдсөн хэмжээгээр тусгагдсан байдаг нийлмэл томъёо, тэгтэй тэнцүү, тэгвэл хүхрийн үл мэдэгдэх цэнэгийг илэрхийлнэ. 2X"(томъёонд хоёр хүхрийн атом байгаа тул) бид дараах математикийн тэгшитгэлийг үүсгэнэ.
(+1) x 2 + 2X+ (-2) x 3 = 0
Энэ тэгшитгэлийг 2 х-ээр шийдвэл бид олж авна
2X= (-1) x 2 + (+2) x 3
эсвэл
X = [(-2) + (+6)] : 2 = +2;
Тиймээс Na 2 S 2 O 3 нэгдэл дэх хүхрийн исэлдэлтийн төлөв (+2) тэнцүү байна. Гэхдээ нэгдлүүдийн зарим элементийн исэлдэлтийн төлөвийг тодорхойлохын тулд ийм тохиромжгүй аргыг үргэлж ашиглах шаардлагатай байх болов уу? Мэдээж үргэлж биш. Жишээлбэл, хоёртын нэгдлүүдийн хувьд: исэл, сульфид, нитрид гэх мэт исэлдэлтийн төлөвийг тодорхойлохын тулд "загалмайн хөндлөн" гэж нэрлэгддэг аргыг ашиглаж болно. Өгөгдсөн гэж үзье нийлмэл томъёо:титаны исэл– Ti 2 O 3 . Хүчилтөрөгчийн исэлдэлтийн төлөв нь бидэнд мэдэгдэж байгаа бөгөөд (-2): Ti 2 O 3-тай тэнцүү байна гэсэн үндсэн дээр энгийн математикийн шинжилгээг ашиглан титаны исэлдэлтийн төлөв нь тэнцүү байх болно гэдгийг тогтооход хэцүү биш юм. (+3). Эсвэл, жишээ нь, холбоотой метан CH 4 нь устөрөгчийн исэлдэлтийн төлөвийг (+1) мэддэг бол нүүрстөрөгчийн исэлдэлтийн төлөвийг тодорхойлоход хэцүү биш юм. Энэ нь энэ нэгдлийн томьёотой тохирч байх болно (-4). Түүнчлэн, "загалмайн дээр" аргыг ашиглан дараах тохиолдолд гэдгийг тогтооход хэцүү биш юм нийлмэл томъёо Cr 4 Si 3, дараа нь хромын исэлдэлтийн төлөв (+3), цахиур (-4) байна.
Давсны хувьд энэ нь бас хэцүү биш юм. Түүгээр ч барахгүй өгөгдсөн эсэх нь хамаагүй дунд зэргийн давсэсвэл хүчиллэг давс. Эдгээр тохиолдолд давс үүсгэгч хүчлээс эхлэх шаардлагатай. Жишээлбэл, давс өгдөг натрийн нитрат(NaNO 3). Энэ нь азотын хүчлийн дериватив (HNO 3) бөгөөд энэ нэгдэлд азотын исэлдэлтийн төлөв (+5) байдаг тул түүний давс - натрийн нитрат дахь азотын исэлдэлтийн төлөв нь мөн тэнцүү байна. +5). Натрийн бикарбонат(NaHCO 3) нь нүүрстөрөгчийн хүчлийн хүчил давс юм (H 2 CO 3). Хүчилтэй адил энэ давс дахь нүүрстөрөгчийн исэлдэлтийн төлөв (+4) тэнцүү байх болно.
Металл ба металл бус (эмхэтгэх үед) нэгдлүүдийн исэлдэлтийн төлөв байдгийг тэмдэглэх нь зүйтэй. электрон балансын тэгшитгэл) тэгтэй тэнцүү байна: K 0, Ca 0, Al 0, H 2 0, Cl 2 0, N 2 0 Жишээ болгон бид хамгийн ердийн элементүүдийн исэлдэлтийн төлөвийг өгөв.

Зөвхөн исэлдүүлэгч бодисууд нь хамгийн их, ихэвчлэн эерэг исэлдэлтийн төлөвтэй бодисууд юм, жишээлбэл: KCl +7 O 4, H 2 S +6 O 4, K 2 Cr +6 O 4, HN +5 O 3, KMn +7. O 4. Үүнийг батлахад хялбар. Хэрэв эдгээр нэгдлүүд нь бууруулагч бодис байж болох юм бол эдгээр төлөвт тэд электроноо өгөх ёстой:
Cl +7 – e = Cl +8
S +6 – e = S +7
Гэхдээ хлор ба хүхрийн элементүүд ийм исэлдэлтийн төлөвтэй байж чадахгүй. Үүний нэгэн адил, зөвхөн бууруулагч бодисууд нь хамгийн бага, ихэвчлэн сөрөг исэлдэлтийн төлөвтэй бодисууд юм, жишээлбэл: H 2 S -2, HJ -, N -3 H 3. Редокс урвалын явцад ийм нэгдлүүд исэлдүүлэгч бодис байж чадахгүй, Учир нь тэд электрон нэмэх шаардлагатай болно:
S -2 + e = S -3
J - + e = J -2
Гэхдээ хүхэр, иодын хувьд ийм исэлдэлтийн төлөвтэй ионууд нь ердийн зүйл биш юм. Завсрын исэлдэлтийн төлөвтэй элементүүд, жишээлбэл, N +1, N +4, S +4, Cl +3, C +2 нь исэлдүүлэх болон багасгах шинж чанарыг хоёуланг нь харуулж чадна.
3
. Редокс урвалын төрлүүд.
Дөрвөн төрлийн исэлдэлтийн урвал байдаг.
1)
Молекул хоорондын исэлдэлтийн урвал.
Хамгийн түгээмэл урвалын төрөл. Эдгээр урвалууд өөрчлөгддөг исэлдэлтийн төлөвэлементүүдянз бүрийн молекулуудад, жишээ нь:
2Bi +3 Cl 3 + 3Sn +2 Cl 2 = 2Bi 0 + 3Sn +4 Cl 4
Би +3 - 3 д= Bi 0
Sn +2 + 2 д= Sn +4
2) Молекул хоорондын исэлдэлтийн урвалын нэг төрөл бол урвал юм харьцаа,исэлдүүлэгч бодис ба бууруулагч бодис нь ижил элементийн атомууд байдаг: энэ урвалд өөр өөр исэлдэлтийн төлөвтэй нэг элементийн хоёр атом нь өөр исэлдэлтийн төлөвтэй нэг атом үүсгэдэг.
SO 2 +4 + 2H 2 S -2 = 3S 0 + 2H 2 O
S -2 - 2 д= S 0
S+4+4 д= S 0
3) Хариу үйлдэл пропорциональ бус байдалХэрэв исэлдүүлэгч ба ангижруулагч нь ижил элементийн атомууд эсвэл нэг исэлдэлтийн төлөвтэй элементийн нэг атом нь хоёр исэлдэлтийн төлөвтэй нэгдэл үүсгэдэг бол гүйцэтгэнэ.
N +4 O 2 + NaOH = NaN +5 O 3 + NaN +3 O 2 + H 2 O
N +4 - д= N +5
N +4 + д= N +3
4) Молекул доторхИсэлдүүлэгч атом ба бууруулагч атом нь ижил бодист байх тохиолдолд исэлдүүлэх урвал явагдана, жишээлбэл:
N -3 H 4 N +5 O 3 = N +1 2 O + 2H 2 O
2N -3 - 8 д=2N +1
2N +5 + 8 д= 2N +1
4 . Редокс урвалын механизм.
Редокс урвал нь нэг элементийн атомаас нөгөөд электрон шилжих замаар явагддаг. Хэрэв атом эсвэл молекул электроноо алдвал энэ процессыг исэлдэлт гэж нэрлэдэг бөгөөд энэ атом нь бууруулагч бодис юм, жишээлбэл:
Аль 0 - 3 д= Al 3+
2Cl - - 2 д= Cl 2 0
Fe 2+ - д= Fe 3+
Эдгээр жишээн дээр Al 0, Cl -, Fe 2+ нь ангижруулагч бодисууд бөгөөд тэдгээрийг Al 3+, Cl 2 0, Fe 3+ нэгдэл болгон хувиргах процессыг исэлдүүлэгч гэж нэрлэдэг. Хэрэв атом эсвэл молекул электрон авдаг бол энэ процессыг бууралт гэж нэрлэдэг бөгөөд энэ атом нь исэлдүүлэгч бодис юм, жишээлбэл:
Ca 2+ + 2 д= Ca 0
Cl 2 0 + 2 д= 2Cl -
Fe 3++ д= Fe 2+
Исэлдүүлэгч бодисууд нь дүрмээр бол металл бус (S, Cl 2, F 2, O 2) эсвэл хамгийн их исэлдэлтийн төлөвтэй (Mn +7, Cr +6, Fe +3) металлын нэгдлүүд юм. Бууруулах бодисууд нь метал (K, Ca, Al) эсвэл хамгийн бага исэлдэлтийн төлөвтэй металл бус нэгдлүүд (S -2, Cl -1, N -3, P -3);
 Редокс тэгшитгэлүүд нь ялгаатай молекулын тэгшитгэлурвалд орох бодис ба урвалын бүтээгдэхүүний коэффициентийг сонгох нарийн төвөгтэй байдлаас үүдэлтэй бусад урвалууд. Үүний тулд тэд ашигладаг электрон балансын арга, эсвэл электрон-ион тэгшитгэлийн арга(заримдаа сүүлийнх нь " хагас урвалын арга"). Редокс урвалын тэгшитгэлийг эмхэтгэх жишээ болгон процессыг авч үзье төвлөрсөн хүхрийн хүчил(H 2 SO 4) устөрөгчийн иодид (HJ) -тай урвалд орно:
Редокс тэгшитгэлүүд нь ялгаатай молекулын тэгшитгэлурвалд орох бодис ба урвалын бүтээгдэхүүний коэффициентийг сонгох нарийн төвөгтэй байдлаас үүдэлтэй бусад урвалууд. Үүний тулд тэд ашигладаг электрон балансын арга, эсвэл электрон-ион тэгшитгэлийн арга(заримдаа сүүлийнх нь " хагас урвалын арга"). Редокс урвалын тэгшитгэлийг эмхэтгэх жишээ болгон процессыг авч үзье төвлөрсөн хүхрийн хүчил(H 2 SO 4) устөрөгчийн иодид (HJ) -тай урвалд орно:
H 2 SO 4 (конц.) + HJ → H 2 S + J 2 + H 2 O
Юуны өмнө үүнийг тогтооё исэлдэлтийн төлөвУстөрөгчийн иодид дахь иод (-1), хүхрийн хүчил дэх хүхэр: (+6). Урвалын явцад иод (-1) молекул төлөвт исэлдэж, хүхэр (+6) исэлдэлтийн төлөвт (-2) - устөрөгчийн сульфид хүртэл буурна.
J - → J 0 2
S +6 → S -2
Үүнийг зохиохын тулд үүнийг анхаарч үзэх хэрэгтэй тоо хэмжээтоосонцорхагас урвалын зүүн ба баруун талын атомууд ижил байх ёстой
2J - - 2 д→ J 0 2
S +6 + 8 д→ S -2
Энэхүү хагас урвалын диаграммын баруун талд босоо шугамыг байрлуулснаар бид урвалын коэффициентийг тодорхойлно.
2J - - 2 д→ J 0 2 |8
S +6 + 8 д→ S -2 |2
"2" -оор бууруулснаар бид эцсийн коэффициент утгыг авна.
2J - - 2 д→ J 0 2 |4
S +6 + 8 д→ S -2 |1
Энэ диаграмын дор нэгтгэн дүгнэж үзье хагас урвалуудхэвтээ шугам ба урвалд юу оролцож байгааг нэгтгэн дүгнэ бөөмсийн тооатомууд:
2J - - 2 д→ J 0 2 |4
S +6 + 8 д→ S -2 |1
____________________
8J - + S +6 → 4 J 0 2 + S -2
Үүний дараа зайлшгүй шаардлагатай. Коэффициентуудын олж авсан утгыг молекул тэгшитгэлд орлуулснаар бид үүнийг дараах хэлбэрт оруулав.
8HJ + H 2 SO 4 = 4J 2 + H 2 S + H 2 O
Тэгшитгэлийн зүүн ба баруун талд байгаа устөрөгчийн атомын тоог тоолсноор бид усны өмнө "4" коэффициентийг засах шаардлагатай гэдэгт итгэлтэй байж, бүрэн тэгшитгэлийг олж авна.
8HJ + H 2 SO 4 = 4J 2 + H 2 S + 4H 2 O
Энэ тэгшитгэлийг ашиглан үүсгэж болно цахим аргаионы тэнцвэр. Энэ тохиолдолд усны молекулуудын өмнө коэффициентийг засах шаардлагагүй болно. Уг тэгшитгэл нь урвалд оролцож буй нэгдлүүдийн ионуудын диссоциац дээр суурилдаг: Жишээлбэл, хүхрийн хүчлийн диссоциациҮүний үр дүнд хоёр устөрөгчийн протон ба сульфатын анион үүсдэг.
H 2 SO 4 ↔ 2H + + SO 4 2-
Устөрөгчийн иодид ба устөрөгчийн сульфидын диссоциацийг ижил төстэй байдлаар бичиж болно.
HJ ↔ N + + J -
H 2 S ↔ 2Н + + S 2-
J 2 нь салдаггүй. H 2 O мөн бараг салдаггүй.Бүтэц хагас урвалын тэгшитгэлйодын хувьд ижил хэвээр байна:
2J - - 2 д→ J 0 2
Хүхрийн атомын хагас урвал дараах хэлбэртэй байна.
SO 4 -2 → S -2
Хагас урвалын баруун талд дөрвөн хүчилтөрөгчийн атом дутагдаж байгаа тул энэ хэмжээг устай тэнцвэржүүлэх шаардлагатай.
SO 4 -2 → S -2 + 4H 2 O
Дараа нь хагас урвалын зүүн талд протоны зардлаар устөрөгчийн атомыг нөхөх шаардлагатай (учир нь орчны урвал нь хүчиллэг байдаг):
SO 4 2- + 8H + → S -2 + 4H 2 O
Дамжуулсан электронуудын тоог тоолсноор бид тэгшитгэлийн бүрэн дүрслэлийг олж авна хагас урвалын арга:
SO 4 2- + 8Н + + 8 д→ S -2 + 4H 2 O
Хагас урвалын аль алиныг нь нэгтгэн дүгнэвэл бид олж авна электрон балансын тэгшитгэл:
2J - - 2 д→ J 0 2 |8 4
SO 4 2- + 8Н + + 8 д→ S -2 + 4H 2 O |2 1
8J - + SO 4 2- +8H + → 4J 2 0 + S 0 + 4H 2 O
Энэ оруулгаас энэ нь дараах арга юм электрон-ионы тэгшитгэл-ээс илүү исэлдэлтийн урвалын бүрэн дүр зургийг өгдөг электрон балансын арга.Уг процесст оролцож буй электронуудын тоо нь тэнцвэржүүлэх хоёр аргын хувьд адилхан боловч сүүлийн тохиолдолд исэлдэлтийн процесст оролцож буй протон ба усны молекулуудын тоо "автоматаар" тогтоогдсон мэт байна.
Энэ аргыг ашиглан эмхэтгэх боломжтой исэлдэлтийн урвалын хэд хэдэн тодорхой тохиолдлыг авч үзье электрон-ионы тэнцвэр. Зарим исэлдэлтийн процессыг шүлтлэг орчны оролцоотойгоор гүйцэтгэдэг, жишээлбэл:
KCrO 2 + Br 2 + KOH → KBr + K 2 CrO 4 +H 2 O
Энэ урвалын бууруулагч нь хромит ион (CrO 2 -) бөгөөд энэ нь хромат ион (CrO -2 4) болж исэлддэг. Исэлдүүлэгч бодис - бром (Br 0 2) нь бромидын ион (Br -) болж буурдаг.
CrO 2 - → CrO 4 2-
Br 0 2 → 2 Br -
Урвал нь шүлтлэг орчинд явагддаг тул эхний хагас урвалыг гидроксидын ионуудыг (OH -) харгалзан үзэх ёстой.
CrO 2 - + 4OH - - 3 д= CrO 2- 4 + 2H 2 O
Бид хоёр дахь хагас урвалыг сайн мэддэг арга замаар хийдэг.
CrO 2 - + 4OH - -3 д= CrO 4 2 - + 2H 2 O |2
Br 0 2 + 2 д= Br - |3
__________
2CrO 2 - + 3Br 2 0 + 8OH - = 2CrO 2- 4 + 6Br - + 4H 2 O
Үүний дараа эцэст нь хийх шаардлагатай байна урвалын тэгшитгэлд коэффициентийг оноохмөн бүрэн молекулын тэгшитгэлЭнэхүү исэлдэлтийн процесс нь дараах хэлбэртэй болно.
2KCrO 2 + 3Br 2 + 8KOH = 2K 2 CrO 4 + 6KBr + 4H 2 O.
Зарим тохиолдолд задрахгүй бодисууд нь исэлдэлтийн урвалд оролцдог. Жишээлбэл:
AsH 3 + HNO 3 = H 3 AsO 4 + NO 2 + 4H 2 O
Дараа нь хагас урвалын аргаЭнэ үйл явцыг харгалзан эмхэтгэсэн:
AH 3 + 4H 2 O – 8 д= AsO 4 3- + 11H + |1
NO 3 + 2H + + д= NO 2 + H 2 O |8
AH 3 + 8NO 3 + 4H 2 O + 2H + = AsO 4 3- + 8NO 2 + 11H + O
Молекулын тэгшитгэлхэлбэрийг авна:
AsH 3 + 8HNO 3 = H 3 AsO 4 + 8NO 2 + 4H 2 O.
Редокс урвалыг заримдаа хэд хэдэн бодисыг исэлдүүлэх-бууруулах үйл явц дагалддаг. Жишээлбэл, зэсийн сульфидтэй урвалд ордог төвлөрсөн азотын хүчил:
Cu 2 S + HNO 3 = Cu(NO 3) 2 + H 2 SO 4 + NO + H 2 O
Редокс процесст зэс, хүхэр, азотын атомууд оролцдог. Тэгшитгэл зохиохдоо хагас урвалын аргаЭнэ үйл явцын үе шатуудыг харгалзан үзэх шаардлагатай.
Cu+ → Cu2+
S 2- → S +6
N 5+ → N +2
Энэ тохиолдолд исэлдэлтийн болон бууралтын процессыг нэг үе шатанд нэгтгэх шаардлагатай.
2Cu + - 2 д→ 2Cu 2+ | 10 д
S 2- - 8 д→ S 6+
_______________________
N 5+ + 3 д→ N 2+ | 3 д
Редокс хагас урвал дараах хэлбэртэй байна.
2Cu + - 2 д→ 2Cu 2+
S 2- - 8 д→ S 6+ 3 ( нөхөн сэргээх үйл явц)
_______________________
N 5+ + 3 д→ N 2+ 10 (исэлдэлтийн процесс)
_____________________________________
6Cu + + 3S 2- + 10N 5+ → 6Cu 2+ + 3S 6+ + 10N 2+
Эцэст нь молекулын урвалын тэгшитгэлхэлбэрийг авна:
3Cu 2 S + 22HNO 3 = 6Cu(NO 3) 2 + 3H 2 SO 4 + 10NO + 8H 2 O.
Органик бодис агуулсан исэлдэлтийн урвалд онцгой анхаарал хандуулах хэрэгтэй. Жишээлбэл, глюкозын исэлдэлтийн үед калийн перманганатхүчиллэг орчинд дараах урвал явагдана.
C 6 H 12 O 6 + KMnO 4 + H 2 SO 4 > CO 2 + MnSO 4 + K 2 SO 4 + H 2 O
Үлдэгдэл гаргахдаа хагас урвалын аргаглюкозын хувиргалт, түүний задралгүй байдлыг харгалзан үздэг боловч протон ба усны молекулуудын улмаас устөрөгчийн атомын тоог залруулдаг.
C 6 H 12 O 6 + 6H 2 O - 24 д= 6CO 2 + 24H +
Хагас урвал оролцоно калийн перманганатхэлбэрийг авна:
MnO 4 - + 8H + + 5 д= Mn 2+ +4H 2 O
Үүний үр дүнд бид исэлдэлтийн процессын дараах схемийг олж авна.
C 6 H 12 O 6 + 6H 2 O - 24 д= 6CO 2 + 24H + | 5
MnО 4 - +8H + + 5 д= Mn +2 + 4H 2 O |24
___________________________________________________
5C 6 H 12 O 6 + 30H 2 O + 24MnO 4 - + 192H + = 30CO 2 + 120H + + 24Mn 2+ + 96H 2 O
Зүүн болон баруун талд байгаа протон, усны молекулуудын тоог багасгах замаар хагас урвалууд, бид финалыг авна молекулын тэгшитгэл:
5C 6 H 12 O 6 + 24KMnO 4 + 36H 2 SO 4 = 30CO 2 + 24MnSO 4 + 12K 2 SO 4 + 66H 2 O
5. Редокс урвалын шинж чанарт хүрээлэн буй орчны нөлөө.
Орчноос хамаарч (илүүдэл H +, саармаг, илүүдэл OH -) ижил бодисуудын хоорондын урвалын шинж чанар өөрчлөгдөж болно. Ихэвчлэн хүчиллэг орчинг бий болгоход ашигладаг хүхрийн хүчил(H 2 SO 4), Азотын хүчил(HNO 3), давсны хүчил (HCl), натрийн гидроксид (NaOH) эсвэл калийн гидроксид (KOH) нь OH орчин болгон ашигладаг. Жишээлбэл, байгаль орчин хэрхэн нөлөөлж байгааг харуулах болно калийн перманганат(КMnO 4) . ба түүний урвалын бүтээгдэхүүн:

Жишээлбэл, Na 2 SO 3 -ийг ангижруулагч, KMnO 4 -ийг исэлдүүлэгч бодис болгон авч үзье.
Хүчиллэг орчинд:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 → 5Na 2 SO 4 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
SO 3 2- + H 2 O - 2 д→ SO 4 2- + 2H + |5
MnO 4 - + 8H + + 5 д→ Mn 2+ + 4H 2 O |2
________________________________________________
5SO 3 2- + 2MnO 4 - + 6H + → 5SO 4 2- + 2Mn 2+ + 3H 2 O
Төвийг сахисан (эсвэл бага зэрэг шүлтлэг):
3Na 2 SO 3 + 2KMnO 4 + H 2 O → 3Na 2 SO 4 + 2MnO 2 + 2KOH
SO 3 2- + H 2 O - 2 д→ SO 4 2- + 2H + |3
MnO 4 - + 2H 2 O + 3 д→ MnO 2 + 4OH |2
_____________________________________
3SO 3 2- + 2 MnO 4 - + H 2 O → 3SO 4 2- + 2MnO 2 + 2OH
Өндөр шүлтлэг орчинд:
Na 2 SO 3 + 2KMnO 4 + 2NaOH → Na 2 SO 4 + K 2 MnO 4 + Na 2 MnO + H 2 O
SO 3 2- + 2 OH - - 2 д→ SO 4 2- + H 2 O |1
MnO 4 - + д→ MnO 4 2 |2
____________________________________
SO 3 2- + 2 MnO 4 - + 2OH → SO 4 2- + 2MnO 4 2- + H 2 O
Устөрөгчийн хэт исэл(H 2 O 2) хүрээлэн буй орчноос хамааран дараахь схемийн дагуу буурна.
1) Хүчиллэг орчин (H +) H 2 O 2 + 2H + + 2 д→ 2H 2 O
2) Төвийг сахисан орчин (H 2 O) H 2 O 2 + 2 д→ 2OH
3) Шүлтлэг орчин (OH -) H 2 O 2 + 2 д→ 2OH
Устөрөгчийн хэт исэл(H 2 O 2) нь исэлдүүлэгч бодисоор ажилладаг.
2FeSO 4 + H 2 O 2 + H 2 SO 4 → Fe 2 (SO 4) 3 + 2H 2 O
Fe 2+ - д= Fe 3+ |2
H 2 O 2 + 2H + + 2 д= 2H 2 O |1
________________________________
2Fe 2+ + H 2 O 2 + 2H + → 2Fe 3+ + 2 H 2 O
Гэсэн хэдий ч маш хүчтэй исэлдүүлэгч бодисуудтай тулгарах үед (KMnO 4) Устөрөгчийн хэт исэл(H 2 O 2) нь бууруулагчийн үүрэг гүйцэтгэдэг:
5H 2 O 2 + 2KMnO 4 + 3H 2 SO 4 → 5O 2 + 2MnSO 4 + K 2 SO 4 + 8H 2 O
H 2 O 2 – 2 д→ O 2 + 2H + |5
MnO 4 - + 8H + + 5 д→ Mn 2+ + 4H 2 O |2
_________________________________
5H 2 O + 2 MnO 4 - + 6H + → 5O 2 + 2Mn 2+ + 8H 2 O
6.
Редокс урвалын бүтээгдэхүүнийг тодорхойлох. 
Энэ сэдвийн практик хэсэг нь исэлдэлтийн процессыг авч үзэх бөгөөд зөвхөн эхлэлийн урвалжуудыг заана. Урвалын бүтээгдэхүүнийг ихэвчлэн тодорхойлох шаардлагатай. Жишээлбэл, хариу үйлдэл нь үүнд хамаарна төмрийн хлорид(FeCl 3) ба калийн иодид(КЖ):
FeCl 3 + KJ = A + B + C
суулгах шаардлагатай нийлмэл томъёо Redox процессын үр дүнд үүссэн A, B, C.
Урвалжуудын исэлдэлтийн анхны төлөв нь дараах байдалтай байна: Fe 3+, Cl -, K +, J -. Fe 3+ нь исэлдүүлэгч бодис болох (хамгийн их исэлдэлтийн төлөвтэй) зөвхөн исэлдэлтийн төлөвөө Fe 2+ хүртэл бууруулж чадна гэж таамаглахад хялбар байдаг.
Fe 3++ д= Fe 2+
Хлоридын ион ба калийн ион нь урвалд исэлдэлтийн төлөвөө өөрчилдөггүй, харин иодидын ион нь зөвхөн исэлдэлтийн төлөвөө нэмэгдүүлэх боломжтой, өөрөөр хэлбэл. J 2 0 төлөв рүү очих:
2J - - 2 д= J 2 0
Урвалын үр дүнд исэлдэлтийн процессоос гадна байх болно солилцооны урвал FeCl 3 ба KJ хооронд, гэхдээ исэлдэлтийн төлөвийн өөрчлөлтийг харгалзан урвалыг энэ схемийн дагуу тодорхойлохгүй.
FeCl 3 + KJ = FeJ 3 + KCl,
гэхдээ хэлбэрээ авна
FeCl 3 + KJ = FeJ 2 + KCl,
Энд C бүтээгдэхүүн нь J 2 0 нэгдэл:
FeCl 3 + 6KJ = 2FeJ 2 + 6KJ + J 2
Fe 3++ д═> Fe 2+ |2
2J - - 2 д═> J 2 0 |1
________________________________
2Fe +3 + 2J - = 2Fe 2+ + J 2 0
Ирээдүйд исэлдэлтийн процессын бүтээгдэхүүнийг тодорхойлохдоо "лифтний систем" гэж нэрлэгддэг системийг ашиглаж болно. Үүний зарчим нь аливаа исэлдэлтийн урвалыг олон давхар байшингийн лифтүүдийн хоёр эсрэг чиглэлд хөдөлгөөнөөр илэрхийлж болно. Түүнээс гадна, "шал" байх болно исэлдэлтийн төлөвхолбогдох элементүүд. Редокс үйл явц дахь хоёр хагас урвалын аль нэг нь буурах эсвэл ихсэх дагалддаг тул исэлдэлтийн төлөвХэрэв нэг буюу өөр элемент байгаа бол энгийн үндэслэлээр бид үүссэн урвалын бүтээгдэхүүн дэх тэдгээрийн исэлдэлтийн төлөвийг таамаглаж болно.
Жишээ болгон хүхэртэй урвалд ордог урвалыг авч үзье натрийн гидроксидын төвлөрсөн уусмал ( NaOH):
S + NaOH(conc) = (A) + (B) + H 2 O
Энэ урвалын өөрчлөлт нь зөвхөн хүхрийн исэлдэлтийн түвшинд л явагдах тул тодорхой болгохын тулд бид түүний боломжит төлөв байдлын диаграммыг зурах болно.

(A) ба (B) нэгдлүүд нь нэгэн зэрэг хүхрийн S +4 ба S +6 төлөв байж болохгүй, учир нь энэ тохиолдолд процесс зөвхөн электрон ялгарах үед л явагдах болно, өөрөөр хэлбэл. нөхөн сэргээх болно:

S 0 - 4 д= S +4
S 0 - 6 д= S +6
Гэхдээ энэ нь исэлдэлтийн процессын зарчимтай зөрчилдөх болно. Дараа нь нэг тохиолдолд процесс нь электрон ялгарах замаар үргэлжлэх ёстой, нөгөө тохиолдолд эсрэг чиглэлд шилжих ёстой гэж үзэх хэрэгтэй. исэлдүүлэх:

S 0 - 4 д= S +4
S0+2 д= S -2
Нөгөөтэйгүүр, нөхөн сэргээх үйл явц S +4 эсвэл S +6 мужид явагдах магадлал хэр байна вэ? Урвал нь хүчиллэг орчинд биш шүлтлэг орчинд явагддаг тул исэлдэх чадвар нь хамаагүй бага байдаг тул энэ урвалд S +4 нэгдэл үүсэх нь S +6-аас илүү дээр юм. Тиймээс эцсийн хариу үйлдэл дараах хэлбэртэй байна.
4S + 6NaOH(conc) = Na 2 SO 3 + 2Na 2 S + 3H 2 O
S 0 +2 д= S - 2 | 4 | 2
S 0 + 6OH - - 4 д= SO 3 2 - + 3H 2 O | 2 | 1
3S 0 + 6OH - = 2S - 2 + SO 3 2 - + 3H 2 O
Өөр нэг жишээ болгон фосфины хоорондох дараах урвалыг авч үзье төвлөрсөн азотын хүчил(HNO3):
PH 3 + HNO 3 = (A) + (B) + H 2 O
Энэ тохиолдолд бид фосфор, азотын исэлдэлтийн төлөвийг өөрчилдөг. Тодорхой болгохын тулд бид тэдгээрийн исэлдэлтийн төлөв байдлын диаграммыг үзүүлэв.

Фосфорисэлдэлтийн төлөвт (-3) зөвхөн бууруулагч шинж чанарыг харуулах тул урвалын явцад исэлдэлтийн төлөвөө нэмэгдүүлнэ. Азотын хүчилөөрөө хүчтэй исэлдүүлэгч бодис бөгөөд хүчиллэг орчин үүсгэдэг тул (-3) төлөвөөс фосфор нь исэлдэлтийн дээд хэмжээндээ (+5) хүрнэ.
Үүний эсрэгээр азот нь исэлдэлтийн түвшинг бууруулдаг. Энэ төрлийн урвалд ихэвчлэн (+4) төлөвт ордог.

Цаашилбал, урвалын орчин нь хүчтэй хүчиллэг байдаг тул (+5) төлөвт байгаа фосфор нь бүтээгдэхүүн (A) зөвхөн ортофосфорын хүчил H 3 PO 4 байж болно гэж таамаглахад хэцүү биш юм. Ийм тохиолдолд азот нь исэлдэлтийн төлөвийг (+2) эсвэл (+4), илүү ихэвчлэн (+4) авдаг. Тиймээс бүтээгдэхүүн (B) байх болно Азотын исэл NO2. Үлдсэн зүйл бол тэнцвэрийн аргыг ашиглан энэ тэгшитгэлийг шийдэх явдал юм.
P - 3 - 8 д= P +5 | 1
N+ 5 + д= N +4 | 8
P - 3 + 8N +5 = P +5 + 8N +4
PH 3 + 8HNO 3 = H 3 PO 4 + 8NO 2 + 4H 2 O
вэб сайт, материалыг бүрэн эсвэл хэсэгчлэн хуулахдаа эх сурвалжийн холбоос шаардлагатай.