Химийн холбоо гэдэг нь нэг атомаас нөгөө атом руу электрон шилжсэний үр дүнд үүсдэг молекул эсвэл молекулын нэгдлүүдийн атомуудын хоорондын холбоо юм.
Хэд хэдэн төрлийн химийн холбоо байдаг: ковалент, ион, металл, устөрөгч.
Ковалент холбоо (лат. co - хамтдаа + валенс - хүчтэй)
Хоёр атомын хооронд ковалент холбоо нь солилцооны механизм (хос электроныг хуваалцах) эсвэл донор-хүлээн авагч механизм (донорын электронууд ба хүлээн авагчийн чөлөөт тойрог зам) -аар үүсдэг.
Ковалент холбоо нь энгийн бодисын молекул дахь атомуудыг холбодог (Cl 2, Br 2, O 2), органик бодис(C 2 H 2), түүнчлэн ерөнхий тохиолдолд металл бус ба өөр металл бус атомуудын хооронд (NH 3, H 2 O, HBr).
Хэрэв ковалент холбоо үүсгэгч атомууд ижил цахилгаан сөрөг утгатай байвал тэдгээрийн хоорондын холбоог ковалент туйлт бус холбоо гэнэ. Ийм молекулуудад "туйл" байдаггүй - электрон нягтрал жигд тархдаг. Жишээ нь: Cl 2, O 2, H 2, N 2, I 2.
Хэрэв ковалент холбоо үүсгэгч атомууд өөр өөр утгатайэлектрон сөрөг чанар, дараа нь тэдгээрийн хоорондын холбоог туйлтай ковалент гэж нэрлэдэг. Ийм молекулуудад "туйл" байдаг - электрон нягтрал нь илүү электрон сөрөг элемент рүү шилждэг. Жишээ нь: HCl, HBr, HI, NH 3, H 2 O.

Ковалентын холбоог солилцооны механизм - электрон хосыг хуваалцах замаар үүсгэж болно. Энэ тохиолдолд атом бүр бонд үүсгэхэд "тэнцүү" хөрөнгө оруулалт хийдэг. Жишээлбэл, N2 молекулыг бүрдүүлдэг азотын хоёр атом нь гадаад түвшнээс 3 электроныг өгч, холбоо үүсгэдэг.

Ковалентын холбоо үүсэх донор-хүлээн авагч механизм байдаг бөгөөд нэг атом нь ганц хос электроны донорын үүргийг гүйцэтгэдэг. Нөгөө атом нь электронуудаа дэмий үрдэггүй, харин зөвхөн энэ хос электроны тойрог замыг (эс) хангадаг.
- NH 4 + - аммонийн ион дахь
- NH 4 + Cl, NH 4 + Br - бүх давс дахь аммонийн ионы дотор
- NO 3 - - нитратын ион дахь
- KNO 3, LiNO 3 - бүх нитрат дахь нитратын ионы дотор
- O 3 - озон
- H 3 O + - гидронийн ион
- CO - нүүрстөрөгчийн дутуу исэл
- K, Na 2 - бүх цогцолбор давсанд дор хаяж нэг ковалент холбоо байдаг бөгөөд энэ нь донор хүлээн авагч механизмын дагуу үүсдэг.

Ионы холбоо
Ионы холбоо нь эсрэг цэнэгтэй ионуудын электростатик харилцан үйлчлэлд суурилдаг химийн бондуудын нэг юм.
Хамгийн түгээмэл тохиолдолд ердийн металл ба ердийн металл бус хоёрын хооронд ионы холбоо үүсдэг. Жишээ нь:
NaF, CaCl 2, MgF 2, Li 2 S, BaO, RbI.
Бүх давс нь CaSO 4, Na 3 PO 4 ионы холбоотой байдаг тул уусах чадварын хүснэгт нь маш том ойлголт юм. Аммонийн ион ч гэсэн үл хамаарах зүйл биш бөгөөд аммонийн катион ба янз бүрийн анионуудын хооронд ионы холбоо үүсдэг, жишээлбэл: NH 4 I, NH 4 NO 3, (NH 4) 2 SO 4.
Химийн хувьд ихэвчлэн нэг молекул дотор хэд хэдэн холбоо байдаг. Жишээлбэл, аммонийн фосфатыг авч үзье, энэ молекул дахь холбоо бүрийн төрлийг зааж өгнө.

Металл бонд нь металлын атомуудыг хооронд нь холбодог химийн холбоо юм. Энэ төрлийн холбоог тусад нь онцлон тэмдэглэв, учир нь түүний ялгаа нь метал дахь дамжуулагч электронуудын өндөр концентраци - "электрон хий" байдаг. Байгалийн хувьд металлын холбоо нь ковалент холбоонд ойрхон байдаг.
Метал дахь электронуудын "үүл" янз бүрийн нөлөөн дор хөдөлж болно. Энэ нь металлын цахилгаан дамжуулах чанарыг үүсгэдэг зүйл юм.

Устөрөгчийн холбоо нь устөрөгч агуулсан зарим молекулуудын хооронд үүссэн химийн холбоо юм. Хамгийн нийтлэг алдаануудын нэг бол хий нь устөрөгч нь устөрөгчийн холбоо агуулдаг гэж үзэх явдал юм - энэ нь огт үнэн биш юм.
Устөрөгчийн холбоо нь устөрөгчийн атом ба өөр илүү электрон сөрөг атом (O, S, N, C) хооронд үүсдэг.
Ойлгох ёстой хамгийн чухал зүйл бол устөрөгчийн холбоо нь молекулуудын дотор биш харин тэдгээрийн хооронд үүсдэг. Тэд молекулуудын хооронд байдаг:
- H2O
- Органик спирт: C 2 H 5 OH, C 3 H 7 OH
- Органик хүчил: CH 3 COOH, C 2 H 5 COOH

Устөрөгчийн бондын улмаас зарим тохиолдолд ижил үл хамаарах зүйл ажиглагдаж байгаа бөгөөд энэ нь гидрохалын хүчлүүдийн цуврал дахь хүчиллэг шинж чанар нэмэгдсэнтэй холбоотой юм: HF → HCl → HBr → HI. Фтор бол бусад молекулын устөрөгчийн атомыг хүчтэй татдаг бөгөөд энэ нь хүчлийн устөрөгчийг зайлуулах чадварыг бууруулж, хүч чадлыг нь бууруулдаг.
© Беллевич Юрий Сергеевич 2018-2020
Энэ нийтлэлийг Юрий Сергеевич Беллевич бичсэн бөгөөд түүнийх юм оюуны өмч. Зохиогчийн эрх эзэмшигчийн урьдчилан зөвшөөрөлгүйгээр мэдээлэл, объектыг хуулбарлах, тараах (үүнд интернет дэх бусад сайт, эх сурвалжид хуулбарлах замаар) эсвэл бусад хэлбэрээр ашиглах нь хуулийн дагуу шийтгэгддэг. Нийтлэлийн материал болон тэдгээрийг ашиглах зөвшөөрөл авахын тулд холбоо барина уу
Ихэнх элементүүдийн атомууд бие биетэйгээ харьцаж чаддаг тул тусдаа байдаггүй. Энэ харилцан үйлчлэл нь илүү нарийн төвөгтэй хэсгүүдийг үүсгэдэг.
Химийн холбооны мөн чанар нь цахилгаан цэнэгийн харилцан үйлчлэлийн хүч болох цахилгаан статик хүчний үйлчлэл юм. Электрон ба атомын цөм ийм цэнэгтэй байдаг.
Гадаад электрон түвшинд (валент электронууд) байрладаг электронууд нь цөмөөс хамгийн алслагдсан тул түүнтэй хамгийн сул харилцан үйлчлэлцдэг тул цөмөөс салж чаддаг. Тэд атомуудыг хооронд нь холбох үүрэгтэй.
Химийн харилцан үйлчлэлийн төрлүүд
Химийн бондын төрлийг дараах хүснэгтэд үзүүлэв.
Ионы холболтын шинж чанар
 улмаас үүсдэг химийн урвал ионы таталцалөөр өөр цэнэгтэй байхыг ион гэж нэрлэдэг. Хэрэв холбогдож буй атомууд нь электрон сөрөг чанар (өөрөөр хэлбэл электрон татах чадвар) мэдэгдэхүйц ялгаатай бөгөөд электрон хос илүү электрон сөрөг элемент рүү очвол ийм зүйл тохиолддог. Электроныг нэг атомаас нөгөөд шилжүүлсний үр дүн нь цэнэглэгдсэн тоосонцор - ион үүсэх явдал юм. Тэдний хооронд таталцал үүсдэг.
улмаас үүсдэг химийн урвал ионы таталцалөөр өөр цэнэгтэй байхыг ион гэж нэрлэдэг. Хэрэв холбогдож буй атомууд нь электрон сөрөг чанар (өөрөөр хэлбэл электрон татах чадвар) мэдэгдэхүйц ялгаатай бөгөөд электрон хос илүү электрон сөрөг элемент рүү очвол ийм зүйл тохиолддог. Электроныг нэг атомаас нөгөөд шилжүүлсний үр дүн нь цэнэглэгдсэн тоосонцор - ион үүсэх явдал юм. Тэдний хооронд таталцал үүсдэг.
Тэд хамгийн бага цахилгаан сөрөг үзүүлэлттэй байдаг ердийн металлууд, хамгийн том нь ердийн металл биш юм. Иймээс ионууд нь ердийн металл ба ердийн металл бусуудын харилцан үйлчлэлийн үр дүнд үүсдэг.
Металлын атомууд эерэг цэнэгтэй ион (катион) болж, электронуудыг гадаад электрон түвшиндээ өгч, металл бусууд электроныг хүлээн авч, улмаар сөрөг цэнэгтэйионууд (анионууд).
Атомууд илүү тогтвортой энергийн төлөвт шилжиж, электрон тохиргоогоо дуусгадаг.
Ионы холбоо нь чиглэлгүй, ханадаггүй, учир нь электростатик харилцан үйлчлэл нь бүх чиглэлд явагддаг тул ион нь эсрэг тэмдгийн ионуудыг бүх чиглэлд татаж чаддаг.
Ионуудын зохион байгуулалт нь тус бүрийн эргэн тойронд тодорхой тооны эсрэг цэнэгтэй ионууд байдаг. Ионы нэгдлүүдийн "молекул" гэсэн ойлголт утгагүй юм.
Боловсролын жишээ
 Натрийн хлорид (nacl) дахь холбоо үүсэх нь электроныг Na атомаас Cl атом руу шилжүүлж, харгалзах ионуудыг үүсгэсэнтэй холбоотой юм.
Натрийн хлорид (nacl) дахь холбоо үүсэх нь электроныг Na атомаас Cl атом руу шилжүүлж, харгалзах ионуудыг үүсгэсэнтэй холбоотой юм.
Na 0 - 1 e = Na + (катион)
Cl 0 + 1 e = Cl - (анион)
Натрийн хлоридын хувьд натрийн катионуудын эргэн тойронд зургаан хлоридын анион, хлоридын ион тус бүрийн эргэн тойронд зургаан натрийн ион байдаг.
Барийн сульфидын атомуудын хооронд харилцан үйлчлэл үүсэх үед дараах процессууд явагдана.
Ba 0 - 2 e = Ba 2+
S 0 + 2 e = S 2-
Ба хоёр электроноо хүхэрт өгснөөр хүхрийн анион S 2-, барийн катион Ba 2+ үүснэ.
Металлын химийн холбоо
 Металлын гаднах энергийн түвшин дэх электронуудын тоо бага, тэдгээр нь цөмөөс амархан тусгаарлагддаг. Энэ салалтын үр дүнд металлын ионууд болон чөлөөт электронууд үүсдэг. Эдгээр электронуудыг "электрон хий" гэж нэрлэдэг. Электронууд металлын эзлэхүүний туршид чөлөөтэй хөдөлж, атомуудаас байнга холбогдож, тусгаарлагддаг.
Металлын гаднах энергийн түвшин дэх электронуудын тоо бага, тэдгээр нь цөмөөс амархан тусгаарлагддаг. Энэ салалтын үр дүнд металлын ионууд болон чөлөөт электронууд үүсдэг. Эдгээр электронуудыг "электрон хий" гэж нэрлэдэг. Электронууд металлын эзлэхүүний туршид чөлөөтэй хөдөлж, атомуудаас байнга холбогдож, тусгаарлагддаг.
Металл бодисын бүтэц нь дараах байдалтай байна. болор эснь материйн араг яс бөгөөд түүний зангилааны хооронд электронууд чөлөөтэй хөдөлдөг.
Дараах жишээг өгч болно.
Mg - 2e<->Mg 2+
Cs-e<->Cs+
Ca - 2e<->Ca2+
Fe-3e<->Fe 3+
Ковалент: туйл ба туйл биш
 Химийн харилцан үйлчлэлийн хамгийн түгээмэл төрөл бол ковалент холбоо юм. Харилцан үйлчилдэг элементүүдийн электрон сөрөг байдлын утгууд нь эрс ялгаатай байдаггүй тул зөвхөн нийтлэг электрон хосыг илүү электрон сөрөг атом руу шилжүүлдэг.
Химийн харилцан үйлчлэлийн хамгийн түгээмэл төрөл бол ковалент холбоо юм. Харилцан үйлчилдэг элементүүдийн электрон сөрөг байдлын утгууд нь эрс ялгаатай байдаггүй тул зөвхөн нийтлэг электрон хосыг илүү электрон сөрөг атом руу шилжүүлдэг.
Ковалент харилцан үйлчлэл нь солилцооны механизм эсвэл донор хүлээн авагч механизмаар үүсдэг.
Хэрэв атом бүр гаднах электрон түвшинд хосгүй электронтой бөгөөд атомын орбиталуудын давхцал нь хоёр атомд аль хэдийн хамаарах хос электронууд гарч ирэхэд хүргэдэг бол солилцооны механизм хэрэгждэг. Атомын аль нэг нь гаднах электрон түвшинд хос электронтой, нөгөө нь чөлөөт орбитальтай бол атомын орбиталууд давхцах үед хос электронууд хуваагдаж, донор хүлээн авагч механизмын дагуу харилцан үйлчилдэг.
Ковалентын үржвэрийг дараахь байдлаар хуваана.
- энгийн эсвэл ганц;
- давхар;
- гурав дахин.
Давхар нэг нь хоёр хос электроныг нэг дор, гурвалсан нь гурван электроныг хуваалцах боломжийг олгодог.
Холбоотой атомуудын хоорондох электрон нягтын (туйлшрал) хуваарилалтын дагуу ковалент холбоог дараахь байдлаар хуваана.
- туйл биш;
- туйл.
Туйлт бус холбоо нь ижил атомуудаар, туйлын холбоо нь янз бүрийн цахилгаан сөрөг нөлөөллөөр үүсдэг.
 Ижил электрон сөрөг хүчин чадалтай атомуудын харилцан үйлчлэлийг туйлшгүй холбоо гэж нэрлэдэг. Ийм молекул дахь нийтлэг хос электронууд нь атомын аль алинд нь татагдахгүй, харин хоёуланд нь адилхан хамаарна.
Ижил электрон сөрөг хүчин чадалтай атомуудын харилцан үйлчлэлийг туйлшгүй холбоо гэж нэрлэдэг. Ийм молекул дахь нийтлэг хос электронууд нь атомын аль алинд нь татагдахгүй, харин хоёуланд нь адилхан хамаарна.
Электрон сөрөг шинж чанараараа ялгаатай элементүүдийн харилцан үйлчлэл нь туйлын холбоо үүсэхэд хүргэдэг. Энэ төрлийн харилцан үйлчлэлийн үед электрон хосууд илүү электрон сөрөг элемент рүү татагддаг боловч түүнд бүрэн шилждэггүй (өөрөөр хэлбэл ион үүсэхгүй). Электрон нягтралын ийм шилжилтийн үр дүнд атомууд дээр хэсэгчилсэн цэнэгүүд гарч ирдэг: илүү цахилгаан сөрөг цэнэг нь сөрөг, бага электрон сөрөг цэнэг эерэг цэнэгтэй байдаг.
Ковалентын шинж чанар ба шинж чанарууд
Ковалент бондын үндсэн шинж чанарууд:
- Урт нь харилцан үйлчилж буй атомуудын цөм хоорондын зайгаар тодорхойлогддог.
- Туйлшрал нь электрон үүлний атомын аль нэг рүү шилжих замаар тодорхойлогддог.
- Чиглэл нь орон зайд чиглэсэн холбоо, үүний дагуу тодорхой геометрийн хэлбэртэй молекулуудыг бий болгох шинж чанар юм.
- Ханалт нь хязгаарлагдмал тооны бонд үүсгэх чадвараар тодорхойлогддог.
- Туйлшрах чадвар нь гадаад цахилгаан орны нөлөөн дор туйлшралыг өөрчлөх чадвараар тодорхойлогддог.
- Бондыг таслахад шаардагдах энерги нь түүний хүчийг тодорхойлдог.
 Ковалентын туйлшралгүй харилцан үйлчлэлийн жишээ нь устөрөгч (H2), хлор (Cl2), хүчилтөрөгч (O2), азот (N2) болон бусад олон молекулууд байж болно.
Ковалентын туйлшралгүй харилцан үйлчлэлийн жишээ нь устөрөгч (H2), хлор (Cl2), хүчилтөрөгч (O2), азот (N2) болон бусад олон молекулууд байж болно.
H· + ·H → H-H молекулнэг туйлт бус бондтой,
O: + :O → O=O молекул нь давхар туйлтгүй,
Ṅ: + Ṅ: → N≡N молекул нь гурвалсан туйлт биш юм.
Химийн элементүүдийн ковалент бондын жишээнд нүүрстөрөгчийн давхар исэл (CO2) ба нүүрстөрөгчийн дутуу исэл (CO), хүхэрт устөрөгч (H2S), давсны хүчил (HCL), ус (H2O), метан (CH4), хүхрийн исэл (SO2) болон молекулууд орно. бусад олон.
CO2 молекул дахь нүүрстөрөгч ба хүчилтөрөгчийн атомуудын хоорондын хамаарал нь ковалент туйлтай байдаг, учир нь илүү электрон сөрөг устөрөгч нь электрон нягтралыг татдаг. Хүчилтөрөгч дээр хосгүй хоёр электрон байдаг гадаад түвшин, нүүрстөрөгч нь харилцан үйлчлэлийг бий болгох дөрвөн валентийн электроныг өгч чадна. Үүний үр дүнд давхар холбоо үүсч, молекул нь дараах байдалтай байна: O=C=O.
Тодорхой молекул дахь бондын төрлийг тодорхойлохын тулд түүнийг бүрдүүлэгч атомуудыг авч үзэхэд хангалттай. Энгийн металл бодисууд нь металлын холбоо, металл бус металлууд нь ионы холбоо, энгийн металл бус бодисууд нь ковалент туйлт бус холбоо, янз бүрийн металл бус бодисуудаас бүрдсэн молекулууд нь туйлын ковалент холбоог үүсгэдэг.
Ионы химийн холбоо нь химийн элементүүдийн атомуудын (эерэг эсвэл сөрөг цэнэгтэй ионуудын) хооронд үүсдэг холбоо юм. Тэгэхээр ионы холбоо гэж юу вэ, яаж үүсдэг вэ?
Ионы химийн бондын ерөнхий шинж чанар
Ионууд нь электрон өгөх эсвэл хүлээн авах явцад атомууд хувирдаг цэнэгтэй бөөмс юм. Тэд бие биедээ маш хүчтэй татагддаг тул ийм төрлийн холбоо бүхий бодисууд буцлах, хайлах цэгүүд өндөр байдаг.

Цагаан будаа. 1. Ионууд.
Ионы холбоо нь электростатик таталцлын улмаас ионуудаас ялгаатай химийн холбоо юм. Үүнийг ковалент холбоог хязгаарлах тохиолдол гэж үзэж болно, энэ нь холбогдсон атомуудын цахилгаан сөрөг байдлын ялгаа маш их тул цэнэгүүдийг бүрэн салгах болно.

Цагаан будаа. 2. Ионы химийн холбоо.
Хэрэв EO >1.7 бол бонд цахим болно гэж ерөнхийд нь үздэг.
Элементүүд бие биенээсээ хол байх тусам цахилгаан сөрөг байдлын ялгаа их болно. тогтмол хүснэгтхугацаанд. Энэ холбоо нь метал ба металл бус, ялангуяа хамгийн алслагдсан бүлгүүдэд байрладаг, жишээлбэл, I ба VII-ийн шинж чанар юм.
Жишээ нь: хоолны давс, натрийн хлорид NaCl:

Цагаан будаа. 3. Натрийн хлоридын ион химийн холбооны диаграмм.
Кристалд ионы холбоо байдаг бөгөөд энэ нь хүчтэй, урт боловч ханасан биш, чиглээгүй байдаг. Ионы холбоо нь зөвхөн давс, шүлт, зарим металлын исэл зэрэг нарийн төвөгтэй бодисуудын онцлог шинж юм. Хийн төлөвт ийм бодисууд ионы молекул хэлбэрээр байдаг.
Ионы химийн холбоо нь ердийн металл ба металл бус хоёрын хооронд үүсдэг. Металлаас метал бус руу электронууд заавал шилжиж, ион үүсгэдэг. Үүний үр дүнд ионы холбоо гэж нэрлэгддэг электростатик таталцал үүсдэг.
Үнэн хэрэгтээ бүрэн ионы холбоо үүсдэггүй. Ионы холбоо гэж нэрлэгддэг хэсэг нь ион, хэсэгчлэн ковалент шинж чанартай байдаг. Гэсэн хэдий ч нарийн төвөгтэй молекулын ионуудын холбоог ион гэж үзэж болно.
Ионы холбоо үүсэх жишээ
Ионы холбоо үүсэх хэд хэдэн жишээ байдаг:
- кальци ба фторын харилцан үйлчлэл
Ca 0 (атом) -2e=Ca 2 + (ион)
- Кальци дутуу электроныг олж авахаас хоёр электроныг өгөх нь илүү хялбар байдаг.
F 0 (атом)+1е= F- (ион)
Фтор нь эсрэгээрээ долоон электрон өгөхөөс илүү нэг электрон хүлээн авахад хялбар байдаг.
Үүссэн ионуудын цэнэгүүдийн хоорондох хамгийн бага нийтлэг үржвэрийг олъё. Энэ нь 2-той тэнцүү байна. Кальцийн атомаас хоёр электрон хүлээн авах фторын атомын тоог тодорхойлъё: 2: 1 = 2. 4.
Ионы химийн бондын томъёог бүтээцгээе.
Ca 0 +2F 0 →Ca 2 +F−2.
- натри ба хүчилтөрөгчийн харилцан үйлчлэл
Химийн холбоо гэдэг нь химийн бөөмс эсвэл талстыг бүхэлд нь тогтвортой байлгах атомуудын харилцан үйлчлэл юм.
Химийн бондын мөн чанар нь эсрэг цэнэгтэй бөөмсийн (катион ба анион, атомын цөм ба электрон хос, металлын катион ба электрон) электростатик таталт юм.
Үүсэх механизмын дагуу тэд дараахь зүйлийг ялгадаг.
a) ионы холбоо - металлын катион ба металл бус анион хоорондын холбоо. Иймээс ионы төрлийн холбоо нь хүчтэй металл ба хүчтэй металл бус атомуудаас үүссэн бодисуудад үүсдэг. Энэ тохиолдолд металлын атомууд гадаад (заримдаа гадаадаас өмнөх) энергийн түвшнээс электроноо өгч эерэг цэнэгтэй ион (катион), металл бус атомууд электроныг гадаад энергийн түвшинд хүлээн авч сөрөг цэнэгтэй ион болж хувирдаг. (анионууд) (бодисын жишээ: ердийн металлын исэл K2O, CaO, MgO, суурь KOH, Ca(OH)2, давс NaNO3, CaSO4).
б) ковалент холбоо - металл бус атомуудын хоорондын холбоо. Металл бус атом бүрийн гаднах энергийн түвшний хосгүй электронуудаас нийтлэг электрон хосууд үүссэний улмаас ковалент холбоо үүсдэг (томьёо 8 - элементийн бүлгийн дугаар). Нийлмэл дэх бондын тоо нь хуваалцсан электрон хосуудын тоотой тэнцүү байна. Хэрэв нэгдэл нь ижил атомуудаас үүссэн бол химийн элемент-метал бус, дараа нь холбоог ковалент бус туйлбар гэж нэрлэдэг (жишээ нь: N2, Cl2, O2, H2). Ковалентын туйлт бус холбоо нь энгийн металл бус бодисуудад байдаг. Хэрэв нэгдэл нь өөр өөр металл бус элементүүдийн атомуудаас бүрддэг бол энэ холбоог туйлын ковалент гэж нэрлэдэг. Энэ тохиолдолд нийтлэг электрон хосууд илүү өндөр цахилгаан сөрөг хүчин чадалтай элемент рүү шилжиж, элементүүд дээр хэсэгчлэн эерэг ба хэсэгчлэн сөрөг цэнэгүүд гарч ирдэг (бодисуудын жишээ: HCl, NO, CCl4, H2SO4). Ковалент туйлын холбоо нь металл бус атомуудаас бүрдсэн нарийн төвөгтэй бодисуудад байдаг.
Валент гэдэг нь химийн элементийн атомуудын химийн холбоо үүсгэх чадвар юм. Тоон утгаараа валент нь тухайн химийн элементийн атомууд өөр химийн элементийн атомуудтай үүсгэсэн химийн бондын тоотой давхцдаг. Хамгийн өндөр валент нь элементийн бүлгийн дугаартай давхцдаг (үл хамаарах зүйл: хүчилтөрөгч (II) ба азот (IV)).
в) металлын холбоо - металлын атом ба электронуудын хоорондын холбоо. Металлын атомууд гадаад энергийн түвшнээс бүх электронуудаа атом хоорондын нийтлэг орон зайд шилжүүлж, эерэг цэнэгтэй ион (катион) болж хувирсны үр дүнд металлын холбоо үүсдэг. Нийгэмшсэн электронууд атом хоорондын орон зайд чөлөөтэй хөдөлж, электростатик таталцлын улмаас бүх катионуудыг нэг цогц болгон холбодог. Металл холбоо нь энгийн металл бодис эсвэл металлын хайлш (бодисын жишээ: Al, Fe, Cu, хүрэл, гууль) -д ажиглагддаг.
Ховор химийн бодисуудхимийн элементүүдийн бие даасан, хамааралгүй атомуудаас бүрддэг. Хэвийн нөхцөлд зөвхөн цөөн тооны язгуур хий гэж нэрлэгддэг хий нь ийм бүтэцтэй байдаг: гелий, неон, аргон, криптон, ксенон, радон. Ихэнх тохиолдолд химийн бодисууд нь тусгаарлагдсан атомуудаас тогтдоггүй, харин янз бүрийн бүлэгт нэгтгэгддэг. Атомуудын ийм холбоо нь хэд хэдэн, зуу, мянга, бүр илүү олон атомтай байж болно. Эдгээр атомуудыг ийм бүлэгт байлгадаг хүчийг нэрлэдэг химийн холбоо.
Өөрөөр хэлбэл, химийн холбоо нь бие даасан атомуудыг илүү нарийн бүтэцтэй (молекулууд, ионууд, радикалууд, талстууд гэх мэт) холбож өгдөг харилцан үйлчлэл гэж хэлж болно.
Химийн холбоо үүсэх шалтгаан нь илүү төвөгтэй бүтцийн энерги нь түүнийг бүрдүүлдэг бие даасан атомуудын нийт энергиээс бага байдагтай холбоотой юм.
Ялангуяа X ба Y атомуудын харилцан үйлчлэл нь XY молекулыг үүсгэдэг бол энэ нь гэсэн үг юм. дотоод энергиЭнэ бодисын молекулууд нь түүний үүссэн бие даасан атомуудын дотоод энергиээс бага байдаг.
E(XY)< E(X) + E(Y)
Ийм учраас бие даасан атомуудын хооронд химийн холбоо үүсэхэд энерги ялгардаг.
Цөмтэй хамгийн бага холболтын энергитэй гадаад электрон давхаргын электронууд гэж нэрлэгддэг валент. Жишээлбэл, борын хувьд эдгээр нь 2-р энергийн түвшний электронууд юм - 2-д 2 электрон с-тойрог замууд ба 1-ээс 2 х- тойрог замууд:
Химийн холбоо үүсэх үед атом бүр нь язгуур хийн атомуудын электрон тохиргоог олж авах хандлагатай байдаг. Ингэснээр түүний гаднах электрон давхаргад 8 электрон байдаг (эхний үеийн элементүүдэд 2). Энэ үзэгдлийг октет дүрэм гэж нэрлэдэг.
Хэрэв эхэндээ ганц атомууд валентийн электроныхоо зарим хэсгийг бусад атомуудтай хуваалцдаг бол атомууд сайн хийн электрон тохиргоонд хүрэх боломжтой. Энэ тохиолдолд нийтлэг электрон хосууд үүсдэг.
Электрон хуваах зэргээс хамааран ковалент, ионы болон металлын холбоог ялгаж болно.
Ковалент холбоо
Ковалент холбоо нь ихэвчлэн металл бус элементүүдийн атомуудын хооронд үүсдэг. Хэрэв ковалент холбоо үүсгэгч металл бус атомууд өөр өөр химийн элементүүдэд хамаарах бол ийм холбоог туйлын ковалент холбоо гэж нэрлэдэг. Энэ нэрийн шалтгаан нь өөр өөр элементийн атомууд нийтлэг электрон хосыг татах өөр өөр чадвартай байдагт оршино. Мэдээжийн хэрэг, энэ нь нийтлэг электрон хосыг атомуудын аль нэг рүү шилжүүлэхэд хүргэдэг бөгөөд үүний үр дүнд үүн дээр хэсэгчилсэн сөрөг цэнэг үүсдэг. Хариуд нь нөгөө атом дээр хэсэгчилсэн эерэг цэнэг үүсдэг. Жишээлбэл, устөрөгчийн хлоридын молекул дахь электрон хос нь устөрөгчийн атомаас хлорын атом руу шилждэг.
Туйлшсан ковалент холбоо бүхий бодисын жишээ:
CCl 4, H 2 S, CO 2, NH 3, SiO 2 гэх мэт.
Ижил химийн элементийн металл бус атомуудын хооронд ковалент туйлт бус холбоо үүсдэг. Атомууд нь ижил байдаг тул хуваалцсан электронуудыг татах чадвар нь мөн адил байна. Үүнтэй холбогдуулан электрон хосын шилжилт ажиглагдахгүй.
Хоёр атом хоёулаа электроноор хангаж, нийтлэг электрон хос үүсгэх үед ковалент холбоо үүсэх дээрх механизмыг солилцоо гэж нэрлэдэг.
Мөн донор хүлээн авагч механизм байдаг.
Донор-хүлээн авагч механизмаар ковалент холбоо үүсэхэд нэг атомын дүүрсэн орбитал (хоёр электронтой), нөгөө атомын хоосон орбиталаас болж хуваалцсан электрон хос үүснэ. Ганц хос электроныг хангадаг атомыг донор, хоосон орбиталтай атомыг хүлээн авагч гэнэ. N, O, P, S гэх мэт хосолсон электронтой атомууд электрон хосын донорын үүрэг гүйцэтгэдэг.
Жишээлбэл, донор-хүлээн авагч механизмын дагуу дөрөв дэх ковалент үүсэх N-H холболтуудаммонийн катион NH 4+-д:
Туйлшралаас гадна ковалент холбоо нь эрчим хүчээр тодорхойлогддог. Бондын энерги нь атомуудын хоорондын холбоог таслахад шаардагдах хамгийн бага энерги юм.
Холбогдсон атомуудын радиус нэмэгдэх тусам холболтын энерги буурдаг. Атомын радиус нь дэд бүлгүүдийг доошлуулдаг гэдгийг бид мэддэг тул жишээлбэл, галоген-устөрөгчийн бондын бат бэх нь цувралд нэмэгддэг гэж дүгнэж болно.
Сайн уу< HBr < HCl < HF
Мөн бондын энерги нь түүний олон талт байдлаас хамаардаг - бондын олон талт байдал их байх тусам түүний энерги их байдаг. Бондын олон талт байдал гэдэг нь хоёр атомын хоорондох электрон хосуудын тоог илэрхийлдэг.
Ионы холбоо
Ионы холбоог ковалент холболтын онцгой тохиолдол гэж үзэж болно. туйлын холболт. Хэрэв ковалент-туйлт холбоонд нийтлэг электрон хос нь хос атомын аль нэгэнд хэсэгчлэн шилжсэн бол ионы холбоонд атомын аль нэгэнд бараг бүрэн "өгөгдсөн" болно. Электрон (үүд)-ийг өгч буй атом эерэг цэнэг авч, болдог катион, мөн түүнээс электрон авсан атом сөрөг цэнэг авч, болдог анион.
Тиймээс ион холбоо нь катионуудын анионуудад электростатик таталцлын үр дүнд үүссэн холбоо юм.
Энэ төрлийн холбоо үүсэх нь ердийн металл ба ердийн металл бус атомуудын харилцан үйлчлэлийн явцад тохиолддог.
Жишээлбэл, калийн фтор. Калийн катион нь саармаг атомаас нэг электроныг салгаснаар, фторын ион нь фторын атомд нэг электрон нэмснээр үүсдэг.

Үүссэн ионуудын хооронд электростатик таталцлын хүч үүсч, ионы нэгдэл үүснэ.
Химийн холбоо үүсэхэд натрийн атомаас электронууд хлорын атом руу шилжиж, эсрэгээр цэнэглэгдсэн ионууд үүссэн бөгөөд тэдгээр нь гадаад энергийн бүрэн түвшинд хүрсэн байна.
Металлын атомаас электронууд бүрэн салдаггүй, харин ковалент холбоонд байдаг шиг зөвхөн хлорын атом руу шилждэг нь тогтоогдсон.
Металл атом агуулсан ихэнх хоёртын нэгдлүүд нь ион юм. Жишээлбэл, исэл, галоген, сульфид, нитрид.
Ионы холбоо нь энгийн катионууд ба энгийн анионуудын (F −, Cl −, S 2-), түүнчлэн энгийн катионууд ба комплекс анионуудын (NO 3 −, SO 4 2-, PO 4 3-, OH −) хооронд үүсдэг. Иймээс ионы нэгдлүүдэд давс, суурь (Na 2 SO 4, Cu(NO 3) 2, (NH 4) 2 SO 4), Ca (OH) 2, NaOH) орно.
Металл холболт
Энэ төрлийн холбоо нь металлд үүсдэг.
Бүх металлын атомууд нь гаднах электрон давхаргад атомын цөмтэй холбоогүй энерги багатай электронуудтай байдаг. Ихэнх металлын хувьд гаднах электроноо алдах үйл явц нь энергийн хувьд таатай байдаг.
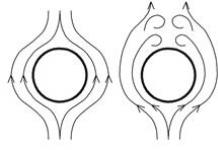
Цөмтэй ийм сул харилцан үйлчлэлийн улмаас метал дахь эдгээр электронууд нь маш хөдөлгөөнтэй байдаг бөгөөд металлын талст бүрт дараах процесс тасралтгүй явагддаг.
M 0 - ne - = M n +, энд M 0 нь төвийг сахисан металлын атом, M n + нь ижил металлын катион юм. Доорх зурагт болж буй үйл явцын дүрслэлийг харуулав.
Өөрөөр хэлбэл электронууд металлын талстыг дайрч, нэг металлын атомаас салж, түүнээс катион үүсгэж, өөр катионтой нэгдэж, төвийг сахисан атом үүсгэдэг. Энэ үзэгдлийг "электрон салхи" гэж нэрлэдэг ба металл бус атомын талст дахь чөлөөт электронуудын цуглуулгыг "электрон хий" гэж нэрлэдэг. Металлын атомуудын хоорондын ийм төрлийн харилцан үйлчлэлийг металлын холбоо гэж нэрлэдэг.
Устөрөгчийн холбоо
Хэрэв бодис дахь устөрөгчийн атом нь өндөр цахилгаан сөрөг нөлөөтэй элементтэй (азот, хүчилтөрөгч, фтор) холбогдсон бол энэ бодис нь устөрөгчийн холбоо гэж нэрлэгддэг үзэгдлээр тодорхойлогддог.
Устөрөгчийн атом нь электрон сөрөг атомтай холбогддог тул устөрөгчийн атом дээр хэсэгчилсэн эерэг цэнэг, электрон сөрөг элементийн атом дээр хэсэгчилсэн сөрөг цэнэг үүсдэг. Үүнтэй холбогдуулан нэг молекулын хэсэгчилсэн эерэг цэнэгтэй устөрөгчийн атом ба нөгөө молекулын электрон сөрөг атомын хооронд электростатик таталцал үүсэх боломжтой болдог. Жишээлбэл, усны молекулуудын хувьд устөрөгчийн холбоо ажиглагддаг.
Устөрөгчийн холбоо нь усны хэвийн бус хайлах цэгийг тайлбарладаг. Уснаас гадна устөрөгчийн фтор, аммиак, хүчилтөрөгч агуулсан хүчил, фенол, спирт, амин зэрэг бодисуудад устөрөгчийн хүчтэй холбоо үүсдэг.