Химийн улсын нэгдсэн шалгалтад 2018 онд үндсэн хугацаанд 84.5 мянга гаруй хүн хамрагдсан нь 2017 оныхоос 11 мянга гаруй хүнээр илүү байна. Дундаж оноогүйцэтгэл шалгалтын хуудасбараг өөрчлөгдөөгүй хэвээр 55.1 нэгж (2017 онд - 55.2) болж байна. тэнцээгүй төгсөгчдийн эзлэх хувь хамгийн бага оноо, 15.9% болсон нь 2017 оныхоос (15.2%) арай өндөр байна. Хоёр дахь жилдээ өндөр оноотой (81-100 оноо) суралцагчдын тоо нэмэгдэж байна: 2018 онд 2017 онтой харьцуулахад 1.9% (2017 онд - 2016 онтой харьцуулахад 2.6%) өссөн байна. Мөн 100 онооны тодорхой өсөлтийг тэмдэглэв: 2018 онд энэ нь 0.25% байна. Хүлээн авсан үр дүн нь ахлах сургуулийн сурагчдыг тодорхой даалгаврын загваруудад илүү зорилтот түвшинд бэлтгэсэнтэй холбоотой байж болох юм. өндөр түвшиншалгалтын хувилбарын 2-р хэсэгт орсон хүндрэлүүд. Өөр нэг шалтгаан нь олимпиадын ялагчид химийн хичээлийн улсын нэгдсэн шалгалтанд оролцож, шалгалтын ажлыг 70-аас дээш оноо авсан тохиолдолд уралдаант бус элсэлтийн эрхийг олгодог. Нээлттэй ажлын банкинд байршуулах нь үр дүнг сайжруулахад тодорхой үүрэг гүйцэтгэсэн байж болох юм. илүүшалгалтын сонголтонд багтсан даалгаврын жишээ. Ийнхүү 2018 онд хийх гол ажлуудын нэг нь ялгах чадварыг бэхжүүлэх явдал байв бие даасан даалгавармөн шалгалтын хувилбарыг бүхэлд нь.
Илүү нарийвчилсан аналитик, арга зүйн Улсын нэгдсэн шалгалтын материал 2018 оныг линкээр үзэх боломжтой.
Манай вэбсайтад 2018 оны Химийн улсын нэгдсэн шалгалтад бэлтгэх 3000 орчим даалгавар багтсан болно. Шалгалтын ажлын ерөнхий тоймыг доор үзүүлэв.
ХИМИЙН ХЭРЭГЛЭЭ 2019 ОНЫ ШАЛГАЛТЫН ТӨЛӨВЛӨГӨӨ
Даалгаврын хүндрэлийн түвшинг тодорхойлох: B - үндсэн, P - гүнзгий, V - өндөр.
Агуулгын элементүүд болон үйл ажиллагааг шалгасан |
Даалгаврын хүндрэлийн түвшин |
Хамгийн их оноодаалгаврыг гүйцэтгэхийн тулд |
Даалгаврыг дуусгах тооцоолсон хугацаа (мин.) |
| Дасгал 1.Эхний дөрвөн үеийн элементүүдийн атомын электрон бүрхүүлийн бүтэц: s-, p- ба d-элементүүд. Атомын электрон тохиргоо. Атомын үндсэн ба өдөөгдсөн төлөвүүд. | |||
| Даалгавар 2.Элемент ба тэдгээрийн нэгдлүүдийн химийн шинж чанарын өөрчлөлтийн үе ба бүлгүүдийн загвар. IA-IIIA бүлгийн металлуудын ерөнхий шинж чанар, тэдгээрийн байрлалтай холбоотой Тогтмол хүснэгт химийн элементүүдД.И. Менделеев ба тэдгээрийн атомын бүтцийн онцлог. Шилжилтийн элементүүдийн шинж чанар - зэс, цайр, хром, төмөр - химийн элементүүдийн үечилсэн хүснэгт дэх байр сууриар нь D.I. Менделеев ба тэдгээрийн атомын бүтцийн онцлог. Химийн элементүүдийн үечилсэн систем дэх байр суурьтай холбогдуулан IVA-VIIA бүлгийн металл бусуудын ерөнхий шинж чанар D.I. Менделеев ба тэдгээрийн атомын бүтцийн онцлог |
|||
| Даалгавар 3.Цахилгаан сөрөг чанар. Химийн элементүүдийн исэлдэлтийн төлөв ба валент | |||
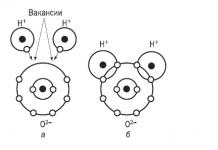
| Даалгавар 4.Ковалент химийн холбоо, түүний сорт, үүсэх механизм. Онцлог шинж чанарууд ковалент холбоо(туйлшрал ба холбох энерги). Ионы холбоо. Металл холболт. Устөрөгчийн холбоо. Молекул ба молекул бус бүтцийн бодисууд. Кристал торны төрөл. Бодисын шинж чанар нь тэдгээрийн найрлага, бүтцээс хамаарах байдал | |||
| Даалгавар 5.Ангилал биш органик бодис. Органик бус бодисын нэршил (жижиг болон олон улсын) | |||
| Даалгавар 6.Онцлог шинж чанартай Химийн шинж чанарэнгийн металл бодис: шүлт, шүлтлэг шороо, хөнгөн цагаан; шилжилтийн металлууд: зэс, цайр, хром, төмөр. Энгийн металл бус бодисын химийн шинж чанар: устөрөгч, галоген, хүчилтөрөгч, хүхэр, азот, фосфор, нүүрстөрөгч, цахиур. Оксидын химийн шинж чанар: үндсэн, амфотер, хүчиллэг |
|||
| Даалгавар 7.Суурь ба амфотерийн гидроксидын химийн шинж чанар. Хүчиллэгийн химийн шинж чанар. Давсны химийн шинж чанар: дунд, хүчиллэг, үндсэн; цогцолбор (хөнгөн цагаан ба цайрын гидроксо нэгдлүүдийн жишээг ашиглан). Усан уусмал дахь электролитийн электролитийн диссоциаци. Хүчтэй ба сул электролитууд. Ион солилцооны урвал | |||
| Даалгавар 8.Органик бус бодисын химийн шинж чанар: - энгийн бодис-металл: шүлт, шүлтлэг шороо, магни, хөнгөн цагаан, шилжилтийн металл (зэс, цайр, хром, төмөр); - хүчил; |
|||
| Даалгавар 9.Органик бус бодисын химийн шинж чанар: – энгийн металл бодис: шүлт, шүлтлэг шороо, магни, хөнгөн цагаан, шилжилтийн металл (зэс, цайр, хром, төмөр); - энгийн металл бус бодисууд: устөрөгч, галоген, хүчилтөрөгч, хүхэр, азот, фосфор, нүүрстөрөгч, цахиур; - исэл: үндсэн, амфотер, хүчиллэг; - суурь ба амфотерийн гидроксид; - хүчил; - давс: дунд, хүчиллэг, үндсэн; цогцолбор (хөнгөн цагаан, цайрын гидроксо нэгдлүүдийн жишээг ашиглан) |
|||
| Даалгавар 10.Органик бус бодисын харилцан хамаарал | |||
| Даалгавар 11.Органик бодисын ангилал. Органик бодисын нэршил (жижиг болон олон улсын) | |||
| Даалгавар 12.Органик нэгдлүүдийн бүтцийн онол: гомологи ба изомеризм (бүтцийн ба орон зай). Молекул дахь атомуудын харилцан нөлөөлөл. Органик бодисын молекул дахь бондын төрлүүд. Нүүрстөрөгчийн атомын орбиталуудын эрлийзжилт. Радикал. Функциональ бүлэг | |||
| Даалгавар 13.Нүүрсустөрөгчийн химийн шинж чанар: алкан, циклоалкан, алкен, диен, алкин, үнэрт нүүрсустөрөгчид(бензол ба бензолын гомологууд, стирол). Нүүрс устөрөгч үйлдвэрлэх үндсэн аргууд (лабораторид) |
|||
| Даалгавар 14.Ханасан нэг атомт ба олон атомт спирт, фенолын химийн шинж чанар. Альдегидийн химийн шинж чанар, ханасан карбоксилын хүчил, эфир. Хүчилтөрөгч агуулсан органик нэгдлүүдийг олж авах үндсэн аргууд (лабораторид). | |||
| Даалгавар 15.Азот агуулсан органик нэгдлүүдийн химийн шинж чанар: амин ба амин хүчлүүд. Хамгийн чухал арга замуудамин болон амин хүчлийг олж авах. Биологийн чухал бодисууд: өөх тос, нүүрс ус (моносахарид, дисахарид, полисахарид), уураг | |||
| Даалгавар 16.Нүүрс устөрөгчийн химийн шинж чанар: алкан, циклоалкан, алкен, диен, алкин, үнэрт нүүрсустөрөгч (бензол ба бензолын гомологууд, стирол). Нүүрс устөрөгч үйлдвэрлэх хамгийн чухал аргууд. Органик химийн ион (В.В. Марковниковын дүрэм) ба радикал урвалын механизм | |||
| Даалгавар 17.Ханасан нэг атомт ба олон атомт спирт, фенол, альдегид, карбоксилын хүчил, эфирийн химийн шинж чанар. Хүчилтөрөгч агуулсан органик нэгдлүүдийг олж авах хамгийн чухал аргууд | |||
| Даалгавар 18.Нүүрс устөрөгч, хүчилтөрөгч агуулсан ба азот агуулсан органик нэгдлүүдийн хоорондын хамаарал | |||
| Даалгавар 19.Органик бус ба органик химийн химийн урвалын ангилал | |||
| Даалгавар 20.Урвалын хурд, түүний янз бүрийн хүчин зүйлээс хамаарал | |||
| Даалгавар 21.Редокс урвалууд. | |||
| Даалгавар 22.Хайлмал ба уусмалын электролиз (давс, шүлт, хүчил) | |||
| Даалгавар 23.Давсны гидролиз. Усан уусмалын орчин: хүчиллэг, төвийг сахисан, шүлтлэг | |||
| Даалгавар 24.Эргэж болох ба эргэлт буцалтгүй химийн урвал. Химийн тэнцвэр. Төрөл бүрийн хүчин зүйлийн нөлөөн дор тэнцвэрт байдал өөрчлөгдөх | |||
| Даалгавар 25.Органик бус бодис ба ионуудын чанарын урвал. Органик нэгдлүүдийн чанарын урвал | |||
| Даалгавар 26.Лабораторид ажиллах дүрэм. Лабораторийн шилэн эдлэл, тоног төхөөрөмж. Идэмхий, шатамхай, хортой бодис, гэр ахуйн химийн бодисуудтай ажиллахдаа аюулгүй ажиллагааны дүрэм. Шинжлэх ухааны судалгааны аргууд химийн бодисуудболон өөрчлөлтүүд. Хольцыг ялгах, бодисыг цэвэрлэх арга. Металлургийн тухай ойлголт: металл үйлдвэрлэх ерөнхий аргууд. Химийн үйлдвэрлэлийн шинжлэх ухааны ерөнхий зарчмууд (аммиак, хүхрийн хүчил, метанолыг үйлдвэрлэлийн үйлдвэрлэлийн жишээг ашиглан). Байгаль орчны химийн бохирдол, түүний үр дагавар. Нүүрс устөрөгчийн байгалийн эх үүсвэр, тэдгээрийн боловсруулалт. Өндөр молекул жинтэй нэгдлүүд. Полимержилт ба поликонденсацийн урвал. Полимер. Хуванцар, утас, резин |
|||
| Даалгавар 27."Уусмал дахь бодисын массын хэсэг" гэсэн ойлголтыг ашиглан тооцоо хийх. | |||
| Даалгавар 28.Химийн урвалын үед хийн эзлэхүүний харьцааны тооцоо. Термохимийн тэгшитгэлийг ашиглан тооцоо хийх | |||
| Даалгавар 29.Бодисын тодорхой хэмжээ, урвалд оролцож буй аль нэг бодисын масс эсвэл эзэлхүүн дээр үндэслэн бодисын масс эсвэл хийн эзэлхүүнийг тооцоолох | |||
| Даалгавар 30 (C1).Редокс урвалууд | |||
| Даалгавар 31 (C2).Усан уусмал дахь электролитийн электролитийн диссоциаци. Хүчтэй ба сул электролитууд. Ион солилцооны урвал. | |||
| Даалгавар 32 (C3).Органик бус бодисын янз бүрийн ангиллын хоорондын хамаарлыг баталгаажуулах урвалууд | |||
| Даалгавар 33 (C4).Органик нэгдлүүдийн хамаарлыг баталгаажуулах урвалууд | |||
| Даалгавар 34 (C5)."Уусмал байдал", "уусмал дахь бодисын массын хэсэг" гэсэн ойлголтыг ашиглан тооцоолол. Хэрэв бодисын аль нэг нь илүү их өгөгдсөн (хольцтой) бол урвалын бүтээгдэхүүний массын (эзэлхүүн, бодисын хэмжээ) тооцоолол, хэрэв бодисын аль нэг нь ууссан бодисын тодорхой массын хувьтай уусмал хэлбэрээр өгөгдсөн бол. бодис. Онолын хувьд боломжтой урвалын бүтээгдэхүүний гарцын масс эсвэл эзлэхүүний хувийг тооцоолох. Холимог дахь химийн нэгдлийн массын (масс) тооцоо |
|||
| Даалгавар 35 (C6).Молекулын үүсэх ба бүтцийн томъёободисууд |
ОЙРЦОГЧ 2019 ОНЫ ХУВЬШ
Хамгийн багадаа нийцсэн байдал үндсэн цэгүүдба хамгийн бага тестийн оноо 2019 он. Боловсрол, шинжлэх ухааны хяналтын холбооны албаны тушаалын 1-р хавсралтад нэмэлт, өөрчлөлт оруулах тухай тушаал.

Химийн улсын нэгдсэн шалгалтанд бие даан бэлтгэх боломжтой юу?
Хэрэв та сургуулийн хөтөлбөрийг "5" биш, харин "10" гэж гайхалтай мэддэг бол
Хэрэв та бүх зүйлийг сайтар ойлговол
Хэрэв та сургуулийн сурах бичгээс гадна тусгай ном ашиглан суралцдаг бол бие даан суралцахХимийн улсын нэгдсэн шалгалтанд -
Та багшгүйгээр үүнийг сайн хийж чадна!
Гэсэн хэдий ч Химийн улсын нэгдсэн шалгалтад бие даан бэлдэх цөөхөн хэдэн оюутан бий.
Хэрэв та багштай хамт сурвал бэлтгэл хийхэд илүү хялбар болно. Энэ тохиолдолд амжилтанд хүрэх магадлал өндөр байна.
Химийн хичээлээр улсын нэгдсэн шалгалт өгдөг хүмүүст яагаад багш хэрэгтэй байна вэ?
Нэгдүгээрт, химийн багш нь улсын нэгдсэн шалгалтанд яг юу хэрэгтэйг мэддэг. IN сургуулийн сурах бичигмаш их материал байгаа бөгөөд химийн улсын нэгдсэн шалгалт нь шалгалт юм сургуулийн сургалтын хөтөлбөр, үүнд онцлон тэмдэглэсэн нь огт өөр байна.
Хоёрдугаарт, химийн багш бол таны түвшинг үнэхээр үнэлэх мэдлэг, чадвартай хүн юм. Хэрэв та химийн чиглэлээр улсын нэгдсэн шалгалтанд бие даан бэлдэж байгаа бол үүнийг хийхэд хэцүү байх болно! Ихэнхдээ оюутан сэдвийг ойлгосон гэж боддог. Гэхдээ энэ нь ихэвчлэн химийн шалгалтын хоёр, гурван асуудлыг ямар нэгэн байдлаар зөв хийсэн гэсэн үг юм.
Анхаар. IN Улсын нэгдсэн шалгалтын даалгаварХимийн хувьд алдаатай үндэслэл нь санамсаргүй байдлаар зөв хариулт өгөхөд хүргэдэг. Хэрэв та Химийн улсын нэгдсэн шалгалтанд бие даан бэлтгэж байгаа бол болгоомжтой байгаарай! Өөрийн түвшинг бодитоор үнэлэх арга замыг эрэлхийл.
Гуравдугаарт, химийн багш нь шаардлагатай бүх материалыг хураангуй хэлбэрээр олж, өгч, оюутанд бүрэн ойлгуулах боломжтой. Тэр зөв даалгавруудыг сонгодог. Оюутан өөрөө үүнийг хийж чадахгүй - учир нь тэр химийн хичээлийг зохих түвшинд хараахан ойлгоогүй байна.
Химийн улсын нэгдсэн шалгалтанд бие даан бэлтгэхээр шийдсэн хүмүүст би "Хими. Улсын нэгдсэн шалгалтанд бэлтгэх зохиогчийн курс." Би бас Н.Е.Кузьменко, В.В.Еремин, В.А.Попков нарын “Химийн эхлэл” номыг санал болгож байна. Шаардлагатай хэмжээнээс ч илүү материал бий Улсын нэгдсэн шалгалтанд тэнцсэн, гэхдээ энэ нь гүнзгий ойлгоход зайлшгүй шаардлагатай. Химийн хичээлд улсын нэгдсэн шалгалтанд ороогүй хэсгүүд байдаг ч хэрэв та тэдгээрийг мэддэг бол юу болж байгааг илүү сайн ойлгох болно. Жишээлбэл, эдгээр нь квант тоо ба атомын бүтэц, эдгээр нь органик химийн урвалын механизмууд юм.
Химийн улсын нэгдсэн шалгалтанд бие даан бэлтгэх нь тийм ч хялбар биш юм. Хими бол бидний тодорхой хэв маягийг анзаарах замаар тайлбарлахыг оролдож буй олон төрлийн баримтууд юм. Бид үл хамаарах зүйлүүдийг "харш" гэж нэрлэдэг. 200 жилийн дараа эрдэмтэд: "Хөөрхий 21-р зууны эртний эрдэмтэд, тэд ямар их зүйлийг мэдэхгүй, ямар их андуурсан бэ!" гэж хэлэх байх. Тиймээс бид одоо 18-19-р зууны эрдэмтдийн тухай ярьж байна.
Улсын нэгдсэн шалгалтанд ямар үл хамаарах зүйл тохиолдож болох вэ? Би багшийн хувьд үүнийг мэддэг ч оюутан мэдэхгүй. Зөвхөн таван үл хамаарах зүйл байдаг гэдгийг би оюутандаа хэлж чадна, энэ нь зөрүүтэй юм. Ямар ч сэдвээр гэх мэт!
Гэхдээ энэ нь бүгд биш юм. Өөр өөр, адилхан эрх мэдэлтэй сурах бичгүүд хоорондоо зөрчилдөж болох нь харагдаж байна! Ялангуяа "Химийн урвал" сэдвээр.
Органик химийн хувьд 100% урвалын гарц байдаггүй. Бодит байдал дээр бидний органик химийн урвал гэж нэрлэдэг зүйл бол өөр өөр бүтээгдэхүүн үйлдвэрлэх хэд хэдэн зэрэгцээ үйл явц юм. Тэдний зарим нь үндсэн үйл явц гэж тооцогддог бол бусад нь хоёрдогч, өөр өөр зохиогчид санал нийлэхгүй байна.
Багш нар олон жилийн турш Улсын нэгдсэн шалгалтын хувилбаруудад дүн шинжилгээ хийж, шалгуурыг судалж, Улсын нэгдсэн шалгалтад яг юу шаардлагатайг мэддэг болсон. Гэхдээ оюутан үүнийг мэдэхгүй байж магадгүй!
Тэр ч байтугай туршилтын хэсэгХимийн улсын нэгдсэн шалгалт маш хэцүү байдаг. Жишээлбэл, даалгавар нь таван боломжит хариулттай байдаг. Та гурвыг нь сонгоод тодорхой дарааллаар байрлуулах хэрэгтэй! Химийн улсын нэгдсэн шалгалтанд бие даан бэлдэж байхдаа үүнийг хийж чадах уу? Сонголт чинийх!
Ажил нь хоёр хэсгээс бүрдэнэ.
- 1-р хэсэг - богино хариулттай даалгавар (26 - үндсэн түвшин, 9 ахисан түвшин),
- 2-р хэсэг - нарийвчилсан хариулт бүхий даалгавар (өндөр түвшний 5 даалгавар).
Хамгийн их тоо үндсэн цэгүүдхэвээр үлдсэн: 64.
Гэсэн хэдий ч зарим өөрчлөлтийг хийх болно:
1. Суурь хүндрэлийн түвшний даалгавруудад(хуучин А хэсэг) дараахь зүйлийг агуулна.
a) Олон сонголттой 3 даалгавар (6,11,18) (6-аас 3, 5-аас 2)
б) нээлттэй хариулттай 3 даалгавар (тооцооллын асуудал), зөв хариулт нь тооцооллын үр дүн байх болно. тодорхой нарийвчлалтайгаар бүртгэнэ;
Бусад үндсэн түвшний даалгавруудын нэгэн адил эдгээр даалгаврууд нь эхний 1 оноотой байх болно.
2. Даалгавар илүү өндөр түвшин(өмнө нь В хэсэг) нэг төрлөөр илэрхийлэгдэнэ: дагаж мөрдөх даалгавар. Тэд 2 оноо авна (нэг алдаа байвал - 1 оноо);
3. "Химийн буцах ба эргэлт буцалтгүй урвал. Химийн тэнцвэрт байдал. Төрөл бүрийн хүчин зүйлийн нөлөөн дэх тэнцвэрт байдлын шилжилт" сэдвийн асуултыг үндсэн түвшний даалгавраас ахисан түвшний даалгаварт шилжүүлэв.
Харин азот агуулсан нэгдлүүдийн асуудлыг үндсэн түвшинд шалгана.
4. Цаг зарцуулалт нэгдсэн шалгалтхимийн хичээл 3 цагаас 3.5 цаг хүртэл нэмэгдэнэ(180-аас 210 минут хүртэл).