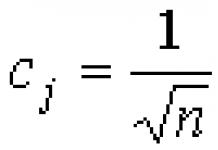Зураг 3.3-т фазын диаграммыг P–V координат, Зураг 3.4-т T–S координат дахь фазын диаграммыг үзүүлэв.

Зураг 3.3. Фазын P-V диаграмм Зураг 3.4. T-S фазын диаграм
Тэмдэглэл:
t + l – хатуу ба шингэний тэнцвэрт орших бүс
t + p - хатуу ба уурын тэнцвэрт орших бүс
l + n – шингэн ба уурын тэнцвэрт байдлын зэрэгцэн орших муж
Хэрэв P–T диаграмм дээр хоёр фазын төлөвийн талбайг муруй хэлбэрээр дүрсэлсэн бол P–V ба T–S диаграммд эдгээр нь зарим хэсэг юм.
AKF шугамыг хилийн муруй гэж нэрлэдэг. Энэ нь эргээд доод хилийн муруй (АК хэсэг) ба дээд хилийн муруй (KF хэсэг) гэж хуваагддаг.
Зураг 3.3 ба 3.4-т хоёр фазын гурван төлөвийн мужууд нийлдэг BF шугам нь 3.1 ба 3.2-р зураг дээрх өргөтгөсөн гурвалсан T цэг юм.
Тогтмол температурт ууршихтай адил бодис хайлах үед хатуу ба шингэн фазын тэнцвэрт хоёр фазын холимог үүсдэг. Хоёр фазын хольцын найрлага дахь шингэний фазын хувийн эзэлхүүний утгыг Зураг 3.3-т AN муруйгаас, хатуу фазын хувийн эзэлхүүний утгыг BE муруйгаас авна. .
AKF контураар хязгаарлагдсан талбайн дотор бодис нь буцалж буй шингэн (L) ба хуурай ханасан уур (P) гэсэн хоёр фазын холимог юм.
Эзлэхүүний нэмэлт байдлаас шалтгаалан ийм хоёр фазын хольцын тодорхой эзэлхүүнийг томъёогоор тодорхойлно

Тодорхой энтропи:

Фазын диаграмын ганц цэгүүд
Гурвалсан цэг
Гурвалсан цэг нь гурван фазын тэнцвэрийн муруйг нэгтгэх цэг юм. 3.1 ба 3.2-р зурагт энэ нь T цэг юм.
Зарим цэвэр бодисууд, жишээлбэл, хүхэр, нүүрстөрөгч гэх мэт хатуу төлөвт нэгтгэх нь хэд хэдэн үе шаттай (өөрчлөгдсөн) байдаг.
Шингэн ба хийн төлөвт өөрчлөлт ороогүй болно.
(1.3) тэгшитгэлийн дагуу нэг бүрэлдэхүүн хэсэгтэй дулааны хэв гажилтын системд гурваас илүүгүй фаз нь нэгэн зэрэг тэнцвэрт байдалд байж болохгүй.
Хэрэв бодис нь хатуу төлөвт хэд хэдэн өөрчлөлттэй байвал бодисын нийт фазын тоо гурваас давсан бөгөөд ийм бодис нь хэд хэдэн гурвалсан цэгтэй байх ёстой. Жишээлбэл, 3.5-р зурагт нэгтгэх хатуу төлөвт хоёр өөрчлөлт орсон бодисын P–T фазын диаграммыг үзүүлэв.

Зураг 3.5. Фазын P-T диаграмм
хоёр талсттай бодисууд
ямар үе шатууд
Тэмдэглэл:
I - шингэн үе шат;
II - хийн үе шат;
III 1 ба III 2 - нэгтгэх хатуу төлөвийн өөрчлөлт
(талст үе шатууд)
Гурвалсан T 1 цэгт дараахь зүйлс тэнцвэрт байдалд байна: хий, шингэн ба талст фаз III 2. Энэ цэг нь үндсэн гурвалсан цэг.
Гурвалсан T2 цэг дээр дараахь зүйлс тэнцвэрт байдалд байна: шингэн ба хоёр талст фаз.
T3 гурвалсан цэг дээр хийн болон хоёр талст фаз тэнцвэртэй байна.
Усны таван талст өөрчлөлт (үе шат) байдаг: III 1, III 2, III 3, III 5, III 6.
Энгийн мөс бол талст үе шат III 1 бөгөөд бусад өөрчлөлтүүд нь олон мянган МПа маш өндөр даралтаар үүсдэг.
Энгийн мөс нь 204.7 МПа даралттай, 22 0С температуртай байдаг.
Үлдсэн өөрчлөлтүүд (үе шатууд) нь уснаас илүү мөстэй байдаг. Эдгээр мөсний нэг болох "халуун мөс" нь 2000 МПа даралтаар + 80 0 С хүртэл ажиглагдсан.
Термодинамик параметрүүд үндсэн усны гурвалсан цэг дараах:
T tr = 273.16 K = 0.01 0 C;
P tr = 610.8 Па;
Vtr = 0.001 м 3 / кг.
Хайлах муруй гажиг (  ) зөвхөн ердийн мөсөнд байдаг.
) зөвхөн ердийн мөсөнд байдаг.
(1. Фазын дүрэм. 2. Тэнцвэрийн фазын диаграммын тухай ойлголт. 3. Сегментийн дүрэм. 4. Төрийн диаграммIIIтөрлийн)
1. Фазын дүрэм
Температур эсвэл бүрэлдэхүүн хэсгүүдийн концентраци өөрчлөгдөхөд систем (хайлш) нь өөр өөр төлөвт байж болно. Нэг төлөвөөс нөгөөд шилжих явцад фазын өөрчлөлтүүд тохиолддог - шинэ үе шатууд гарч ирдэг эсвэл одоо байгаа үе шатууд алга болдог.
Системийн төлөв байдлыг өөрчлөх боломж, тухайлбал фазын тоо, химийн найрлага нь түүний хувьсах чадвараар тодорхойлогддог. эрх чөлөөний зэрэглэлийн тоо.
Тодорхойлолт. Системийн эрх чөлөөний зэрэглэлийн тоо нь системийн фазын тоог өөрчлөхгүйгээр өөрчлөх боломжтой гадаад (температур, даралт) болон дотоод (концентраци) хүчин зүйлсийн тоо юм.
Фазын дүрмийн тэгшитгэл ( Гиббсын хууль) хэд хэдэн бүрэлдэхүүн хэсгүүдээс бүрдсэн тогтмол даралттай системийн хувьд хэлбэртэй байна
C = K – F + 1, (3.1)
Энд C нь эрх чөлөөний зэрэглэлийн тоо (системийн хувьсах чадвар); K - бүрэлдэхүүн хэсгүүдийн тоо; Ф - үе шатуудын тоо.
Эрх чөлөөний зэрэглэлийн тоо үргэлж тэгээс их буюу тэнцүү байдаг тул i.e. 0 байвал бүрэлдэхүүн хэсгүүд болон фазын тоо хоорондын нөхцөл хангагдана
F K + 1, (3.2)
хайлш дахь тэнцвэрийн фазын хамгийн их тоог тогтоох.
2. Тэнцвэрийн фазын диаграммын тухай ойлголт
Тэнцвэрийн фазын диаграмм ( төлөвийн диаграммууд) хайлшийн бүтцийг судлах, тэдгээрийн дулааны боловсруулалтын горимыг сонгох гэх мэтийг ашигладаг.
Тэнцвэрийн фазын диаграмм нь тэнцвэрийн нөхцөлд өгөгдсөн нөхцөлд (бүрэлдэхүүн хэсгүүдийн концентраци ба температур) ямар фазууд байгааг харуулдаг. Диаграммаас та нэгтгэх төлөв, фазын тоо хэмжээ, химийн найрлага, түүнчлэн хайлшийг бүрдүүлдэг бүрэлдэхүүн хэсгүүдийн температур, концентрацаас хамааран бүтцийн фазын төлөвийг тодорхойлж болно.
Тэнцвэрийн фазын диаграм нь "график" бөгөөд абсцисса тэнхлэг дээр бүрэлдэхүүн хэсгүүдийн концентрацийг (ямар ч хайлш дахь бүрэлдэхүүн хэсгүүдийн нийт агууламж 100%), ордны тэнхлэг дээр температурыг дүрсэлсэн байдаг. Диаграммын x тэнхлэг дээрх туйлын цэгүүд (зүүн ба баруун) нь цэвэр бүрэлдэхүүн хэсгүүдтэй тохирч байна. Энэ тэнхлэгийн бусад цэг нь хайлшийн бүрэлдэхүүн хэсгүүдийн тодорхой концентрацтай тохирч байна.
Жишээлбэл, хоёр бүрэлдэхүүн хэсгийн хайлшийн хувьд (Зураг 3.1) цэг Ацэвэр таарч байна, өөрөөр хэлбэл. 100% А бүрэлдэхүүн хэсэг агуулсан, цэг IN– цэвэр бүрэлдэхүүн хэсэг В, цэг С – 75% А ба 25% В агуулсан хайлш, цэг Д – 75% B ба 25% A агуулсан хайлш. Баяжуулах тэнхлэг нь бүрэлдэхүүн хэсгүүдийн аль нэгний агууламжийн өөрчлөлтийг заана (Зураг 3.1 - Б бүрэлдэхүүн хэсэг).
Цагаан будаа. 3.1 – Тэнцвэрийн фазын диаграммын координатууд
Фазын диаграммыг бүтээхийн тулд янз бүрийн найрлагатай хайлшийг өөр өөр температурт судалдаг. Диаграммыг бүтээх уламжлалт арга бол дулааны шинжилгээний арга бөгөөд "температур - цаг" координат дахь хайлшийн хөргөлтийн муруйг олж авах боломжийг олгодог. хөргөлтийн муруй(хайлш).
Хайлш нь маш бага хурдтай, өөрөөр хэлбэл тэнцвэрт байдалд ойрхон нөхцөлд хөргөнө.
Хөргөлтийн диаграммыг бүтээх ажлыг дараах дарааллаар гүйцэтгэнэ.
"температур - концентраци" координатууд дээр судлагдсан найрлагын хайлштай тохирох босоо шугамыг зурсан (баяжуулалтын алхам бага байх тусам диаграмм илүү нарийвчлалтай байх болно);
эдгээр хайлшийн хувьд хөргөлтийн муруйг барьсан;
Босоо шугамууд дээр цэгүүд нь температур өөрчлөгдөх температурыг заана. нэгтгэх байдалэсвэл бүтэцхайлш;
Янз бүрийн хайлшийн ижил хувирлын цэгүүд нь системийн ижил төлөвийн талбайг хязгаарласан шугамаар холбогддог.
Бид "цайрын цагаан тугалга" фазын диаграммыг бүтээхдээ лабораторийн №1 ажилд ийм бүтээн байгуулалт хийсэн.Zn – Сн»).
Диаграммын төрөл нь хатуу ба шингэн төлөвт байгаа бүрэлдэхүүн хэсгүүд хоорондоо хэрхэн харьцахаас хамаарна.
Хамгийн энгийн диаграммууд нь хоёртын (хоёр буюу хоёр бүрэлдэхүүн хэсэг) системүүд юм. Олон бүрэлдэхүүн хэсгүүдийн системийг "илүүдэл" бүрэлдэхүүн хэсгүүдийн тогтмол утгуудаар багасгаж болно), үндсэн төрлүүд нь хайлшийн фазын диаграммуудыг багтаасан байдаг хатуу төлөв(хэвийн температурт):
a) цэвэр бүрэлдэхүүн хэсгүүдийн механик хольц (I төрөл);
б) бүрэлдэхүүн хэсгүүдийн хязгааргүй уусах чадвартай хайлш (II төрөл);
в) бүрэлдэхүүн хэсгүүдийн уусах чадвар хязгаарлагдмал хайлш (III төрөл);
г) химийн нэгдэл үүсгэсэн хайлш (IV төрлийн).
Лекц дээр бид гурав дахь төрлийн фазын диаграмын жишээг ашиглан тэнцвэрийн фазын диаграммыг бүтээх талаар авч үзэх болно - бүрэлдэхүүн хэсгүүдийн уусах чадвар хязгаарлагдмал хайлш (бусад төрлийн диаграммыг лабораторийн ажилд авч үзнэ).
Гэхдээ эхлээд ийм диаграммд дүн шинжилгээ хийхэд юу чухал болохыг ярилцъя: сегментийн дүрэм(хөшүүрэг).
Ингээд авч үзье П− Т− Xхоёртын системд зориулсан диаграммууд. Эрчимжүүлсэн судалгааны ажил П− Т− Xфазын диаграммууд нь өндөр даралтыг (арван, хэдэн зуун мянган атмосфер) ашиглах нь зарим тохиолдолд фазын диаграммын төрлийг өөрчлөх, фазын болон полиморф хувирлын температурын огцом өөрчлөлт, гадаад төрх байдалд хүргэдэг болохыг харуулсан. атмосферийн даралтад тухайн системд байхгүй шинэ үе шатууд. Жишээлбэл, өндөр температурт хатуу төлөвт хязгааргүй уусах чадвартай диаграмм ба хатуу уусмал α-г бага температурт α1 + α2 гэсэн хоёр хатуу уусмал болгон задлах диаграм нь аажмаар даралт ихсэх тусам эвтектиктэй диаграм болж хувирдаг (4.18-р зургийг үз). А). Зураг дээр. 4.18, б GaP хагас дамжуулагч нэгдэл үүсэх Ga–P системийн төлөвийн диаграммыг үзүүлэв. Даралтаас хамааран энэ нэгдэл нь нийцтэй эсвэл тохирохгүй хайлж болно. Үүний дагуу давхар диаграммын харагдах байдал өөрчлөгддөг. Т− Xянз бүрийн изобар хэсгүүд дээр гурвалсан П− Т− Xдиаграммууд.
Практикт эзэлхүүнтэй П− Т− Xдиаграммыг маш ховор хийдэг. Гурван хэмжээст болгон хувиргах үе шатыг ихэвчлэн хийдэг П− Т− XАна графикууд
Цагаан будаа. 4.18. А- П− Т− Xдиаграмм; б- П− Т− Xтөлөвийн диаграм
GaP-ийн нэгдэл нийцтэй ба тохирохгүй хайлдаг Ga–P системүүд
даралтаас хамаарна.
Тэдний хавтгай дээрх проекцуудыг ашиглан лиз П− Т, Т− XТэгээд П− X, түүнчлэн тогтмол температур эсвэл даралттай янз бүрийн хэсгүүд (4.18-р зургийг үз). А).
Систем дэх фазын өөрчлөлтийг шинжлэхдээ ялгах хэрэгтэй гэдгийг анхаарна уу П− Т− Xдиссоциацийн даралттай фазын диаграммууд П dis9 нь жижиг бөгөөд Пфазын диаграмм дээр - энэ нь гадаад даралт бөгөөд диссоциацийн даралт өндөр ба П- Энэ П dis. Бүрэлдэхүүн хэсгүүд нь диссоциацийн даралт багатай, хольцын хамгийн их хайлах цэг нь хамгийн бага буцалгах цэгээс бага байдаг системд (системд маш дэгдэмхий бүрэлдэхүүн хэсгүүд байдаггүй) фазын хувиргалт дахь хийн фазын үүргийг үл тоомсорлож болно. . Хэрэв аль нэг бүрэлдэхүүн хэсгийн диссоциацийн даралт өндөр байвал (систем нь дэгдэмхий бүрэлдэхүүн хэсгүүдийг агуулдаг) шингэнээс дээш ба түүнээс доош температурт хийн фазын найрлагыг харгалзан үзэх шаардлагатай.
Фазын диаграммыг нарийвчлан авч үзье П dis − Т− Xөндөртэй
диссоциацийн даралт (өндөр дэгдэмхий бүрэлдэхүүн хэсгүүдтэй фазын диаграммууд). Хагас дамжуулагч электроникийн дэгдэмхий бүрэлдэхүүн хэсгүүдийг агуулсан нэгдлүүдийн үүрэг нэмэгдсэнтэй холбоотойгоор тэдэнд анхаарал хандуулах нь нэмэгдсэн гэдгийг тэмдэглэх нь зүйтэй. Жишээлбэл, эдгээрт дэгдэмхий найрлагатай фосфор, хүнцэл агуулсан AIIIBV нэгдлүүд, мөнгөн ус агуулсан AIIBVI нэгдлүүд, хүхэр агуулсан AIVBVI гэх мэт орно.
Бүх хагас дамжуулагч нэгдлүүд нь нэг төрлийн, өөрөөр хэлбэл, өөрөө уусах чадвартай байдаг.
9 П dis - тэнцвэрт байгаа бүх фазын диссоциацийн өгөгдсөн нөхцлийн тэнцвэрт даралт. Хэрэв системд маш тогтворгүй нэг бүрэлдэхүүн хэсэг байгаа бол П dis нь системийн өндөр дэгдэмхий бүрэлдэхүүн хэсгийн тэнцвэрт диссоциацийн даралт юм.
стехиометрийн найрлагаас хэтэрсэн бүрэлдэхүүн хэсгүүдийн аль нэг буюу гуравдагч бүрэлдэхүүн хэсэг.
Стехиометрийн найрлагаас аливаа хазайлт нь цахилгаан шинж чанарт нөлөөлдөг (3-р бүлгийг үз). Тиймээс тодорхой шинж чанартай дэгдэмхий бүрэлдэхүүнийг агуулсан талстыг дахин үйлдвэрлэхийн тулд тухайн найрлагатай нэгдлүүдийг дахин үйлдвэрлэх шаардлагатай.
Гэсэн хэдий ч нэгдлийн бүрэлдэхүүн хэсгүүдийн аль нэгний хэлбэлзэл нь аль бүрэлдэхүүн хэсгийн диссоциацийн даралт өндөр байхаас хамаарч анион эсвэл катион хоосон орон зай үүссэний улмаас стехиометрийн найрлагаас хазайхад хүргэдэг. бусад бүрэлдэхүүн хэсэг. Бүлэгт аль хэдийн хэлэлцсэнчлан. 3, хэд хэдэн нэгдлүүдийн сул орон тоо нь хүлээн авагч эсвэл донорын түвшинг үүсгэж, улмаар физик шинж чанарт нөлөөлдөг.
А ба В байрлал дахь сул орон тоо үүсэх энерги нь бараг хэзээ ч ижил байдаггүй тул анионик ба катионуудын концентраци нь өөр өөр байдаг бөгөөд нэгдлийн нэгэн төрлийн бүс нь стехиометрийн найрлагатай харьцуулахад тэгш бус болж хувирдаг. Үүний дагуу бараг бүх нэгдлүүдийн хувьд хайлах хамгийн их температур нь стехиометрийн найрлагатай хайлштай тохирохгүй байна.10
Хайлмал эсвэл уусмалаас өсөлтийн температур дахь диссоциацийн даралттай тэнцэх дэгдэмхий бүрэлдэхүүн хэсгийн гаднах даралтаар ургуулсан бол дэгдэмхий чанараас болж нэгдлийн найрлага өөрчлөгдөхөөс урьдчилан сэргийлэх боломжтой. Энэ нөхцлийг ашиглан сонгосон П dis − Т– Xдиаграммууд.
Хайлш дахь өндөр дэгдэмхий бүрэлдэхүүн хэсгийн диссоциацын даралт нь түүний найрлагаас ихээхэн хамаардаг бөгөөд энэ бүрэлдэхүүн хэсгийн концентраци буурах тусам ихэвчлэн буурдаг, жишээлбэл, In-As системийн хувьд (хүнцлийн диссоциацийн даралт бараг дөрвөн дарааллаар буурдаг. хүнцлийн концентрацийг 100-20% хүртэл бууруулах. Үүний үр дүнд нэгдэл дэх дэгдэмхий бүрэлдэхүүн хэсгийн диссоциацийн даралт нь ижил температурт цэвэр бүрэлдэхүүн хэсгийн диссоциацийн даралтаас хамаагүй бага байна.
Энэ нэгдлийг олж авах хоёр температурын схемд энэ нөхцөл байдлыг ашигладаг. Нэг зууханд хоёр температурын бүс үүсдэг.
10 Гэсэн хэдий ч нэг төрлийн нарийн мужтай нэгдлүүд, тухайлбал AIII BV ба ихэнх нэгдлүүд, ялангуяа нэг төрлийн бүсийн дундаж өргөнтэй AIV BVI нэгдлүүдийн хувьд хайлах бодит температурын хазайлтаас хамаарч нийцтэй хайлах нэгдлүүд гэсэн ойлголтыг ашигладаг. нэгдлийн хайлах температураас стехиометрийн найрлагатай нэгдлүүдийн хэмжээ бага байна.

Цагаан будаа. 4.19. П dis − ТХэсэг П dis − Т− X Pb–S системийн фазын диаграммууд. 1 -
гурван фазын шугам; 2 - Жич PbS+S2 дээр 2 цэвэр хүхэр; 3 - Жич PbS+Pb дээр 2.
Нэг нь температуртай Т 1, нэгдлийн талсжих температуртай тэнцүү. Энд хайлмал бүхий савыг байрлуулсан байна. Хоёр дахь бүсэд нэгдлийн цэвэр дэгдэмхий бүрэлдэхүүн хэсэг болох As-ыг байрлуулна. Температур ТХоёрдахь бүсийн 2-ыг ижил температурт хадгалдаг бөгөөд энэ нь цэвэр хэлбэрийн дэгдэмхий бүрэлдэхүүн хэсгийн диссоциацийн даралт нь температур дахь нэгдэл дэх энэ бүрэлдэхүүн хэсгийн диссоциацийн даралттай тэнцүү байна. Т 1. Үүний үр дүнд эхний бүсэд нэгдлээс дээш дэгдэмхий бүрэлдэхүүн хэсгийн уурын даралт нь нэгдэл дэх хэсэгчилсэн диссоциацийн даралттай тэнцүү байх ба энэ бүрэлдэхүүн хэсэг нь хайлмалаас дэгдэмхийлэхээс сэргийлж, нэгдлийн талстжилтыг баталгаажуулдаг. өгөгдсөн найрлага.
Зураг дээр. 4.19 өгөгдсөн П− Т Pb–S фазын диаграммын проекц.
Хатуу шугам нь хатуу, шингэн ба хийн фазын гурван фазын тэнцвэрийн шугамыг харуулж, хатуу нэгдлийн тогтвортой байдлын бүсийг хязгаарладаг; тасархай шугам - нэгэн төрлийн бүсийн доторх изоконцентрацийн шугамууд. Изоконцентрацийн шугамууд нь стехиометрийн (ижил найрлага) илүүдэл хар тугалга (дамжуулагч) руу тэнцүү хазайлттай найрлагыг харуулж байна. n-төрөл) эсвэл илүүдэл хүхэр рүү (дамжуулагч х-төрөл), температур ба хүхрийн уурын даралтын өгөгдсөн утгын тэнцвэрт байдал. Шугам n= хтемператур ба даралтын утгатай тохирч байна Жич 2, хатуу фаз нь хатуу стехиометрийн найрлагатай. Энэ нь стехиометрийн нэгдлийн хайлах цэг болох температурт гурван фазын шугамыг гатлана. эсвэл илүүдэл хүхэр рүү (дамжуулагч х-төрөл).
Зураг дээрээс харж болно. 4.19-д зааснаар стехиометрийн найрлагатай нэгдлүүдийн хайлах цэг нь хар тугалга ихтэй хайлш нь томъёоны найрлагатай харьцуулахад хайлах дээд температураас бага байна. Дэгдэмхий бүрэлдэхүүн хэсгийн уурын хэсэгчилсэн даралтаас болор найрлагын огцом хамаарал харагдаж байна. Өндөр температурын бүсэд янз бүрийн найрлагад тохирсон бүх муруйнууд шугам руу ойртдог n= х. Температур буурах тусам янз бүрийн найрлагад тохирсон тэнцвэрийн даралтын зөрүү нэмэгддэг. Энэ нь өндөр температурт явагддаг талсжилтын үед өгөгдсөн найрлагатай хайлшийг шууд олж авахад хүндрэлтэй байгааг тайлбарладаг. Өөр өөр найрлагад зориулсан хэсэгчилсэн даралтын муруй нь ижил төстэй байдаг тул дэгдэмхий бүрэлдэхүүн хэсгийн уурын даралт дахь санамсаргүй жижиг хазайлт нь хатуу фазын найрлагад мэдэгдэхүйц өөрчлөлт гарахад хүргэдэг.
Хэрэв ургасны дараа болорыг бага температурт удаан хугацаагаар хатгаж, янз бүрийн найрлагад зориулсан изоконцентрацийн шугамууд эрс ялгаатай даралтанд өртвөл болорын найрлагыг өгөгдсөн утгад хүргэж болно. Үүнийг практикт ихэвчлэн ашигладаг.
Оршил
Фазын диаграмм нь янз бүрийн материалын харилцан үйлчлэлийн талаар ярихдаа материалын шинж чанарын талаархи аливаа хэлэлцүүлгийн салшгүй хэсэг юм. Фазын диаграмм нь микроэлектроникт онцгой ач холбогдолтой, учир нь Хар тугалга ба идэвхгүй давхаргыг үйлдвэрлэхийн тулд олон төрлийн материалыг ашиглах шаардлагатай. Нэгдсэн хэлхээний үйлдвэрлэлд цахиур нь янз бүрийн металлуудтай нягт холбоотой байдаг тул цахиур нь бүрэлдэхүүн хэсгүүдийн нэг болох фазын диаграммд онцгой анхаарал хандуулах болно.
Энэхүү хураангуй нь ямар төрлийн фазын диаграммууд байдаг, фазын шилжилтийн тухай ойлголт, хатуу уусах чадвар, микроэлектроникийн бодисын хамгийн чухал системийг авч үздэг.
Фазын диаграммын төрлүүд
Нэг фазын диаграмм нь даралт, эзэлхүүн, температураас хамааран зөвхөн нэг материалын фазын төлөвийг харуулсан график юм. Гурван хэмжээст графикийг хоёр хэмжээст хавтгай дээр зурах нь ихэвчлэн заншилгүй байдаг - тэд түүний проекцийг температур - даралтын хавтгайд дүрсэлдэг. Нэг фазын төлөвийн диаграмын жишээг Зураг дээр үзүүлэв. 1.
Цагаан будаа. 1.
Диаграмм нь материал нь зөвхөн нэг фазын төлөвт - хатуу, шингэн эсвэл хий хэлбэрээр байж болох хэсгүүдийг тодорхой зааж өгсөн болно. Заасан шугамын дагуу бодис нь хоорондоо уялдаа холбоотой хоёр фазын төлөвтэй (хоёр үе шат) байж болно. Аливаа хослолууд явагддаг: хатуу - шингэн, хатуу - уур, шингэн - уур. Диаграммын шугамууд огтлолцох цэг буюу гурвалсан цэг гэж нэрлэгддэг цэг дээр бүх гурван үе шат нэгэн зэрэг оршиж болно. Түүнээс гадна, энэ нь нэг температурт боломжтой тул гурвалсан цэг нь температурын сайн жишиг цэг болдог. Ихэвчлэн лавлах цэг нь усны гурвалсан цэг юм (жишээлбэл, жишиг уулзвар нь мөс-ус-уурын системтэй харьцаж байгаа термопар ашиглан нарийвчлалтай хэмжилт хийхэд).
Хоёртын фазын диаграм (хоёртын системийн фазын диаграм) нь хоёр бүрэлдэхүүн хэсэгтэй системийн төлөв байдлыг илэрхийлдэг. Ийм диаграммд температурыг ординатын тэнхлэгийн дагуу, хольцын бүрэлдэхүүн хэсгүүдийн хувийг абсцисса тэнхлэгийн дагуу зурдаг (ихэвчлэн энэ нь нийт массын хувь (жин %) эсвэл нийт массын хувь юм. атомын тоо (ат.%)). Даралтыг ихэвчлэн 1 атм гэж үздэг. Хэрэв шингэн ба хатуу фазыг авч үзвэл эзэлхүүний хэмжилтийг үл тоомсорлодог. Зураг дээр. 2. жин буюу атомын хувийг ашиглан А ба В бүрэлдэхүүн хэсгүүдийн ердийн хоёр фазын фазын диаграммыг үзүүлэв.

Цагаан будаа. 2.
Захиа? ууссан В-тэй А бодисын фазыг зааж өгсөн, ? А бодис нь ууссан В бодисын фаз гэсэн үг, тийм үү? + ? Эдгээр үе шатуудын холимог гэсэн үг. Үсэг (шингэнээс) нь шингэний үе шатыг илэрхийлдэг бөгөөд L+?? болон L+? дундаж шингэн фаз нэмэх фаз эсвэл тус тус. Фазуудыг тусгаарлах шугамууд, өөрөөр хэлбэл бодисын өөр өөр фазууд байж болох шугамууд дараах нэртэй байна: солиус - фазууд нэгэн зэрэг орших шугам? эсвэл? L+ үе шаттай юу? болон L+? тус тус; solvus - аль фазууд нэгэн зэрэг оршдог шугам? Тэгээд? + ? эсвэл? Тэгээд? + ?, мөн ликвидус нь аль фазын L ба L+ фазын шугам вэ? эсвэл L+?
Шингэн шингээлтийн хоёр шугамын огтлолцох цэг нь ихэвчлэн А ба В бодисын бүх боломжит хослолуудын хамгийн бага хайлах цэг бөгөөд эвтектик цэг гэж нэрлэгддэг. Эвтектик цэг дэх бүрэлдэхүүн хэсгүүдийн харьцаатай хольцыг эвтектик хольц (эсвэл зүгээр л эвтектик) гэж нэрлэдэг.
Холимог шингэн төлөвөөс (хайлмал) хатуу төлөвт хэрхэн шилждэг, фазын диаграм нь өгөгдсөн температурт байгаа бүх фазын тэнцвэрийн найрлагыг урьдчилан таамаглахад хэрхэн тусалдаг талаар авч үзье. Зураг руу эргэж орцгооё. 3.

Цагаан будаа. 3.
Эхэндээ хольц нь T1 температурт C M найрлагатай, T1-ээс T2 хүртэлх температурт шингэн фаз, T2 температурт L ба? фазууд нэгэн зэрэг оршдог гэж үзье. L фазын найрлага нь одоо байгаа C M, фазын найрлага? C ?1 байна. Температурыг T 3 хүртэл бууруулснаар шингэний найрлага нь шингэний муруйн дагуу өөрчлөгдөж, фазын найрлага өөрчлөгдөх үү? - изотермтэй огтлолцох хүртэл солидусын муруй дагуу (хэвтээ шугам) T 3 . Одоо L фазын найрлага нь C L, фазын найрлага нь C ?2 байна. С ?2 найрлагад зөвхөн фаз руу орсон бодис байх ёсгүй гэдгийг тэмдэглэх нь зүйтэй. температурт T 3 , гэхдээ бас үе шатанд шилжсэн бүх бодис? өндөр температурт С ?2 найрлагатай байх ёстой. Энэхүү найрлагыг тэгшитгэх нь А бүрэлдэхүүн хэсгийг одоо байгаа фаз руу хатуу төлөвт тараах замаар явагдах ёстой бөгөөд ингэснээр T 3 температурт хүрэхэд фазын бүх бодис C?2 найрлагатай болно. Температурын цаашдын бууралт нь биднийг эвтектик цэг рүү авчирдаг. Энэ нь үе шаттай юу? Тэгээд? шингэн фазтай нэгэн зэрэг оршдог. Бага температурт зөвхөн фазууд байдаг уу? Тэгээд?. Фазын холимог үүссэн үү? Тэгээд? найрлага C E дүүргэгчтэй? анхны найрлагатай С?3. Дараа нь энэ хольцыг эвтектикээс доош температурт удаан хугацаагаар байлгаснаар хатуу биетийг гаргаж авах боломжтой. Үүссэн хатуу бодис нь хоёр үе шатаас бүрдэнэ. Фаз тус бүрийн найрлагыг изотермийн харгалзах solvus шугамтай огтлолцох цэг дээр тодорхойлж болно.
Одоо байгаа үе шат бүрийн найрлагыг хэрхэн тодорхойлохыг саяхан харуулсан. Одоо үе шат бүрт бодисын хэмжээг тодорхойлох асуудлыг авч үзье. Зураг дээрх будлианаас зайлсхийхийн тулд. 4. Хоёр фазын энгийн диаграммыг дахин үзүүлэв. T 1 температурт хайлмал найрлага нь C M (Б бүрэлдэхүүн хэсэг гэсэн үг), дараа нь T 2 үе шатанд L нь найрлагатай C L , ба фаз гэж үзье? C s найрлагатай байх болно. Хатуу төлөвт байгаа бодисын массыг M L, хатуу төлөвт байгаа бодисын массыг M S гэж үзье. Нийт массыг хадгалах нөхцөл нь дараах тэгшитгэлд хүргэдэг
(M L + M S)C M = M L C L + M S C S.

Цагаан будаа. 4.
Энэ нь T1 температурт байгаа бодисын нийт массыг В хувиар үржүүлсэн нь В бодисын нийт масс болохыг харуулж байна. Энэ нь температурын шингэн ба хатуу фаз дахь В бодисын массын нийлбэртэй тэнцүү байна. T2. Энэ тэгшитгэлийг шийдэж, бид олж авна
Энэ илэрхийлэлийг "түвшингийн дүрэм" гэж нэрлэдэг. Энэ дүрмийг ашиглан хайлмалын анхны найрлага ба түүний нийт массыг мэдсэнээр хоёр фазын диаграммын аль ч хэсэгт аль ч фазын масс болон В бодисын хэмжээг тодорхойлох боломжтой. Яг ижил аргаар бид тооцоолж болно
Зураг дээр. 5. Хайлмал хатуурах өөр нэг жишээг үзүүлэв. Температурын T 1-ээс T 2 хүртэл буурах нь L ба фазуудыг холиход хүргэдэг. C M ба C найрлагатай юу? . Цаашид хөргөх явцад L найрлага нь шингэний дагуу өөрчлөгддөг ба найрлага? - өмнө дурдсанчлан солидусын дагуу. Температур нь T 3 хүрэхэд найрлага? нь C M-тэй тэнцүү болох ба түвшний дүрмийн дагуу T 3-аас доош температурт шингэн фаз оршин тогтнох боломжгүй. T4-ээс доош температурт фазууд? Тэгээд? фазын агрегатууд байдаг уу? Тэгээд?. Жишээ нь, температурт T 5 фазын дүүргэгч? T5 изотерм ба solvus-ийн огтлолцолоор тодорхойлогдох найрлагатай байх болно?. Нийлмэл үү? ижил төстэй байдлаар тодорхойлогддог - изотерм ба solvus-ийн огтлолцолоор?.

Цагаан будаа. 5.
Хоёр фазын диаграммын хэсгүүдийг одоо ч гэж нэрлэдэг үү? ба?, хатуу уусах талбайнууд байна: талбайд? А ба В ууссан байна.Өгөгдсөн температурт В-д уусч болох хамгийн их А хэмжээ нь температураас хамаарна. Эвтектик буюу түүнээс дээш температурт А ба В хурдан хайлуулж болно.Хэрэв үүссэн хайлшийг огцом хөргөвөл А-ийн атомууд В-ийн торонд "хүргэгдэх" боломжтой.Харин өрөөний температурт хатуу уусах чадвар их байвал бага (энэ нь энэ температурт авч үзэх арга нь тийм ч тохиромжтой биш гэдгийг харуулж байна), дараа нь хайлш дээр хүчтэй стресс үүсч, түүний шинж чанарт ихээхэн нөлөөлдөг (их хэмжээний стресстэй үед хэт ханасан хатуу уусмалууд үүсдэг, систем нь тийм биш юм. тэнцвэрийн төлөв бөгөөд диаграмм нь зөвхөн тэнцвэрийн төлөв байдлын тухай мэдээллийг өгдөг). Заримдаа, жишээлбэл, мартенсит үйлдвэрлэхийн тулд ганг бөхөөх замаар бэхжүүлэх үед ийм нөлөө үзүүлэх нь зүйтэй. Гэхдээ микроэлектроникийн хувьд түүний үр дүн нь хор хөнөөлтэй байх болно. Тиймээс, допинг, өөрөөр хэлбэл тархахаас өмнө цахиурт нэмэлт бодис нэмэх нь хэт их хайлшаас болж гадаргууг гэмтээхгүй байх үүднээс өндөр температурт хийгддэг. Хэрэв субстрат дахь нэмэлт бодисын хэмжээ нь ямар ч температурт хатуу уусах чадварын хязгаараас их байвал хоёр дахь үе шат гарч, холбогдох хэв гажилт үүсдэг.