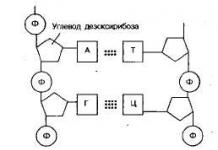
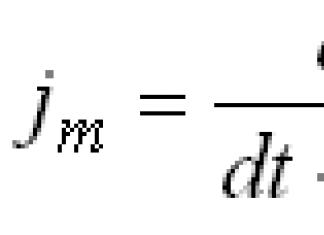Үргэлжлэл. Эхлэлийг нь үзнэ үү № 15, 16/2004
Хичээл 5. Гибридизаци
нүүрстөрөгчийн атомын орбиталууд
Ковалент химийн холбоог дараах электрон хосуудыг ашиглан үүсгэнэ.

Химийн холбоо үүсгэх, өөрөөр хэлбэл. Зөвхөн хосгүй электронууд нь өөр атомын "гадаад" электронтой нийтлэг электрон хос үүсгэж чадна. Цахим томьёо бичихдээ хосгүй электронууд тойрог замын үүрэнд нэг нэгээр нь байрлана.
Атомын тойрог замнь атомын цөмийг тойрсон орон зайн цэг бүрт электрон үүлний нягтыг тодорхойлдог функц юм. Электрон үүл гэдэг нь электроныг өндөр магадлалтайгаар илрүүлэх орон зайн бүс юм.
Батлуулахын тулд цахим бүтэцнүүрстөрөгчийн атом ба энэ элементийн валент нь нүүрстөрөгчийн атомын өдөөлт гэсэн ойлголтыг ашигладаг. Хэвийн (өдөөгдөөгүй) төлөвт нүүрстөрөгчийн атом нь хоёр хосгүй 2-той байдаг Р 2 электрон. Сэтгэл хөдөлсөн төлөвт (энергийг шингээх үед) 2-ын аль нэг нь с 2 электрон чөлөөтэй явж болно Р- тойрог зам. Дараа нь нүүрстөрөгчийн атомд дөрвөн хосгүй электрон гарч ирнэ.
Атомын электрон томъёонд (жишээлбэл, нүүрстөрөгчийн 6 С – 1) байгааг санацгаая с 2 2с 2 2х 2) үсгийн өмнө том тоонууд - 1, 2 - энергийн түвшний тоог заана. Захидал сТэгээд Рэлектрон үүлний (орбитал) хэлбэрийг зааж, үсгүүдийн баруун талд байгаа тоонууд нь тухайн тойрог зам дахь электронуудын тоог заана. Бүгд с- бөмбөрцөг тойрог замууд:

2-оос бусад эрчим хүчний хоёр дахь түвшинд с- гурван тойрог зам байдаг 2 Р- тойрог замууд. Эдгээр 2 Р-орбиталууд нь дамббеллтэй төстэй эллипсоид хэлбэртэй бөгөөд бие биенээсээ 90 ° өнцгөөр орон зайд чиглэгддэг. 2 Р-Орбиталууд 2-ыг тэмдэглэнэ p x, 2p yба 2 p zэдгээр орбиталууд байрлах тэнхлэгүүдийн дагуу.
Химийн холбоо үүсэх үед электрон орбиталууд ижил хэлбэртэй болдог. Тиймээс ханасан нүүрсустөрөгчид нэг с- тойрог зам ба гурван Р- нүүрстөрөгчийн атомын орбиталууд дөрвөн ижил (эрлийз) үүсгэдэг. sp 3-орбитал:
![]()
Энэ - sp 3 - эрлийзжүүлэх.
Гибридизаци- атомын орбиталуудын зохицол (холимог) ( сТэгээд Р) гэж нэрлэгддэг шинэ атомын орбитал үүсэх нь эрлийз тойрог замууд.
Эрлийз тойрог замууд нь залгагдсан атом руу сунасан тэгш бус хэлбэртэй байдаг. Электрон үүл нь бие биенээ түлхэж, бие биенээсээ аль болох хол зайд байрладаг. Энэ тохиолдолд дөрвөн тэнхлэг sp 3-эрлийз тойрог замуудтетраэдрийн орой руу чиглэсэн байна (энгийн гурвалжин пирамид).
Үүний дагуу эдгээр орбиталуудын хоорондох өнцөг нь 109°28"-тай тэнцүү тетраэдр юм.
Электрон орбиталуудын оройнууд нь бусад атомуудын орбиталуудтай давхцаж болно. Хэрэв электрон үүл нь атомын төвүүдийг холбосон шугамын дагуу давхцаж байвал ийм ковалент холбоог гэнэ. sigma()-холболт. Жишээлбэл, этан молекул C 2 H 6-д хоёр эрлийз орбитал давхцаж, хоёр нүүрстөрөгчийн атомын хооронд химийн холбоо үүсдэг. Энэ бол холболт юм. Нэмж дурдахад нүүрстөрөгчийн атом бүр өөрийн гурваараа sp 3-орбитал давхцаж байна с- гурван устөрөгчийн атомын орбиталууд, гурван холбоо үүсгэдэг.
Нийтдээ нүүрстөрөгчийн атомын хувьд өөр өөр төрлийн эрлийзжилт бүхий гурван валентийн төлөв боломжтой. Үүнээс бусад нь sp 3-гибридизаци байдаг sp 2 - ба sp- эрлийзжүүлэх.
sp 2 -Гибридизаци- нэгийг холих с- ба хоёр Р- тойрог замууд. Үүний үр дүнд гурван эрлийз үүсдэг sp 2 - тойрог зам. Эдгээр sp 2-орбиталууд нь нэг хавтгайд байрладаг (тэнхлэгтэй X, цагт) ба 120° орбиталуудын хоорондох өнцөг бүхий гурвалжны оройнууд руу чиглэнэ. Эрлийзжүүлээгүй
Р-Орбитал нь гурван эрлийзийн хавтгайд перпендикуляр байна sp 2-орбитал (тэнхлэгийн дагуу чиглэсэн z). Дээд тал Р-орбиталууд хавтгайгаас дээш, доод тал нь хавтгайн доор байна.
Төрөл sp 2-нүүрстөрөгчийн эрлийзжилт нь давхар холбоо бүхий нэгдлүүдэд явагддаг: C=C, C=O, C=N. Түүнээс гадна хоёр атомын хоорондох холбоонуудын зөвхөн нэг нь (жишээ нь, C = C) - холбоо байж болно. (Атомын бусад холболтын орбиталууд эсрэг чиглэлд чиглэгддэг.) Хоёр дахь холбоо нь эрлийз бус давхцлын үр дүнд үүсдэг. Р-атомын цөмүүдийг холбосон шугамын хоёр талын орбиталууд.
Хажуугийн давхцалаас үүссэн ковалент холбоо Р-хөрш зэргэлдээх нүүрстөрөгчийн атомын орбиталууд гэж нэрлэдэг pi()-холболт.
Боловсрол
|
Орбитын давхцал бага тул -бонд нь -бондоос бага бат бөх байдаг.
sp-Гибридизаци– энэ нь нэгийг холих (хэлбэр ба эрчим хүчний хувьд тааруулах) юм с-ба нэг
Р-орбиталууд нь хоёр эрлийз үүсгэдэг sp- тойрог замууд. sp-Орбиталууд нэг шулуун дээр (180° өнцгөөр) байрлаж, нүүрстөрөгчийн атомын цөмөөс эсрэг чиглэлд чиглэнэ. Хоёр
Р-орбиталууд эрлийз бус хэвээр байна. Тэдгээр нь харилцан перпендикуляр байрладаг
холболтын чиглэл. Зураг дээр sp-орбиталуудыг тэнхлэгийн дагуу харуулав y, ба эрлийзжүүлээгүй хоёр
Р-орбиталууд – тэнхлэгийн дагуу XТэгээд z.
Нүүрстөрөгч-нүүрстөрөгчийн гурвалсан холбоо нь давхардсанаар үүссэн -бондоос бүрдэнэ
sp-эрлийз тойрог зам, хоёр -бонд.
Хавсаргасан бүлгүүдийн тоо, эрлийзжүүлэлтийн төрөл, үүссэн химийн бондын төрөл зэрэг нүүрстөрөгчийн атомын параметрүүдийн хоорондын хамаарлыг 4-р хүснэгтэд үзүүлэв.
Хүснэгт 4
Ковалент нүүрстөрөгчийн холбоо
| Бүлгүүдийн тоо, холбоотой нүүрстөрөгчтэй |
Төрөл эрлийзжүүлэх |
Төрөл оролцож байна химийн холбоо |
Нийлмэл томъёоны жишээ |
|---|---|---|---|
| 4 | sp 3 | Дөрөв - холболт | |
| 3 | sp 2 | Гурав - холболт ба нэг - холболт |
|
| 2 | sp | Хоёр - холболт ба хоёр - холболт |
H–CC–H |
Дасгал.
1. Атомуудын аль электроныг (жишээлбэл, нүүрстөрөгч эсвэл азот) хосгүй гэж нэрлэдэг вэ?
2. Ковалентын холбоо бүхий нэгдлүүдэд "хуваалцсан электрон хос" гэсэн ойлголт юу гэсэн үг вэ (жишээлбэл, CH 4). эсвэл H 2 S )?
3. Атомын электрон төлөвүүд (жишээлбэл, С эсвэлН ) үндсэн гэж нэрлэдэг бөгөөд аль нь сэтгэл хөдөлсөн бэ?
4. Атомын электрон томьёо дахь тоо, үсэг нь юу гэсэн үг вэ (жишээлбэл, С эсвэлН )?
5. Атомын тойрог зам гэж юу вэ? С атомын хоёр дахь энергийн түвшинд хэдэн орбитал байдаг вэ? мөн тэд юугаараа ялгаатай вэ?
6. Эрлийз тойрог замууд нь үүссэн анхны орбиталуудаас юугаараа ялгаатай вэ?
7. Нүүрстөрөгчийн атомын ямар төрлийн эрлийзжилтийг мэддэг бөгөөд тэдгээр нь юунаас бүрддэг вэ?
8. Нүүрстөрөгчийн атомын аль нэг электрон төлөвийн тойрог замын орон зайн байршлын зургийг зур.
9. Химийн холбоог юу гэж нэрлэдэг вэ Тэгээд юу гэж? Тодорхойл-Тэгээд-холболт дахь холболтууд:
10. Доорх нэгдлүүдийн нүүрстөрөгчийн атомын хувьд: a) эрлийзжүүлэлтийн төрөл; б) түүний химийн холболтын төрөл; в) холбох өнцөг.

1-р сэдвийн дасгалын хариулт
Хичээл 5
1. Орбитал дээр нэг нэгээр нь байрладаг электронуудыг нэрлэдэг хосгүй электронууд. Жишээлбэл, өдөөгдсөн нүүрстөрөгчийн атомын электрон дифракцийн томъёонд дөрвөн хосгүй электрон, азотын атом гурван байна.
2. Нэгийг үүсгэхэд хоёр электрон оролцдог химийн холбоо, дуудсан хуваалцсан электрон хос. Ерөнхийдөө химийн холбоо үүсэхээс өмнө энэ хосын электронуудын нэг нь нэг атомд, нөгөө электрон нь өөр атомд харьяалагддаг байсан:

3. Электрон орбиталуудыг дүүргэх дараалал ажиглагдаж буй атомын электрон төлөв: 1 с 2 , 2с 2 , 2х 2 , 3с 2 , 3х 2 , 4с 2 , 3г 2 , 4х 2 гэх мэтийг дууддаг суурь нөхцөл. IN сэтгэл хөдөлсөн байдалатомын валентийн электронуудын нэг нь илүү их энергитэй чөлөөт тойрог замд байрладаг бөгөөд ийм шилжилт нь хосолсон электронуудыг салгах замаар дагалддаг. Схемийн хувьд үүнийг дараах байдлаар бичсэн болно.
Үндсэн төлөвт зөвхөн хоёр хосгүй валентийн электрон байсан бол өдөөгдсөн төлөвт дөрвөн ийм электрон байдаг.
5.
Атомын орбитал нь тухайн атомын цөмийг тойрсон орон зайн цэг бүрт электрон үүлний нягтыг тодорхойлдог функц юм. Нүүрстөрөгчийн атомын хоёр дахь энергийн түвшинд дөрвөн тойрог зам байдаг - 2 с, 2p x, 2p y,
2p z. Эдгээр орбиталууд нь ялгаатай:
a) электрон үүлний хэлбэр ( с- бөмбөг, Р- дамббелл);
б) РОрбиталууд огторгуйд өөр өөр чиглэлтэй байдаг - харилцан перпендикуляр тэнхлэгүүдийн дагуу x, yТэгээд z, тэдгээрийг тодорхойлсон p x, p y,
p z.
6.
Эрлийз орбиталууд нь анхны (эрлийз бус) орбиталуудаас хэлбэр, энергийн хувьд ялгаатай байдаг. Жишээлбэл, с- тойрог зам - бөмбөрцөг хэлбэр; Р- тэгш хэмтэй найм, sp-эрлийз тойрог зам - тэгш хэмт бус зураг найм.
Эрчим хүчний ялгаа: Э(с) < Э(sp) < Э(Р). Тиймээс, sp-орбитал – эхийг холих замаар олж авсан хэлбэр, энергийн дундаж утгыг авсан тойрог зам с-
Тэгээд х- тойрог замууд.
7. Нүүрстөрөгчийн атомын хувьд гурван төрлийн эрлийзжилтийг мэддэг. sp 3 , sp 2 ба sp (5-р хичээлийн текстийг үзнэ үү).
9.
-бонд - атомын төвүүдийг холбосон шугамын дагуу орбиталууд толгой дараалан давхцаж үүссэн ковалент холбоо.
-бонд – хажуугийн давхцалаас үүссэн ковалент холбоо Р-атомуудын төвүүдийг холбосон шугамын хоёр талын орбиталууд.
-Холбогдсон атомуудын хоорондох хоёр, гурав дахь зураасаар холбоог харуулна.
Хуудас 1
Валентын онол нь ерөнхийд нь химийн онол, ялангуяа органик химийн онолыг хөгжүүлэхэд чухал үүрэг гүйцэтгэсэн. Кекуле валентийн онол дээр үндэслэн нүүрстөрөгчийн атомыг дөрвөн валент гэж үзсэн бөгөөд 1858 онд энэ таамаглал дээр үндэслэн хамгийн энгийн органик молекулууд болон радикалуудын бүтцийг төсөөлөхийг оролдсон. Мөн 1858 онд Шотландын химич Арчибалд Скотт Купер (1831-1892) атомуудыг холбодог хүчийг (эсвэл бондыг ихэвчлэн нэрлэдэг) зураас хэлбэрээр дүрслэхийг санал болгов. Анхны органик молекулыг "барьсны" дараа органик молекулууд яагаад органик бус молекулуудаас хамаагүй том, илүү төвөгтэй байдаг нь тодорхой болсон.
Кекулегийн санаа бодлын дагуу нүүрстөрөгчийн атомууд нь нэг буюу хэд хэдэн дөрвөн валентын холбоог ашиглан хоорондоо холбогдож, шулуун эсвэл салаалсан урт гинж үүсгэдэг. Өөр ямар ч атом нүүрстөрөгчийн хэмжээнд ийм гайхалтай чадварыг эзэмшдэггүй бололтой.
Тиймээс нүүрстөрөгчийн атом бүр дөрвөн валентийн холбоо, устөрөгчийн атом бүр нэг ийм холбоо байна гэж төсөөлвөл бид хамгийн энгийн гурван нүүрсустөрөгч (молекулууд нь зөвхөн нүүрстөрөгч ба устөрөгчийн атомуудаас бүрддэг нэгдлүүд), метан CH4, этан C2H6, пропан C3H8-ийг дүрсэлж болно. , дараах байдлаар:
Нүүрстөрөгчийн атомын тоог нэмэгдүүлснээр энэ дарааллыг бараг хязгааргүй үргэлжлүүлж болно. Нүүрс устөрөгчийн гинжин хэлхээнд хүчилтөрөгч (хоёр валентын холбоо) эсвэл азотыг (гурван валентийн холбоо) нэмснээр бид этилийн спирт (C2H6O) ба метиламин (CH5N) молекулуудын бүтцийн томъёог төсөөлж болно. 
Хөрш зэргэлдээх атомуудын хооронд хоёр холбоо (давхар холбоо) эсвэл гурван холбоо (гурвалсан холбоо) байх боломжтой гэж үзвэл этилен (C2H4), ацетилен (C2H2), метил цианид (C2H3N), ацетон (C3H6O) зэрэг нэгдлүүдийн бүтцийн томъёог дүрсэлж болно. ) ба цууны хүчил (C2H4O2): 
Хэрэгсэл бүтцийн томъёонуудЭнэ нь маш тодорхой байсан тул олон органик химич үүнийг шууд хүлээн зөвшөөрсөн. Тэд органик молекулуудыг радикалуудаас бүрдсэн бүтэц гэж дүрслэх бүх оролдлогыг бүрэн хуучирсан гэж зарлав. Үүний үр дүнд нэгдлийн томъёог бичихдээ түүний атомын бүтцийг харуулах шаардлагатай гэж үзсэн.
Оросын химич Александр Михайлович Бутлеров (1823-1886) үүнийг ашигласан. шинэ системтүүний боловсруулсан органик нэгдлүүдийн бүтцийн онол дахь бүтцийн томьёо. Өнгөрсөн зууны 60-аад оны үед тэрээр бүтцийн томьёо ашиглан изомеруудын оршин тогтнох шалтгааныг хэрхэн тодорхой тайлбарлаж болохыг харуулсан (5-р бүлгийг үз). Жишээлбэл, этилийн спирт ба диметил эфир нь C2H6O-ийн ижил эмпирик томьёотой боловч эдгээр нэгдлүүдийн бүтцийн томъёо нь мэдэгдэхүйц ялгаатай байна. 
Тиймээс атомуудын зохион байгуулалтыг өөрчилснөөр тэс өөр шинж чанартай хоёр багц гарч ирдэг нь гайхах зүйл биш юм. Этилийн спиртэд зургаан устөрөгчийн атомын нэг нь хүчилтөрөгчийн атомтай холбогддог бол диметил эфирт зургаан устөрөгчийн атом бүгд нүүрстөрөгчийн атомтай холбогддог. Хүчилтөрөгчийн атом нь устөрөгчийн атомыг нүүрстөрөгчийн атомаас илүү сул байлгадаг тул этилийн спиртэнд нэмсэн натрийн металл нь устөрөгчийг (нийтийн зургааны нэг) орлоно. Диметилийн эфирт нэмсэн натри нь устөрөгчийг огт хөдөлгөдөггүй. Тиймээс бүтцийн томъёог гаргахдаа удирдан чиглүүлж болно химийн урвал, мөн бүтцийн томьёо нь эргээд урвалын мөн чанарыг ойлгоход тусална.
Бутлеров зарим бодис нь үргэлж хоёр нэгдлүүдийн холимог үүрэг гүйцэтгэдэг таутомеризм (динамик изомеризм) гэж нэрлэгддэг нэг төрлийн изомеризмд онцгой анхаарал хандуулсан. Хэрэв эдгээр нэгдлүүдийн аль нэг нь цэвэр хэлбэрээр тусгаарлагдвал тэр даруй хэсэгчлэн өөр нэгдэл болж хувирна. Бутлеров тавтомеризм нь устөрөгчийн атом нь хүчилтөрөгчийн атомаас хөрш нүүрстөрөгчийн атом руу (мөн эсрэгээр) аяндаа шилжсэнээс үүсдэг болохыг харуулсан.
Бүтцийн томъёоны системийн үнэн зөвийг бүрэн нотлохын тулд зургаан нүүрстөрөгчийн атом, зургаан устөрөгчийн атом агуулсан нүүрсустөрөгч болох бензолын бүтцийн томъёог тодорхойлох шаардлагатай байв. Үүнийг шууд хийх боломжгүй байсан. Валентын шаардлагыг хангахын зэрэгцээ нэгдлийн илүү тогтвортой байдлыг тайлбарлах тийм бүтцийн томъёо байхгүй юм шиг санагдсан. Бензолын бүтцийн томъёоны анхны хувилбарууд нь зарим нүүрсустөрөгчийн томъёотой маш төстэй байсан - маш тогтворгүй нэгдлүүд бөгөөд химийн шинж чанараараа бензолтой төстэй биш байв.
Аммиакийн молекулд азотын атомын эргэн тойрон дахь электронууд мөн sp 3 эрлийзжүүлсэн орбиталд байрладаг. Усны молекулын хувьд ижил төстэй зураг ажиглагдаж байна.
NH3H2O 
Sp 3 тойрог замын эрлийзжүүлэлтийн үед нүүрстөрөгчийн атом нь зөвхөн энгийн s холбоог үүсгэж чаддаг. Нүүрстөрөгчөөр давхар холбоо үүсэх үед sp 2 эрлийзжүүлэлтийг ашигладаг (Зураг 7). Энэ тохиолдолд нэг 2s, хоёр 2p орбитал эрлийзжихэд оролцох ба нэг 2p орбитал эрлийзжээгүй хэвээр байна. sp 2 тойрог замууд нь эквивалент, тэдгээрийн тэнхлэгүүд нь хоорондоо уялдаатай бөгөөд 120 ° өнцгийг үүсгэдэг; эрлийз бус 2p орбитал нь эрлийз орбиталуудын хавтгайд перпендикуляр байна.
Цагаан будаа. 7 сТэгээд
хоёр2 хорбиталууд гурвыг үүсгэдэг sp 2- эрлийз тойрог замууд.

Нүүрстөрөгч нь гурвалсан холбоо үүсгэх үед sp эрлийзжилтийг ашигладаг. Энэ тохиолдолд нэг 2s ба нэг p орбитал эрлийзжихэд оролцож, хоёр 2p орбитал эрлийз бус хэвээр байна (Зураг 8).

Цагаан будаа. 8Нэгийг эрлийзжүүлэх математикийн процедурын зураг 2 сба од
ноа2 хтойрог замууд нь хоёр үүсгэдэг sp- эрлийз тойрог замууд.

ацетилен
Дасгал 13. (а) этан хүчил, (б) этанал, этанамидын молекул дахь атомуудын хоорондын холбоог атомын орбиталаар дүрсэлж, бүх холболтын өнцгийг урьдчилан таамаглах.
Хариулах(А) 

Бондын урт ба энерги
Хуваалцсан электрон хосууд нь хоёр холбогдсон атомыг тодорхой зайд хадгалдаг холболтын урт. Атомуудын хоорондох холбоосын урт нь тэдгээрийн ковалент радиусын (r) нийлбэртэй ойролцоогоор тэнцүү байдаг (Хүснэгт 2) нь ямар ч бондын уртыг тооцоолох боломжтой болгодог. l A - B = r A + r B
хүснэгт 2
Зарим элементийн ковалент радиус (r), Å
Жишээ нь. 14.V(a) C-H, (b) C-C, (c) C=C ба (d) CºС-ийн холболтын уртыг тооцоол.
(e.) C-O, (f) C=O, (g) C-Cl, ... Ковалентын радиусын утгыг хүснэгтэд үзүүлэв. 1.2.
Хариулах(a) 0.77 + 0.37 = 1.14 Å, (б) 2 x 0.77 = 1.54 Å, (в) 2 x 0.67 = 1.34 Å, (d) ...
Ерөнхийдөө хоёр атомын хоорондох холбоо нэмэгдэхийн хэрээр тэдгээрийн урт нь багасдаг. Зарим молекулуудад нүүрстөрөгч-нүүрстөрөгчийн бондын урт нь дан (1.54Å) ба давхар (1.33Å) бондын уртын хоорондох завсрын урттай байдаг. Энэ тохиолдолд бид харилцааны дарааллын талаар ярьдаг. Ийм харилцааны дарааллын ойролцоо утгыг графикаар олж болно.
Эрчим хүч бол ажил хийх чадвар юм. Хөдөлгөөнт объект нь кинетик энергитэй байдаг. Хэрэв объектууд бие биенээ татах эсвэл түлхэж байвал тэдгээр нь боломжит энергитэй болно. Пүршээр холбосон хоёр бөмбөлөг нь пүршийг чангалж эсвэл шахаж байвал боломжит энергитэй байж болно. Хэрэв пүршийг сунгавал бөмбөгний хооронд татах энерги, шахагдсан бол түлхэх энерги бий болно. Хэрэв та хавар өгвөл
тайвшир, дараа нь хоёр тохиолдолд бөмбөгний боломжит энерги нь кинетик энерги болж хувирна.
Химийн энерги нь боломжит энергийн нэг хэлбэр юм. Энэ нь молекулын өөр өөр хэсгүүд бие биенээ татдаг эсвэл түлхэж байдаг тул оршин байдаг. Обьект потенциал энерги ихтэй байх тусмаа тогтворгүй байдаг. . Урвалын үед химийн энергийг дулааны энерги болгон гаргаж болно.
Молекулын үнэмлэхүй энергийн агуулгыг тодорхойлох нь бараг боломжгүй юм. Тиймээс бид зөвхөн тухай л ярьж байна харьцангуй боломжит энергимолекулууд.Молекулуудын харьцангуй потенциал энергийг харьцангуй энтальпи хэлбэрээр илэрхийлэхэд тохиромжтой.Уралд орох бодис ба урвалын бүтээгдэхүүний харьцангуй энтальпийн ялгааг DH°-аар тэмдэглэнэ. Экзотермик урвалын хувьд DH° нь сөрөг утгатай, эндотермик урвалын хувьд эерэг утгатай байна. Атомоос устөрөгчийн молекул үүсэхэд дулаан ялгардаг ба устөрөгчийн молекул атомуудад хуваагдах үед дулааныг хангах шаардлагатай.
H· + H· ¾® H¾H DH° = –104 ккал/моль (–435 кЖ/моль)
Н-Н ¾® H· + H· DH° = +104 ккал/моль (+435 кЖ/моль)
1 ккал = 4.184 кЖ
Хлорын молекул үүсэх үед атомуудаас устөрөгчийн молекул үүсэхээс бага энерги ялгардаг.
Сl· + Cl· ¾® Сl¾Cl DH° = -58 ккал/моль
Cl-Cl ¾® Cl· + Cl· DH° = +58 ккал/моль
Хүснэгт 3
Бондын энерги, ккал/моль.
Хэрэв бид нэг, давхар, гурвалсан нүүрстөрөгч-нүүрстөрөгчийн бондын энергийг харьцуулж үзвэл давхар бондын энерги хоёр дахин бага, гурвалсан бондын энерги нь нэг бондын энергиээс гурав дахин бага болохыг харж болно. S-S холболтууд. Тиймээс олон тооны холбоог энгийн болгон хувиргах, жишээлбэл, полимержих үед энерги ялгарах дагалддаг.

Бондын энерги (E), ккал/моль 88 146 200
Бусад элементүүдийн хувьд эсрэг дүр зураг ихэвчлэн ажиглагддаг. Жишээлбэл, дан азот-азотын бондоос давхар, гурвалсан бонд руу шилжих үед тэдгээрийн энерги нь хоёр, гурав дахин нэмэгддэг.

Бондын энерги (E), ккал/моль 38 100 226
Тиймээс нүүрстөрөгчийн гинж үүсэх нь нүүрстөрөгчийн хувьд ашигтай, хоёр атомт молекул үүсэх нь азотын хувьд ашигтай байдаг. Азот-азотын гинж нь дөрвөөс илүүгүй атомаас бүрдэх боломжтой.
Органик хими бол нүүрстөрөгчийн атомын хими юм. Органик нэгдлүүдийн тоо нь органик бус нэгдлүүдээс хэдэн арван дахин их байдаг бөгөөд үүнийг зөвхөн тайлбарлаж болно. нүүрстөрөгчийн атомын онцлог :
а) тэр орсон цахилгаан сөрөг байдлын хуваарийн дунд мөн хоёр дахь үе, тиймээс түүнд өөрийн электроныг өгч, бусад хүмүүсийн электроныг хүлээн авч, эерэг эсвэл сөрөг цэнэгийг олж авах нь ашиггүй юм;
б) электрон бүрхүүлийн тусгай бүтэц – электрон хос ба чөлөөт орбитал байхгүй (ижил төстэй бүтэцтэй зөвхөн нэг атом байдаг - устөрөгч, иймээс нүүрстөрөгч, устөрөгч нь маш олон нэгдэл үүсгэдэг - нүүрсустөрөгч).
Нүүрстөрөгчийн атомын электрон бүтэц
C – 1s 2 2s 2 2p 2 or 1s 2 2s 2 2p x 1 2p y 1 2p z 0
График хэлбэрээр:
Өдөөгдсөн төлөвт байгаа нүүрстөрөгчийн атом нь дараах электрон томьёотой байна.
*C – 1s 2 2s 1 2p 3 or 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Эсийн хэлбэрээр: 
s- ба p-орбиталуудын хэлбэр


Атомын тойрог зам - харгалзах квант тоо бүхий электрон олдох магадлал өндөртэй орон зайн муж.
Энэ нь гурван хэмжээст электрон "контурын зураг" бөгөөд долгионы функц нь тойрог замын тухайн цэгээс электроныг олох харьцангуй магадлалыг тодорхойлдог.
Атомын орбиталуудын харьцангуй хэмжээ нь энерги нэмэгдэх тусам нэмэгддэг ( үндсэн квант тоо- n), тэдгээрийн хэлбэр, орон зай дахь чиг баримжаа нь l ба m квант тоогоор тодорхойлогддог. Орбитал дахь электронууд нь спин квант тоогоор тодорхойлогддог. Орбитал бүр нь эсрэг эргэлттэй 2-оос илүүгүй электрон агуулж болно.
Бусад атомуудтай холбоо үүсгэх үед нүүрстөрөгчийн атом нь электрон бүрхүүлээ өөрчилдөг бөгөөд ингэснээр хамгийн хүчтэй холбоо үүсч, улмаар аль болох их энерги ялгарч, систем нь хамгийн тогтвортой байдлыг олж авдаг.
Атомын электрон бүрхүүлийг өөрчлөхөд эрчим хүч шаардагдах бөгөөд дараа нь илүү хүчтэй холбоо үүсэх замаар нөхөгддөг.
Электрон бүрхүүлийн хувирал (эрлийзжих) нь нүүрстөрөгчийн атомын холбоо үүсгэдэг атомын тооноос хамааран үндсэндээ 3 төрөлтэй байж болно.
Гибридизацийн төрлүүд:
sp 3 – атом нь 4 хөрш атомтай холбоо үүсгэдэг (тетраэдрийн эрлийзжилт):
sp 3 – эрлийз нүүрстөрөгчийн атомын электрон томъёо:
*С –1s 2 2(sp 3) 4 эс хэлбэрээр 

Эрлийз орбиталуудын хоорондох холбоосын өнцөг ~109° байна.
Нүүрстөрөгчийн атомын стереохимийн томъёо:

sp 2 - Гибридизаци (валент төлөв)- атом нь 3 хөрш атомтай холбоо үүсгэдэг (тригональ эрлийзжилт):
sp 2 – эрлийз нүүрстөрөгчийн атомын электрон томъёо:
*С –1s 2 2(sp 2) 3 2p 1 эс хэлбэрээр 
Эрлийз орбиталуудын хоорондох холбоосын өнцөг нь ~120 ° байна.
sp 2 - эрлийз нүүрстөрөгчийн атомын стереохимийн томъёо:

sp- эрлийзжилт (валент төлөв) – атом нь 2 хөрш атомтай холбоо үүсгэдэг (шугаман эрлийзжилт):
SP – эрлийз нүүрстөрөгчийн атомын электрон томъёо:
*С –1s 2 2(sp) 2 2p 2 эс хэлбэрээр 
Эрлийз орбиталуудын хоорондох холбоосын өнцөг ~180° байна.
Стереохимийн томъёо:

s-орбитал нь бүх төрлийн эрлийзжилтэд оролцдог, учир нь энэ нь хамгийн бага энергитэй.
Электрон үүлний бүтцийн өөрчлөлт нь хамгийн хүчтэй холбоог бий болгож, үүссэн молекул дахь атомуудын хамгийн бага харилцан үйлчлэлийг бий болгодог. Хаана эрлийз орбиталууд ижил биш байж болох ч холболтын өнцөг өөр байж болно. жишээ нь CH 2 Cl 2 ба CCl 4
2. Нүүрстөрөгчийн нэгдлүүдийн ковалент холбоо
Ковалентын холбоо, шинж чанар, үүсэх арга, шалтгаан - сургуулийн сургалтын хөтөлбөр.
Би танд сануулъя:
1. Боловсролын харилцаа холбоо атомуудын хоорондох атомын орбиталуудын давхцлын үр дүн гэж үзэж болох бөгөөд энэ нь илүү үр дүнтэй байх тусам (давхцах интеграл том байх тусам холбоо илүү хүчтэй болно.
Тооцоолсон мэдээллээс харахад атомын орбиталуудын харьцангуй давхцлын үр ашиг S rel дараах байдлаар нэмэгддэг.

Тиймээс 4 устөрөгчийн атомтай холбоо үүсгэхийн тулд sp 3 нүүрстөрөгчийн орбитал гэх мэт эрлийз орбиталуудыг ашигласнаар илүү бат бөх холбоо үүсдэг.
2. Нүүрстөрөгчийн нэгдлүүдийн ковалент холбоо нь хоёр аргаар үүсдэг.
A)Хэрэв хоёр атомын орбитал үндсэн тэнхлэгийнхээ дагуу давхцаж байвал үүссэн холбоог гэнэ - σ бонд.
Геометр.Иймд метан дахь устөрөгчийн атомуудтай холбоо үүсэхэд нүүрстөрөгчийн атомын дөрвөн эрлийз sp 3 ~ орбитал нь дөрвөн устөрөгчийн атомын s-орбиталуудтай давхцаж, тус бүрдээ 109°28" өнцгөөр байрлах дөрвөн ижил хүчтэй σ холбоо үүсгэдэг. бусад (стандарт тетраэдр өнцөг) Үүнтэй төстэй хатуу тэгш хэмтэй тетраэдр бүтэц нь жишээлбэл, CCl 4 үүсэх үед үүсдэг; хэрэв нүүрстөрөгчтэй холбоо үүсгэгч атомууд тэгш бус байвал, жишээлбэл, CH 2 C1 2 тохиолдолд орон зайн бүтэц бий болно. Энэ нь бүхэлдээ тэгш хэмээс бага зэрэг ялгаатай боловч үндсэндээ тетраэдр хэвээр байна.
σ холболтын уртнүүрстөрөгчийн атомуудын хоорондын ялгаа нь атомуудын эрлийзжилтээс хамаардаг ба sp 3 - эрлийзжихээс sp руу шилжих үед буурдаг. Үүнийг s орбитал нь p орбиталаас цөмд ойр байдаг тул түүний эрлийз тойрог замд эзлэх хувь их байх тусам богино, тиймээс үүссэн холбоо богино байдагтай холбон тайлбарлаж байна.
B) Хэрэв хоёр атомтай бол х - бие биентэйгээ параллель байрладаг тойрог замууд нь атомууд байрлах хавтгайн дээр ба доор хажуугийн давхцлыг гүйцэтгэдэг тул үүссэн холбоог гэнэ. - π (пи) - харилцаа холбоо


Хажуугийн давхцалатомын орбиталууд нь гол тэнхлэгийн дагуу давхцахаас бага үр ашигтай байдаг π -ээс бага бат бөх холболтууд σ - холболтууд. Энэ нь ялангуяа давхар нүүрстөрөгч-нүүрстөрөгчийн бондын энерги нь нэг бондоос хоёр дахин бага энергитэй байдагт илэрдэг. Тиймээс этан дахь С-С бондын энерги нь 347 кЖ/моль байхад этан дахь C = C бондын энерги ~ 700 кЖ/моль биш харин ердөө 598 кЖ/моль байна.
Хоёр атомын 2p орбиталын хажуугийн давхцлын зэрэг , улмаар хүч чадал π -Нүүрстөрөгчийн хоёр атомтай, тэдгээрт холбогдсон дөрвөн атом байвал бонд хамгийн их байна атомууд нэг хавтгайд хатуу байрладаг, өөрөөр хэлбэл хэрэв тэд хавтгай , учир нь зөвхөн энэ тохиолдолд атомын 2p орбиталууд хоорондоо яг параллель байх тул хамгийн их давхцах чадвартай байдаг. Эргэн тойрон эргэхээс шалтгаалсан хавтгайн төлөвөөс аливаа хазайлт σ -Хоёр нүүрстөрөгчийн атомыг холбосон холбоо нь давхардлын зэрэг буурч, улмаар хүч чадал буурахад хүргэдэг. π -бонд, ингэснээр молекулын тэгш байдлыг хадгалахад тусалдаг.
Эргүүлэхнүүрстөрөгч-нүүрстөрөгчийн давхар бондын эргэн тойронд байх боломжгүй.
Хуваарилалт π -Молекулын хавтгай дээрх электронууд нь оршихуй гэсэн үг сөрөг цэнэгийн хэсгүүд, ямар ч электрон дутагдалтай урвалжуудтай харилцан үйлчлэхэд бэлэн байна.
Хүчилтөрөгч, азот гэх мэт атомууд нь мөн өөр өөр валентын төлөвтэй (эрлийзжих) бөгөөд тэдгээрийн электрон хосууд эрлийз ба p-орбиталд хоёуланд нь байж болно.
Нүүрстөрөгч (С) нь атомын жинтэй үелэх системийн зургаа дахь элемент юм 12. Элемент нь металл бус бөгөөд 14 С изотоптой. Бүх органик бодисуудад нүүрстөрөгчийн молекулууд багтдаг тул нүүрстөрөгчийн атомын бүтэц нь бүх органик химийн үндэс суурь болдог. .
нүүрстөрөгчийн атом
Менделеевийн үелэх систем дэх нүүрстөрөгчийн байрлал:
- зургаа дахь серийн дугаар;
- дөрөв дэх бүлэг;
- хоёрдугаар үе.

Цагаан будаа. 1. Үелэх систем дэх нүүрстөрөгчийн байрлал.
Хүснэгтийн өгөгдөл дээр үндэслэн нүүрстөрөгчийн элементийн атомын бүтцэд зургаан электрон байрладаг хоёр бүрхүүл багтдаг гэж бид дүгнэж болно. Найрлагад орсон нүүрстөрөгчийн валент органик бодис, тогтмол бөгөөд IV-тэй тэнцүү. Энэ нь гадаад электрон түвшин дөрвөн электронтой, дотоод түвшин хоёр байна гэсэн үг юм.
Дөрвөн электроноос хоёр нь бөмбөрцөг хэлбэрийн 2s тойрог замыг, үлдсэн хоёр нь 2p дамббелл орбитал эзэлдэг. Өдөөгдсөн төлөвт 2s орбиталаас нэг электрон 2p орбиталуудын аль нэгэнд очдог. Электрон нэг тойрог замаас нөгөө тойрог руу шилжих үед энерги зарцуулагддаг.
Ийнхүү өдөөгдсөн нүүрстөрөгчийн атом дөрвөн хосгүй электронтой байдаг. Түүний тохиргоог 2s 1 2p 3 томъёогоор илэрхийлж болно. Энэ нь дөрөв үүсгэх боломжтой болгодог ковалент холбообусад элементүүдтэй. Жишээлбэл, метан молекулд (CH4) нүүрстөрөгч нь устөрөгчийн дөрвөн атомтай холбоо үүсгэдэг - устөрөгч ба нүүрстөрөгчийн s орбиталуудын хооронд нэг холбоо, нүүрстөрөгчийн p орбитал ба устөрөгчийн s орбиталуудын хооронд гурван холбоо үүсдэг.
Нүүрстөрөгчийн атомын бүтцийг +6C) 2) 4 эсвэл 1s 2 2s 2 2p 2 хэлбэрээр илэрхийлж болно.

Цагаан будаа. 2. Нүүрстөрөгчийн атомын бүтэц.
Физик шинж чанар
Нүүрстөрөгч нь байгальд тохиолддог чулуулаг. Нүүрстөрөгчийн хэд хэдэн аллотроп өөрчлөлтийг мэддэг:
- бал чулуу;
- алмаз;
- карабин;
- нүүрс;
- хөө тортог.
Эдгээр бүх бодисууд нь болор торны бүтцээрээ ялгаатай байдаг. Ихэнх хатуу- алмаз - нүүрстөрөгчийн куб хэлбэртэй. Өндөр температурт алмаз нь зургаан өнцөгт бүтэцтэй бал чулуу болж хувирдаг.

Цагаан будаа. 3. Бал чулуу ба алмазын болор тор.
Химийн шинж чанар
Нүүрстөрөгчийн атомын бүтэц, өөр бодисын дөрвөн атомыг холбох чадварыг тодорхойлдог Химийн шинж чанарбүрэлдэхүүн. Нүүрстөрөгч нь металлуудтай урвалд орж карбид үүсгэдэг.
- Ca + 2C → CaC 2;
- Cr + C → CrC;
- 3Fe + C → Fe 3 C.
Мөн металлын ислүүдтэй урвалд ордог:
- 2ZnO + C → 2Zn + CO 2;
- PbO + C → Pb + CO;
- SnO 2 + 2C → Sn + 2CO.
Өндөр температурт нүүрстөрөгч нь металл бус, ялангуяа устөрөгчтэй урвалд орж нүүрсустөрөгч үүсгэдэг.
C + 2H 2 → CH 4.
Хүчилтөрөгчтэй хамт нүүрстөрөгч үүсдэг нүүрстөрөгчийн давхар исэлба нүүрстөрөгчийн дутуу исэл:
- C + O 2 → CO 2;
- 2C + O 2 → 2СО.
Мөн нүүрстөрөгчийн дутуу исэл нь устай харилцан үйлчлэхэд үүсдэг.