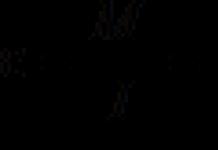Кристал ба аморф биетүүд
Хичээлийн зорилго:
Кристал болон аморф биетүүдийн үндсэн шинж чанарыг илчлэх.
Оюутнуудад талстуудын зөв хэлбэр, талстуудын шинж чанарыг судлах загварчлалын арга болох анизотропийн шинж чанарыг танилцуулах.
Тоног төхөөрөмж:
Кристал биетүүдийн багц; богино фокусын урттай линз.
Архины гэрэл, шилэн саваа.
Мультимедиа проектор бүхий компьютер; хичээлийн төлөвлөгөө, хичээлд зориулсан мультимедиа програм, Microsoft Point дээр хийсэн.
Хичээлийн үеэр
Оршил:Бидний эргэн тойрон дахь ихэнх хатуу биетүүд нь талст төлөвт байдаг бодисууд юм. Үүнд: барилгын болон бүтцийн материалууд: төрөл бүрийн ган, бүх төрлийн металлын хайлш, ашигт малтмал гэх мэт Физикийн тусгай салбар бол хатуу биеийн физик юм - хатуу биетүүдийн бүтэц, шинж чанарыг судлах чиглэлээр ажилладаг. Физикийн энэ чиглэл нь бүх физикийн судалгаанд тэргүүлдэг. Энэ нь орчин үеийн технологийн үндэс суурийг бүрдүүлдэг.
Технологийн аль ч салбар нь хатуу биетийн шинж чанарыг ашигладаг: механик, дулааны, цахилгаан, оптик гэх мэт. Кристалуудыг технологид улам бүр ашиглаж байна. Зөвлөлтийн эрдэмтэд - академич, Лениний нэрэмжит шагналт нарын гавьяаг та мэдэх байх Нобелийн шагналуудА.М.Прохоров, Н.Г.Басова нар квант генератор бүтээхэд. Орчин үеийн оптик квант генераторуудын үйлдэл - лазер нь дан талстуудын шинж чанарыг ашиглахад суурилдаг (бадмаараг гэх мэт) Кристал хэрхэн бүтэцтэй байдаг вэ? Яагаад олон талстууд гайхалтай шинж чанартай байдаг вэ? Талстыг аморф биетүүдээс ялгах бүтцийн онцлог юу вэ? Та эдгээр болон үүнтэй төстэй асуултуудад хичээлийн төгсгөлд хариулж болно. "Болор ба аморф биетүүд" гэсэн сэдвийг бичье.
Шинэ материалын танилцуулга:
Хамтарсан материал руугаа орцгооё. Хатуу бодис ямар шинж чанартай байдаг вэ?
Оюутан:
1) Тэд хэлбэр, эзлэхүүнээ хадгалдаг.
2) Тэдний бүтцэд талст тортой байдаг.
Багш: Бүх хатуу биетүүдийг талст ба аморф гэж хуваадаг. Бид тэдний ижил төстэй болон ялгаатай талууд юу болохыг авч үзэх болно.
Кристал гэж юу вэ?
Кристалууд - эдгээр нь атом эсвэл молекулууд нь орон зайд тодорхой, дараалсан байрлалыг эзэлдэг хатуу биетүүд юм. Нэг бодисын талстууд өөр өөр хэлбэртэй байдаг. Тусдаа талст нүүрний хоорондох өнцөг нь ижил байна. Зарим болор хэлбэр нь тэгш хэмтэй байдаг. Талстуудын өнгө нь бохирдлоос хамаарч өөр өөр байдаг нь ойлгомжтой.
Кристалын дотоод бүтцийг нүдээр харуулахын тулд болор тор ашиглан түүний дүрсийг ашигладаг. Хэд хэдэн төрлийн талстууд байдаг:
1) ион
2) атом
3) металл
4) молекул.
Хамгийн тохиромжтой болор хэлбэр нь олон өнцөгт юм. Ийм болор нь хавтгай нүүр, шулуун ирмэгээр хязгаарлагдаж, тэгш хэмтэй байдаг. Кристалуудаас олж болно янз бүрийн элементүүдтэгш хэм. Кристал биетүүднэг талст ба поликристал гэж хуваагддаг.
Монокристалууд - нэг талст (кварц, гялтгануур...) Хамгийн тохиромжтой талст хэлбэр нь олон талст юм. Ийм болор нь хавтгай нүүр, шулуун ирмэгээр хязгаарлагдаж, тэгш хэмтэй байдаг. Талстаас янз бүрийн тэгш хэмийн элементүүдийг олж болно. Тэгш хэмийн хавтгай, тэгш хэмийн тэнхлэг, тэгш хэмийн төв. Өнгөц харахад тэгш хэмийн төрлүүдийн тоо хязгааргүй их байж болох юм шиг санагддаг. 1867 онд Оросын инженер А.В.Гадолин талстууд ердөө 32 төрлийн тэгш хэмтэй байдгийг анх баталжээ. Цасан талст - цасан ширхгийн тэгш хэмийг шалгацгаая
Талстуудын тэгш хэм ба тэдгээрийн бусад шинж чанаруудыг бид дараа нь авч үзэх нь болорыг бүрдүүлдэг бөөмсийн зохион байгуулалтын талаархи чухал ойлголтод хүргэсэн. Та нарын хэн нэгэн нь үүнийг томъёолохыг оролдож чадах уу?
Оюутан. Кристал дахь тоосонцор нь тодорхой бүтэцтэй байхаар байрладаг зөв хэлбэр, сараалжтай.
Багш аа. Кристал дахь бөөмс нь ердийн орон зайн тор үүсгэдэг. Янз бүрийн талстуудын орон зайн сүлжээнүүд өөр өөр байдаг. Хоолны давсны орон зайн торны загварыг энд үзүүлэв. (Загвар үзүүлэв.) Нэг өнгийн бөмбөлөг нь натрийн ионыг, өөр өнгийн бөмбөг хлорын ионыг дуурайдаг. Хэрэв та эдгээр зангилааг шулуун шугамаар холбовол танилцуулсан загвартай төстэй орон зайн тор үүснэ. Орон зайн тор бүрт түүний бүтцийн зарим давтагдах элементүүдийг, өөрөөр хэлбэл нэгж нүдийг тодорхойлох боломжтой.
Орон зайн торны тухай ойлголт нь талстуудын шинж чанарыг тайлбарлах боломжийг олгосон.
Тэдний шинж чанарыг авч үзье.
1) Гадаад ердийн геометрийн хэлбэр (загвар)
2) Тогтмол хайлах цэг.
3) Анизотропи - болор дахь сонгосон чиглэлээс физик шинж чанарын ялгаа (гялтгануур, кварцын болор бүхий жишээг харуулав)
Гэхдээ дан талстууд байгальд ховор байдаг. Гэхдээ ийм болорыг хиймэл нөхцөлд ургуулж болно.
Одоо поликристалуудтай танилцацгаая.
Поликристалууд - эдгээр нь бие биенээсээ санамсаргүй байдлаар чиглэсэн олон тооны талстуудаас бүрдэх хатуу биетүүд юм (ган, цутгамал ...)
Поликристалууд нь ердийн хэлбэр, гөлгөр ирмэгтэй байдаг бөгөөд тэдгээрийн хайлах цэг нь бодис бүрийн хувьд тогтмол утгатай байдаг. Гэхдээ нэг талстаас ялгаатай нь поликристалууд нь изотроп, i.e. физик шинж чанарбүх чиглэлд адилхан. Үүнийг дотор нь талстууд санамсаргүй байдлаар байрлуулсан, тус бүр нь анизотропитой байдаг ч талст бүхэлдээ изотроп байдагтай холбон тайлбарладаг.
Талст биетүүдээс гадна аморф биетүүд байдаг.
Аморф биетүүд - Эдгээр нь атомуудын зохион байгуулалтад зөвхөн богино зайн дараалал хадгалагддаг хатуу биетүүд юм. (Цахиур, давирхай, шил, жилий, чихрийн чихэр).
Жишээлбэл, кварц нь талст төлөвт эсвэл аморф төлөвт байж болно - цахиур. (Сурах бичиг дээрх зургийг үзнэ үү). Тэдгээр нь тогтмол хайлах цэггүй, шингэн шинж чанартай байдаг (спиртийн чийдэн дээр шилэн саваа гулзайлгаж байгааг харуулж байна). Аморф биетүүд нь изотроп, хамт бага температуртэд болор биетэй адил, өндөр температурт шингэн зүйл шиг байдаг.
Талст ба аморф биетүүдийн ажиглалт
(тэмдэглэлийн дэвтэрт тэмдэглэл хийх)
Томруулдаг шил ашиглан бид хоолны давсны талстыг шалгадаг. - Тэд ямар хэлбэртэй вэ? (шоо дөрвөлжин хэлбэртэй).
Зэсийн сульфатын талстуудыг харцгаая. – Эдгээр талстуудын онцлог юу вэ? (зарим нь тэгш ирмэгтэй).
Цайрын хугарлыг хараад түүн дээрх жижиг талстуудын ирмэгийг олъё.
Аморф биетүүдийг авч үзье: шил, жилий эсвэл лав. Хагарсан шилийг анхаарч үзье. Металл хугарлаас юугаараа ялгаатай вэ? (хурц ирмэгтэй гөлгөр гадаргуу).
Бие даасан ажилд зориулсан даалгавар.
1. Хүйтэн цаг агаарт цас яагаад хөл дор жиргэдэг вэ?
Хариулах : Хэдэн зуун мянган цасан ширхгүүд - талстууд - хагардаг.
2. Цайрдсан төмрийн гадаргуу дээрх хээ нь юунаас гаралтай вэ?
Хариулах : Цайрын талсжилтын улмаас хэв маяг гарч ирдэг.
3. Эцсийн шалгалт.
Багш:Өдрийн тэмдэглэлээ нээж, гэрийн даалгавраа бичнэ үү: § 75.76(1); § 24, 26,27. Сонирхсон хүмүүст зориулсан даалгавар: зэсийн сульфат эсвэл хөнгөн цагааны уусмалаас талстыг ургуулах.
Уран зохиол:
1. Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физик 10-р анги. – М.: Боловсрол 1992 он.
2. Пинский А.А. Физик 10-р анги. – М.“Гэгээрэл” 1993 он
3. Тарасов Л.В.Энэ гайхалтай тэгш хэмтэй ертөнц. - М.: Боловсрол, 1982.
4. Сургуулийн хүүхдүүдэд зориулсан орчин үеийн физик: нарийн төвөгтэй системийн физик. - М.: Боловсрол, 1978.
5. нэвтэрхий толь бичигзалуу физикч.
6. В.Г. Разумовский, Л.С. Хижняков. Орчин үеийн хичээлахлах сургуульд физик. – М.: Боловсрол, 1983 он.
7. 8-10-р ангийн физикийн хичээл заах арга зүй ахлах сургууль. 2-р хэсэг / Ed. V.P. Орехова, А.В. Усова ба бусад - М.: Боловсрол 1980 он.
8. В.А.Волков. Физикийн хичээлийн хөгжил. М. “VAKO” 2006 он
Эцсийн туршилт
1. Өгүүлбэрийг гүйцээж бич.
1) нэг талст;
2) поликристалууд.
a) нэг талст;
1) давсны үр тариа;
3) элсэн чихрийн үр тариа;
4) нэг хэсэг цэвэршүүлсэн элсэн чихэр
в) аморф төлөв.
1) талст бие;
2) аморф биетүүд.
Эцсийн туршилт
1. Өгүүлбэрийг гүйцээж бич.
"Физик шинж чанар нь болор доторх чиглэлээс хамаарахыг ... гэж нэрлэдэг."
2. Алга болсон үгийг нөхөж бич.
"Хатуу биеийг ... ба ... гэж хуваадаг."
3. Хатуу болон талстуудын хоорондын уялдаа холбоог ол.
1) нэг талст;
2) поликристалууд.
a) нэг талст;
б) олон тооны жижиг талстууд.
4. Бодис ба түүний төлөвийн хоорондын уялдаа холбоог ол.
1) давсны үр тариа;
3) элсэн чихрийн үр тариа;
4) нэг хэсэг цэвэршүүлсэн элсэн чихэр
а) поликристал төлөв байдал;
б) монокристал төлөв байдал;
в) аморф төлөв.
5. Бие болон хайлах цэгийн хоорондын уялдаа холбоог ол.
1) талст бие;
2) аморф биетүүд.
a) тодорхой хайлах цэг байхгүй;
б) хайлах температур тогтмол байна.
Бүх бие, бодисууд олддог хэд хэдэн нэгтгэх төлөв байдаг. Энэ:
- шингэн;
- плазм;
- хатуу.
Хэрэв бид гараг ба сансар огторгуйн цогцыг авч үзвэл ихэнх бодис, биетүүд хий, плазмын төлөв байдалд хэвээр байна. Гэсэн хэдий ч дэлхий дээр хатуу хэсгүүдийн агууламж бас чухал юм. Тиймээс бид талст ба аморф хатуу бодис гэж юу болохыг олж мэдэхийн тулд тэдгээрийн талаар ярилцах болно.
Кристал ба аморф биетүүд: ерөнхий ойлголт
Бүх хатуу бодис, бие, объектыг дараахь байдлаар хуваана.
- талст;
- аморф.
Тэдний хоорондох ялгаа нь асар их, учир нь хуваагдал нь бүтцийн шинж тэмдэг, илэрсэн шинж чанарууд дээр суурилдаг. Товчхондоо, хатуу талст бодисууд нь тодорхой төрлийн орон зайн талст тортой, өөрөөр хэлбэл бүхэлдээ биш харин тодорхой чиглэлд өөрчлөгдөх чадвартай бодис, биетүүд юм (анизотропи).
Хэрэв бид аморф нэгдлүүдийг тодорхойлдог бол тэдгээрийн анхны шинж чанар нь өөрчлөгдөх чадвар юм Физик шинж чанарбүх чиглэлд нэгэн зэрэг. Үүнийг изотропи гэж нэрлэдэг.
Талст болон аморф биетүүдийн бүтэц, шинж чанар нь огт өөр. Хэрэв эхнийх нь орон зайд эмх цэгцтэй байрласан хэсгүүдээс бүрдэх тодорхой хязгаарлагдмал бүтэцтэй бол сүүлийнх нь ямар ч дэг журамгүй болно.

Хатуу бодисын шинж чанар
Талст болон аморф биетүүд нь хатуу биетүүдийн нэг бүлэгт багтдаг бөгөөд энэ нь тэдгээрт өгөгдсөн бүх шинж чанарыг агуулна гэсэн үг юм. нэгтгэх байдал. Тэр бол ерөнхий шинж чанаруудТэдний хувьд дараахь зүйл байх болно.
- Механик - уян хатан чанар, хатуулаг, хэв гажилтын чадвар.
- Дулааны - буцлах ба хайлах цэг, дулааны тэлэлтийн коэффициент.
- Цахилгаан ба соронзон - дулаан ба цахилгаан дамжуулалт.
Тиймээс бидний авч үзэж буй мужууд эдгээр бүх шинж чанартай байдаг. Зөвхөн тэдгээр нь аморф биетүүдэд талст биетүүдээс арай өөрөөр илэрдэг.
Үйлдвэрлэлийн зориулалттай чухал шинж чанарууд нь механик болон цахилгаан юм. Деформациас сэргэх, эсвэл эсрэгээр нь сүйрч, нунтаглах чадвар нь чухал шинж чанар юм. Мөн чухал зүйл бол бодис дамжуулж чаддаг явдал юм цахилгаанэсвэл үүнийг хийх чадваргүй.

Кристал бүтэц
Хэрэв бид талст ба аморф биетүүдийн бүтцийг тайлбарлавал юуны өмнө тэдгээрийг бүрдүүлдэг бөөмсийн төрлийг зааж өгөх хэрэгтэй. Кристалуудын хувьд эдгээр нь ион, атом, атом-ион (металл дахь), молекул (ховор) байж болно.
Ерөнхийдөө эдгээр бүтэц нь бодисыг бүрдүүлэгч хэсгүүдийн зохион байгуулалтын үр дүнд бий болсон хатуу эмх цэгцтэй орон зайн тороор тодорхойлогддог. Хэрэв та болорын бүтцийг дүрслэн төсөөлвөл дараахь зүйлийг олж авах болно: атомууд (эсвэл бусад хэсгүүд) бие биенээсээ тодорхой зайд байрладаг тул үр дүн нь ирээдүйн болор торны хамгийн тохиромжтой элемент юм. Дараа нь энэ эс олон удаа давтагдаж, ерөнхий бүтэц нь ингэж хөгждөг.
Гол онцлог нь ийм бүтэц дэх физик шинж чанар нь бүх чиглэлд биш харин зэрэгцээ ялгаатай байдаг. Энэ үзэгдлийг анизотропи гэж нэрлэдэг. Өөрөөр хэлбэл, хэрэв та болорын аль нэг хэсэгт нөлөөлсөн бол хоёр дахь тал нь түүнд хариу үйлдэл үзүүлэхгүй байж магадгүй юм. Тиймээс, та хагас ширхэг ширээний давс цавчих болно, гэхдээ хоёр дахь нь хэвээр үлдэнэ.
Кристалуудын төрлүүд
Хоёр төрлийн талстыг тодорхойлох нь заншилтай байдаг. Эхнийх нь монокристал бүтэц, өөрөөр хэлбэл тор нь өөрөө 1. Энэ тохиолдолд талст ба аморф биетүүд шинж чанараараа огт өөр байдаг. Эцсийн эцэст, нэг болор нь цэвэр анизотропи шинж чанартай байдаг. Энэ нь хамгийн жижиг бүтэц болох анхан шатны бүтцийг илэрхийлдэг.
Хэрэв дан талстыг олон удаа давтаж, нэг бүхэл болгон нэгтгэвэл бид поликристалын тухай ярьж байна. Дараа нь бид анизотропийн тухай яриагүй, учир нь нэгжийн эсийн чиглэл нь ерөнхий эмх цэгцтэй бүтцийг зөрчиж байна. Үүнтэй холбоотойгоор поликристалл ба аморф биетүүд нь физик шинж чанараараа бие биетэйгээ ойрхон байдаг.

Металл ба тэдгээрийн хайлш
Кристал ба аморф бие биендээ маш ойрхон байдаг. Металл болон тэдгээрийн хайлшийг жишээ болгон авч үзвэл үүнийг шалгахад хялбар байдаг. Тэд өөрсдөө хэвийн нөхцөлд хатуу бодис юм. Гэсэн хэдий ч тодорхой температурт тэд хайлж эхэлдэг бөгөөд бүрэн талстжих хүртэл тэдгээр нь сунадаг, зузаан, наалдамхай масстай хэвээр байх болно. Мөн энэ нь аль хэдийн биеийн аморф төлөв юм.
Тиймээс хатуухан хэлэхэд бараг бүх талст бодис тодорхой нөхцөлд аморф болж хувирдаг. Сүүлчийнхтэй адил талсжихдаа эмх цэгцтэй орон зайн бүтэцтэй хатуу болж хувирдаг.
Металл байж болно янз бүрийн төрөл орон зайн бүтэц, хамгийн алдартай бөгөөд судлагдсан нь дараахь зүйл юм.
- Энгийн куб.
- Нүүр төвтэй.
- Эзлэхүүн төвтэй.
Кристал бүтэц нь призм эсвэл пирамид дээр суурилж болох бөгөөд түүний гол хэсгийг дараахь байдлаар төлөөлдөг.
- гурвалжин;
- параллелограмм;
- дөрвөлжин;
- зургаан өнцөгт.
Энгийн ердийн куб тортой бодис нь хамгийн тохиромжтой изотроп шинж чанартай байдаг.

Аморфизмын тухай ойлголт
Талст болон аморф биетүүдийг гаднаас нь ялгахад хялбар байдаг. Эцсийн эцэст, сүүлийнх нь ихэвчлэн андуурч болно наалдамхай шингэн. Аморф бодисын бүтэц нь мөн ион, атом, молекул дээр суурилдаг. Гэсэн хэдий ч тэдгээр нь эмх цэгцтэй, хатуу бүтэц үүсгэдэггүй тул шинж чанар нь бүх чиглэлд өөрчлөгддөг. Өөрөөр хэлбэл тэдгээр нь изотроп шинж чанартай байдаг.
Бөөмүүд нь эмх замбараагүй, санамсаргүй байдлаар байрладаг. Зөвхөн заримдаа тэд жижиг локус үүсгэж болох бөгөөд энэ нь үзэсгэлэнгийн ерөнхий шинж чанарт нөлөөлөхгүй хэвээр байна.
Ижил биетүүдийн шинж чанарууд
Тэд болортой ижил байдаг. Ялгаа нь зөвхөн тодорхой бие бүрийн үзүүлэлтүүдэд л байдаг. Жишээлбэл, аморф биетүүдийн дараах шинж чанаруудыг ялгаж салгаж болно.
- уян хатан байдал;
- нягтрал;
- зуурамтгай чанар;
- уян хатан чанар;
- дамжуулалт ба хагас дамжуулалт.
Та холболтын хилийн төлөвийг ихэвчлэн олж болно. Кристал болон аморф биетүүд хагас аморф болж болно.
Мөн анхаарал татаж буй нөхцөл байдлын онцлог нь гадны хурц нөлөөн дор илэрдэг онцлог шинж юм. Иймээс аморф биет хурц цохилт, хэв гажилтанд өртвөл энэ нь поликристалл шиг аашилж, жижиг хэсгүүдэд хуваагддаг. Гэсэн хэдий ч хэрэв та эдгээр хэсгүүдэд цаг хугацаа өгвөл тэд удахгүй дахин нэгдэж, наалдамхай шингэн төлөвт шилжих болно.

Нэгдлүүдийн өгөгдсөн төлөвт фазын шилжилт явагдах тодорхой температур байдаггүй. Энэ үйл явц нь заримдаа бүр хэдэн арван жилийн туршид (жишээлбэл, бага нягтралтай полиэтиленийн задрал) ихээхэн хэмжээгээр нэмэгддэг.
Аморф бодисын жишээ
Ийм бодисын олон жишээ бий. Хамгийн тодорхой бөгөөд байнга тулгардаг хэд хэдэн зүйлийг тоймлон хүргэе.
- Шоколад бол ердийн аморф бодис юм.
- Давирхай, түүний дотор фенол-формальдегид, бүх хуванцар.
- Хув.
- Ямар ч найрлагатай шил.
- Битум.
- Тар.
- Лав болон бусад.
Аморф бие нь маш удаан талстжилтын үр дүнд үүсдэг, өөрөөр хэлбэл температур буурах үед уусмалын зуурамтгай чанар нэмэгддэг. Ийм бодисыг хатуу бодис гэж нэрлэх нь ихэвчлэн хэцүү байдаг тул тэдгээрийг наалдамхай, өтгөн шингэн гэж ангилах магадлал өндөр байдаг.
Хатуурах явцад огт талсжихгүй тэдгээр нэгдлүүд нь онцгой төлөвтэй байдаг. Тэднийг нүдний шил гэж нэрлэдэг бөгөөд муж нь шилэн юм.

Шилэн бодис
Талст болон аморф биетүүдийн шинж чанарууд нь нийтлэг гарал үүсэл, нэг дотоод шинж чанартай тул бидний олж мэдсэнээр ижил төстэй байдаг. Гэхдээ заримдаа шилэн гэж нэрлэгддэг бодисын онцгой төлөвийг тэднээс тусад нь авч үздэг. Энэ нь орон зайн тор үүсгэхгүйгээр талсжиж, хатуурдаг нэгэн төрлийн эрдсийн уусмал юм. Өөрөөр хэлбэл, шинж чанарын өөрчлөлтийн хувьд энэ нь үргэлж изотроп хэвээр байна.
Жишээ нь, ердийн цонхны шил нь яг хайлах цэггүй байдаг. Энэ үзүүлэлт нэмэгдэхэд аажмаар хайлж, зөөлрөж, шингэн төлөвт хувирдаг. Хэрэв цохилтыг зогсоовол процесс урвуу болж, хатуурал эхлэх боловч талсжилтгүй болно.
Ийм бодисыг өндөр үнэлдэг бөгөөд өнөөдөр шил нь дэлхий даяар хамгийн түгээмэл бөгөөд эрэлт хэрэгцээтэй барилгын материалын нэг юм.
Хатуу бодисууд хэлбэрээ удаан хугацаанд хадгалж байдаг тул эзлэхүүнээ өөрчлөхийн тулд ихээхэн хүчин чармайлт гаргах шаардлагатай байдаг.
Хатуу бодисыг тодорхойлохдоо бид дүрмээр бол тэдгээрийн шинж чанарыг холбодог гадаад шинж тэмдэг- хэлбэр, хэмжээг хадгалах. Гэсэн хэдий ч хатуу биетүүд бие биенээсээ ялгаатай байдаг дотоод бүтэц. Тэдний зарим нь бий болор бүтэц- тэдгээрийн бүрдэх бичил хэсгүүд (атом, ион, молекулууд) нь тодорхой зайд эмх цэгцтэй байрладаг, өөрөөр хэлбэл урт хугацааны дарааллыг хадгалдаг. Ийм хатуу бодис гэж нэрлэдэг талст.Үүнд: металл, хоолны давс, элсэн чихэр, алмаз, бал чулуу, кварц гэх мэт.
Бусад биетүүдэд атом, ион, молекулуудын тодорхой дараалсан зохион байгуулалт байдаггүй бөгөөд тэдгээрийн дотоод бүтцээрээ шингэнийг илүү санагдуулдаг, учир нь тэдгээр нь бичил хэсгүүдийн байрлалын богино зайн дарааллаар тодорхойлогддог. Ийм байгууллагуудыг нэрлэдэг аморф.Эдгээр нь лав, шил, төрөл бүрийн давирхай, хуванцар гэх мэт.
Кристал ба аморф биетүүд нүдээр ялгах боломжтой: хугарлын үед аморф биетүүд жигд бус хэлбэртэй гадаргуу үүсгэдэг ба талстууд нь тэгш ирмэгтэй, шаталсан гадаргуутай байдаг.
Аморф төлөв байдал нь нэлээд тогтворгүй бөгөөд цаг хугацааны явцад аморф биетүүдталст болж болно. Жишээлбэл, аморф шинж чанартай чихрийн чихэр дээр удаан хадгалсны дараа чихрийн талстууд үүсдэг. Мөн тодорхой нөхцөлд талст биетүүд аморф болж болно. Жишээлбэл, зарим металлыг хурдан хөргөх нь тэдний аморф (шилэн) төлөвийг бий болгоход хүргэдэг.
Аморф биетүүдмолекул хоорондын бондын янз бүрийн чиглэлд ижил шинж чанартай байдаг. Тийм учраас тэд ингэж хэлдэг изотроп. Температур нэмэгдэхийн хэрээр тэдгээр нь "зөөлөн" болж, шингэнийг харуулдаг боловч талст биетүүд шиг тогтсон хайлах цэггүй байдаг.
Үг "изотроп"гр гаралтай.isos - жигд, ижил;тропос - чиглэл.
Кристал биетүүдЭдгээр нь атом, молекулуудыг байрлуулах тодорхой дотоод дарааллаар тодорхойлогддог бөгөөд янз бүрийн орон зайн тор үүсгэдэг бөгөөд тэдгээрийг талст гэж нэрлэдэг. Тэдний хэлбэрээс хамааран тэдгээр нь өөр өөр байдаг моно талстуудбодисууд нь тодорхой геометрийн хэлбэрийг үүсгэдэг. Тиймээс ширээний давсны нэг талст нь шоо хэлбэртэй, мөс нь зургаан өнцөгт призмийн хэлбэртэй, алмааз нь ердийн зургаан өнцөгт хэлбэртэй байдаг (Зураг 3.12). Дүрмээр бол тэдгээр нь жижиг хэмжээтэй боловч байгальд том дан талстууд байдаг, жишээлбэл, хүн шиг өндөр кварцын блок олдсон.
IN байгалийн нөхцөлИхэнх талст хатуу биетүүд эмх замбараагүй ургасан жижиг дан талстуудаас тогтдог. Тэд гэж нэрлэдэг поликристалууд.Ийм поликристалын жишээ бол янз бүрийн хэлбэртэй байдаг цасан ширхгүүд боловч далавч нь үргэлж зургаан өнцөгт чиглэлтэй байдаг. Сайтаас авсан материал
Монокристалууд өөр өөр байдаг анизотропишинж чанарууд, өөрөөр хэлбэл, талст нүүрний чиглэлийн чиглэлээс хамаардаг. Жишээлбэл, гялтгануур гэх мэт байгалийн ашигт малтмал нь нэг хавтгайн дагуух хүчний нөлөөн дор ялтсууд болж амархан хуваагддаг боловч перпендикуляр чиглэлд мэдэгдэхүйц хүч чадал харуулдаг. Поликристалууд нь шинж чанараараа изотроп шинж чанартай байдаг. Энэ нь тэдгээрийн бүрдэх нэг талстуудын санамсаргүй чиглэлтэй холбоотой юм.
Үг "анизотроп"Грек хэлнээс орчуулбал "чиглэлээрээ ижил биш" гэсэн утгатай.
Химийн найрлагадаа ижил төстэй олон талст биетүүд өөр өөр физик шинж чанартай байдаг. Энэ үзэгдлийг гэж нэрлэдэг полиморфизм.Жишээлбэл, химийн шинж чанараараа алмаз ба бал чулуу нь хоёр өөр өөрчлөлттэй нүүрстөрөгч юм. Тэд янз бүрийн хэлбэрийн болор тортой тул тэдгээрийн доторх атомуудын харилцан үйлчлэлийн хүч өөр өөр байдаг. Энэ нь ялангуяа тэдний хатуулаг ялгаатай болохыг тайлбарладаг: бал чулуу нь зөөлөн, алмаз бол хатуу эрдэс юм.
Лабораторийн нөхцөлд мөсний арав орчим өөрчлөлтийг олж авдаг боловч зөвхөн нэг нь байгальд байдаг.
Энэ хуудсан дээр дараахь сэдвээр материалууд байна.
Кристал биетүүдэд ямар шинж чанарууд байдаг вэ?
Кристал биетүүдийн товч тайлан
Талстыг аморфаас хэрхэн ялгах вэ?
Хатуу биетийн физикийн талаар товчхон
Товчхондоо болор аморф биетүүд
Энэ материалын талаархи асуултууд:
Байгальд шинж чанараараа ялгаатай хоёр төрлийн хатуу бодис байдаг - талст ба аморф.
Кристал биетүүдхатуу хэвээр байх, өөрөөр хэлбэл. тодорхой температур хүртэл өгөгдсөн хэлбэрээ хадгалж, шингэн төлөвт шилжинэ. Хөргөх үед процесс нь эсрэг чиглэлд явагддаг. Тиймээс цэвэр металлын хувьд нэг төлөвөөс нөгөөд шилжих шилжилт нь тодорхой хайлах температурт явагддаг (Зураг 1.1).
Аморф биетүүдхалах үед тэдгээр нь өргөн температурын хязгаарт зөөлөрч, наалдамхай болж, дараа нь шингэн төлөвт хувирдаг. Хөргөх үед процесс нь эсрэг чиглэлд явагддаг.
Хатуу биетийн талст төлөв нь аморф төлөвөөс илүү тогтвортой байдаг.
Аморф хатуу биетүүд нь шингэнээс ялгаатай нь бөөмсийн хөдөлгөөнийг бууруулдаг (зуурамтгай чанар нь хязгааргүй өндөр), тэдгээр нь хөлдөөсөн шингэн юм. Аморф төлөвийг шингэн төлөвөөс түргэвчилсэн хөргөлтөөр олон органик болон органик бус бодисуудад тогтоож болно. Харин дахин халаахад 20...250С-т удаан хугацаагаар, зарим тохиолдолд хэв гажилтын үед аморф хатуу биетийн тогтворгүй байдал нь талст төлөвт хэсэгчлэн эсвэл бүрэн шилжсэнээр илэрдэг.
Ийм шилжилтийн жишээнд халаах үед органик бус шил үүлэрхэг, халах үед хайлсан хув хэсэгчилсэн талсжих, түүнчлэн сунгах үед резин нь хатуурах зэрэг болно.
Зураг 1.1 Металл талсжих үеийн хөргөлтийн муруй
Кристал биетүүд нь тэдгээрийн бүрдсэн хэсгүүдийн (ион, атом, молекул) орон зайд эмх цэгцтэй байрлалаар тодорхойлогддог.
Кристалын шинж чанар нь үүнээс хамаарна цахим бүтэцатом, молекул эсвэл ион (өөрөөр хэлбэл болор тор үүсгэдэг бөөмс), талст дахь тэдгээрийн харилцан үйлчлэлийн шинж чанар, бөөмсийн орон зайн зохион байгуулалт. Талстуудын бүтцийн эдгээр бүх нарийн ширийн зүйлийг үзэл баримтлалаар дүрсэлсэн байдаг "бүтэц".
Бүтцийн бүрэлдэхүүн хэсгүүдийн хэмжээ, тэдгээрийг тодорхойлох аргуудаас хамааран нарийн бүтэц, микро ба макро бүтэц гэсэн ойлголтуудыг ашигладаг.
Нарийн бүтэцболор дахь бөөмсийн зохион байгуулалтыг дүрсэлсэн; Үүнийг дифракцийн аргаар (рентген цацраг, электроны дифракц, нейтроны дифракц) судалдаг. Богино долгион (? = 10 -10 .. 10 -12 м) рентген туяа (эсвэл электрон, нейтроны долгион) бүхий болор бөөмсийн харилцан үйлчлэлийн үр дүнд олж авсан дифракцийн хэв маягт дүн шинжилгээ хийснээр нэгийг зөвшөөрөх мэдээллийг олж авах боломжтой. талстуудын бүтцийг тогтоох.
Ихэнх материалууд нь жижиг талстуудаас (үр тариа) тогтдог. Ийм жижиг бүтцийн бүрэлдэхүүн хэсгүүдийг ажиглаарай - бичил бүтэцоптик (10 -7 м хүртэл) эсвэл электрон (2?10 -10 м хүртэл) микроскоп ашиглан хийж болно.
Микроскопийн аргууд нь талстуудын хэмжээ, хэлбэр, янз бүрийн шинж чанартай талстууд, тэдгээрийн тархалт, харьцангуй эзэлхүүний агууламж, гадаад орц, бичил хоосон зайны хэлбэр, талстуудын чиг баримжаа, тусгай талстографийн шинж чанарууд (ихэрлэх) зэргийг тодорхойлох боломжийг олгодог. , гулсалтын шугам гэх мэт). Энэ нь микроскоп ашиглан олж авах боломжтой мэдээллийн бүрэн жагсаалтаас хол байна.
Кристалуудын бүтцийг судлах - макро бүтэц- нүцгэн нүдээр эсвэл томруулдаг шил ашиглан жижиг томруулж, том талстуудын хугарал, агшилтын хөндий, нүх сүв, хэмжээ, хэлбэрийг тодорхойлох боломжтой. Тусгайлан бэлтгэсэн дээжийг (өнгөлсөн, сийлсэн) ашиглан ан цав, химийн нэг төрлийн бус байдал, фиброз зэргийг илрүүлдэг.
Макро бүтцийг судлах нь энгийн хэдий ч материалыг судлах маш үнэ цэнэтэй арга юм.
Хатуу бодис.
INШингэнээс ялгаатай нь хатуу бодисууд байдаг хэлбэрийн уян хатан байдал Хатуу биеийн геометрийг өөрчлөх оролдлого хийх бүрд уян харимхай хүчнүүд үүсдэг бөгөөд энэ нөлөөллөөс сэргийлдэг. Хатуу бодисын дотоод бүтцийн шинж чанарт үндэслэн тэдгээрийг ялгадаг талст Тэгээд аморф хатуу бодис. Кристал болон аморф бие нь бие биенээсээ олон физик шинж чанараараа эрс ялгаатай байдаг.
Аморф биетүүдөөрийн замаар дотоод бүтэцшингэнийг маш санагдуулдаг тул тэдгээрийг ихэвчлэн нэрлэдэг хэт хөргөсөн шингэн . Шингэний нэгэн адил аморф бие нь бүтцийн хувьд изотроп шинж чанартай байдаг. Тэдний шинж чанар нь авч үзсэн чиглэлээс хамаардаггүй. Үүнийг аморф биетүүдэд яг л шингэн зүйлд байдагтай холбон тайлбарладаг. ойрын дараалал (зохицуулалтын дугаар), алслагдсан нь (бондуудын урт ба өнцөг) байхгүй байна Эдгээр нь аморф биеийн бүх макрофизик шинж чанаруудын бүрэн нэгэн төрлийн байдлыг хангадаг. Аморф биетүүдийн ердийн жишээ бол шил, давирхай, битум, хув юм.
Аморф биетүүдээс ялгаатай нь талст биетүүд нь тодорхой эмх цэгцтэй бичил бүтэцтэй бөгөөд энэ нь макро түвшинд хадгалагдаж, гадна талдаа хавтгай ирмэгтэй, хурц ирмэгтэй жижиг мөхлөг хэлбэрээр харагддаг. талстууд.
Байгальд нийтлэг байдаг талст биетүүд (металл ба хайлш, элсэн чихэр ба хоолны давс, мөс ба элс, чулуу ба шавар, цемент ба керамик, хагас дамжуулагч гэх мэт) ихэвчлэн байдаг. поликристалууд, санамсаргүй байдлаар нийлсэн нэг талстуудаас бүрддэг (талстууд), хэмжээ нь 1 микрон (10 -6 м) орчим байдаг.Гэхдээ заримдаа нэлээд том хэмжээтэй дан талстууд олддог. Жишээлбэл, рок болор дан талстууд хүний өндөрт хүрдэг. орчин үеийн технологиДан талстууд чухал үүрэг гүйцэтгэдэг тул тэдгээрийг зохиомлоор өсгөх технологийг боловсруулсан.
Нэг талст дотор аливаа бодисын атомууд (ионууд) орон зайд тодорхой чиглэгдсэн геометрийн бүтцийн зангилаанд алсын зайн дарааллын дагуу байрладаг. болор тор Бодис бүр геометрийн хувьд бие даасан, хатуу төлөвт өөрийн гэсэн болор торыг үүсгэдэг. Түүний хэлбэр нь тухайн бодисын молекулуудын бүтцээр тодорхойлогддог. Үргэлж торонд тодруулж болно нэгж нүд, түүний бүх геометрийн шинж чанарыг хадгалах, гэхдээ зангилааны боломжит хамгийн бага тоог багтаасан.
Тодорхой бодис бүрийн дан талстууд өөр өөр хэмжээтэй байж болно. Гэсэн хэдий ч тэд бүгд ижил геометрийг хадгалдаг бөгөөд энэ нь харгалзах талст нүүрний хоорондох тогтмол өнцгийг хадгалахад илэрдэг. Хэрэв нэг болор хэлбэр нь хүчээр эвдэрсэн бол дараа нь хайлмалаас ургах эсвэл зүгээр л халах үед энэ нь өмнөх хэлбэрээ сэргээх болно. Кристал хэлбэрийг дахин сэргээх шалтгаан нь термодинамикийн тогтвортой байдлын сайн мэдэх нөхцөл - боломжит энергийг багасгах хүсэл юм. Кристалуудын хувьд энэ нөхцлийг Ж.В.Гиббс, П.Кюри, Г.В.Волф нар бие биенээсээ хамааралгүйгээр дараах зарчим хэлбэрээр томъёолсон. болорын гадаргуугийн энерги хамгийн бага байх ёстой.
Хамгийн онцлог шинж чанарууддан талстууд юм анизотропи тэдгээрийн олон физик, механик шинж чанарууд. Жишээлбэл, олон талстуудын хатуулаг, хүч чадал, хэврэгшил, дулааны тэлэлт, уян хатан долгионы хурд, цахилгаан дамжуулах чанар, дулаан дамжуулалт зэрэг нь болор дахь чиглэлээс хамаарна. Поликристаллуудад анизотропи нь зөвхөн тэдгээрийг бүрдүүлдэг жижиг дан талстуудын эмх замбараагүй харилцан чиг баримжаагаас болж бараг илэрдэггүй. Энэ нь болор торонд янз бүрийн чиглэлд зангилааны хоорондох зай нь ерөнхий тохиолдолд мэдэгдэхүйц ялгаатай байдагтай холбоотой юм.
Өөр чухал онцлогталстууд нь эхний эрэмбийн фазын шилжилтийн термодинамик онолд бүрэн нийцсэн тогтмол температурт хайлж талсждаг гэж үзэж болно. Аморф хатуу биетүүдэд тодорхой тодорхойлогдсон фазын шилжилт байдаггүй. Халах үед тэдгээр нь янз бүрийн температурын өөрчлөлтөд жигд зөөлрдөг.Энэ нь аморф биетүүд нь тодорхой тогтмол бүтэцтэй байдаггүй бөгөөд халах үед энэ нь үе шаттайгаар устдаг бол талстууд халах үед нэгэн төрлийн болор торыг устгадаг гэсэн үг юм. түүний урт хугацааны дараалал) хатуу тогтсон эрчим хүчний нөхцөлд, тиймээс тогтмол температурт.
Зарим хатуу биетүүд талст болон аморф төлөвт тогтвортой байж болно. Ердийн жишээ бол шил юм. Хайлмалыг хангалттай хурдан хөргөхөд шил нь маш наалдамхай болж, талст бүтэцтэй болохоос өмнө хатуурдаг. Гэсэн хэдий ч маш удаан хөргөлттэй, тодорхой температурт өртөх үед ижил шил нь талсжиж, тодорхой шинж чанарыг олж авдаг (ийм шилийг нэрлэдэг. шилэн керамик ). Өөр нэг нийтлэг жишээ бол кварц юм. Байгальд энэ нь ихэвчлэн болор хэлбэрээр байдаг бөгөөд аморф кварц нь хайлмалаас үргэлж үүсдэг (үүнийг нэрлэдэг хайлсан кварц ). Туршлагаас харахад бодисын молекулууд илүү төвөгтэй, тэдгээрийн молекул хоорондын холбоо нь илүү хүчтэй байх тусам хөргөх үед хатуу аморф өөрчлөлтийг олж авах нь илүү хялбар байдаг.