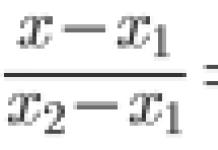В начале XXв. опытами по облучению тонкой фольги α-частицами Э. Резерфорд определил структуру атома. Он показал, что атом имеет планетарную модель (рис. 3), то есть состоит из плотного положительно заряженного ядра, вокруг которого обращается рыхлая электронная оболочка.
Рис. 3. Планетарная модель строения атома Э. Резерфорда
В целом атом является электронейтральной элементарной структурой химического элемента. Физический смысл порядкового номера Z-элемента в периодической системе элементов был установлен в планетарной модели атома Резерфорда. Z совпадает с числом положительных элементарных зарядов в ядре, закономерно возрастающих на единицу при переходе от предыдущего элемента к последующему. Химические свойства элементов и ряд их физических свойств объясняются поведением внешних, так называемых валентных электронов их атомов.
Поэтому периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах различных элементов. Теория периодической системы основывается на следующих положениях:
а) порядковый номер химического элемента равен общему числу электронов в атоме данного элемента;
б) состояние электронов в атоме определяется набором их квантовых чисел п, l , m и m s . Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией;
в) заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
Электроны в атоме, занимающие совокупность состояний с одинаковым значением главного квантового числа п , образуют электронную оболочку, или электронный слой. В зависимости от значенийn различают следующие оболочки:К прип = 1,L прип = 2,М приn = 3,N прип = 4,О прип = 5 и т. д. Максимальное число электронов, которые могут находиться в оболочках согласно принципу Паули: вК -оболочке – 2 электрона, в оболочкахL ,М ,N иО соответственно 8, 18, 32 и 50 электронов. В каждой из оболочек электроны распределяются по подгруппам или подоболочкам, каждая из которых соответствует определенному значению орбитального квантового числа. В атомной физике принято обозначать электронное состояние в атоме символомп l , указывающим значение двух квантовых чисел. Электроны, находящиеся в состояниях, характеризуемых одинаковыми квантовыми числамиn иl , называются эквивалентными. ЧислоZ -эквивалентных электронов указывается показателем степени в символеnl z . Если электроны находятся в некоторых состояниях с определенными значениями квантовых чиселп иl , то считается заданной так называемая электронная конфигурация. Например, основное состояние атома кислорода можно выразить следующей символической формулой: 1s 2 , 2s 2 , 2p 4 . Она показывает, что два электрона находятся в состояниях сn = 1 иl = 0, два электрона имеют квантовые числаn = 2 иl = 0 и четыре электрона занимают состоянияc n = 2 иl = 1.
Порядок заполнения электронных состояний в оболочках атомов, а в пределах одной оболочки – в подгруппах (подоболочках) должен соответствовать последовательности расположения энергетических уровней с данными п иl . Сначала заполняются состояния с наименьшей возможной энергией, а затем состояния со все более высокой энергией. Для легких атомов этот порядок соответствует тому, что сначала заполняется оболочка с меньшимп и лишь затем должна заполняться электронами следующая оболочка. В пределах однойоболочки сначала заполняются состояния с l = 0, а затем состояния с большими l , вплоть доl =п – 1. Взаимодействие между электронами приводит к тому, что для достаточно больших главных квантовых чиселn состояния с большимn и малымl могут иметь меньшую энергию, то есть быть энергетически более выгодными, чем состояния с меньшимп , но с большимl . Из изложенного следует, что периодичность химических свойств элементов объясняется повторяемостью электронных конфигураций во внешних электронных подгруппах у атомов родственных элементов.
Корпускулярно-волновой дуализм свойств света.
Подведем итоги раздела «Оптика».
В рамках геометрической оптики природа света не рассматривается. Используется понятие светового луча, для которого формулируются законы геометрической оптики. Эти законы позволяют рассчитывать траекторию движения световых лучей в случае, когда размеры различных препятствий на пути луча достаточно большие. Использование этих законов позволило создавать различные оптические системы и приборы (линза, микроскоп, телескоп, фотоаппарат, диапроектор).
Рассматривая свет как электромагнитную волну, удалось понять такие явления как интерференция, дифракция, поляризация света. Волновая природа света проявляет себя, когда размеры препятствия на пути световой волны сравнимы с длиной волны. Явления интерференции, дифракции, поляризации света находят разнообразное практическое применение (спектрометрия, дефектоскопия, голография).Волновые свойства света необходимо учитывать при конструировании различных оптических систем.
В квантовой оптике свет проявляет себя как поток частиц или квантов света – фотонов. В рамках квантовых представлений находят объяснения такие явления как тепловое излучение тел, внешний и внутренний фотоэффект, эффект Комптона и др.
Тот факт, что свет в одних опытах обнаруживает волновые свойства, а в других – корпускулярные, означает, что он имеет сложную двойственную природу, которую принято характеризовать термином корпускулярно-волновой дуализм . Впоследствии было установлено существование корпускулярно-волнового дуализма частиц вещества.
Г.Я.Мякишев, Б.Б.Буховцев, В.М.Чаругин. Физика. 11 класс. Учебник для общеобразовательных учреждений.- М.: «Просвещение», 2009 и др. Глава 11.
Тема 18. (2 часа)
Атомная физика. Опыты Резерфорда. Планетарная модель атома. Квантовые постулаты Бора. Лазеры.
Открытие сложного строения атома – важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие. В процессе создания количественной теории строения атома возникла атомная физика, позволившая объяснить атомные спектры, физические и химические свойства различных веществ, давшая начало другим разделам физики. Были открыты законы движения микрочастиц – законы квантовой механики.
Одну из первых моделей строения атома предложил в 1903 г. Дж. Дж. Томсон . Он предположил, что атом имеет форму шара; положительный заряд распределен равномерно по всему объему этого шара, а отрицательно заряженные электроны находятся внутри него. Радиус атома равен примерно 10 -10 м. Однако экспериментальные результаты доказали ошибочность такой модели.
Опыты Резерфорда . Новая модель атома была предложена Резерфордом в результате проделанных опытов по изучению рассеяния быстрых α -частиц на атомах вещества. В этих опытах в свинцовый контейнер 1 помещался радиоактивный препарат 2 (радий, рис.18.1).Узкий пучок 3 α -частиц (полностью ионизированных атомов гелия, испускаемых радием) направлялся на тонкую металлическую фольгу 4. За ней помещался экран 5, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Вспышки на экране наблюдались Рис.18.1
с помощью микроскопа 6.
Обнаружено, что α -частицы проникают через тонкие металлические пластины почти без отклонения от прямолинейного пути. Вместе с тем небольшая часть альфа-частиц испытывала отклонение на значительно большие (до 180 ○) углы.
Резерфорд предположил, что рассеяние альфа-частиц на большие углы объясняется тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10 -10 м, а сосредоточен в центральной части атома в области значительно меньших размеров.
В этой центральной положительно заряженной части атома – атомном ядре, сосредоточена почти вся масса атома. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию альфа-частиц нужно принять радиус ядра равным примерно 10 -15 м. При таком малом радиусе напряженность электрического поля ядра вблизи его поверхности очень велика. В этом поле на движущуюся α -частицу действует большая сила, которая и отклоняет частицу на большие углы, в том числе и в обратном направлении.
После обнаружения в опытах Резерфорда положительно заряженного ядра необходимо было ответить на вопросы о том, где же в атоме находятся электроны и чем занято в нем остальное пространство. Резерфорд предположил, что атом устроен подобно планетной системе. Как вокруг Солнца на больших расстояниях от него обращаются планеты, так вокруг ядерного ядра в атоме обращаются электроны. Радиус орбиты самого удаленного от ядра электрона и есть радиус атома. Такая модель строения атома была названа планетарной или ядерной моделью.
Однако атомные системы отличаются от планетарных систем физической природой сил, удерживающих планеты и электроны на их орбитах: планеты притягиваются к звездам силами всемирного тяготения, а во взаимодействии электронов с атомным ядром основную роль играют силы кулоновского притяжения разноименных электрических зарядов. Силы гравитационного притяжения между электроном и атомным ядром ничтожно малы по сравнению с электромагнитными.
Ядерная модель атома хорошо объясняет основные закономерности рассеяния заряженных частиц. Так как большая часть пространства между атомным ядром и обращающимися вокруг него электронами пуста, то быстрые заряженные частицы могут почти свободно проникать через слои вещества, содержащие несколько тысяч слоев атомов.
При столкновении с электроном альфа-частица практически не рассеивается, так как ее масса примерно в 8000 раз больше массы электрона. Однако в том случае, когда альфа-частица пролетает вблизи одного из атомных ядер, под действием электрического поля атомного ядра может произойти ее рассеяние на любой угол до 180°. Но из-за малых размеров ядра по сравнению с размерами атома такие события происходят весьма редко.
Ядерная модель атома позволила объяснить результаты опытов по рассеянию альфа-частиц в веществе, но встретилась с другой принципиальной трудностью: законы движения электронов в атоме Резерфорда противоречили законам электродинамики.
Как известно, любое ускоренное движение электрических зарядов сопровождается излучением электромагнитных волн. Движение по окружности является ускоренным движением, поэтому электрон в атоме, должен излучать электромагнитные волны с частотой, равной частоте обращения вокруг ядра. Это должно приводить к уменьшению энергии электрона, постепенному его приближению к атомному ядру и падению на ядро.
Таким образом, атом, состоящий из атомного ядра и обращающихся вокруг него электронов, согласно законам классической физики, неустойчив. Но в действительности атомы устойчивы и в невозбужденном состоянии не излучают свет.
До конца XIX века считалось, что атом неделим. Но после того как английский физик Джозеф Джон Томсон в 1897 г. открыл электрон, стало понятно, что учёные ошибались.
Итак, открыв электрон , Томсон пришёл к выводу, что он обладает массой и имеет отрицательный заряд. Было сделано предположение, что электрон является составной частью атома. Но раз он имеет отрицательный заряд, следовательно, в состав атома должны входить частицы, имеющие положительный заряд, так как в целом атом нейтрален.
Модель атома Томсона
Томсон предложил свою модель атома. Он считал, что атом имеет форму шара. Внутри этого шара находится положительно заряженное вещество, в котором существуют отрицательно заряженные электроны. Свою модель Томсон в шутку называл «булочкой с изюмом». То есть, в его модели электроны как бы вкраплены в какую-то положительно заряженную массу, как изюминки в булочке.
Опыт Резерфорда

Опыт Резерфорда
Дальнейшие исследования атома учёными показали, что модель, предложенная Томсоном, была неправильной.
В 1909 г. английский физик Эрнест Резерфорд провёл опыт с рассеиванием альфа-частиц, которые образуются при распаде химического элемента радия. Масса альфа-частиц в 8000 раз превышает массу электрона.
В эксперименте Резерфорда пучок альфа-частиц пропускался через тонкую золотую фольгу. Нужно сказать, что фольга была настолько тонка, что её толщина составляла практически один слой молекул. Если Томсон был прав, и атом состоял из некоего облака с электронами, то альфа-частицы, обладающие большой массой, должны были легко проходить через фольгу. Но на деле оказалось, что часть альфа-частиц действительно проходила, отклоняясь лишь на небольшой угол, а часть словно наталкивалась на какое-то препятствие и отскакивала назад. Это было невероятно. Впоследствии Резерфорд сравнивал свой опыт с выстрелом 15-дюймовым снарядом по папиросной бумаге. Результат его опыта был таким, как если бы снаряд не только не пробил папиросную бумагу, но и отскочил от неё. То есть внутри атома существовало что-то, мешавшее альфа-частицам проходить сквозь атом. Так как альфа-частицы имели положительный заряд, то, скорее всего, они проходили мимо других частиц с положительным зарядом. И размеры этих частиц были намного меньше размеров самого атома. Атом золота должен был состоять из ядра, имеющего положительный заряд и окружавших его отрицательно заряженных электронов.
Можно сказать, что это было рождение ядерной физики.
Планетарная модель атома

Модель атома Резерфорда
Резерфорд предложил свою модель атома, которая объясняла строение атома. Он считал, что вся основная масса атома сосредоточена в положительно заряженном ядре. А вокруг этого ядра вращаются отрицательно заряженные электроны так, как планеты вращаются вокруг Солнца. И вращаются электроны под действием кулоновской силы, действующей на них со стороны ядра. Модель Резерфорда была названа планетарной.
Электроны в атоме вращаются с такой огромной скоростью, что образуют над поверхностью ядра подобие облака. Все атомы располагаются на некотором расстоянии друг от друга. И не «слипаются» они, потому что вокруг ядра каждого атома существует свое электронное «облако», заряженное отрицательно. И это «облако» отталкивается от отрицательно заряженного электронного «облака» другого атома.
Но модель атома Резерфорда имела недостатки. Она была несовместима с законами классической физики. Почему электрон не падает на ядро? Потому что вращается вокруг него. Но, вращаясь, он должен излучать электромагнитные волны и терять энергию. И, постепенно растратив всю энергию, электрон должен упасть на ядро. Но этого не происходит в действительности. То есть, процессы, происходящие в атоме, не подчиняются классическим законам.
Впоследствии датский физик Нильс Бор дал объяснение этому явлению. Он предположил, что электроны в атоме двигаются только по стационарным орбитам, находясь на которых они не излучают энергию. И Бор оказался прав.
Строение атома
Единицы заряда, массы и энергии в атомной физике.
Итак, заряд любой частицы содержит всегда целое число элементарных зарядов. Для частицы атомных размеров это целое число будет к тому же и небольшим. Ввиду этого в атомной физике удобно за единицу электрического заряда принять элементарный заряд е=1,60 10-19 Кл. За единицу массы в атомной физике принимается 1/12 массы атома изотопа углерода 12С. Атомная масса этого изотопа равна 12, а молярная масса М = 12 10-3 кг/моль. Поэтому атомная единица массы (а. е. м.) равна
Атомную единицу массы можно определить также как массу атома элемента с атомной массой 1. Поэтому масса атома (точнее ее средняя величина), выраженная в атомных единицах массы, равна атомной массе элемента.
Отметим, что элемента с атомной массой, равной единице, в природе не существует. Атомная масса водорода близка к единице, но несколько больше ее: она равна 1,008. Итак, масса легчайшего из атомов равна 1,008 а. е. м.
Единица энергии, принятая в атомной физике, есть энергия, приобретаемая частицей с зарядом е (например, электроном) при прохождении разности потенциалов 1 В. Эта единица носит название электронвольт и обозначается эВ. Энергия, приобретаемая зарядом при движений в электрическом поле, равна произведению заряда на разность потенциалов начальной и конечной точек пути, поэтому
1 эВ=1,6 10-19 Кл 1В=1,6 10-19Дж.
Из определения электронвольта следует, что электрон, ускоренный разностью потенциалов U [В], имеет энергию, численно равную U [эВ]. Ион с зарядом 2е, пройдя ту же разность потенциалов, приобретает энергию 2U [эВ], и т. д.
В электронвольтах можно измерять энергию не только заряженных, но и нейтральных частиц. Для примера выразим в электронвольтах энергию атома кислорода (m=16 а. е. м.), движущегося со скоростью v=103 м/c:
Используются также кратные электронвольту единицы:
1 кэВ=103 эВ, 1МэВ=106 эВ, 1 ГэВ=109 эВ, 1 ТэВ=1012 эВ.
Модель атома Резерфорда-Бора.
Все вещество состоит из элементарных частиц. Но вещество не состоит из элементарных частиц непосредственно. Кирпичиками или элементами, из которых построено все вещество являются атомы. До 1912 г. ученые представляли атом в виде положительно заряженного шара, внутри которого находятся отрицательно заряженные электроны. Конструкция похожая на кекс с изюминками-электронами была предложена однофамильцами Томсонами – Джозефом Джоном и Уильямом лордом Кельвином.

В целом положительные и отрицательные заряды в таком атоме скомпенсированы и атом электрически нейтрален. Предполагалось, что вся масса атома сконцентрирована в электронах. Поскольку электрон намного легче атома, то даже самые простые атомы должны содержать тысячи электронов.
В 1909 г. Резерфорд поручил молодому тогда еще физику Марсдену исследовать рассеяние альфа лучей при прохождении их через тонкие металлические пластинки. Большинство элементарных частиц испытывали незначительные отклонения после прохождения через пластинки. Однако Марсдену удалось обнаружить и очень сильно отклонившиеся частицы. Их, правда, было очень мало, но удивительно было то, что они вообще были. Конечно, Марсдену могло это показаться. Для регистрации альфа частиц использовался спинтарископ – небольшой прозрачный экран, покрытый специальным флуоресцирующим веществом. Когда элементарная частица попадает в такой экран, возникает слабая вспашка. Вспышка очень маленькая и слабая. Ее наблюдают под микроскопом. Чтобы глаз мог ее заметить, человек должен привыкнуть к темноте. Для этого он, прежде чем начать работать, то есть регистрировать и считать вспышки, должен полчаса посидеть в полной темноте. Вполне естественно поэтому предположить, что Марсден мог ошибиться.
Резерфорд просит Марсдена повторить опыты, но на этот раз специально следить за частицами, получившими большое отклонение вплоть до 90°.
Когда через несколько дней Марсден вошел в кабинет Резерфорда и сказал "есть такие частицы", Резерфорд от удивления выронил трубку. Резерфорд, хотя и предложил Марсдену провести эти опыты, сам не ожидал такого результата.
Резерфорд потом вспоминал: "это было самым невероятным событием моей жизни. Это было почти столь же невероятно, как если бы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился к вам и нанес вам удар ".
Опыты снова были перепроверены, но на этот раз к экспериментам подключился Гейгер. Явление было экспериментально изучено и материалы экспериментов опубликованы в том же году. Однако смысл результатов был загадочным. Не мог атом Томсона задержать, летящую с большой скоростью альфа-частицу.
В 1911 г. Резерфорд публикует свою статью "Рассеивание альфа- и бета-частиц веществом и структура атома", в которой предлагает свою знаменитую планетарную модель атома.

Маленькое очень массивное положительно заряженное ядро, от которого как раз и отскакивали альфа-частица в описанных опытах, расположено в центре атома Резерфорда. Вокруг ядра вращаются легкие отрицательно заряженные электроны. Большую часть пространства внутри атома заполняет пустота. В целом модель очень похожа на нашу Солнечную систему.
К великому сожалению Резерфорда, статья была встречена молчанием. Резерфорд, конечно понимал почему. Его атом был недолговечен. Электрон, вращаясь вокруг ядра, должен излучать электромагнитные волны и терять вследствие этого энергию. При этом скорость его должна была бы замедлиться, и он должен был бы упасть на ядро. Однако опыт свидетельствует, что практически все атомы в природе устойчивы.
Выправил ситуацию Нильс Бор.
Теория Бора
Постулаты Бора по своему характеру аналогичны законам Кеплера, которых тоже три. И те и другие являются угаданными закономерностями, полученными на основе экспериментальных фактов. Кеплеру было пожалуй даже труднее. Как, например, можно прийти к результату, что (формула)? Только после того, как Ньютон сформулировал законы механики, законы Кеплера стало возможно объяснить.
Основным недостатком модели Резерфорда было то, что электрон, движущийся по круговой орбите вокруг ядра, должен излучать электромагнитные волны, но факты говорят о том, что он не излучает. Ученые, в том числе и Резерфорд, не могли объяснить этого противоречия. Не мог этого сделать и Бор. Он просто встал на сторону фактов: раз электроны не излучают, значит так и должно быть. Так появился первый постулат. Всего как мы уже сказали их три.
Постулаты Бора
1. Электроны движутся в атоме по стационарным орбитам, при этом они не излучают и не поглощают энергии.
2. Стационарными орбитами будут те, для которых момент количества движения электрона mvr равна целому кратному .
![]() , где k = 1, 2, 3, 4...
, где k = 1, 2, 3, 4...
3. При переходе с одной орбиты на другую электрон излучает или поглощает энергию в виде фотона.
Находясь на более далеких орбитах, электрон обладает большей энергией, поэтому, переходя на орбиту ближе к ядру, он излучает один фотон с энергией

Когда же атом поглощает фотон, электрон может подняться на более высокий уровень.
Размеры атома водорода
Электрон, вращаясь вокруг ядра, испытывает к нему силу кулоновского притяжения:

где – заряд атомного ядра с порядковым номером Z.
Эта сила в соответствии со вторым законом Ньютона должна равняться , следовательно:  или
или  .
.
Второй постулат Бора говорит нам о том, что радиус орбиты не может быть произвольным, а должен подчиняться уравнению:
где мы будем обозначать k-ую стационарную орбиту. Отсюда получаем

 .
.
Мы получили радиус k-ой стационарной орбиты атома с порядковым номером Z. Для водорода Z=1. Найдем радиус первой (k = 1) самой внутренней орбиты, на которой электрон обладает минимальным запасом энергии.
Следовательно, диаметра атома водорода равен примерно , что хорошо согласуется с экспериментальными данными.
Найдем энергию электрона на k-ой орбите.
Его энергия складывается из кинетической энергии движения по орбите и потенциальной электростатической энергии взаимодействия с ядром.
Стали важным шагом в развитии физики. Огромное значение имела модель Резерфорда. Атом как система и частицы, его составляющие, был изучен более точно и подробно. Это привело к успешному становлению такой науки, как ядерная физика.
Античные представления о строении вещества
Предположение о том, что окружающие тела состоят из мельчайших частиц, были высказаны еще в античные времена. Мыслители того времени представляли атом в виде мельчайшей и неделимой частицы любого вещества. Они утверждали, что нет во Вселенной ничего меньшего по размеру, чем атом. Таких взглядов придерживались великие древнегреческие ученые и философы - Демокрит, Лукреций, Эпикур. Гипотезы этих мыслителей сегодня объединены под названием «античный атомизм».
Средневековые представления
Времена античности прошли, и в средние века также были ученые, которые высказывали различные предположения о строении веществ. Однако преобладание религиозных философских взглядов и власть церкви в тот период истории на корню пресекали любые попытки и стремления человеческого разума к материалистическим научным выводам и открытиям. Как известно, средневековая инквизиция весьма недружелюбно вела себя с представителями научного мира того времени. Остается сказать, что у тогдашних светлых умов было пришедшее из античности представление о неделимости атома.
Исследования 18-19 веков
18 столетие было отмечено серьезными открытиями в области элементарного строения вещества. Во многом благодаря стараниям таких ученых, как Антуан Лавуазье, Михаил Ломоносов и Независимо друг от друга они сумели доказать, что атомы действительно существуют. Но вопрос об их внутреннем строении оставался открытым. Конец 18 века был отмечен таким знаменательным событием в научном мире, как открытие Д. И. Менделеевым периодической системы химических элементов. Это стало по-настоящему мощным прорывом того времени и приоткрыло завесу над пониманием того, что все атомы имеют единую природу, что они родственны друг другу. В дальнейшем, в 19 веке, еще одним важным шагом на пути к разгадке строения атома стало доказательство того, что в составе любого из них присутствует электрон. Работа ученых этого периода подготовила благодатную почву для открытий 20-го века.

Эксперименты Томсона
Английский физик Джон Томсон в 1897 году доказал, что в состав атомов входят электроны с отрицательным зарядом. На этом этапе ложные представления о том, что атом - предел делимости любого вещества, были окончательно разрушены. Как же Томсон сумел доказать существование электронов? Ученый в своих опытах помещал в сильно разреженные газы электроды и пропускал электрический ток. В результате возникали катодные лучи. Томсон тщательно изучил их особенности и обнаружил, что они являются потоком заряженных частиц, которые движутся с огромной скоростью. Ученый сумел высчитать массу этих частиц и их заряд. Он также выяснил, что их нельзя преобразовать в нейтральные частицы, поскольку электрический заряд - это основа их природы. Так были Томсон является и создателем первой в мире модели строения атома. Согласно ей, атом - это сгусток положительно заряженной материи, в которой равномерно распределены отрицательно заряженные электроны. Такое строение объясняет общую нейтральность атомов, так как противоположные заряды уравновешивают друг друга. Опыты Джона Томсона стали неоценимо важными для дальнейшего изучения строения атома. Однако многие вопросы оставались без ответа.

Исследования Резерфорда
Томсон открыл существование электронов, но он не сумел найти в атоме положительно заряженных частиц. исправил это недоразумение в 1911 году. Во время экспериментов, изучая активность альфа-частиц в газах, он обнаружил, что в атоме присутствуют частицы, положительно заряженные. Резерфорд увидел, что при прохождении лучей сквозь газ или через тонкую металлическую пластину происходит резкое отклонение незначительного количества частиц от траектории движения. Их буквально отбрасывало назад. Ученый догадался, что такое поведение объясняется столкновением с положительно заряженными частицами. Такие эксперименты позволили физику создать модель строения атома Резерфорда.

Планетарная модель
Теперь представления ученого несколько отличались от предположений, высказанных Джоном Томсоном. Разными стали и их модели атомов. позволил ему создать совершенно новую теорию в этой области. Открытия ученого имели решающее значение для дальнейшего развития физики. Модель Резерфорда описывает атом как ядро, расположенное в центре, и движущиеся вокруг него электроны. Ядро обладает положительным зарядом, а электроны - отрицательным. Модель атома по Резерфорду предполагала вращение электронов вокруг ядра по определенным траекториям - орбитам. Открытие ученого помогло объяснить причину отклонения альфа-частиц и стало толчком к развитию ядерной теории атома. В модели атома Резерфорда прослеживается аналогия с движением планет Солнечной системы вокруг Солнца. Это очень точное и яркое сравнение. Поэтому модель Резерфорда, атом в которой движется вокруг ядра по орбите, была названа планетарной.

Работы Нильса Бора
Двумя годами позже датский физик Нильс Бор попытался объединить представления о строении атома с квантовыми свойствами светового потока. Ядерная модель атома Резерфорда была положена ученым в основу его новой теории. По предположению Бора, атомы вращаются вокруг ядра по круговым орбитам. Такая траектория движения приводит к ускорению электронов. Кроме того, кулоновское взаимодействие этих частиц с центром атома сопровождается созданием и расходованием энергии для поддержания пространственного электромагнитного поля, возникающего из-за движения электронов. При таких условиях отрицательно заряженные частицы должны когда-нибудь упасть на ядро. Но этого не происходит, что указывает на большую устойчивость атомов как систем. Нильс бор понял, что законы классической термодинамики, описанные уравнениями Максвелла, не работают во внутриатомных условиях. Поэтому ученый поставил перед собой задачу вывести новые закономерности, которые были бы справедливы в мире элементарных частиц.

Постулаты Бора
Во многом благодаря тому, что существовала модель Резерфорда, атом и его составляющие были неплохо изучены, Нильс Бор смог подойти к созданию своих постулатов. Первый из них гласит о том, что атом имеет при которых он не изменяет свою энергию, а электроны при этом движутся по орбитам, не меняя своей траектории. Согласно второму постулату, при переходе электрона с одной орбиты на другую происходит выделение или поглощение энергии. Она равна разности энергий предшествующего и последующего состояний атома. При этом, если электрон перепрыгивает на более близкую к ядру орбиту, то происходит излучение и наоборот. Несмотря на то что движение электронов мало напоминает орбитальную траекторию, расположенную строго по окружности, открытие Бора позволило получить великолепное объяснение существованию линейчатого спектра Приблизительно в это же время ученые-физики Герц и Франк, жившие в Германии, подтвердили учение Нильса Бора о существовании стационарных, стабильных состояний атома и возможность изменения значений атомной энергии.

Сотрудничество двух ученых
Кстати, Резерфорд длительное время не мог определить Ученые Марсден и Гейгер попытались осуществить перепроверку утверждений Эрнеста Резерфорда и в результате подробных и тщательных экспериментов и расчетов пришли к выводу о том, что именно ядро является важнейшей характеристикой атома, и в нем сосредоточен весь его заряд. В дальнейшем было доказано, что значение заряда ядра численно равно порядковому номеру элемента в периодической системе элементов Д. И. Менделеева. Интересно, что Нильс Бор вскоре познакомился с Резерфордом и полностью согласился с его взглядами. В последующем ученые длительно работали вместе в одной лаборатории. Модель Резерфорда, атом как система, состоящая из элементарных заряженных частиц, - все это Нильс Бор посчитал справедливым и навсегда отложил в сторону свою электронную модель. Совместная научная деятельность ученых была очень успешной и принесла свои плоды. Каждый из них углубился в изучение свойств элементарных частиц и сделал значимые для науки открытия. Позже Резерфорд обнаружил и доказал возможность разложения ядра, но это уже тема другой статьи.