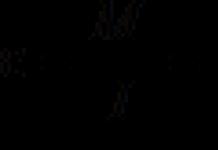SECTION 3. TOXIOMÉTRIE
CHAPITRE 3.1. DÉPENDANCE « DOSE-EFFET » EN TOXICOLOGIE
1. Remarques générales
Le spectre des manifestations du processus toxique est déterminé par la structure du toxique. Cependant, la gravité de l'effet qui se développe dépend de la quantité de substance active.
Pour désigner la quantité d'une substance agissant sur un objet biologique, la notion de dose est utilisée. Par exemple, l'introduction d'un toxique à raison de 500 mg dans l'estomac d'un rat pesant 250 g et d'un lapin pesant 2 000 g signifie que les animaux ont reçu des doses égales respectivement à 2 et 0,25 mg/kg (la notion de la « dose » sera discutée plus en détail ci-dessous).
La relation dose-effet peut être retracée à n'importe quel niveau d'organisation de la matière vivante : de la molécule à la population. Dans ce cas, dans l'écrasante majorité des cas, un schéma général sera enregistré : avec l'augmentation de la dose, le degré de dommage au système augmente ; Un nombre croissant de ses éléments constitutifs sont impliqués dans le processus.
Selon la dose efficace, presque toutes les substances, sous certaines conditions, peuvent être nocives pour l'organisme. Ceci est vrai pour les toxiques qui agissent à la fois majoritairement localement (tableau 1) et après résorption dans les milieux internes (tableau 2).
Tableau 1. Relation entre la concentration de formaldéhyde dans l'air inhalé et la gravité du processus toxique
(P.M. Misiak, J.N. Miceli, 1986)
Tableau 2. Relation entre la concentration d'éthanol dans le sang et la gravité du processus toxique
(TG Tong, D, Pharm, 1982)
La manifestation de la relation dose-effet est significativement influencée par la variabilité intra et interspécifique des organismes. En effet, les individus appartenant à une même espèce diffèrent significativement les uns des autres par leurs caractéristiques biochimiques, physiologiques et morphologiques. Ces différences sont dans la plupart des cas dues à leurs caractéristiques génétiques. En raison des mêmes caractéristiques génétiques, les différences interspécifiques sont encore plus prononcées. À cet égard, les doses d'une substance particulière dans lesquelles elle cause des dommages aux organismes de la même espèce et, en particulier, d'espèces différentes, diffèrent parfois de manière très significative. Par conséquent, la relation dose-effet reflète non seulement les propriétés du toxique, mais également l’organisme sur lequel il agit. En pratique, cela signifie qu'une évaluation quantitative de la toxicité, basée sur l'étude de la relation dose-effet, doit être réalisée dans le cadre d'expérimentations sur divers objets biologiques, et qu'il est nécessaire de recourir à des méthodes statistiques pour traiter les données obtenues.
2. Relation dose-effet au niveau des cellules et organes individuels
2.1. Remarques préliminaires
L’objet le plus simple nécessaire pour enregistrer l’effet biologique d’un toxique est une cellule. Lors de l'étude des mécanismes d'action toxique, cette disposition est souvent omise, concentrant l'attention sur l'évaluation des caractéristiques de l'interaction d'une substance chimique avec des molécules cibles (voir ci-dessus). Une approche aussi simplifiée, justifiée dès les premières étapes des travaux, est totalement inacceptable lorsqu'on passe à l'étude de la régularité fondamentale de la toxicologie - la relation dose-effet. À ce stade, il est nécessaire d'étudier les caractéristiques quantitatives et qualitatives de la réaction de l'ensemble de l'appareil effecteur de l'objet biologique à des doses croissantes du toxique et de les comparer avec les schémas d'action du xénobiotique au niveau moléculaire.
2.2. Concepts de base
Le concept de récepteur de l'action de substances toxiques sur une cellule ou un organe suppose qu'il repose sur la réaction d'une substance avec une structure biologique spécifique - un récepteur (voir section « Mécanisme d'action »). Ces idées ont été développées plus profondément au cours d'études sur les modèles d'interaction des xénobiotiques avec des récepteurs sélectifs de biorégulateurs endogènes (neurotransmetteurs, hormones, etc.). C’est dans ce type d’expériences que les schémas de base sous-tendant la relation dose-effet ont été établis. Il est généralement admis que le processus de formation d'un complexe d'une substance avec un récepteur obéit à la loi de l'action de masse. Cependant, les concepts qui permettent de relier les caractéristiques quantitatives et qualitatives de cette réaction primaire et la gravité de l'effet de la part de l'ensemble du système biologique restent encore aujourd'hui hypothétiques. Pour pallier les difficultés qui se posent, il est d'usage de distinguer deux caractéristiques toxicométriques d'un xénobiotique :
1. Affinité - reflète le degré d'affinité du toxique pour un type de récepteur donné ;
2. Efficacité - caractérise la capacité des substances à provoquer un certain effet après interaction avec le récepteur. Dans ce cas, les xénobiotiques qui imitent l'action d'un biorégulateur endogène sont appelés ses agonistes. Les substances qui bloquent l'action des agonistes sont appelées antagonistes.
2.3. Affinité
La mesure de l'affinité d'un toxique est essentiellement une étude expérimentale de la relation entre la quantité d'une substance ajoutée au milieu d'incubation et la quantité du complexe toxique-récepteur formé à la suite d'une interaction avec le récepteur. Les études de radioligands (voir ci-dessus) constituent une technique méthodologique courante.
Lors de l'application de la loi de l'action de masse pour déterminer l'affinité, il est nécessaire de prendre en compte le fait que le chercheur connaît les caractéristiques quantitatives du contenu dans l'environnement d'un seul des participants au processus - le toxique [P]. Le nombre de récepteurs [R]T impliqués dans la réaction est toujours inconnu. Il existe des techniques et des hypothèses méthodologiques qui permettent de s'affranchir de cette complexité lors de l'expérimentation et au stade de l'analyse du traitement des résultats obtenus.
2.3.1. Description de l'interaction toxique-récepteur conformément à la loi de l'action de masse
Dans le cas le plus simple, les caractéristiques cinétiques d’une réaction du second ordre sont utilisées pour décrire le processus de formation d’un complexe entre une substance et un récepteur.
P + R «RP (1)
Selon la loi de l’action de masse :
KD = [P][R]/ = k -1 /k +1 (2)
K D est la constante de dissociation du complexe toxique-récepteur.
1/K D - constante du processus associatif, est une mesure de l'affinité du toxique pour le récepteur.
Puisque le nombre total de récepteurs dans le système étudié (culture cellulaire, organe isolé, etc.) est la somme des [R] libres et des récepteurs qui interagissent avec la substance, alors :
[R]T = + [R] (3)
En tenant compte des équations (2) et (3), nous avons
/[R] T = y = [P]/([P] + KD) (4)
Le degré de saturation d'un récepteur avec un toxique « y » est le rapport entre le récepteur lié à la substance et le nombre total de récepteurs. Puisque la quantité de complexe formé peut être déterminée expérimentalement, il devient possible de calculer la valeur KD conformément à l'équation (4). Dans une représentation graphique, la dépendance de la saturation du récepteur sur la concentration d'un toxique dans le milieu a la forme d'une hyperbole, qui peut également être utilisée pour déterminer la valeur de la constante de dissociation.
2.3.2. Modèles plus complexes d’interactions toxique-récepteur
Les courbes de liaison des substances toxiques obtenues expérimentalement sur les récepteurs sont souvent plus raides ou plus plates que prévu sur la base de la loi de l'action de masse. Parfois, des courbes sont révélées avec une dépendance complexe du degré de saturation du récepteur en substance toxique à sa concentration. Ces écarts s'expliquent généralement par trois circonstances :
1. La réaction entre la substance et le récepteur n’est pas bimoléculaire. Dans ce cas, une forme différente de spécification de la dépendance est requise que celle présentée par l’équation (4) :
y = [P] n /([P] n + KD) (5)
où n (Constante de guérison) reflète formellement le nombre de molécules toxiques participant à la formation d'un complexe toxique-récepteur.
2. La population du récepteur avec lequel le toxique interagit est hétérogène. Ainsi, si un objet biologique contient deux sous-types de récepteurs en quantités égales, différant de 3 fois par la valeur de la constante d'association du complexe toxique-récepteur, alors la valeur totale de la constante de guérison pour la dépendance étudiée sera égale à 0,94. . Avec de grandes différences dans les valeurs des constantes d'association, sa valeur intégrale différera encore plus de 1,0.
3. Le processus de formation du complexe toxique-récepteur est influencé dans une certaine mesure par des phénomènes tels que des changements dans la conformation du récepteur, la coopérativité de ses sous-unités individuelles et divers effets allostériques. Ainsi, la courbe de liaison d'un toxique au récepteur a souvent la forme d'un S. Cela indique l'influence mutuelle des sites voisins de liaison du toxique à la macromolécule (par exemple, la formation d'un complexe avec une sous-unité du récepteur entraîne une modification de son affinité pour d'autres sous-unités libres). Un effet similaire est observé lors de l'étude de la liaison de l'acétylcholine par une préparation de membranes tissulaires contenant un récepteur cholinergique. Une augmentation de la concentration de [3H]-acétylcholine libre dans le milieu d'incubation s'accompagne d'une augmentation de l'affinité de la substance pour les protéines réceptrices (Figure 1). L'anesthésique local prilocaïne, ajouté au milieu d'incubation, perturbe le phénomène de coopérativité des récepteurs et limite ainsi l'augmentation de l'affinité de l'acétylcholine pour ceux-ci. Ceci est mis en évidence par un changement dans la forme de la courbe «concentration liante - toxique» et sa transformation de la forme en S à l'hyperbolique conventionnelle.
Figure 1. Effet de la prilocaïne sur la liaison de l'acétylcholine au récepteur cholinergique (J.B. Cohen et al., 1974)
2.4. Efficacité
De nombreuses expériences ont montré qu'il n'existe pas toujours de relation directe entre la capacité d'une substance à former un complexe avec un certain type de récepteur et la gravité de l'effet biologique qui en résulte (par exemple, contraction des fibres musculaires lisses de la paroi intestinale, modification du rythme cardiaque, sécrétion de sécrétions par la glande, etc.) . Un certain nombre de théories ont été proposées pour décrire les résultats d'études expérimentales dans lesquelles cette dépendance a été étudiée.
Comme indiqué précédemment, tous les toxiques qui interagissent avec le récepteur peuvent être conditionnellement divisés en agonistes et antagonistes. À cet égard, ci-dessous, pour indiquer la concentration d'un toxique dans l'environnement, les symboles suivants seront utilisés : [A] - concentration d'agoniste ; [B] est la concentration de l'antagoniste.
2.4.1. Théories de l'occupation
La toute première des théories proposées appartenait à Clark (1926), qui suggérait que la gravité de l'effet observé était linéairement liée au nombre de récepteurs occupés par le toxique (/[R]).
Comme suit de l'équation (4)
/[R] T = [A]/([A] + K A) = E A /E M (6)
où E A est la gravité de l'effet de l'agoniste à la concentration appliquée ;
E M - l'effet maximal possible du système biologique étudié ;
K A est la constante de dissociation du complexe agoniste-récepteur.
Selon la théorie de Clark, un effet de 50 % se développe à une dose d'agoniste à laquelle 50 % des récepteurs sont occupés ([A] 50). Cette dose de substance est dite modérément efficace (ED 50).
De même, conformément à la loi d’action de masse, l’antagoniste interagit également avec le récepteur sans provoquer d’effet.
K V = [V][R]/[VR] (8)
où K B est la constante de dissociation du complexe récepteur-antagoniste.
Si un agoniste et un antagoniste agissent simultanément sur un récepteur, alors, naturellement, le nombre de récepteurs capables d'entrer en contact avec l'agoniste diminue. Le nombre total de récepteurs dans un objet biologique peut être désigné par
[R] T = [R] + + (9)
Selon la théorie considérée, un toxique peut être soit un agoniste, soit un antagoniste. Cependant, les résultats de nombreuses études indiquent qu’une telle classification des substances est insuffisante pour décrire les effets observés. Il a été établi que l’effet maximal provoqué par différents agonistes agissant sur le même système récepteur n’est pas le même.
Pour surmonter cette contradiction, Stephenson (1956) a proposé trois hypothèses :
L'effet maximal peut être provoqué par un agoniste même si seule une petite partie des récepteurs est occupée ;
L’effet qui en résulte n’est pas linéairement lié au nombre de récepteurs occupés ;
Les toxiques ont une efficacité inégale (activité stimulante relative), c'est-à-dire la capacité de provoquer un effet en interagissant avec le récepteur. Par conséquent, des substances ayant une efficacité différente, pour provoquer le même effet, doivent occuper un nombre différent de récepteurs.
Conformément à ces idées, la force de l'effet dépend non seulement du nombre de récepteurs occupés, mais également de l'ampleur d'un certain stimulus « S », formé lors de la formation du complexe « toxique-récepteur » :
E A /E M = ¦(S) = ¦(e/[R] T) = ¦(ey A) (10)
où e est une quantité sans dimension caractérisant l'efficacité de l'agoniste. Selon Stephenson, il s'agit d'une mesure de la capacité d'un toxique à provoquer un effet lors de la formation d'un complexe avec un récepteur. Stephenson a déterminé quantitativement e = 1, à condition que l'effet maximum d'une substance sur un biosystème soit 50 % de la réponse théoriquement possible de ce biosystème à un stimulus excitant.
Furchgott (1964) a suggéré que la valeur de « e » dépend directement de la concentration totale de récepteurs dans le système biologique [R]T, et a introduit le concept supplémentaire d'« efficacité interne » d'une substance (e), dont la valeur est inversement proportionnel à la concentration de récepteurs dans le système
e = e/[R] T (11)
Comme suit l'équation (10)
E A /E M = ¦(e[R] T y A) (12)
La substitution de l'expression (6) dans l'équation (12) conduit à
E A /E M = ¦(e[A]/([A] + K)) (13)
Si la concentration de récepteurs prêts à interagir avec l'agoniste diminue de q fois (avec blocage irréversible des récepteurs par l'antagoniste), alors l'efficacité réelle de la substance étudiée devient égale à qe, alors l'équation (13) prend la forme
E A * /EM * = ¦(qe/( + K)) (14)
Ce modèle est présenté graphiquement dans la figure 2.

Figure 2. L'effet de l'histamine sur une préparation de l'intestin grêle d'un cobaye dans des conditions de blocage croissant des récepteurs par la dibénamine (ED 50 = 0,24 μM ; K A = 10 μM ; e = 21) (R.F. Furchgott, 1966)
Un autre concept permettant de décrire la relation entre la concentration efficace d'une substance et la gravité de l'effet en développement a été proposé par Ariens (1954). L'auteur propose de caractériser la substance étudiée par une valeur désignée comme « activité interne » (a E)
(a E) = E A. MAX / E M (15)
Étant donné que l'effet maximal théoriquement possible ne peut être déterminé expérimentalement qu'en cas d'utilisation d'un agoniste puissant, la valeur a E pour la plupart des substances se situe généralement dans la plage 0.< a Е <1. Для полного агониста a Е = 1, a Е антагониста равна 0.
Ainsi, l'effet biologique maximal possible peut se développer lorsque le toxique occupe une partie des récepteurs. Dans ce cas, la liaison irréversible d’un certain nombre de récepteurs ne devrait conduire qu’à un déplacement de la courbe dose-effet vers la droite, sans réduire l’ampleur de l’effet maximum. Ce n’est que lorsqu’une certaine limite de liaison du récepteur à l’antagoniste est franchie que l’ampleur de l’effet maximum commence à diminuer.
Habituellement, au cours d'études sur la relation dose-effet du point de vue des théories professionnelles, les paramètres suivants sont déterminés pour caractériser les substances toxiques :
1. K A - constante d'association du complexe agoniste-récepteur (pK A = -lgK A). Étant donné que la valeur de cette valeur est souvent évaluée par une méthode indirecte (c'est-à-dire non pas par la quantité de complexe toxique-récepteur formé, mais par l'ampleur de l'effet développé lorsqu'une certaine quantité de toxique est ajoutée à l'environnement), basée sur la notion de « stimuli », il vaut mieux parler de constante d'association « apparente ».
2. EC 50 ou ED 50 - telles concentrations ou doses d'un toxique, sous l'influence desquelles se forme une réponse d'un objet biologique égale en intensité à 50 % du maximum possible (pD 2 = -lg ED 50).
3. K B - constante de dissociation du complexe récepteur-antagoniste. La puissance d’un antagoniste compétitif peut être exprimée en utilisant un seul paramètre : l’affinité avec le récepteur. Ce paramètre est évalué avec l'ajout obligatoire d'un agoniste au milieu d'incubation.
2.4.2. La théorie de la « vitesse d'interaction »
Pour expliquer les données révélées lors de l'étude de la relation dose-réponse, qui ne peuvent être comprises du point de vue de la théorie de l'occupation, Paton (1961) a proposé la théorie de la « vitesse d'interaction ».
Paton a suggéré que le développement progressif de l'effet sous l'action d'un agoniste, l'existence d'une relation entre le taux de développement de l'effet et la force du toxique peut s'expliquer si l'on suppose que la gravité de la réponse du biologique Le système est déterminé non seulement par le nombre de récepteurs occupés, mais également par la vitesse à laquelle la substance entre, interagit avec le récepteur puis s'en déconnecte. L'auteur a utilisé la comparaison suivante : un récepteur n'est pas une touche d'orgue, sur laquelle plus on appuie longtemps, plus on extrait le son longtemps, mais c'est une touche de piano - ici le son est extrait au moment de l'impact, et puis, même si vous maintenez la touche enfoncée pendant une longue période, le son s'estompe toujours .
Selon la théorie de Paton, les agonistes puissants sont des substances qui occupent et quittent rapidement le récepteur ; Les antagonistes sont des substances qui se lient longtemps au récepteur.
2.4.3. Théories des changements conformationnels des récepteurs
Pour de nombreuses substances, la courbe dose-réponse s’écarte considérablement de la relation fonctionnelle hyperbolique. Le coefficient de guérison de ces courbes n'est pas égal à 1 (voir ci-dessus). Comme déjà indiqué, ces caractéristiques, ainsi que la nature en forme de S des courbes dose-réponse, peuvent parfois s'expliquer par le phénomène d'interaction coopérative des protéines réceptrices. Il a également été démontré que de nombreux modificateurs chimiques des récepteurs (par exemple, le dithiothréitol - un réducteur des groupes sulfhydryle), des bloqueurs irréversibles des récepteurs cholinergiques (par exemple, les b-haloalkylamines), d'autres médicaments anticholinergiques (atropine), des relaxants musculaires compétitifs, des anesthésiques locaux et de nombreuses autres substances, modifient l'apparence de la courbe dose-effet" pour les agonistes, la faisant passer de la forme en S à l'hyperbolique.

Pour expliquer ces phénomènes et d'autres difficiles à interpréter du point de vue des théories professionnelles (sensibilisation et désensibilisation des récepteurs sous l'action d'agonistes), Katz et Theslef dès 1957, en prenant l'exemple de l'étude de l'action des relaxants musculaires, proposent un modèle cyclique (conformationnel) d'interaction d'un toxique avec un récepteur.
Le modèle est basé sur l'idée que le récepteur [R] et le complexe toxique-récepteur peuvent être dans un état actif (RA, RP A) et inactif (RI, RP I). Ceci est schématisé dans
Figure 3.

Figure 3. Schéma d'interaction d'un toxique avec un récepteur selon le modèle de Katz-Theslef.
Ce modèle permet d'expliquer l'effet des agonistes et des antagonistes compétitifs sur le récepteur.
Un agoniste, tel que l'acétylcholine, interagit avec la PR car il a une affinité plus élevée pour la PR que pour l'IR, formant le complexe RP A. L'équilibre entre RP A et RP I est déplacé vers RP A, puisque RI a une faible affinité pour l'agoniste et que le complexe RP I se dissocie pour former RI libre. Le développement de l'effet se forme au stade de la transformation conformationnelle de RP A en RP I. L'intensité du stimulus apparaissant dans un système biologique dépend du nombre de ces transformations par unité de temps. Les antagonistes compétitifs, par exemple la d-tubocurarine, ont une plus grande affinité pour R A et réduisent l'effet de l'agoniste, désactivant certains récepteurs du processus d'interaction avec ce dernier.
A partir de ce modèle, il est pratiquement impossible de déterminer expérimentalement la valeur des constantes de conversion correspondantes ou l'activité intrinsèque des agonistes. C’est pourquoi, à ce jour, les modèles d’occupation sont encore largement utilisés dans les expériences.
3. Relation dose-effet au niveau corporel
3.1. Remarques préliminaires
Les systèmes biologiques par rapport auxquels la relation dose-effet est étudiée en toxicologie sont les tissus, les organes et l'organisme dans son ensemble. La sensibilité des différents organes et systèmes corporels aux substances toxiques n’est pas la même. C'est pourquoi cette étape de recherche est nécessaire pour une caractérisation détaillée de la toxicité de la substance étudiée.
L'étude d'organes isolés dans des conditions artificielles simulant l'environnement naturel est d'une grande importance pour élucider les mécanismes d'interaction entre le toxique et l'organisme. Les théories de l'action des récepteurs des substances toxiques décrites ci-dessus sont formulées principalement sur la base de données obtenues lors d'expériences spécifiquement sur des organes isolés. Il n’est pas étonnant que les recherches sur ces objets occupent encore une place importante en toxicologie.
3.2. Courbe dose-réponse
En général, on peut supposer que la courbe dose-effet d'un agoniste en coordonnées semi-logarithmiques (logarithme de la dose - gravité de l'effet) prend la forme d'un S, indépendamment d'un certain nombre de caractéristiques qualitatives et quantitatives de la fonction évaluée. La méthode par laquelle la dépendance est étudiée, soit l'ajout progressif d'un toxique dans un incubateur, soit l'action unique d'une substance sur un objet biologique à des concentrations croissantes, n'a pas d'impact significatif sur le résultat si l'effet n'est pas évalué en valeurs absolues, mais est exprimé en pourcentage du maximum possible ( 100%). L'utilisation de valeurs relatives est conseillée, ne serait-ce que parce que toute préparation biologique, préparée avec le plus grand soin, est unique dans toutes ses propriétés, y compris sa sensibilité aux produits chimiques. De plus, au cours de l’expérience, la réactivité du médicament diminue. Ces circonstances nécessitent une normalisation obligatoire de l'objet avant la recherche. Une représentation graphique de la courbe dose-réponse d'un toxique P par rapport à la courbe d'une certaine substance standard fournit toutes les informations nécessaires sur l'action de P, y compris ses caractéristiques toxicométriques.
La comparaison directe des courbes obtenues lors d'une expérience étant techniquement difficile, les paramètres les plus importants des courbes sont souvent comparés.
3.2.1 Dose efficace moyenne (UI 50)
Le paramètre principal de la relation dose-effet pour un certain toxique et objet biologique est la valeur de la dose efficace moyenne (DE 50), c'est-à-dire une telle dose d'une substance qui, lorsqu'elle est exposée à un objet, développe un effet égal à 50 % du maximum possible. Lorsque l'on travaille sur des organes isolés, une valeur EC de 50 (la concentration efficace moyenne de la substance dans l'échantillon) est généralement utilisée. Les doses efficaces sont généralement mesurées en unités de masse de toxique par unité de masse d'objet biologique (par exemple, mg/kg) ; les concentrations efficaces sont exprimées en unités de masse de toxique par unité de volume du milieu utilisé (par exemple, g/litre ; M/litre). Au lieu de la valeur ED 50, son logarithme négatif est parfois utilisé : -log ED 50 = pD 2 (Tableau 3).
Les évaluations dose-réponse mesurent la relation quantitative entre le niveau d'exposition et les effets néfastes sur la santé qui en résultent. L'évaluation des risques identifie deux types d'effets nocifs : cancérigènes et non cancérigènes.
Cancérigènes sont des composés qui induisent des tumeurs après de longues périodes d'exposition chronique dans une évaluation des risques à vie. Les substances cancérigènes n'ont pas de niveau en dessous duquel ils seraient sans danger pour la santé, c'est-à-dire n’ont pas de seuil d’action (effets sans seuil).
Non cancérigènes- il s'agit de substances qui provoquent d'autres modifications néfastes de l'état de santé, notamment une augmentation des niveaux de morbidité et de mortalité, qui peuvent être dues à la fois à une exposition à court terme (aiguë) et à long terme (chronique). Les effets non cancérigènes comprennent :
· effet irritant sur le système respiratoire ;
· divers effets toxiques généraux (toxicité pour le foie, les reins et d'autres organes vitaux) ;
· changements dans l'état du système nerveux central ;
· dysfonctionnement reproductif et décès.
Comme dans le cas des cancérogènes, l'évaluation du danger potentiel et de la toxicité des substances n'ayant pas d'effet cancérigène est réalisée sur la base des résultats d'études épidémiologiques et expérimentales.
L'évaluation des risques tient compte du fait que les cancérogènes ne présentent un risque que lorsque les seuils ou les niveaux d'exposition sûrs sont dépassés. Aux États-Unis, ces doses seuils sont désignées par l'Environmental Protection Agency comme doses ou concentrations de référence - RFD ou RFC.
Les calculs de doses ou de concentrations de référence s'appuient sur des études expérimentales ou naturelles avec détermination de NOAEL ou LOAEL, soit le niveau d'effet nocif indétectable et l'effet nocif minimum détectable, respectivement, en utilisant différents facteurs de sécurité (facteurs d'incertitude). La quantification de la dose de référence dépend de facteurs d'incertitude (facteurs de sécurité) allant de 1 à 10. La RFD est calculée en divisant la NOAEL ou la LOAEL établie par le facteur de sécurité approprié. Le plus souvent, des facteurs de sécurité sont introduits pour tenir compte des différentes sensibilités interspécifiques lors du passage de l'animal à l'homme ; sensibilité individuelle intraspécifique (différenciation de sensibilité entre les plus vulnérables et les plus sains de la population) ; durée d'exposition insuffisante dans l'expérience ; passage du seuil à la concentration inefficace ; insuffisance et qualité des données expérimentales, etc. Une description de la méthodologie de justification actuelle ou RFD (RFC) est donnée par l'Agence américaine de protection de l'environnement (EPA US).
La cancérogénicité potentielle est évaluée de deux manières.
La première méthode s'appuie sur des données épidémiologiques, selon lesquelles un lien statistiquement significatif peut être établi entre l'exposition à des produits chimiques et une augmentation de l'incidence du cancer. Bien que cette méthode soit la plus adéquate et la plus précise, les études épidémiologiques nécessitent de grandes quantités de données, des augmentations significatives des taux d'incidence du cancer observés au-dessus des niveaux de fond et des informations précises sur l'exposition. Ces études sont entravées par d'autres facteurs de confusion (mauvaise alimentation, tabagisme et autres mauvaises habitudes) qui peuvent brouiller les corrélations entre l'exposition chimique à la substance étudiée et l'incidence du cancer.
En raison du manque de données d'observation à long terme chez l'homme, des études expérimentales sur des animaux (le plus souvent des souris, des rats) sur une longue période, généralement tout au long de la vie de l'animal, sont généralement utilisées pour évaluer l'effet cancérigène. La conclusion selon laquelle un composé chimique peut présenter un risque cancérigène pour l'homme repose sur l'augmentation constatée du nombre de tumeurs chez les animaux du groupe expérimental par rapport au groupe témoin. Sur la base de l'analyse des informations expérimentales et disponibles sur la cancérogénicité d'une substance, des classifications ont été élaborées qui subdivisent les substances chimiques selon le degré de risque cancérigène. Les classifications généralement acceptées sont celles proposées par le Centre international de recherche sur le cancer de Lyon (CIRC) et l'Agence américaine de protection de l'environnement (EPA). Selon ces classifications, les cancérogènes chimiques sont divisés en six groupes : du groupe A, qui comprend les substances ayant un effet cancérigène prouvé sur l'homme, au groupe E, qui comprend les substances pour lesquelles aucune cancérogénicité n'a été prouvée.
La tâche de décrire toute la diversité et la complexité des processus se produisant dans le corps peut être résolue sur la base des lois fondamentales auxquelles obéissent les systèmes biologiques. Compte tenu des connaissances limitées qui existent actuellement sur le mécanisme des processus se produisant dans l'organisme, ainsi que de la complexité de l'appareil mathématique utilisé pour décrire les effets toxiques, il est évident qu'il est possible d'obtenir une évaluation précise et en même temps assez simple. l'expression mathématique qui relie l'ampleur de l'effet au niveau et à la durée de l'influence (relation dose-temps-effet) n'est possible que dans certaines limites - à la fois en termes de mécanisme et de conditions expérimentales. Ainsi, lors d'une exposition à relativement long terme à une substance toxique dans des conditions stables, la relation dose-temps-effet est exprimée par l'équation suivante :
où E est l'effet toxique à une concentration et une durée d'exposition données ; E m - effet maximum ; n est le coefficient stœchiométrique de la réaction biologique ; k est la constante de vitesse de la réaction limitante ; ttot est la durée totale d'exposition au xénobiotique ; t égal - le temps d'établissement de l'équilibre entre les concentrations du xénobiotique dans l'environnement extérieur et dans l'organisme ; k - coefficient de distribution organisme/environnement ; C est la concentration d'une substance toxique dans l'environnement.
Cette équation est applicable aux substances ayant des effets toxiques généraux. Pour substances chimiques, qui présentent une toxicité sélective, il est nécessaire d'introduire un coefficient supplémentaire dans le facteur exponentiel qui prend en compte cette spécificité. Pour l'application pratique des systèmes d'évaluation des risques, des formules plus simples sont utilisées. Les principaux sont les suivants.
1. Modèle linéaire ou exponentiel linéaire :
Risque = UR * C * t, (5.4)
Risque = 1 – exp (-UR * C * t), (5,5)
où Risque est le risque d'un effet indésirable, défini comme la probabilité que cet effet se produise dans des conditions données ; C est la concentration (ou dose) réelle de la substance qui a un effet pendant le temps t ; L'UR est une unité de risque, définie comme un facteur de la proportion d'augmentation du risque en fonction de la valeur de la concentration efficace (dose) ; déterminé par des méthodes expertes lors de l'analyse statistique de matériel expérimental ou médico-statistique obtenu par divers auteurs dans des situations comparables.
Il est à noter que l'expression (5.4) est valable si le coefficient UR est faible ou si les concentrations (doses) sont faibles.
2. Le modèle à seuil suppose la présence d'un seuil en dessous duquel le facteur étudié n'a pratiquement aucun effet :
Risque = H(С-С T), (5.6)
où H est la fonction Heaviside (H(x)) = 0 pour x £ 0 et H(x) = 1 pour x > 0) ; C - concentration d'exposition ; C T - concentration seuil.
3. Le modèle des seuils d'action individuels (distribution de probabilité normale de la fréquence des effets, analyse probit) a été utilisé pour la première fois et a été utilisé avec succès pour déterminer la toxicité aiguë des produits chimiques. Cependant, il peut être utilisé dans de nombreux autres cas.
 , (5.7)
, (5.7)
où C est la concentration influente ; a et b sont des coefficients empiriques.
Le choix du modèle dépend du système conceptuel adopté pour l'évaluation des risques. Les technologies réglementaires suivantes sont utilisées en Russie :
Système de régulation hygiénique (système de concentrations maximales admissibles) ;
Technologies internationales, principalement développées au sein de l’Agence américaine de protection de l’environnement ;
Méthodes d'évaluation des risques basées sur les principes nationaux de réglementation hygiénique des facteurs environnementaux nocifs, les modèles privés et les résultats d'études épidémiologiques.
Système MPC :
Le principe du seuil s’applique à tous les effets négatifs ;
Le respect de la norme (limite de concentration maximale, etc.) réduit la probabilité d’absence d’effets néfastes sur la santé ;
Le dépassement de la norme peut entraîner des effets néfastes sur la santé et, jusqu'à récemment, il n'existait aucun mécanisme pratique permettant de déterminer la forme spécifique de ces effets et leur expression quantitative.
A titre d'exemple, nous donnons des approches d'évaluation de la pollution air atmosphérique, sur la base des normes sanitaires et hygiéniques. Les principales impuretés dont l'utilisation et le rejet dans l'atmosphère sont autorisés sont précisés dans la réglementation médicale et environnementale (MPC) en vigueur. Si la teneur en impuretés nocives ne dépasse pas les réglementations spécifiées, cela est considéré comme une situation dans laquelle il n'y a aucun risque d'effets néfastes sur la santé. Lorsque ce risque se réalise, l'indicateur de pollution totale (P) est calculé et le degré de détresse médicale et environnementale est évalué conformément aux données du tableau. 5.3.
La relation entre les doses de substances actives et l'effet sous forme de pourcentage d'animaux morts peut être exprimée graphiquement sous forme de courbes dose-effet.
Avec l'augmentation de la dose et de la durée d'action, l'effet toxique augmente généralement. Mais des dérogations à cette règle sont possibles. Les courbes dose-réponse comportent différentes sections dans lesquelles des changements mineurs les doses d'une substance provoquent soit une augmentation significative de l'effet de l'exposition, soit n'entraînent qu'un faible changement. Si nous considérons les substances toxiques a, b, c dans l'ordre d'exposition, alors dans différentes zones de la courbe dose-effet, cet ordre sera différent.
Si nous évaluons la toxicité d'une substance en fonction de la dose, alors le résultat analyse comparative La toxicité d'une substance peut varier en fonction de la région de la courbe dose-réponse dans laquelle l'analyse est effectuée.
7. La notion de concentrations maximales admissibles. Normes MPC pour le rationnement des substances nocives dans l'air et le sol.
La toxicométrie repose sur l'établissement de concentrations maximales admissibles dans divers environnements. La concentration maximale admissible d'un polluant est sa plus petite quantité par unité de volume d'air ou d'eau qui, avec une exposition quotidienne du corps humain sur une longue période d'action, ne provoque pas de maladies et ne perturbe pas les activités normales de la vie.
Lors de la régulation des substances nocives dans l'air, MPC MR (maximum maximum unique) et MPC SS (moyenne quotidienne) sont utilisés.
MPC unique maximum est la principale caractéristique du danger d'une substance nocive. La valeur maximale unique du MPC est établie afin d'éviter les réactions des récepteurs humains lors d'une exposition à court terme à la substance. La concentration maximale admissible unique ne doit pas permettre de réactions désagréables des récepteurs du corps humain.
MPC SS– est défini comme la concentration d’un polluant dans l’air qui n’a pas d’effet direct ou indirect sur une personne lorsqu’elle respire 24 heures sur 24.
La norme suivante est utilisée dans le sol - MPC P (dans la couche arable), cette concentration ne doit pas provoquer de phénomènes directs ou indirects influence négative sur la santé humaine, ainsi que sur la capacité d'auto-épuration des sols et sur la végétation des plantes.
8. Le concept de concentrations maximales admissibles. Normes MAC pour le rationnement des substances nocives dans l'eau. Types d'utilisation de l'eau du DSD, dans quels cas est-il utilisé en toxicologie
On distingue les types d'utilisation de l'eau suivants :
Utilisation de l'eau domestique et potable. L'utilisation des plans d'eau comme source d'approvisionnement des ménages et comme source d'approvisionnement pour les entreprises de l'industrie alimentaire.
Usage communautaire – utilisation des plans d’eau pour la baignade et le sport.
Pêcherie - utilisation de réservoirs pour l'habitat du poisson, la reproduction, la migration des poissons et autres animaux aquatiques.
Selon les types d'utilisation de l'eau répertoriés, on distingue les normes suivantes :
MPC à des fins domestiques et de consommation, MPC à des fins culturelles et domestiques, MPC pour la pêche. Les normes MPC les plus strictes sont établies pour les plans d’eau de pêche. Dans la pratique courante, les normes de pêche sont le plus souvent utilisées, car la majorité des plans d'eau en Russie appartiennent à la catégorie I, celles. aux réservoirs à des fins de pêche. La valeur MPC est mesurée en unités de masse de polluant par unité de volume d'eau, mg/l.
Dose journalière acceptable (DJA)- il s'agit de la quantité d'une substance présente dans l'eau, l'air, le sol ou les aliments, exprimée en poids corporel (mg/kg de poids corporel), qui peut pénétrer dans l'organisme séparément ou en combinaison quotidiennement tout au long de la vie sans risque notable pour la santé.
Décharge maximale admissible (MPD) - quantité maximale substances contenues dans les eaux usées dont le rejet est autorisé à ce stade plan d'eau par unité de temps, qui ne viole pas les normes de qualité de l'eau dans une zone donnée du réservoir
9. Principaux types de classifications des substances nocives et des intoxications (classification pratique, hygiénique).
Classification pratique des substances toxiques :
I. Poisons industriels : 1) carburant, 2) solvants, 3) colorants, 4) réfrigérants, 5) réactifs chimiques, 6) plastifiants (introduits pour donner une meilleure plasticité au mélange)
II Pesticides utilisés en agriculture : 1) insecticides (provenant des insectes), 2) vermicides (provenant des vers), 3) acaricides (provenant des tiques), 4) zoocides, 5) fongicides, 6) bactéricides, 7) herbicides (provenant des mauvaises herbes) défoliants- les substances utilisées pour l'effeuillage avant la récolte afin de faciliter la récolte mécanique.
déshydratants– des substances qui déshydratent les plantes et accélèrent leur maturation.
répulsifs– des substances anti-insectes.
III Médicaments(ils ont leur propre classement).
IV Produits chimiques utilisés dans la vie quotidienne : 1) compléments alimentaires, 2) installations sanitaires.
V Poisons biologiques contenus dans les plantes et les champignons.
VI Agents de guerre chimique utilisés comme armes de destruction massive.
Courbe dose-réponse(ou effet concentration) décrit le changement de l'influence d'un ligand sur un objet biologique en fonction de la concentration de ce ligand. Une telle courbe peut être construite pour des cellules ou des organismes individuels (lorsque de petites doses ou concentrations provoquent un effet faible, et de grandes - un effet fort : courbe graduée) ou des populations (dans ce cas, on calcule dans quel pourcentage d'individus un certain la concentration ou la dose du ligand provoque un effet : courbe corpusculaire).
L'étude des relations dose-réponse et la construction de modèles appropriés constituent un élément fondamental pour déterminer la gamme de doses et/ou de concentrations thérapeutiques et sûres de médicaments ou d'autres produits chimiques rencontrés par une personne ou une autre entité biologique.
Les principaux paramètres déterminés lors de la construction des modèles sont l'effet maximum possible (E max) et la dose (concentration) qui provoque l'effet semi-maximal (DE50 et EC 50, respectivement).
Lors de la réalisation de ce type de recherche, il convient de garder à l'esprit que la forme de la relation dose-effet dépend généralement du temps d'exposition de l'objet biologique à l'action de la substance d'essai (inhalation, ingestion d'aliments, contact avec la substance d'essai). peau, etc.), donc une évaluation quantitative de l'effet dans le cas de différents temps d'exposition et de différentes voies d'entrée du ligand dans l'organisme, elle conduit le plus souvent à des résultats différents. Ainsi, dans une étude expérimentale, ces paramètres devraient être unifiés.
Propriétés des courbes
Une courbe dose-réponse est un graphique bidimensionnel montrant la dépendance de la réponse d'un objet biologique à l'ampleur du facteur de stress (concentration d'une substance toxique ou d'un polluant, température, intensité du rayonnement, etc.). Par « réponse », le chercheur peut entendre processus biochimique, voire le taux de mortalité ; par conséquent, les unités de mesure peuvent être des nombres d'individus (en cas de mortalité), des catégories descriptives ordonnées (par exemple, l'étendue des dommages) ou des unités physiques ou chimiques (valeur de la pression artérielle, activité enzymatique). Habituellement dans essai clinique Plusieurs effets sont étudiés à différents niveaux organisationnels de l'objet d'étude (cellulaire, tissulaire, organisme, population).
Lors de la construction d'une courbe, la dose de la substance testée ou sa concentration (généralement en milligrammes ou en grammes par kilogramme de poids corporel, ou en milligrammes par mètre cube l'air pendant l'application par inhalation) est généralement tracée le long de l'axe des abscisses, et l'ampleur de l'effet est tracée le long de l'axe des ordonnées. Dans certains cas (généralement avec un intervalle de dose important entre l'effet minimum pouvant être enregistré et l'effet maximum possible), une échelle logarithmique est utilisée sur l'axe y (cette option de construction est également appelée « coordonnées semi-logarithmiques »). Le plus souvent, la courbe dose-réponse a une forme sigmoïde et est décrite par l'équation de Hill, particulièrement évidente dans les coordonnées semi-logarithmiques.
L'analyse des courbes statistiques est généralement effectuée par des méthodes de régression statistique telles que l'analyse probit, l'analyse logit ou la méthode Spearman-Kerber. Dans le même temps, les modèles qui utilisent une approximation non linéaire sont généralement préférés aux modèles linéaires ou linéarisés, même si la dépendance empirique semble linéaire sur l'intervalle étudié : cela est basé sur le fait que dans la grande majorité des relations dose-réponse, la les mécanismes de développement de l'effet sont non linéaires, mais les données expérimentales de distribution peuvent apparaître linéaires dans certaines circonstances spécifiques et/ou certains intervalles de dose.
En outre, une technique assez courante pour analyser la courbe dose-effet est son approximation par l'équation de Hill pour déterminer le degré de coopérativité de l'effet.